RELAÇÕES ÁGUA-PLANTA
IMPORTÂNCIA DA ÁGUA
PARA OS VEGETAIS
→ Constituinte celular
- a água é o principal constituinte do protoplasma e faz
parte da estrutura dos compostos celulares
- 80 a 95% da massa de tecidos vegetais em crescimento
- 5 a 15% da massa em sementes (necessitam de
quantidade considerável de água para a germinação)
- importante para a formação de carboidratos, proteínas e
ácidos nucléicos
IMPORTÂNCIA DA ÁGUA
PARA OS VEGETAIS
→ Participação em reações químicas
- a água forma o ambiente onde ocorre a maioria das
reações bioquímicas celulares:
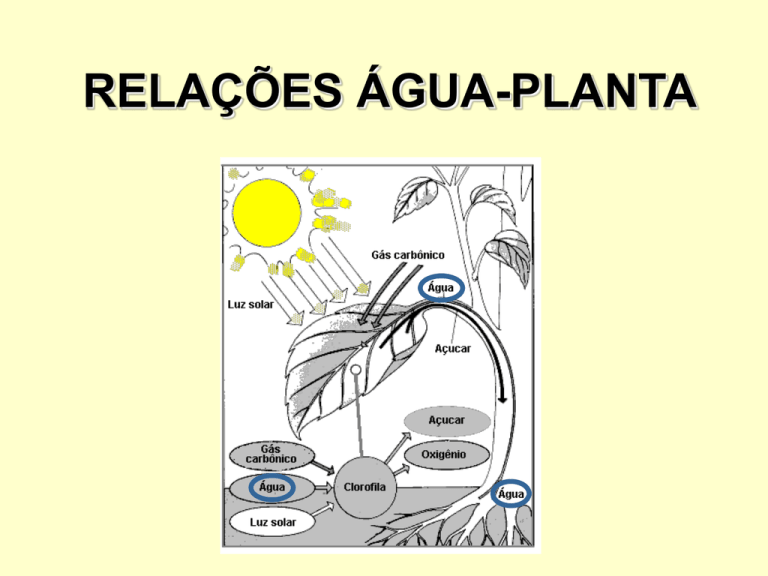
luz
6CO2 + 6H2O clorofila
→ C6H12O6 + 6O2 = Fotossíntese
→ Solvente universal
- a água é o melhor solvente (líquido capaz de dissolver
substâncias) conhecido
IMPORTÂNCIA DA ÁGUA
PARA OS VEGETAIS
→ Solvente universal
- como solvente constitui o meio onde as moléculas
(nutrientes e fotoassimilados) se movimentam, dentro e
entre as células
- é o meio de transporte de solutos e gases
→ Turgescência
- permite que a planta fique em pé = célula túrgida =
repleta de água
- participa nos processos de abertura e fechamento dos
estômatos = somente abrem quando a célula está túrgida
ESTÔMATOS
IMPORTÂNCIA DA ÁGUA
PARA OS VEGETAIS
→ Qual a conseqüência da falta de água na planta?
Redução do conteúdo hídrico
↓
Redução da turgidez das células
↓
Murchamento
↓
Fechamento dos estômatos
IMPORTÂNCIA DA ÁGUA
PARA OS VEGETAIS
→ Qual a conseqüência da falta de água na planta?
Fechamento dos estômatos
↓
Redução na velocidade da fotossíntese
↓
Desorganização celular
↓
Morte da planta
Obs: existem plantas especializadas no armazenamento de água (cactus)
ESTRUTURA E
PROPRIEDADES DA ÁGUA
A água tem propriedades que lhe permitem atuar como
um solvente e ser transportada ao longo do corpo da
planta = estas propriedades dependem da estrutura
polar da molécula da água.
Molécula = dois ou mais átomos ligados por ligações químicas.
Ligação química = é uma força de atração que une dois átomos para formar
uma molécula.
A molécula da água consiste em 1 átomo de oxigênio (O)
ligado covalentemente a dois átomos de hidrogênio (H).
LIGAÇÕES QUÍMICAS
Na+ + Cl- → NaCl
INTERAÇÃO IÔNICA =
atração de cargas opostas
LIGAÇÃO COVALENTE =
compartilhamento de pares
de elétrons
PONTE DE HIDROGÊNIO =
compartilhamento de
átomo de hidrogênio com
outro átomo (O, N ou F)
MOLÉCULA DA ÁGUA
ESTRUTURA E
PROPRIEDADES DA ÁGUA
O oxigênio tende a atrair os elétrons da ligação covalente
por ser mais eletronegativo que o hidrogênio.
Essa atração resulta em uma carga negativa parcial na
extremidade da molécula formada pelo oxigênio (-) e uma
carga positiva parcial em cada hidrogênio (+) = essas
cargas são iguais, de forma que a molécula de água não
possui carga líquida.
MOLÉCULA DA ÁGUA
ESTRUTURA E
PROPRIEDADES DA ÁGUA
→ Esta
separação de cargas, juntamente com a forma da
molécula, tornam a água uma molécula polar = as
moléculas de água apresentam fraca atração eletrostática
na forma de pontes de hidrogênio.
→ A polaridade
da água e o pequeno tamanho da sua
molécula a tornam ainda um excelente solvente =
solvente universal = assim, a água dissolve quantidades
maiores de uma variedade mais ampla de substâncias
que outros solventes.
PONTE DE HIDROGÊNIO
ESTRUTURA E
PROPRIEDADES DA ÁGUA
Versatilidade como solvente = deve-se ao pequeno
tamanho da molécula de água e a sua natureza polar =
as ligações de hidrogênio entre as moléculas de água e
íons e, entre a água e solutos (componentes de uma
solução) polares em solução, reduzem efetivamente a
atração eletrostática entre as substâncias carregadas e,
portanto, aumentam a sua solubilidade.
SOLVENTE UNIVERSAL
ESTRUTURA E
PROPRIEDADES DA ÁGUA
As numerosas ligações de hidrogênio entre as moléculas de
água resultam em propriedades térmicas:
→ Alto calor específico = é o calor necessário para aumentar
a temperatura de uma substância em uma quantidade
específica = aumenta 1oC em 1 unidade de massa.
Quando aumentamos a temperatura da água suas
moléculas vibram mais rapidamente, mas para permitir
esta movimentação é necessário ser adicionada grande
quantidade de energia (calor) ao sistema para a quebra
das ligações de hidrogênio.
ESTRUTURA E
PROPRIEDADES DA ÁGUA
→ Alto calor latente de vaporização = é a energia
necessária para separar as moléculas de água da fase
líquida e levá-las para a fase gasosa à temperatura
constante = é o que ocorre durante a transpiração (perda
de água na forma de vapor).
As pontes de hidrogênio mantêm as moléculas de
água unidas nos seus estados líquido e sólido = no
estado gasoso as pontes de hidrogênio são quebradas
e as moléculas se separam umas das outras.
ESTRUTURA E
PROPRIEDADES DA ÁGUA
A água ganha ou perde grande quantidade de energia
quando muda o seu estado físico = esta propriedade
modera mudanças de temperatura ambiental.
Transpiração = o alto calor latente de vaporização
permite às plantas se refrescarem por evaporação da
água das superfícies foliares, as quais estão sujeitas a
aquecer por causa do acréscimo de radiação solar = a
transpiração é um componente importante na regulação
térmica das plantas.
ESTRUTURA E
PROPRIEDADES DA ÁGUA
A água apresenta ainda as propriedades de coesão e
adesão, também devidas as ligações de hidrogênio:
Coesão = a água adere a si mesma = atração mútua
entre moléculas de água.
Adesão = a água adere outras superfícies = atração da
água a parede celular ou a superfície de um vidro.
ESTRUTURA E
PROPRIEDADES DA ÁGUA
A coesão das moléculas de água permite que a água
líquida suba a grandes alturas em colunas estreitas e
produza alta tensão (pressão) superficial = força
exercida por moléculas de água junto a interface ar-água,
resultante das propriedades de coesão e adesão de
moléculas de água.
COESÃO + ADESÃO + TENSÃO SUPERFICIAL =
CAPILARIDADE = movimento ascendente da água ao
longo de um tubo capilar (parede celular).
DIFUSÃO = movimento de moléculas devido à agitação
térmica ao acaso de uma região de alta concentração
para uma região de baixa concentração = ao longo de
um gradiente de concentração.
PROCESSOS DE TRANSPORTE
DE ÁGUA
A difusão em soluções pode ser eficaz dentro de
dimensões celulares, mas é lenta para o transporte
de massa a longas distâncias = neste caso ocorre
o fluxo de massa por pressão, independente de
gradientes de concentração.
FLUXO DE MASSA = movimento em conjunto de
grupos de moléculas em massa em resposta a um
gradiente de pressão.
A osmose é movida por um gradiente de potencial hídrico =
gradiente de concentração + gradiente de pressão.
AQUAPORINAS
POTENCIAL HÍDRICO
Os organismos vivos são sistemas organizados, em
permanente estado de não-equilíbrio termodinâmico = a
manutenção da vida exige a entrada de um fluxo contínuo
de energia livre.
De acordo com a 2ª Lei da Termodinâmica os processos
espontâneos tendem a ir de uma condição de alta energia
para uma condição de baixa energia, dissipando energia
térmica durante o processo, até que a condição de
equilíbrio seja alcançada.
A “organização” dos sistemas biológicos depende da
entrada constante de energia a partir do meio ambiente.
POTENCIAL HÍDRICO
Energia = é a capacidade (potencial) de realizar trabalho =
capacidade (potencial) de mudança (biologia).
Trabalho = quando uma força age sobre um objeto pela
distância = transferência de energia.
Energia livre = é aquela energia que está disponível para
realização de trabalho útil, após a compensação ter sido
feita pelo aumento ou diminuição da desordem (entropia).
Entropia = a medida do grau de desordem em um sistema.
ENTROPIA
LEIS DA TERMODINÂMICA
1ª Lei (conservação da energia): “a energia não pode
ser criada ou destruída, mas somente transformada
de uma forma a outra”.
2ª Lei (degradação da energia): “a entropia total de um
sistema termodinâmico isolado tende a aumentar
com o tempo, aproximando-se de um valor máximo” =
para que ocorra a realização de um trabalho útil no
segundo sistema, é necessário que a temperatura do
primeiro sistema seja maior que a temperatura do
segundo = diferença de potencial energético.
=
POTENCIAL HÍDRICO
A diferença de potencial (água) entre dois pontos leva a
movimentação da água do ponto de potencial mais
elevado para o de potencial mais baixo, na tendência
natural de toda a matéria atingir o equilíbrio.
Quando há concentração de moléculas em uma região,
haverá acúmulo de energia e, consequentemente,
transferência de moléculas da região de maior acúmulo de
energia para a região de menor acúmulo de energia:
ALTA ENERGIA
POTENCIAL
BAIXA ENERGIA
POTENCIAL
POTENCIAL HÍDRICO
Potencial químico = Potencial da água =
Potencial hídrico = medida de energia livre da
água por unidade de volume.
Potencial hídrico (Ψ) = tendência global de uma
solução em absorver água a partir da água pura por
uma membrana = Ψ água pura = zero.
POTENCIAL HÍDRICO
Potencial hídrico (Ψ) =
Potencial de soluto (Ψs) + Potencial de pressão (Ψp)
POTENCIAL HÍDRICO
Potencial de soluto (Ψs) ou Potencial osmótico
(Ψo) = efeito de solutos dissolvidos sobre o
comportamento osmótico da solução.
Em um sistema aquoso, a energia livre é expressa
pela comparação com a energia livre da água pura
(zero) = maior valor de energia potencial hídrica.
POTENCIAL HÍDRICO
Em soluções a energia potencial é negativa (-), ou
seja, os solutos reduzem o valor da energia livre da
água por diluição da mesma.
Assim, quanto maior a concentração de soluto em uma
solução, mais negativo (-) é o seu potencial de soluto
(Ψs) e tanto maior é a tendência da água mover-se para
esta solução a partir de uma outra solução de menor
concentração de soluto, com potencial menos negativo
(-) = mais próximo de zero = osmose.
POTENCIAL HÍDRICO
Potencial de pressão (Ψp) ou pressão
hidrostática da solução = pressão gerada por
compressão da água em um espaço restrito.
É a pressão hidrostática de uma solução em excesso
no ambiente sob pressão atmosférica.
POTENCIAL HÍDRICO
As células vegetais são envolvidas por uma parede
rígida = como a água penetra na célula vegetal, a
entrada de mais água sofre uma resistência crescente
por um potencial de pressão (potencial de turgor)
oposto, devido a rigidez da parede celular = a medida
que entra mais água na célula, o potencial de
pressão torna-se cada vez maior = célula túrgida.
SISTEMA SOLO-PLANTAATMOSFERA
A água é liberada
pelos estômatos
na transpiração
A água é conduzida
pelas células do xilema
A água é absorvida pelos pêlos
radiculares
Não esquecer que o
movimento da água é
passivo, isto é, a energia
livre da água diminui à
medida que esta se move
na planta = entretanto,
este movimento é
regulado para minimizar a
desidratação,
principalmente pela
regulação da transpiração
para a atmosfera.
o
CARACTERÍSTICAS
FÍSICAS DOS SOLOS
Solos arenosos = área de superfície por grama de solo é
relativamente pequena e com grandes espaços ou canais
entre as partículas (20 a 2000mm de diâmetro) = maior
porosidade e aeração = menor retenção de água =
permite o movimento mais rápido da água.
Solos argilosos = área de superfície é maior e com
pequenos espaços ou canais entre as partículas (< 2mm) =
menor porosidade e aeração = maior retenção de água.
CARACTERÍSTICAS
FÍSICAS DOS SOLOS
CARACTERÍSTICAS
FÍSICAS DOS SOLOS
Capacidade de campo = capacidade de retenção de
umidade dos solos.
A capacidade de campo é o conteúdo de água de um
solo depois de ter sido saturado com água e de permitida
a drenagem do excesso de água.
Solos arenosos apresentam menor capacidade de
campo (3% de água por volume) do que solos argilosos
(até 40% de água por volume).
PRESSÃO HIDROSTÁTICA E
HÍDRICA NO SOLO
Apresenta os mesmos
componentes do Ψw de células
vegetais: Ψs (soluto) e Ψp (pressão).
O Ψs da água do solo é
desprezível = baixa concentração
de solutos (-0,02 MPa), somente
em solos com muitos sais este
potencial chega a -0,2 MPa.
FLUXO DE MASSA
A água se move no solo principalmente por fluxo de
massa, segundo um gradiente de pressão.
As plantas esgotam a água próxima da superfície de
suas raízes, criando um gradiente de pressão em
relação às regiões vizinhas do solo, que apresentam
assim um maior valor de Ψp.
FLUXO DE MASSA
Uma vez que os espaços porosos cheios de água se
interconectam no solo, a água se move em direção à
superfície radicular por fluxo de massa através desses
canais, obedecendo a um gradiente de pressão.
Esse fluxo depende do tamanho do gradiente de
pressão e da condutividade hidráulica do solo =
esta condutividade é uma medida da facilidade com
que a água se move pelo solo e varia com o tipo de
solo e com o conteúdo de água = solos arenosos tem
condutividade hidráulica > solos argilosos.
FLUXO DE MASSA
Quando o conteúdo de água decresce, há redução da
condutividade hidráulica = substituição de água por ar
nos espaços ou canais.
Em solos muito secos, o Ψw pode cair abaixo do ponto de
murcha permanente = neste ponto as plantas não
conseguem recuperar o potencial de turgor mesmo que
toda a perda de água por transpiração cesse =
o Ψw do solo ≤ o Ψs da planta.
O ponto de murcha permanente depende de propriedades do
solo e da espécie vegetal (ajuste osmótico).
ABSORÇÃO DE ÁGUA
PELAS RAÍZES
Pêlos radiculares = extensões microscópicas das células
da epiderme radicular, que aumentam significativamente a
área de superfície radicular, proporcionando maior
capacidade para absorção de íons e água do solo.
A água penetra principalmente pela porção apical radicular,
pois regiões maduras apresentam camada mais externa
de tecido de proteção (exoderme ou hipoderme), que
possui material hidrofóbico em suas paredes celulares e é
relativamente impermeável.
A água passa exclusivamente pelas
paredes celulares = o apoplasto é o
sistema contínuo de paredes celulares e
espaços intercelulares nos tecidos.
e transmembrana
PRESSÃO DE RAIZ
Toda a raiz pode atuar como “célula osmótica”, pois o
tecido radicular comporta-se como membrana osmótica,
acumulando pressão hidrostática positiva no xilema em
resposta ao acúmulo de solutos.
A redução do Ψs (acúmulo de solutos) na seiva do
xilema diminui o Ψw, proporcionando a força propulsora
para a absorção de água = o que gera o aumento no Ψp.
A pressão de raiz ocorre mais quando o Ψw do solo é
alto e as taxas de transpiração são baixas =
principalmente à noite = plantas com esta pressão de
raiz produzem gotículas do xilema nas margens de suas
folhas, pelos hidatódios = gutação.












