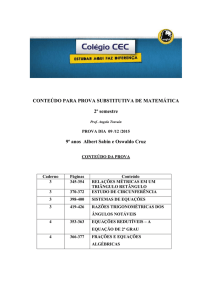
EQUILÍBRIO QUÍMICO
TERMODINÂMICA II
CURSO:ENGENHARIA QUÍMICA
ALGUNS EQUILÍBRIOS TERMODINÂMICOS
•Equilíbrio térmico —temperatura não muda com o tempo.
• Equilíbrio mecânico —pressão não muda com o tempo.
• Equilíbrio de Fases— massa de cada fase não muda com o tempo.
• Equilíbrio Químico — estrutura molecular não muda com o tempo
No equilíbrio líquido-vapor, a velocidade da evaporação é
igual à velocidade da condensação. Ambos os processos continuam
ocorrendo: é um equilíbrio dinâmico!
Equilíbrio entre Fases
de Substâncias puras
FASE:
Uma parte do sistema, uniforme em composição
química e propriedades físicas, separada de
outras partes do sistema por superfícies de
fronteira (interfaces).
Regra de Fases
Fase: porção homogênea do sistema
Grau de liberdade (F) de um sistema é definido como o número de
variáveis intensivas independentes necessárias para especificar seu
estado intensivo.
Ou
É o número de variáveis intensivas que podem variar independentemente
sem provocar distúrbios no número de fases em equilíbrio.
Sistema com um componente (C=1) e uma fase (P=1), pressão e temperatura
podem variar independentemente sem variar o número de fases.
Regra de fases devido a J. W. Gibbs, para um sistema onde não ocorre reação:
F = C - P +2
•
Potential químico :
•
Significado físico da derivada na equação acima:
Variação na energia de Gibbs decorrente da adição de
uma quantidade (moles) infinitesimal de um componente
i à mistura, mantendo-se constantes a temperatura, a
pressão e todos os números de moles dos demais
componentes.
Equações Relacionando Propriedades
Molares e Parciais Molares
• Qualquer propriedade TD M:
nM f (T , P, n1 , n2 ,..., ni ,...)
(nM )
(nM )
(nM )
d (nM )
dP
dT
dni
P T ,n
T P ,n
i ni
P ,T ,n ji
(M )
(M )
d (nM ) n
dP n
dT M i dni
P T ,n
T P ,n
i
ni xi n, dn i xi dn ndxi
d (nM ) ndM Mdn
Lei de Henry e Regra de Lewis-Randall
• As linhas retas da figura anterior que representam a Lei
de Henry e a Regra de Lewis-Randall podem ser
expressas, respectivamente, pelas seguintes equações:
f̂i HL ki .xi
f̂i LR fi .xi
Limites da fugacidade para xi = 0 e xi = 1
• Lei de Henry: estabelece quef̂i 0 , quando xi=0 e a
inclinação da reta tangente à curvaf̂i xi
é a constante
de Henry ki.
f̂i df̂i
lim
ki
xi 0 xi dxi
xi 0
Regra de Lewis-Randall: expressa a exigência •
termodinâmica de que f̂i e sua derivada em relação a
xi tornam-se iguais à fugacidade do componente i puro
(fi) no limite em que xi1.
df̂
f̂
i
i fi
lim
dx
x
x
1
i xi 1 i i
Observação importante (I)
As equações que expressam a Lei de Henry e a Regra
de Lewis-Randall têm formas similares, mas “ki” e “fi”
têm valores experimentais geralmente diferentes.
Ambas as equações representam linhas retas no
gráfico def̂i xi . A termodinâmica impõe a restrição
de que a curva seja tangente a essas 2 retas nos
limites de xi = 0 e xi = 1, e a natureza dessa curva
entre esses limites deve ser determinada
experimentalmente. Devido à forma logarítmica das
equações que a define, a fugacidade é sempre
positiva. Além disso, a termodinâmica restringe que a
inclinaçãodf̂i dxi
seja sempre positiva para um
fluido estável.
Observação importante (II)
A Lei de Henry e a Regra de Lewis-Randall são
representações idealizadas que geralmente não
conseguem descrever a dependência def̂i
com a
composição para uma grande faixa de fração molar.
Contudo, elas representam aproximações
satisfatórias para soluções suficientemente diluídas
ou concentradas na espécie i. Será visto mais
adiante que o conceito de solução ideal se inspirou
na Lei de Henry e na Regra de Lewis-Randall e
exerceu papel fundamental no desenvolvimento de
métodos para uma representação adequada das
propriedades das soluções reais.
Soluções ideais:
1. Ela serve como padrão para uma solução real ser comparada.
2. Seu comportamento é de uma solução.
3. Comtém moléculas de tamanho e natureza químca semelhantes,
exemplo, isômeros
V xiVi
H xi H i
f̂ i id xi f i
S xi Si R xi ln xi
G xi Gi RT xi ln xi
i Gi RT ln xi
seguindo a definição de fugacidade, e com o estado padrão como líquido
puro nas mesmas P e T
Solução ideal
• O modelo de solução ideal serve como base para
descrever de forma aproximada o comportamento de
uma solução real (não-eletrolítica).
• O modelo de solução ideal fornece a dependência da
fugacidade dos componentes na solução com a
composição.
• Considere o modelo representado pela regra de LewisRandall:
ˆf id f (T , P).x
i
i
i
Regra Lewis-Randall para solução ideal
•
O coeficiente de
fugacidade de uma
solução ideal é
obtido dividindo a
regra de LewisRandall por xi P
Bibliografia
•ESCOLA DE QUÍMICA DA UNIVERSIDADE FEDERAL DO RIO DE
JANEIRO- Profº Fernando Luiz Pellegrini Pessoa
•Prof. Dr. Ricardo Aparicio;Instituto de Química / UNICAMP
http://www.iqm.unicamp.br/departamentos/?p=127&c=129&id=73
Universidade de Brasília -Instituto de Química-Prof. João Batista
Equilíbrio e Cinética Química