Departamento de Biologia Celular – IB - UNICAMP
NC 716 - Biologia Celular
- 2009– 1º semestre
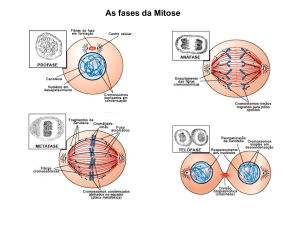
CICLO CELULAR
Responsável: Profa. Shirlei M. Recco-Pimentel
Aluno: Daniel Pacheco Bruschi
Questionário I
1. Quais são as características mais marcantes de cada fase do ciclo celular que a diferencia
da anterior e da seguinte?
2. Que eventos do ciclo celular são fundamentais para garantir a manutenção do número
de cromossomos nas células filhas?
Dois eventos fundamentais para que as duas células filhas possam receber o número
correto de cromossomos corresponde primeiramente a fase S da intérfase, na qual ocorre a
replicação do material genético, sendo portanto, um evento altamente regulado e que
culminará no dobro de filamentos de cromatina que permanecerão então associados na forma
de cromátides-irmãs até o final da metáfase. O segundo evento corresponde ao momento em
que os cromossomos são fixados na placa metafásica, momentos antes do início da anáfase,
crítico uma vez que se um cromossomo não estiver associado ás fibras do fuso de forma
bipolar, poderá ocorrer a segregação anormal dos cromossomos ou então das cromátides-irmãs
para ás células-filhas
3. Explique o comportamento do centrossomo durante o ciclo celular.
O centrossomo durante o ciclo celular sofre o ciclo do centrossomos. Em intérfase, o
centrossomo está normalmente localizado próximo ao núcleo celular. Na transição entre a fase G1
para a fase S, ocorre então a duplicação dos centríolos. A duplicação dos centríolos ocorre de
forma semi-conservativa, na qual o novo centrossomo de cada célula filha será formado por um
centríolo do par antigo e um centríolo do par recém sintetizado. Após a síntese de dois novos
centríolos, ocorre em G2 à maturação dos centrossomos, resultado da síntese do material
pericentriolar além da incorporação maciça de gama-tubulina, para que esta estrutura possa atuar
posteriormente como um centro de nucleação de microtúbulos. Os centrossomos duplicados e
agora maduros permanecem associados entre si por meio de proteínas específicas e perdem esta
associação somente na transição entre a fase G2 e a entrada em mitose, na qual pela ação de
proteínas-cinases atuam fosforilando estas proteínas que perdem sua associação. Neste ponto, os
centrossomos são separados pela ação de proteínas motoras associadas á microtúbulos. Em prófase
inicia, portanto, a migração dos centrossomos para os pólos opostos da célula. No final da mitose,
cada célula conterá um centrossomo, que aparentemente, quando tem a sua perda da orientação
perpendicular de seus centríolos estaria sinalizando para mais um ciclo de centrossomo.
4. Quais são os microtúbulos que compõem o fuso mitótico e qual é o papel de cada tipo
durante a mitose?
Compreende o fuso mitótico os microtúbulos do cinetócoro, microtúbulos polares e
microtúbulos astrais. Os microtúbulos do cinetócoro apresentam como principal função se fixar ao
cinetócoro e quando estabilizados fazem o papel de separação das cromátides-irmãs. Os
microtúbulos polares são microtúbulos de sobreposição que se distribuem no centro da célula e se
estabilizam entre si. Seu deslocamento na anáfase A e B são importantes para que a célula seja
distendida e os pólos da célula sejam afastados pela ajuda de proteínas motoras. Os microtúbulos
astrais estão localizados nos pólos celulares junto ao centrossomo onde ancoram sua extremidade
menos, estabilizando-as e permitem que suas porções mais sejam voltadas para a região cortical da
célula. Sua ação em conjunto com a atividade dos microtúbulos polares irão alongar a célula para
que os dois lotes cromossômicos permaneçam separados espacialmente.
5. Defina cinetócoro (estrutura, composição e função).
Cinetocóro consiste em uma placa trilaminar formada por proteínas, localizada na região
centromérica de cromossomos (exceto em cromossomos holocêntricos, nos quais esta estrutura
pode se distribuir em várias regiões ao longo do braço cromossômico). Nesta região,
normalmente encontra-se nucleossomos formados por histona variante do tipo CENP, que atua
neste caso como uma proteína MAP, associando-se à extremidade mais dos microtúbulos do
cinetócoro, estabilizando-os. Também é importante ressaltar que o cinetócoro de cada cromátide
está voltado para regiões contrárias o que permite que a cromátide seja puxada para os pólos
opostos da célula no momento da separação.
6. Explique como as cromátides irmãs permanecem ligadas até a metáfase e o mecanismo
envolvido na sua separação na anáfase. Tem diferenças nas proteínas de coesão em
diferentes regiões do cromossomo? (veja também o artigo 2)
As cromátides irmãs, logo após sua replicação são associadas á complexos protéicos
conhecidos como COENSINAS, que atuam aprisionando as cromátides e mantendo-as
associadas até momentos específicos do ciclo celular. O complexo coensina é formado por
subunidades que se unem para desempenhar sua função durante a fase S do ciclo celular e se
mantém associadas até o fim da prómetáfase (regiões não centroméricas) ou até a transição de
metáfase-anáfase (centroméricas). Desta forma, a associação de um heterodímero formado por
Smc 1 e Smc3 unido em suas cabeças por uma molécula de ATP é visualizado em G1 e dá
estrutura ao complexo. No final da fase S, a hidrólise do ATP que está associado desabilita a
união do heterodímero de Smc1 e Smc3 possibilitando a sua ligação com as subunidades Sec1
e esta por sua vez ligada à Sec3. A desabilitação do heterodímero permite o distanciamento
das subunidades Smc 1e 3 possibilitando a entrada do filamento de DNA e a associação com
as subunidades Sec1 e Sec3, atuarão então fechando o anel e aprisionando os filamentos de
cromatina (cromátides-irmãs).
No final da pró-metáfase, ocorre o início da remoção de
algumas coesinas não-centroméricas. Essa remoção ocorre por meio de uma mecanismo de
fosforilação das cabeças Smc 1e 3, causando a perda de sua afinidade entre si, o que causa a
abertura do anel que aprisiona a porção de cromatina e a liberação deste segmento
cromossômico. A região centromérica dos cromossomos permanecem associadas á coensina
até a transição da metáfase-anáfase, quando o Complexo Promotor da Anáfase (APC) é
ativado pela sua associação do Cdc20. A ativação do complexo causa ubiquitinação de um
complexo formado pelas proteínas Securina+Separase, na qual a ubiquitinação sobre a
Securina libera a Separase, e atua clivando a subunidade Sec1 do complexo coensina e
causando a abertura do anel, liberando a cromatina.
7. O que acontece com o envoltório nuclear e nucléolo durante o ciclo celular? (informações
devem ser completadas com o mini-seminário)
A atuação de cinases específicas atuam fosforilando as laminas A e B da lâmina nuclear, o que
acaba causando a desintegração desta estrutura e por conseqüência a desintegração do envoltório
nuclear. Esta desintegração inicia em prófase e é completa em pró-metáfase. Também nesta etapa
ocorre a desintegração do nucléolo, também por fosforilação de algumas proteínas estruturais do
nucléolo. Este evento ocorre durante a prófase e também está relacionado com o aumento da
atividade dos complexos CONDESINAS que atuam na condensação da cromatina, tendo sua
ativação mediada por M-CDK que as fosforilam. O nucléolo após estar todo desintegrado pode
então formar dois tipos de estrutura, os corpúsculos de ribonucleoproteínas que permanecem
dispersos no citoplasma da célula e algumas proteínas relacionadas ao nucléolo podem permanecer
associada às regiões da cromatina correspondentes às NORs, como a nucleolina (C23) e a
Numatrina (B23), o que permite a identificação das NORs em cromossomos metafásicos. A
reorganização do nucléolo e do Envoltório nuclear retorna na fase de telófase quando a atividade
das CDK’s é diminuída e as fosfatase aumentam desfofosforilação dos elementos fosforilados,
levando a reorganização destas estruturas. No caso do envoltório nuclear, vesículas contendo
lamina B e fragmentos de envoltório nuclear se associam à superfície dos cromossomos e vão se
fusionando também com as laminas A, reorganizando a lâmina nuclear e re-estruturando o
envoltório nuclear.
8. O que acontece com as organelas citoplasmáticas durante o ciclo celular?
As organelas membranosas como o Complexo de Golgi e o RE são desorganizados, dada a
reorganização dos microtúbulos durante a mitose e que anteriormente estabilizavam a organização
destas organelas. Além disso, acredita-se que fragmentos do RE podem se associar ao complexo de
Golgi. As organelas como cloroplasto, mitocôndrias e peroxissomos entre outras são distribuídas
aleatoriamente durante a citocinese, e seu deslocamento para os pólos opostos são mediados por
microtúbulos.
9. Como ocorre a citocinese em células animais e vegetais? Como se forma o sulco de divisão
nas células animais e o que determina o local onde a contração vai ocorrer.
Em células vegetais, durante fase de G2 ocorre o desaparecimento do arranjo cortical dos
microtúbulos e em prófase ocorre uma reorganização dos microtúbulos, migrando para o córtex
celular formando um feixe em uma região da célula (normalmente na região central) logo abaixo da
membrana plasmática chamado de BANDA PRÉ-PROFÁSICA, na qual desaparece logo após, na
prófase, entretanto seu aparecimento já serviu para a delimitação do local de citocinese. Após a
separação dos cromossomos na anáfase, inicia a formação do Fragmoplasto, uma estrutura formada
no local de citocinese formada por meio de microtúbulos e fibras do fuso onde ocorrerá a deposição
de vesículas do CG que possuem polissacarídeos de parece celular. Neste aspecto, as vesículas vão
de fundindo lateralmente e darão origem a nova membrana plasmática enquanto que a secreção dos
polissacarídeos de membrana por estas vesículas irá formar a matriz extracelular ou PC das novas
células.
Em células animais, a o sulco de divisão é formado na região cortical, logo abaixo da
membrana plasmática por meio da reunião de actina, miosina II e algumas proteínas regulatórias. A
localização da formação do sulco de divisão está relacionada com os microtúbulos, que parecem
indicar o ponto de formação da estrutura do anel contrátil.
9. Quais são as características básicas que o sistema de controle do ciclo celular possui?
(Veja livro do Alberts 5ª. edição)
O ciclo celular deve possuir mecanismos que desencadeiam determinados nos tempos
específicos e ordem correta, já que seria desastroso se houvesse a mitose sem a duplicação do genoma,
por exemplo. E este mesmo mecanismo deve assegurar a ocorrência apenas uma vez de determinados
eventos, como não pode ocorrer duas duplicações do genoma seguidas, por exemplo. O mecanismo de
controle deve assegurar que uma vez iniciados, os eventos sejam completados, pois a mitose não pode
se iniciar, por exemplo, com a desestruturação do EN e condensação dos cromossomos e
simplesmente parar. O sistema deve ser robusto para aceitar algumas falhas, mas também deve
permitir que a condução dos eventos sejam modificadas em resposta aos tipos celulares adjacentes ou
às variações ambientais.
10. O que significam os checkpoints, porque são importantes e em quais etapas do CC
ocorrem?
Os checkpoints correspondem a pontos de checagem que ocorre na célula antes desta passar de
uma fase para outra e tem como função verificar se o processo anterior foi realizado com êxito para a
etapa subseguinte. Em G1, ocorre um primeiro ponto de checagem que atua verificando se o ambiente
é favorável para a proliferação. O segundo ponto de checagem ocorre no final de G2, no qual a célula
monitora se a replicação ocorrida na fase S foi completada ou se os nucleotídeos foram todos
replicados corretamente. O terceiro ponto de checagem ocorre na transição entre a metáfase e anáfase
e corresponde ao monitoramento da fixação dos cromossomos às fibras do cinetócoro, buscando
monitorar se todas as cromátides estão ligadas ao fuso e evitando uma divisão assimétrica dos
cromossomos durante a anáfase.
11. Quais são as principais famílias de proteínas envolvidas no controle do ciclo celular?
Quais mecanismos atuam sobre esses complexos de proteínas alterando sua atividade?
(veja também o artigo 5)
Os mecanismos que podem alterar a atividade das proteínas envolvidas no controle do ciclo: a)
ativação (por fosforilação, desfosforilação, acoplamento), inativação (fosforilação inibitória, proteína
inibitória), proteólise (por ubiquitinação). As principais famílias de proteínas são, primeiramente as
ciclinas (proteínas que são sintetizadas pela célula de maneira cíclica e altamente regulada, nas quais
sua associação é fundamental para a ativação de CDKs), as CDK (proteínas dependentes de ciclina e
que atuam nos processos de fosforilação basicamente, e formam o complexo CDK-ciclina para tal
função). A segunda família reguladora do ciclo corresponde ás proteínas inibidoras de CDKs, que
atuam reguklando a ativiodade das CDKs, por meio de inativação (CKI). A terceira família são
daquelas proteínas cuja sua função causa modificações temporárias na atividade das proteínas, como
no caso das CAK (ativam as CDKs), as Wee1 (incorporam fosfato e inativam), CDC25 (remove
fosfatos para ativar CDKs) e a última classe constituídas por proteínas ubiquitina ligases, que atuam
marcando as proteínas do ciclo para a degradação proteossomal, regulando o ciclo celular (APC; SCF)
13. O que são SCF e APC? Seus substratos são os mesmos? Atuam nas mesmas fases?
Ambas as proteínas são proteínas UBIQUITINA-LIGASES que atuam marcando substratos
específicos para sofrerem proteólise dependente de ubiquitina. As proteínas SCF atuam marcando
proteínas marcadas por fosforilação como as ciclinas G1/S e S, além de atuarem ainda sobre Cdc6,
Mcm e outras proteínas. Atuam principalmente em G1, retirando o excedente de Mcm que não se
ligou ao complexo pré-replicação do DNA (Pré-Rc), atuam também em S, regulando e evitando
que ocorra a re-replicação de segmentos do DNA, marcando por meio de ubiquitinação Cdc6 e as
Mcm e conduzindo-as à proteólise proteossomal. Pode-se dizer que as SCF são encontradas em
todas as fases do ciclo celular e também atuam em CK inibitórias. Já o complexo APC atua
principalmente no final da fase de G2 e expressivamente em M. Esta proteína atua na marcação de
ciclinas M, basicamente. Neste caso, sua atuação está relacionada com substratos como a Securina
(conduzindo- a para degradação proteossomal e liberando Separase na transição metáfase-anáfase.
14. Quais são as condições que a célula deve apresentar em G1 para desencadear o ciclo celular e
que tipo de sinalização/controle ocorre para atingir o ponto de restrição ou start? Destaque o
papel da pRb nesse processo.
Em G1 a célula monitora basicamente a sinalização extracelular, regulando no monitoramento
da questão energética da célula (em procariotos) bem como sinais externos liberados em células
vizinhas que atuam como agentes mitógenos estimulando após associação com receptores de
membrana e conduzem a uma cascata de MAP cinases que irá culminar no aumento da síntese de
CDK-G1 e este aumento é então essencial para a passagem pelo ponto de restrição ou start.. O
aumento de CDK-G1 atuará fosforilando a proteína RAB ou (pRb), que está associada com um
fator de transcrição, o E2F. A fosforilação de Rab permite a dissociação do E2F que permanece
agora livre para desencadear a síntese de G1/S-CDK que levar[á a célula ao início da fase S. A
pRAb segue então a rota de degradação proteossomal.
15. Que mecanismo de controle ocorre após o start que leva a célula a iniciar a fase S e como a
célula garante que só ocorra uma vez a replicação de DNA a cada ciclo?
A célula depois de passar pelo start leva o aumento dos níveis de CDK-G1 atuam fosforilando a
proteína Rab (pRb). Em condições normais Rab está associada com E2F (fator de transcrição).
Com a fosforilação, perde-se a associação Rab-E2F e ocorre a liberação de E2F, que atuará
promovendo a transcrição de genes para G1/S e S-ciclina. A S-ciclina atua ativando o complexo
pré-replicação levando então a replicação do DNA. Neste sentido, a S-CDK atua em duas frentes
distintas: a primeira desencadeará a replicação, recrutando a DNA polimerase e proteínas de
replicação, entre elas a Mcm, que faz com a forquilha de replicação migre pelo DNA, replicando-o.
Na segunda frente de trabalho, ele irá atuar evitando a re-replicação, por meio de fosforilação de
CDC6 e de Mcm, fazendo com que o complexo Pré-replicação seja desestabilizado, e evitando que
a re-replicação do DNA ocorra. A fosforilação destas duas últimas proteínas sinalizará que elas
devem ser marcadas por meio de ubiquitinação (marcação feita pelo complexo SCF) para
degradação proteossomal.
16. Qual é o mecanismo de checkpoint envolvido no controle de danos do DNA durante a
intérfase?
Dois mecanismos de controle de danos aos DNA estão envolvidos na interfase: o primeiro ocorre
em G1, mas próximo ao final desta subfase e o segundo na transição G2 para M. o primeiro
mecanismo ocorrendo em G1 ocorre quando o DNA nuclear sinaliza danos à proteíno-cinasse.
Estas cinases então fosforilam um complexo formado pela proteína p53+Mdm2. Em condições de
ausência de danos p53 está associada á Mdm2, uma ubiquitina-ligase que atua na regulação dos
níveis de p53. Quando fosforilada, p53 desabilita a associação com Mdm2, e ao acúmulo de p53
leva a expressão de genes de p21, uma CKI que atuará inibindo S-CDK e G1/S-CDK, bloqueando a
passagem da célula para a subfase S. O segundo mecanismo de controle de dano ao DNA ocorre na
transição de G2 para M, na qual a célula precisa identificar se o material genético foi corretamente
replicado e não sofreu danos após este processo. Neste mecanismo, caso o DNA apresente danos,
este sinalizará para proteínas-cinases que atuam como sensores intramoleculares, que atuarão por
mecanismos ainda não bem descritos de inibição da atividade de CDC25. Se esta proteína não está
ativa, logo ela não irá remover a fosfatação realizada por Wee1 em CDK-M, o que resultará na
retenção da célula em G2 não avançando para a fase M do ciclo celular.
17. Como ocorre a regulação da atividade da p53? (utilize o artigo 3)
O gene p53, em condições normais atua de maneira a desacelerar a progressão do ciclo celular em
virtude da reparação de danos, tanto se referindo na capacidade de processividade da DNA
polimerase como no bloqueio de transição da fase G1-S . Sua regulação depende da sua ativação
por meio de proteínas-cinases que à fosforilam (proteína ATM) e permite que estas moléculas
atuem como fatores de transcrição, estimulando a expressão gênica de outros genes, entre eles
genes para p21 e/ou p27, que é uma CK e atuam inibindo CDK-G1 e CDK-G1/S, retardando o
ciclo celular. O controle da forma inativa de p53 ocorre por meio da associação desta com a Mdm2
(ubiquitina-ligase), em condições de ausência de danos de DNA.
18. Que controle ocorre em G2 que determina a entrada da célula em mitose? Quais são as
proteínas envolvidas e seus substratos?
O ponto de checagem em G2 ocorre no sentido de identificar se todo o DNA foi corretamente
replicado, sendo que a identificação de DNA incompletamente replicado e/ou presença de
forquilhas de replicação sinaliza á sensores intramoleculares que enviam uma resposta negativa à
mitose. A resposta negativa a mitose ativa inibidores de CDC2, que resltam na inativação desta
proteína e por conseqüência na não ativação de CDK-M impedindo a progressão do ciclo celular.
19. O que são complexos coesina e como se dá sua interação com cromatina?
Complexos coesinas são complexos proteícos formados por subunidades que se associam para,
juntas, desempenharem a função de aprisionamento das cromátides e conseqüente reunião das
cromátides-irmãs até a fase de transição metáfase-anáfase, quando elas são degradadas e permitem
que as cromátide sejam separadas para as duas células-filhas. Estes complexos são formados por
um heterodímero formado por Smc 1 e Smc3 unido em suas cabeças por uma molécula de ATP é
visualizado em G1 e que dá estrutura ao complexo. No final da fase S, a hidrólise do ATP que está
associado desabilita a união das cabeças do heterodímero de Smc1 e Smc3 possibilitando a sua
ligação com as subunidades Sec1 e esta por sua vez ligada à Sec3. A desabilitação do heterodímero
permite o distanciamento das subunidades Smc 1e 3 possibilitando a entrada do filamento de DNA
e a associação com as subunidades Sec1 e Sec3, atuarão então fechando o anel e aprisionando os
filamentos de cromatina (cromátides-irmãs).
20. Que mecanismo de controle e de checagem ocorre na saída da mitose? (utilize também o
artigo 4)
Os mecanismos de controle de checagem de saída de mitose ocorre por meio de dois controles
básicos:o primeiro ocorre por meio do aumento da transcrição de CKI, que atua realizando a
inibição do complexo CDK-M e um segundo mecanismo pelo qual ocorre a diminuição da síntese
de M-ciclina. Em baixos níveis de ciclina, o complexo APC-CDC20 diminui sua atividade e o
complexo APC-Hct1 atua aumentando a inibição do CDK-M que por sua vez diminui a sinalização
para a mitose prosseguir, fazendo com que a célula saia então de mitose e tenha tempo em G1 de
crescer seu conteúdo citoplasmático antes de um novo ciclo celular.
21. Dê exemplos de falhas nos mecanismos de controle do ciclo e de checagem, devido a mutações
em genes que regulam os eventos do ciclo celular e a checagem ou por ação de vírus, e que
têm relação com o aparecimento de tumores. (utilize também os artigos 1 e 5)
Falha ou mutação em p53: a ausência ou a presença defectiva de genes de p53 leva a célula a uma
falta de sistema de reparo que ocorrew no ponto de checagem de G1. Neste aspecto, caso o DNA
contenha danos, o sistema de reparo não poderá atuar reparação uma vez que não ocorrerá a pausa
no ciclo celular (pausa de entrada em G1), que é causada pela estimulação que a p3 faz sobre a
síntese de p21 e esta bloqueia a progressão do ciclo em caso de danos ao DNA, resultando em
acúmulo de danos em nas células que podem conduzir a proliferações celular descontrolada e dar
origem a células defectivas.
Falha ou mutação em Mad2: a falha em Mad2, uma proteína envolvida no ponto de checagem da
fixação dos cromossomos aos microtúbulos do cinetócoro. Quando um cromossomo não está
ligado a este microtúbulo ocorre uma sinalização negativa para a anáfase, travando esta etapa via
inibição de complexo APC-CDC20 (fosforilação de CDC20). Em casos de mutação ou perda desta
Mad2, a sinalização não é enviada e e o complexo APC-CDC20 não é inativado, processeguindo a
anáfase e por conseqüência resultando em aneuploidias, também muito relacionado á tumores ou
massas celulares anormais.
Falha em Rab (pRb): a falha pode ocorrer por meio de mutação ou por infecção viral> Ação sobre
esta proteína leva a um descontrole do início do ciclo celular (G1).
REFERÊNCIAS BIBLIOGRÁFICAS
Livros:
1. Alberts, B. et al. Molecular Biology of the Cell. Garland Publ., N.Y. & London, 2008. pp. 9831009; 1027-1061.
2. Recco-Pimentel, S.M., Veiga-Menoncello, A.C.P. & Aguiar-Jr., O. 2007. Mitose. In: Carvalho,
H.F. & Recco-Pimentel, S.M. A Célula. Ed. Manole, São Paulo, p. 304-317.
3. Borges, H.L. & Rehen, S.K. 2007. Controle do Ciclo Celular. In: Carvalho, H.F. & ReccoPimentel, S.M. A Célula. Ed. Manole, São Paulo, p. 318-331.
Artigos para todos lerem:
1. Garinis, G.A. et al. DNA damage and ageing: new-age ideas for an age-old problem. Nature Cell
Biology, 10 (11): 1241-1247, 2008.
2. Losada, A. Cohesin regulation: fashionable ways to wear a ring. Chromosoma, 116: 321-329,
2007.
3. Kastan, M.B. & Berkovich, E. p53: a two-face cancer gene. Nat. Cell Biol., 9(5): 489-491, 2007.
4.
Cesari, F. Signalling to wait. Nature Reviwes Molecular Cell Biology, 10 (online February 2009).
5. Hook, S.S. et al. Mechanisms to control rereplication and implications for cancer. Current opinion
in Cell Biology, 19: 663-671, 2007.
Mini-seminário:
1. - Burke, B. Network news: complete nuclear coverage. Nature Cell Biology, 9: (10): 1123-1124,
2007.
- Anderson, D.J. & Hetezer, W. Nuclear envelope formation by chromatin-mediated reorganization
of the endoplasmic reticulum. Nature Cell Biology, 9(10): 1160-1165, 2007.



![Ciclo celular [Modo de Compatibilidade]](http://s1.studylibpt.com/store/data/004234212_1-04dedc414d2f87755e3978361fad4b55-300x300.png)