Metabolismo do T. cruzi - Resumo
Metabolism
The Metabolism
Salvatore Giovanni de Simone
Laboratório Bioquímica de Proteínas e Peptídeos, Instituto Oswaldo Cruz, Fiocruz,
21040-900, Rio de Janeiro, RJ, Brasil.
E-mail: [email protected]
Metabolism encompasses the biochemical basis of life of each cell and comprises both
the catabolism (breakdown) and anabolism (synthesis) processes. All trypanosomatids depend
on the existing carbon sources present on the specific host compartment in which they live for
their energy metabolism.
While the trypomastigote forms of T. cruzi use glucose, which is abundant in the fluids
of their vertebrate host(s) insect vectors forms obtain their energy preferentially from amino
acids L-proline, L-aspartic and L-glutamic acid/glutamine, constituents of hemolymph and vector
tissue fluids. These amino acids also participate in the differentiation process from epimastigote
(replicative non-infective form) to trypomastigote (non-replicative infective form), particularly Lproline in the intracellular differentiation cycle (that occurs in the mammalian host). This
important catabolic mechanism produces five-times more reducing equivalents than glucose
catabolism. The two replicating stages of growth are amastigotes and epimastigotes. The
former resides in the cytoplasm and is adapted to a glucose-based metabolism of the host cells,
with thorough access to sugar phosphates. The latter normally grows in a glucose-amino acidrich medium (aerobic fermentation). It is interesting that T. cruzi (but not T. brucei and L. major)
has the capacity to utilize D-proline, in addition to L-proline (due to its capacity to express a
proline racemase), and L-histidine.
Catabolism of glucose and amino acid
Most we know of these metabolic pathways has been deeply investigated in
several parasites, principally in T. brucei. Nevertheless, it is accepted, after the genomic
accomplishment of several important kinetoplastids, that the simplest energy
metabolism of glycolysis is common in most trypanosomatids, although few but
significant differences may exist between these different organisms. Besides, large
amino acid transporter gene families were identified in the genome of T. cruzi, T. brucei
and L. major. These genes encode molecular sensors of the external host environment
and are crucial to the modulation of gene expression during morphological
transformation.
Glycolytic pathway
The glycolytic pathway is organised in such a way that the first seven enzymes
converting glucose into 3-phosphoglycerate are inside the glycosomes (peroxisome-like
organelles), while the last three enzymes of the pathway reside in the cytosol. Under
aerobic conditions, pyruvate is the only excreted end product and net ATP synthesis
occurs in the cytosol, in a reaction catalysed by pyruvate kinase (PYK, step 13), whereas,
in glycosomes, the consumption (steps 1 and 3) and production (step 9) of ATP are
balanced. Similarly glycosomal redox balance is maintained since the NADH produced
by glyceraldehyde-3-phosphate dehydrogenase (GAPDH, step 8) is reoxidized through a
glycerol 3-phosphate shuttle (GP, steps 6 and 45) and the alternative oxidase present in
the mitochondrion (step 47). In contrast, glucose catabolism in all other trypanosomatids
(or adaptive forms) analysed so far involves more elaborate metabolic networks both
within the glycosomes and the fully developed mitochondrion. This is exemplified by the
model proposed for the procyclic T. brucei presented in Fig. 1, which shows three main
differences compared to the slender bloodstream form of T. brucei. First,
phosphoglycerate kinase (PGK, step 10) is located in the cytosol and, therefore, 3phosphoglycerate is produced in the cytosol. Second, the glycosomes contain two
additional kinases converting phosphoenolpyruvate (PEP) into malate (PEPCK: PEP
carboxykinase, step 14) or pyruvate (pyruvate phosphate dikinase, step 15). The CO2
fixation step catalysed by PEPCK is the initial step of a branched pathway leading to the
production of succinate, a major end product excreted by most trypanosomatids. Third,
pyruvate is located at a metabolic branching point leading to several excreted end
products, such as acetate, L-alanine, ethanol and L-lactate (recommended literature).
Figure 1- Catabolism of glucose.
Acetate is a major end product formed in the mitochondrion of all trypanosomatids
and excreted by simple diffusion across the mitochondrial and cytoplasmic membranes.
In addition, some adaptive forms, especially the insect stages, use amino acids present
in their host for energy production. For instance, insect stages of T. cruzi reside in the Lproline-rich environment found in the insect fluids, and thus particularly appreciate this
carbon source. However, they preferentially consume glucose when both glucose and
amino acids are available. Nevertheless, the essential role of L-proline metabolism in
energy production of insect-stage trypanosomes was demonstrated in an experiment
where, in a glucose depleted medium, the rate of L-proline consumption by T. cruzi is
increased approximately six times in insect-stage forms. Interestingly, the ability of these
parasites to adapt to glucose-depleted conditions may be altered by long-term in vitro
culture in glucose-rich medium.
In most trypanosomatids, succinate is a major end product excreted from the
glucose metabolism, but the pathway leading to its production has been the topic of
intense discussion [26,27]. The controversy concerns to the importance of the NADHdependent fumarate reductase (FRD) in the production of succinate. However, it is
accepted that succinate is produced from cytosolic PEP by a split pathway. The
glycosomal PEPCK (step 14) and malate dehydrogenase (step 16) convert PEP into
malate, which is converted into fumarate by two fumarase isoforms. Fumarate is finally
reduced into the excreted succinate by the glycosomal and mitochondrial FRD isoforms
(steps 18 and 20)
The main role of the succinate production pathway (succinic fermentation) is
probably to maintain the glycosomal redox balance, by providing two glycosomal
oxidoreductase enzymes (steps 16 and 18) allowing the reoxidation of the NADH
produced by GAPDH in the glycolytic pathway (step 8). Compared to the most common
lactic fermentation, which involves the lactate dehydrogenase (LDH), succinic
fermentation offers the significant advantage of requiring only half of the PEP produced
to maintain the NAD+/NADH balance.
On the other hand, T. cruzi genome does not contain this gene and no LDH activity is
detectable in parasites. However, this does not mean that lactate cannot be obtained
from different pathways. In trypanosomatids, such as Leishmania, this system is
composed of two enzymes, glyoxalase I and glyoxalase II, which convert methylglyoxal
into D-lactate using trypanothione as a cofactor.
Gliconeogênese
A presença das enzimas glicogeogênicas nos glicossomas é bem entendida, uma
vez que catalizam reações reversíveis da via glicolítica, em condições fisiológicas.
Contudo, a existência de um mecanismo de controle que impeça a atividade
descontrolada de ambos processos parece ser essencial, porém este mecanismo ainda
não foi identificado.
Pentosephosphate pathway
A VPF, é uma via alternativa de oxidação de glicose na maioria das células
eucarióticas e é uma possilidade das células ajustarem suas necessidades de ATP,
poder redutor e precursores nucleotídicos. Existem várias razões que indicam que esta
via distribui-se entre os glicossomos e citosol. A atividade da glicose-6-fosfato
desidrogenase e 6-fosfato glicolactonase de T. brucei foi detectada entre os glicossomos
(15%) e citosol (50%). Acredita-se que isto ocorra também com outras enzimas e em T.
cruzi e Leishmania spp, pois várias outras seqüencias contendo PTS foram identificadas
nos genomas (ex: ribulose-5-fosfoepimerase,ribose-5-fosfoisomerase, transcetolase).
O produto final ribose 5-fosfato é convertido a 5-ribosil-1-pirofosfato que seguirá
para a síntese das bases nitrogenadas purinas e pirimidínicas (processos que ocorrem
nos glicossomas). NADPH é uma coenzima produzida exclusivamente por esta via e é
poder redutor para biossíntese de ácidos graxos. Além disso, nessa via são produzidos
açúcares fosforilados de diferentes tamanhos, permitindo as células ajustarem suas
necessidades através de trocas com a glicólise.
A VPF compreende uma etapa oxidativa inicial, em que a glicose-6-fosfato é
transformada em ribose 5-fosfato e CO2 por duas oxidações e uma etapa oxidativa
ocorre no sentido NADP- NADPH. A esta é seguida a trasformação da ribulose-5-fosfato
em ribose-5-fosfato pela ação de uma isomerase e a pentose após várias transformações
gera açúcares fosforilados com variáveis números de átomos de carbono. Todas as
etapas não-oxidativas são reversíveis permitindo interconverter os diferentes açúcares.
A energia da oxidação da glicose é armazenada na molécula do NADPH e não como ATP,
como na glicólise. O mecanismo de regulação da VPF não é ainda conhecido porém
sabe-se que o fluxo é maior nas formas proliferativas.
A enzima sedoeptulose 1,7-bisfosfatase (S1,7BPase) é uma enzima que parece estar
presente exclusivamente em cloroplastos e envolvida no ciclo de Calvin. Embora esta
seqüência gênica tenha sido detectada em T. cruzi e outros tripanossomatideos (T.
brucei e L. major), os genes que codificam a ribulose-1,5-bisfosfatase carboxilase
("rubisco") e outras enzimas do ciclo não foram ainda encontrados. Por outro lado,
como o ciclo de Calvin e a via das pentoses são processos intrinsecamente organizados
e possuem enzimas comuns, foi postulado que em tripanossomatídeos a S1,7BPase
pode estar envolvida de uma maneira não usual, porém até a presente data não
demonstrada, ou identificada para a via das pentoses. O substrato da S1,7BPase, em
cloroplastos é formado pela ação de uma aldolase bifuncional que pode realizar a reação
regular da via glicolítica, condensação do gliceraldeído 3-fosfato e diidroxiacetona
fosfato a frutose 1,6-bisfosfato, e também a condensação da gliceraldeído 3-fosfato e
eritrose 4-fosfato a S1,7BPase. A aldolase glicolítica pode realizar somente a reação no
sentido reverso.
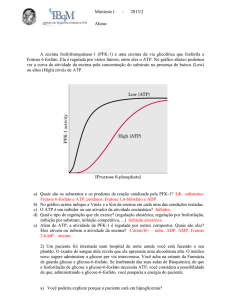
Regulação
A regulação da VPF ainda não é bem entendida entretanto um alto fluxo é
indiscutivelmente necessário nas formas proliferativas. Nas formas sanguíneas de T.
brucei, o fluxo relativo através da VPF é negligenciável, como sugerido pela medida de
piruvato produzido através da glicólise. Em células cultivadas a quantidade de piruvato
produzido aproxima-se de duas moléculas por molécula de glicose consumida. Portanto,
a interligação da glicólise com a VPF parecer ser pequena. Além disso, as enzimas da
VPF possuem baixa atividade específica comparada às da via glicolítica. Contudo, as
atividades específicas são consideravelmente altas em formas procíclicas de T. brucei e
em promastigotas de Leishmania. Em geral, na maioria dos organismos eucarióticos,
quando as trocas energéticas das células são altas, o fornecimento de glicose-6-fosfato
pela VPF também é alta e depende da relação ATP/ADP e NADPH/NADP. As duas
desidrogenases convertem NADP em NADPH e a enzima pode ser inibida
competitivamete pelo NADPH. Quando a taxa ATP/ADP é baixa, a glicose é consumida
pela glicólise produzindo ATP; a síntese de ácidos graxos não ocorre e a relação
NADPH/NADP é alta, conseqüentemente inibindo a VPF. Entretanto, se a relação
ATP/ADP é alta, a via glicolítica poderá ser inibida e a síntese de ácidos graxos ocorre,
consumindo NADPH e desbloqueando as desidrogenases.
Acetil-CoA como um intermediário importante
Acetil-CoA é um metabólito intermediário chave do metabolismo de carboidratos,
aminoácidos e ácidos graxos. O catabolismo das principais fontes de carbono (glicose,
L-prolina e L-treonina) geram a formação de acetil-CoA (Figura 1). A maioria do piruvato
produzido pela glicolítica é descarboxilado a acetil-CoA pelo complexo piruvato
desidrogenase mitocondrial (PDH, etapa 25). As primeiras observações em diferentes
tripanossomatideos sugeriram, que o acetil-CoA produzido pelo metabolismo da glicose
deveria ser convertido em CO2 e acetato através do ciclo dos acidos tricarboxílicos
(ATC). Entretanto, estudos recentes envolvendo o uso de tripanossomos procíclicos
contendo o gene da aconitase nocauteado (etapa 30) revelaram que a maioria do acetilCoA é convertido em acetato excretado. É sabido que todas as formas adaptativas de
tripanossomatideos analisados até o momento (exceto as formas sanguíneas de T.
brucei) produzem acetato a partir de glicose, mostrando a importância desta via na
produção de ATP. O acetato é produzido por duas enzimas: acetato:succinato CoAtransferase (ASCT, etapa 26) que transfere o CoA do acetil-CoA ao succinato,
fornecendo acetato e succinil-CoA que é subseqüentemente reconvertido em succinato
pela succinil-CoA sintetase (SCS, etapa 28) com concomitante produção de ATP.
Por outro lado, o acetil-CoA produzido pelas várias vias catabólicas pode ser usado
para a biossíntese de lipídeos, da mesma forma a glicose e L-treonina são substratos
para a biosíntese de ácidos graxos, através da produção de acetil-CoA. Desde que este
processo ocorre no interior da mitocôndria, e a síntese de ácidos graxos no citoplasma,
o acetil-CoA e oxaloacetato são condensados a citrato pela citrato-sintase (etapa 29) que
é então trocado pelo malato citoplasmático e convertido de novo em acetil-CoA e
oxaloacetato pela citrato-liase (etapa 42). Embora o genoma dos tripanossomatídeos
possua genes codificados da citrato-liase e citrato-liase, resultados experimentais
sugerem a existência de outros possíveis sistemas de trocas que alimentam as vias
anabólicas e a biossíntese de lipídeos.
Acetyl-CoA
as
an
intermediary
metabolite
Acetyl-CoA is a key intermediary metabolite involved in the metabolism of
carbohydrates, amino acids and fatty acids. The catabolism of each of the major carbon
sources (glucose, L-proline and L-threonine) leads to the formation of acetyl-CoA (Fig.1).
Most of the pyruvate produced from glucose by glycolysis is decarboxylated to acetylCoA by the mitochondrial pyruvate dehydrogenase complex (PDH, step 25). Early models
proposed that, in most trypanosomatids, acetyl-CoA produced from the glucose
metabolism is converted into CO2 through the tricarboxylic acid (TCA) cycle and into
acetate. However, the recent analysis of an aconitase (step 30) knockout mutant revealed
that acetyl-CoA does not fuel the TCA cycle of the procyclic trypanosomes grown in a
glucose-rich medium. Consequently, most acetyl-CoA (if not all) is converted into the
excreted acetate. It is noteworthy that all the trypanosomatid adaptive forms analysed so
far (except T. brucei bloodstream forms) produce acetate from glucose, stressing the
importance of this pathway, probably for ATP production. Acetate is produced by a twoenzyme cycle: acetate:succinate CoA-transferase (ASCT, step 26) transfers the CoA
moiety of acetyl-CoA to succinate, yielding acetate and succinyl-CoA that is
subsequently reconverted into succinate by succinyl-CoA synthetase (SCS, step 28) with
the
concomitant
production
of
ATP.
Likewise, acetyl-CoA produced by various catabolic pathways can be used for lipid
biosynthesis, in which glucose and L-threonine were found to be substrates for fatty acid
biosynthesis through the production of acetyl-CoA. Since this process occurs inside the
mitochondrion, whereas biosynthesis of fatty acids takes place in the cytosol, acetylCoA has to be transferred from the mitochondrion to the cytoplasm probably via citrate;
acetyl-CoA and oxaloacetate are condensed to citrate by citrate synthase (step 29),
which is then exchanged for malate from the cytosol to be converted back into acetylCoA and oxaloacetate by citrate lyase (step 42). Although trypanosomatids genome
encodes citrate synthase and citrate lyase, existing experimental data suggest the
existence of other possible exchange systems to feed anabolic pathways and lipid
biosynthesis.
Produção de ATP
As células eucarióticas desenvolveram várias alternativas de controle da fosforilação
oxidativa, incluindo a regulação pela disponibilidade de substrato como o oxigênio, ADP
e equivalentes redutores. Estes últimos podem desempenhar um papel importante,
desde que o catabolismo da L-prolina produza aproximadamente cinco vezes mais
equivalentes redutores do que o catabolismo da glicose. O grau de acoplamento entre a
respiração e fosforilação oxidativa pode também estar sob controle. Dois distintos
processos regulatórios têm sido descritos em eucariotos: o sistema de dissipação do
potencial eletroquímico de prótons representado pelo não acoplamento de proteínas e
os sistemas de dissipação potencial redox representados por oxidases alternativas.
Somente este último tem sido descrito em tripanossomatideos (etapa 47). A
transferência de elétrons através da via mediada por citocromos (complexos III e IV) está
acoplada a produção de ATP através da geração de um gradiente de prótons.
Contrastando, o fluxo de elétrons através da ubiquinol pela via oxidase alternativa não
está acoplada à produção de ATP. Este sistema ambígüo pode fornecer bastante
flexibilidade para modular a geração de um gradiente de prótons e então estar envolvido
na regulação da fosforilação oxidativa.
Até recentemente, era aceito que a maioria dos tripanossomatídeos cultivados em
um meio primário rico produziam ATP através da fosforilação oxidativa. Além disso, toda
a engrenagem enzimática para um metabolismo oxidativo está presente na maioria das
formas adaptativas. Isso inclui uma cadeia respiratória contendo citocromos funcionais
capazes de gerar um gradiente de próton, e também duas oxidases terminais (complexo
IV-citocromo-oxidase sensível a cianeto e uma oxidase alterativa sensível a salicílicohidroxâmico-etapa 47).
Neste modelo, o gradiente de prótons gerados pela cadeia respiratória (complexos I,
III and IV) é usado pela F0F1-ATP sintetase (etapa 48), considerada o principal sítio de
formação de ATP. Entretanto, o papel essencial da síntetase-F0F1-ATP na produção de
energia, em condições de excesso de glicose, tem sido questionada recentemente. Além
disso, um excesso de oligomicina, um inibidor específico da F0F1-ATP sintetase não
afeta a viabilidade das formas e uma grande quantidade é necessária para matar as
células em meio rico de glicose. Em contraste, quando cultivadas em meio sem glicose
as mesmas células tornam-se 1000 vezes mais sensíveis a oligomicina, sugerindo que,
em presença de glicose, as células não são dependentes da fosforilação oxidativa para a
produção de ATP. Em presença de glicose, quando as células desviam seu metabolismo
para o catabolismo de aminoácidos, a fosforilação oxidativa torna-se essencial. Este fato
implica também que, num meio rico em glicose, a maioria do ATP é produzido por
fosforilação em nível de substrato, tendo como enzimas chaves a PGK citosólica (etapa
10), PYK (etapa 13) e a SCS mitocondrial (etapa 28). Por outro lado, foi estimado que a
produção de ATP pela fosforilação em nível de substrato é pelo menos tres vezes maior
em meio rico de glicose do que em meio sem glicose. Portanto, as recentes evidências
experimentais apontam que a ATP-sintetase F0F1- mitocondrial possui um papel
negligenciável em tripanossomos cultivados em meio rico de glicose, e que a maioria da
ATP é sintetizado por fosforilação em nível de substrato. Entretanto, como os
tripanossomos regulam a fosforilação oxidativa é ainda uma questão a ser definida.
Existe a fermentação aeróbica em T. cruzi?
Como mencionado anteriormente, quando os tripanossomatideos crescem em
um meio rico (contendo alta concentração de glicose e aminoácidos) degradam glicose e
aminoácidos em produtos finais parcialmente oxidados, pela fermentação aeróbica
(fermentação na presença de oxigênio). Aparentemente, a fermentação aeróbica é a
conseqüência da ausência de um efeito Pasteur (inibição da glicólise na presença de
oxigênio), contudo o princípio básico da estratégia metabólica desenvolvida pelos
parasitos não está clara. Numerosos organismos usam a fermentação na ausência de
oxigênio, entretanto, os estágios presentes no inseto não estão acostumados a um
crescimento contínuo em condições aeróbicas. Os epimastigotas de T. cruzi têm uma
baixa capacidade de funcionar em anaerobiose e têm um reduzido cosumo de glicose
durante a hipóxia ou estresse oxidativo, portanto, é dependente da respiração para
proliferar. Indubitavelmente, a fermentação aeróbica não é nem uma preadaptação a, e
nem a necessidade de um estilo de vida aeróbico em que o parasito pode necessitar
desenvolver-se no inseto vetor. É também notável o desenvolvimento pelos insetos de
um complexo de tubos interconectados (o sistema traqueal) que transportam oxigênio e
outros gases através do corpo. Este sistema permite que as formas do inseto possam
proliferar em condicões aeróbicas e não necessitem de uma adaptação longínqüa em
ausência de oxigênio. Além disso, a alta concentração de glicose encontrada no sague
(5 mM) favorece a produção de ATP pela via glicolítica. Sob estas condições o
metabolismo oxidativo não é necessário e esta forma adaptativa down-regulate a
expressão das enzimas do ciclo dos ATC e componentes da cadeia respiratória, apesar
da presença do oxigênio que é importante para remover o excesso de equivalentes
redutores pela oxidase alternativa. O estágio do inseto de T. brucei cresce em um
ambiente natural rico em prolina, porém prefere glicose à prolina quando disponível um
meio rico. Como proposto o excesso de glicose (6 mM) combinado com a falta de um
efeito “Pasteur” permite um relativo alto fluxo glicolítico suficiente para gerar ATP por
fosforilação em nível de substrato. Consequentemente, para down-regulate o
metabolismo oxidativo dos tripanossomos procíclicos necessitam provavelmente da
ATP-sintase F0F1, cadeia respiratória e ciclo dos ATC funcionais. Esta hipótese é
consistente com a dramática diminuição da sensibilidade à oligomicina observada no
meio rico em glicose comparado ao sem glicose, que é interpretado como downregulation da fosforilação oxidativa. A down-regulation do consumo da L-prolina no meio
rico em glucose fortalece esta opção, uma vez que o catabolismo da L-prolina pode
estimular a fosforilação oxidativa pela geração de cinco vezes mais equivalentes
redutores do que o catabolismo da glicose (equivalentes redutores produzidos pela
glicólise são primeiramente reoxidados pela fermentação succinica). Este modelo foi
baseado nos resultados de T. brucei procíclicos, contudo podem ser aplicados ao
estágio epimastigota (do inseto) do T. cruzi, que tambem prefere glicose aos
aminoácidos. O mecanismo deste efeito de repressão-glicose não é ainda conhecido.
Metabolismo de aminoácidos
Não existem evidências de que ocorra a síntese endogena de L-arginina ou
outros aminoácidos em T. cruzi. A L-arginina é obtida pelo parasito através de um
trasportador de alta afinidade independente de Na+ e é acumulado em acidocalcinomas,
organelas que servem como reservatório de aminoácidos básicos. Aparentemete, Larginina é precursor do *NO (uma molécula de multi-propriedades), fosfoseria e
possivelmente poliaminas.
Copyright© Doença de Chagas - Todos os Direitos Reservados