Kimikando-na-Lixa.webnode.pt
Ciências Físico-Químicas 10º ano
Ficha de trabalho nº8
“Tipos de ligações químicas e ligação covalente”
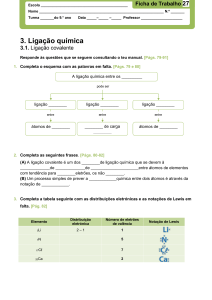
M13-14: Ligação química: é uma união estabelecida entre átomos para formarem moléculas ou, no caso de ligações iónicas ou
metálicas, aglomerados atómicos organizados de forma a constituírem a estrutura básica de uma substância ou composto.
Resulta das atracões e repulsões envolvendo eletrões e núcleos atómicos, conferindo ao conjunto de átomos, iões ou moléculas
ligadas uma menor energia do que quando separados (ligações intramoleculares).
As ligações intramoleculares são mais
fortes
que
as
ligações
intermoleculares (FT nº 9).
Iónica
Caraterísticas
Transferência de eletrões
Covalente
Partilha de eletrões
Metálica
Catiões de elementos metálicos
envoltos numa nuvem
eletrónica
Elementos
H; não metal ou semimetal
H ou não metal
H; não metal ou semimetal
Metal
Metal
Metal
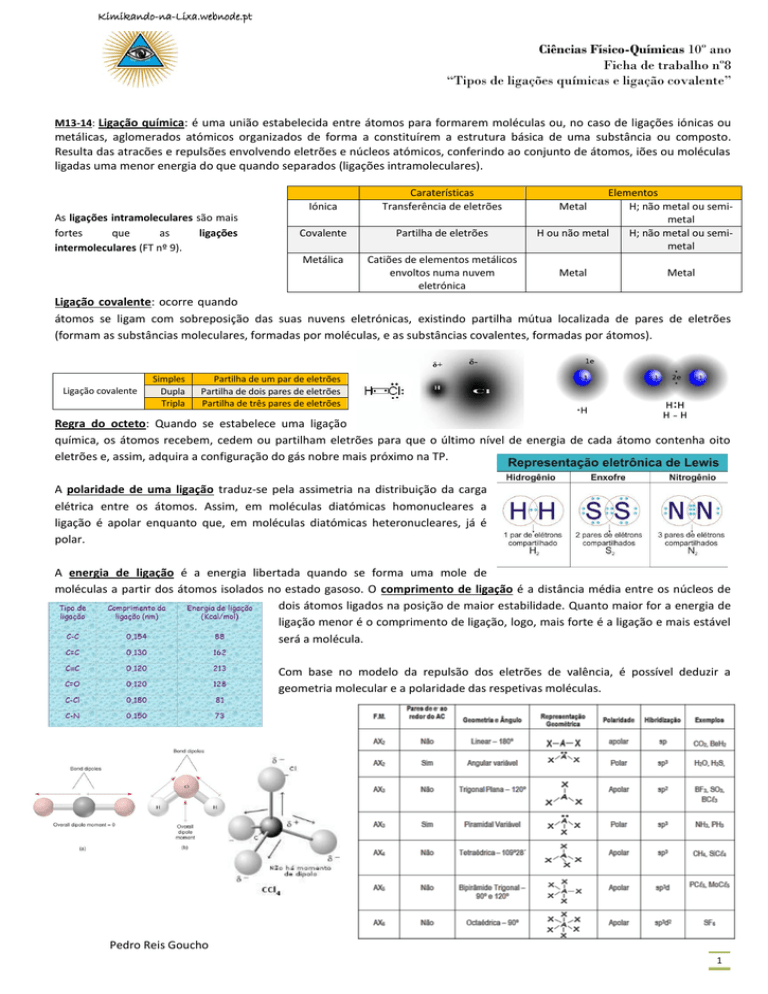
Ligação covalente: ocorre quando
átomos se ligam com sobreposição das suas nuvens eletrónicas, existindo partilha mútua localizada de pares de eletrões
(formam as substâncias moleculares, formadas por moléculas, e as substâncias covalentes, formadas por átomos).
Ligação covalente
Simples
Dupla
Tripla
Partilha de um par de eletrões
Partilha de dois pares de eletrões
Partilha de três pares de eletrões
Regra do octeto: Quando se estabelece uma ligação
química, os átomos recebem, cedem ou partilham eletrões para que o último nível de energia de cada átomo contenha oito
eletrões e, assim, adquira a configuração do gás nobre mais próximo na TP.
A polaridade de uma ligação traduz-se pela assimetria na distribuição da carga
elétrica entre os átomos. Assim, em moléculas diatómicas homonucleares a
ligação é apolar enquanto que, em moléculas diatómicas heteronucleares, já é
polar.
A energia de ligação é a energia libertada quando se forma uma mole de
moléculas a partir dos átomos isolados no estado gasoso. O comprimento de ligação é a distância média entre os núcleos de
dois átomos ligados na posição de maior estabilidade. Quanto maior for a energia de
ligação menor é o comprimento de ligação, logo, mais forte é a ligação e mais estável
será a molécula.
Com base no modelo da repulsão dos eletrões de valência, é possível deduzir a
geometria molecular e a polaridade das respetivas moléculas.
Pedro Reis Goucho
1
Kimikando-na-Lixa.webnode.pt
Ciências Físico-Químicas 10º ano
Ficha de trabalho nº8
“Tipos de ligações químicas e ligação covalente”
As ligações covalentes no átomo de carbono: o átomo de carbono estabelece geralmente ligações covalentes, partilhando os
seus 4 eletrões de valência com eletrões de outros átomos.
Hidrocarbonetos: são compostos constituídos exclusivamente por átomos de C e de H.
Dentro dos compostos orgânicos existem famílias de compostos que contêm grupos funcionais que lhes conferem propriedades físicoquímicas específicas.
Ligação metálica (e redes de átomos de metais): os
átomos dos metais possuem grande facilidade em ceder eletrões; por
isso são constituídos por uma rede de catiões em posições pouco
rígidas, rodeados de “eletrões livres”. Caraterizada pela partilha de
eletrões de valência deslocalizados por todos os átomos.
Ligação iónica (e redes de iões): carateriza-se por intensas forças de
interação eletrostática entre iões de carga contrária formados por
transferência de eletrões entre átomos, originando estruturas com
caráter iónico.
Pedro Reis Goucho
2
Kimikando-na-Lixa.webnode.pt
Ciências Físico-Químicas 10º ano
Ficha de trabalho nº8
“Tipos de ligações químicas e ligação covalente”
1.
O gráfico representa a variação de energia potencial de dois átomos em função da sua distância internuclear para a
formação de uma molécula diatómica.
1.1. Indica o que representa a distância da origem 0 ao ponto C.
1.2. O gráfico mostra que a energia potencial do sistema aumenta entre
as posições de energia mínima e B. Seleciona a que melhor explica a
afirmação anterior.
(A) Aumentam as atracões entre os núcleos dos dois átomos.
(B) Aumentam as repulsões entre as nuvens eletrónicas dos dois
átomos.
(C) Diminuem as repulsões entre os núcleos dos dois átomos.
(D) Aumenta a distância entre os dois átomos.
1.3. Em relação ao mesmo diagrama, indica a opção falsa.
(A) A maior estabilidade possível da molécula é atingida quando
-1
Ep=0kJmol .
(B) Quando se forma a molécula diatómica, esta adquire maior
estabilidade do que quando os átomos se encontram separados.
(C) O valor apresentado na abcissa do gráfico, correspondente a r e é o valor de energia necessário para romper uma mole
de ligações na molécula diatómica.
(D) Quanto menor a energia potencial da molécula maior é a sua estabilidade.
2.
Nas figuras I e II estão representados dois sólidos cristalinos aos quais estão associados dois tipos de ligação química.
Considerando-se estas informações, seleciona as opções corretas.
(A) A figura II corresponde a um sólido condutor de
eletricidade.
(B) A figura I corresponde a um sólido condutor de
eletricidade.
(C) A figura I corresponde a um material que, no estado líquido, é um isolante elétrico.
(D) A figura II corresponde a um material que, no estado líquido, é um condutor elétrico.
3.
Faz a correspondência correta entre as letras da coluna I e os números da coluna II.
Coluna I
A. Ligação covalente
B. Ligação iónica
C. Ligação metálica
D. Ligações intermoleculares
4.
Coluna II
1. Sem partilha significativa de eletrões
2. Partilha deslocalizada de eletrões
3. Partilha localizada de eletrões
4. Transferência de eletrões
As figuras representam, esquematicamente, estruturas de diferentes substâncias, à temperatura ambiente. De acordo com
a sequência I, II e III, seleciona das opções a que
corresponde à sequência de substâncias correta.
(A) Cloreto de sódio, dióxido de carbono e ferro.
(B) Cloreto de sódio, ferro e dióxido de carbono.
(C) Dióxido de carbono, ferro e cloreto de sódio.
(D) Ferro, cloreto de sódio e dióxido de carbono.
5.
A molécula de clorofórmio, CHCl3, pode representar-se por um modelo dito “de bolas” como a figura
ilustra.
5.1. Representa a molécula de clorofórmio na notação de Lewis.
5.2. Indica se a regra do octeto é satisfeita.
Pedro Reis Goucho
3
Kimikando-na-Lixa.webnode.pt
Ciências Físico-Químicas 10º ano
Ficha de trabalho nº8
“Tipos de ligações químicas e ligação covalente”
6.
6.1.
6.2.
6.3.
6.4.
6.5.
As moléculas de fluoreto de hidrogénio, usado no enriquecimento do urânio para a produção de energia nuclear, e os iões
cianeto, cujos sais têm larga utilização mas são muito tóxicos, têm, respetivamente, as fórmulas de estrutura apresentadas.
Indica, para cada uma das partículas:
Escreve a estrutura de Lewis do fluoreto de hidrogénio.
O nº de eletrões representados.
O nº de eletrões que ocupam a região internuclear.
O tipo de ligação estabelecida.
O nº de pares de eletrões não ligantes.
7.
7.1.
7.2.
7.3.
Considera as moléculas: Cl2; CO; HF, N2, F2, H2O, H2O2, FNO (fluoreto de nitrosilo), N2H4 (hidrazina) e Cl2CO (fosgénio).
Representa cada uma delas pela sua fórmula de estrutura, usando notação de Lewis.
Indica, justificando, as moléculas polares e as apolares.
Compara e justifica os comprimentos de ligação nas moléculas de Cl 2 e F2.
8.
Observa os compostos que estão representados pelas suas fórmulas de estrutura. Seleciona as opções corretas.
(A)
(B)
(C)
(D)
(E)
9.
A ligação O-H é sempre polar, porém o composto I é um líquido apolar.
A ligação C-Cl é uma ligação polar, mas o composto III é apolar.
A Ligação C=O é apolar, portanto, o composto II é apolar.
A ligação C=O é polar, mas o composto II é apolar.
A ligação N-H é polar e o composto IV é polar.
A cada letra da coluna I, associa um nº da coluna II (existem eletrões não ligantes no át. central?) e uma letra da coluna III.
Coluna I
A. CCl4
B. PH3
C. SF2
D. CS2
Coluna II
1. Sim
2. Não
Coluna III
a. Linear
b. Angular
c. Piramidal
d. Tetraédrica
10. O monóxido de carbono, CO, e o dióxido de carbono, CO 2, são gases que existem na atmosfera provenientes de fontes
naturais e de fontes antropogénicas. As moléculas podem ser representadas por: A ligação carbono-oxigénio na molécula
de CO2 tem … energia e … comprimento do que a ligação carbono-oxigénio na molécula de CO.
(A) Maior … maior.
(C) Menor … maior.
(B) Menor … menor.
(D) Maior … menor.
11. Utiliza os dados da tabela para responder às seguintes questões.
Molécula
HF
HBr
HI
Ligação
H-F
H-Br
H-I
-1
Energia lig (kJmol )
565
362
295
11.1. Os comprimentos de ligação de HF, HBr e HI podem ser, respetivamente:
(A) 161, 92 e 141 pm.
(C) 92, 141 e 161 pm.
(B) 141, 92 e 161 pm.
(D) 141, 161 e 92 pm.
Pedro Reis Goucho
4
Kimikando-na-Lixa.webnode.pt
Ciências Físico-Químicas 10º ano
Ficha de trabalho nº8
“Tipos de ligações químicas e ligação covalente”
11.2. O comprimento de ligação em HCl é 127 pm. Indica os dois valores da tabela que estabelecem o menor intervalo no qual é
espectável que se encontre o valor da energia de ligação do HCl.
12. Segundo a regra do octeto, os átomos tendem a combinar-se de modo a ter, cada um, oito eletrões na sua camada de
valência, ficando com a mesma configuração eletrónica de um gás nobre. A regra é aplicável, nomeadamente, ao carbono,
nitrogénio, oxigénio e, ainda, a metais como o sódio ou o magnésio.
12.1. Seleciona a opção que representa o tipo de configuração eletrónica de valência de um gás nobre, com exceção do hélio.
2
6
6
2
8
8
(A) ns np .
(B) np .
(C) ns np .
(D) np .
12.2. O átomo de nitrogénio quando combinado com três átomos de hidrogénio constitui a unidade estrutural do amoníaco
(NH3).
12.2.1. Indica o nº de eletrões de valência, ligantes e não ligantes, presentes na molécula de amoníaco.
12.2.2. Representa, com base na regra do octeto, a estrutura de Lewis do amoníaco.
12.2.3. Indica a geometria da molécula.
12.3. Outras combinações entre átomos dão origem a outras substâncias como as da tabela.
Substância
Dinitrogénio
Metano
Água
F.M.
N2
CH4
H2O
Sulfureto de
nitrogénio
H2S
Fluoreto de
hidrogénio
HF
Brometo de
hidrogénio
HBr
12.3.1. Prevê, com base no modelo da repulsão eletrónica, a geometria das moléculas de H 2O e H2S.
12.3.2. Relativamente às moléculas da alínea anterior podemos afirmar que:
(A) O comprimento da ligação H-O é maior do que o da ligação H-S.
(B) O comprimento da ligação H-O é menor do que o da ligação H-S.
(C) A energia de ligação H-O é menor do que a da ligação H-S.
(D) A energia de ligação H-O é igual à da ligação H-S.
12.3.3. Indica as substâncias polares.
12.3.4. Justifica o facto de HF e HBr, apesar de possuírem fórmulas de estrutura semelhantes, apresentarem
comprimentos de ligação 92 pm e 141 pm, respetivamente.
12.3.5. Apresenta a geometria das quatro primeiras substâncias da tabela.
-1
13. Calcula o valor da energia mínima para dissociar 5,0 g de Cl 2, sabendo que a energia de ligação no Cl2 é 242 kJmol .
14. Considera as moléculas de F2 e de HF.
14.1. Representa as suas fórmulas de estrutura.
14.2. Indica a afirmação que justifica que o comprimento de ligação em F2 seja maior que em HF.
(A) A molécula de F2 é apolar e o HF é polar.
(B) O átomo de F possui mais eletrões de valência que o átomo de H.
(C) A carga nuclear do F é superior à carga nuclear do H.
(D) O raio atómico do F é maior que o raio atómico do H.
14.3. Comparando as ligações nas moléculas podemos afirmar que…
(A) É necessária menos energia para separar os dois átomos em HF.
(B) A molécula HF possui mais eletrões ligantes.
(C) A energia de ligação é maior em HF.
(D) A ligação é mais fraca em HF.
15. Escreve as fórmulas de estrutura dos seguintes compostos:
(A) 2,2,4-trimetilpentano.
(D) 2,2-dimetilpentano.
(B) 4-bromo-2-cloro-3-metil-hexano.
(E) 2-cloro-1-fluoropropano.
(C) 3-etil-2,2,3-trimetil-hexano.
(F) Tetrafluorometano.
(G) 2,3-dibromobutano.
(H) 1-cloropropano.
Pedro Reis Goucho
5
Kimikando-na-Lixa.webnode.pt
Ciências Físico-Químicas 10º ano
Ficha de trabalho nº8
“Tipos de ligações químicas e ligação covalente”
16. Os principais constituintes do petróleo bruto e do gás natural são compostos orgânicos da família dos alcanos. Indica a
afirmação falsa.
(A) Os alcanos podem ter ligações carbono-carbono simples e duplas.
(B) Um dos átomos de carbono do 2,2-dimetilpropano está ligado a 4 átomos de carbono.
(C) Os alcanos são hidrocarbonetos por só conterem átomos de carbono e de hidrogénio.
(D) O hexano tem o mesmo nº de átomos de carbono do que o 2,3-dimetilbutano.
17. Indica os nomes dos compostos da figura.
18. Os hidrocarbonetos da figura apresentam a mesma fórmula química. Indica os seus nomes.
19. Considera os quatro hidrocarbonetos da figura.
19.1. Indica os seus nomes IUPAC.
19.2. Identifica um carbono primário, um secundário, um terciário e um quaternário.
20. Na tabela seguinte apresentam-se os valores das energias de ligação entre os átomos de carbono em 3 hidrocarbonetos.
Seleciona a opção que contem os valores possíveis para
o comprimento de ligação, em pm, das ligações nas
moléculas de etano, eteno e etino, respetivamente.
(A) 154: 133: 120
(B) 133: 120: 154
(C) 120: 154: 133
(D) 120: 133: 154
Pedro Reis Goucho
6
Kimikando-na-Lixa.webnode.pt
Ciências Físico-Químicas 10º ano
Ficha de trabalho nº8
“Tipos de ligações químicas e ligação covalente”
21. Outras famílias de compostos orgânicos, por possuírem outros átomos, como o oxigénio e o nitrogénio, são de extrema
importância a nível de química orgânica. A família de um composto é determinada pelo grupo funcional presente na
estrutura da molécula. Considera as seguintes fórmulas de estrutura e seleciona a opção correta para a sequência de
famílias.
(A)
(B)
(C)
(D)
Aldeído … álcool … cetona … ácido carboxílico … amina.
Cetona … aldeído … ácido carboxílico … álcool … amina.
Álcool … cetona … aldeído … ácido carboxílico … amina.
Álcool … aldeído … cetona … ácido carboxílico … amina.
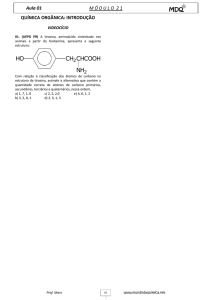
22. A dopamina é um composto químico percursor natural dos neurotransmissores adrenalina e noradrenalina produzidos no
cérebro. A desregulação desta substância está associada a problemas neuropsiquiátricos, como a doença de Parkinson.
22.1. Indica o nº de grupos funcionais que caraterizam cada uma das famílias de compostos orgânicos por ti estudados.
22.2. Indica o nº de átomos de cada espécie existentes numa molécula e escreve a sua fórmula química.
22.3. Indica o nº de átomos existentes em 250 g de dopamina.
23. O paracetamol é um fármaco usado no alívio de dores ligeiras e moderadas. A sua fórmula de estrutura é a representada na
figura seguinte.
23.1. Rodeia com um círculo o grupo caraterístico das aminas.
23.2. Identifica outros grupos caraterísticos de famílias de compostos orgânicos.
23.3. Indica o nº de átomos de hidrogénio e de carbono na molécula de paracetamol.
23.4. Indica, justificando, se o paracetamol é um composto aromático.
24. Identifica os grupos funcionais das seguintes moléculas orgânicas.
Pedro Reis Goucho
7