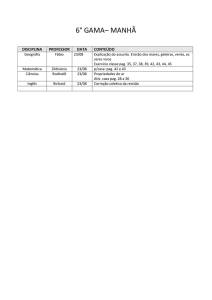
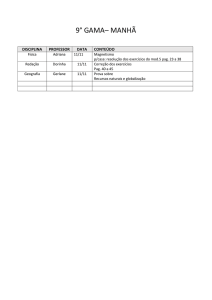
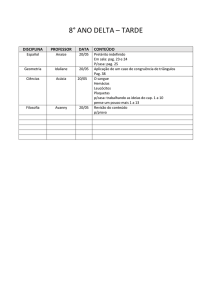
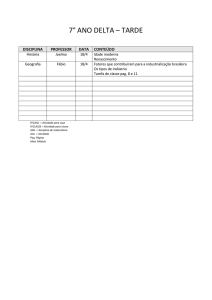
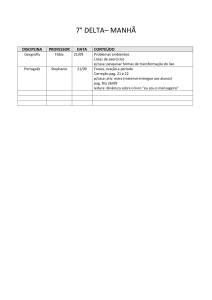
PAG Química – Termodinâmica
1. Escolha o termo melhor associado com cada exemplo, símbolo ou relação:
(A)
(B)
(C)
(D)
(E)
(F)
endotérmico
calor de formação
estado padrão
exotérmico
entalpia
calor de combustão
(1) ΔS
(2) ΔH < 0
(3) ΔH para C (grafite) + 2 H2 (g) → CH4 (g)
(4) ΔG > 0
(5) ΔH > 0
(6) H2O (l), 25ºC e 1 atm
(7) ΔG
(8) H
(9) ΔH para C (grafite) + 4 H (g) → CH4 (g)
(10) ΔH para 2 C2H6 (g) + 7 O2 (g) → 4 CO2 (g) + 6 H2O (l)
PAG Química – Termodinâmica
2. Diga se cada uma das reações a seguir, se realizada de maneira isotérmica,
pode exercer trabalho de expansão sobre as vizinhanças. Justifique.
a) CH4 (g) + 2 O2 (g) ⎯→ CO2 (g) + 2 H2O (g)
b) CaCO3 (s)⎯→CaO (s) + CO2 (g)
c) 2 CO (g) + O2 (g) ⎯→ 2 CO2 (g)
d) 2 N2O (g)⎯→ 2 N2 (g) + O2 (g)
PAG Química – Termodinâmica
3. Escreva as equações termoquímica para a fusão e a vaporização de um mol
de água. A partir destes dados, proponha uma expressão que permita calcular a
variação de entalpia para a sublimação de um mol de água sólida.
PAG Química – Termodinâmica
4. a) na sua opinião o inferno é endotérmico ou exotérmico? Justifique.
b) o calor é característica de um sistema ou de um processo? Justifique.
c) por que é mais comum falar-se em variação de entalpia (ΔH) de um processo
do que em variação de energia (ΔU)?
d) por que o calor de formação de um elemento no seu estado padrão é zero?
PAG Química – Termodinâmica
Resposta da internet: Primeiramente, postulamos que se almas existem então elas
devem ter alguma massa. Se elas tem, então um mol de almas também tem massa.
Então, a que taxa as almas estão se movendo para fora e a que taxa elas estão se
movendo para dentro do inferno? Eu acho que podemos assumir seguramente que
uma vez que uma alma entra no inferno ela nunca mais sai. Por isso, não há almas
saindo. Para as almas que entram no inferno, vamos dar uma olhada nas diferentes
religiões que existem no mundo hoje em dia. Algumas dessas religiões pregam que se
você não pertencer a ela, você vai para o inferno. Como há mais de uma religião
desse tipo e as pessoas não possuem duas religiões, podemos projetar que todas as
pessoas e almas vão para o inferno. Com as taxas de natalidade e mortalidade do
jeito que estão, podemos esperar um crescimento exponencial das almas no inferno.
Agora vamos olhar a taxa de mudança de volume no inferno. A Lei de Boyle diz que
para a temperatura e a pressão no inferno serem as mesmas, a relação entre a
massa das almas e o volume do inferno deve ser constante. Existem então duas
opções:
1) Se o inferno se expandir numa taxa menor do que a taxa com que as almas
entram, então a temperatura e a pressão no inferno vão aumentar até ele explodir.
2) Se o inferno estiver se expandindo numa taxa maior do que a entrada de almas,
então a temperatura e a pressão irão baixar ate que o inferno se congele.
Então, qual das duas? Se nós aceitarmos o que a maior gata da UFRGS me disse no
primeiro ano: "haverá uma noite fria no inferno antes de eu me deitar contigo e
levando-se em conta que ainda NÃO obtive sucesso na tentativa de ter relações com
ela, então a opção 2 não é verdadeira. Por isso, o inferno é exotérmico.
PAG Química – Termodinâmica
5. Um mol de CaCO3 foi aquecido a 700o C até sua decomposição. A operação foi
realizada em um cilindro fechado por um pistão, sempre contra a pressão atmosférica.
Qual o trabalho (em J) realizado pela reação CaCO3 (s) → CaO (s) + CO2 (g)?
PAG Química – Termodinâmica
6. Um mol de um gás ideal com Cp = 5 cal/molK e Cv = 3 cal/molK,
inicialmente nas CNTP, sofre uma transformação reversível em que seu
volume é duplicado. A natureza do processo não é especificada, porém sabese que ΔH = 500 cal e q = 400 cal.
a) calcule a temperatura e a pressão finais, assim como ΔU e w do processo
b) se o gás fosse levado às mesmas condições finais por um processo
constando de uma transformação isométrica e uma isotérmica, ambas
reversíveis, quais seriam os valores de ΔH, e ΔU para o processo total, neste
caso?
PAG Química – Termodinâmica
PAG Química – Termodinâmica
7. Uma certa massa de CO2 , num estado caracterizado pela temperatura T1,
pressão P1 e volume V1, sofre um processo I que leva o gás ao estado T2, P2,
V2. A seguir, o gás sofre um outro processo (II), que o traz de volta ao seu
estado inicial. A respeito dos processos I e II, justifique se as informações
abaixo são falsas ou verdadeiras:
a) o calor trocado no processo I é necessariamente igual ao trocado no
processo II.
b) o calor trocado no processo global (I + II) é nulo.
c) o trabalho trocado no processo I é necessariamente igual ao trocado no
processo II.
d) o trabalho trocado no processo global (I + II) é nulo.
e) a energia interna do gás após o processo global (I + II) não sofre variação.
U
PAG Química – Termodinâmica
8. Acetileno (C2H2) é usado como combustível no maçarico de oxi-acetileno, para
soldar. A reação é: C2H2 (g) + 2,5 O2 (g) → 2 CO2 (g) + H2O (g)
a) sem fazer cálculos, preveja se a reação é exotérmica ou endotérmica
b) calcule a entalpia da reação.
Dados: ΔHof CO2 (g) = - 393,51 kJ/mol; ΔHof H2O (g) = - 241,82 kJ/mol; ΔHof C2H2 (g)
= 226,73 kJ/mol
PAG Química – Termodinâmica
9. Quando uma amostra de 1 mol de octano, um dos componentes da
gasolina, é queimado com excesso de oxigênio em uma bomba calorimétrica
a 25o C, a temperatura aumenta para 81,22o C.
C8H18 (l) + 25/2 O2 (g) à 8 CO2 (g) + 9 H2O (l)
a) qual o valor de ΔUo e de ΔHo molares de combustão do C8H18?
b) quantos mols de octano são necessários queimar para aquecer uma xícara
(250 g) de água de 25o C para 99o C, a pressão constante?
Dados: c (H2O, l) = 4,18 J.g-1.K-1. A capacidade calorífica total da bomba
calorimétrica é 97,1 kJ/K.
PAG Química – Termodinâmica
9
U
U
U
12,5
-5466,4 kJ/mol
ou ΔH = ΔU + ΔngRT
5466370 J
1,41
PAG Química – Termodinâmica
10. A equação termoquímica para a combustão do propano é:
C3H8 (g) + 5 O2 (g) → 3 CO2 (g) + 4 H2O (l)
ΔHocomb = - 2221,6 kJ/mol
Calcule:
a) o calor necessário para aquecer 250 mL de água de 20o C para 100o C (c =
4,18 J/g, d = 1 g/mL).
b) o calor necessário para vaporizar os mesmos 250 mL de água líquida a vapor,
na temperatura de 100o C e pressão constante de 1 atm (ΔHof H2O (l) = - 286 kJ/
mol, ΔHof H2O (v) = - 242 kJ/mol).
c) o calor total requerido para aquecer e vaporizar os 250 mL de água.
d) a massa de gás propano que deve ser queimada para promover o
aquecimento e a vaporização, de acordo com o item c.
e) a variação de energia interna (ΔUo) da combustão do propano, molar e para a
massa calculada em no item d.
ΔU
ΔU
ΔU
ΔU
ΔU
ΔU
PAG Química – Termodinâmica
11. A equação termoquímica para a combustão do butano é:
C4H10 (g) + 13/2 O2 (g) → 4 CO2 (g) + 5 H2O (l)
mol
ΔHocomb = - 2879,5 kJ/
Calcule:
a) o calor necessário para aquecer 250 mL de água de 20o C para 100o C (c =
4,18 J/g, d = 1 g/mL).
b) o calor necessário para vaporizar os mesmos 250 mL de água líquida a vapor,
na temperatura de 100o C e pressão constante de 1 atm (ΔHof H2O (l) = - 286 kJ/
mol, Δ Hof H2O (v) = - 242 kJ/mol).
c) o calor total requerido para aquecer e vaporizar os 250 mL de água.
d) a massa de gás propano que deve ser queimada para promover o aquecimento
e a vaporização, de acordo com o item c.
e) a variação de energia interna (ΔUo) da combustão do butano, molar e para a
massa calculada em no item d.
C4H10 (g) + 13/2 O2 (g) → 4 CO2 (g) + 5 H2O (l)
58
58
C4H10
2879,5
13,99
ΔU
-2879500
-2879500
ΔU
-2872, 1
ΔU
ΔU
-2872067,3
58
13,99
ΔU
ΔU
8
-2872, 1
PAG Química – Termodinâmica
12. Uma amostra de sacarose, C12H22O11 (s), pesando 3,85 g, é queimada
em uma bomba calorimétrica contendo 6 litros de água. A temperatura total
do sistema bomba calorimétrica + água subiu de 23,40 para 25,64o C. O
calor específico da água, c, é 4,18 J/gK, a capacidade calorífica da bomba,
C, é 3180 J/K e a densidade da água é 1 g/mL
a) escreva a reação de combustão da sacarose, considerando que os
produtos são água líquida e gás CO2.
Calcule:
b) o calor total absorvido pela bomba calorimétrica e pela água.
c) o calor liberado pela reação.
d) ΔUo e ΔHo molar de combustão da sacarose
PAG Química – Termodinâmica
PAG Química – Termodinâmica
13. Em uma bomba calorimétrica foram queimados 2,56 gramas de enxofre com
excesso de oxigênio. A bomba contém 815 gramas de água. A temperatura do
conjunto bomba calorimétrica + água se elevou de 21,25°C para 26,72ºC. A
capacidade calorífica da bomba é 923 J/K e o calor específico da água é 4,184 J/g.K.
a) calcule o calor total absorvido pela bomba calorimétrica e pela água.
b) calcule o calor liberado pela reação:
S8 (s) + 8 O2 (g) → 8 SO2 (g)
c) calcule ΔUo molar de combustão do enxofre sólido.
d) calcule ΔHo molar de combustão do enxofre sólido.
Suponha agora que, por não ter prestado atenção na explicação recebida, o aluno
colocou 1000 g de água no calorímetro.
e) qual o aumento de temperatura observado?
f) qual o valor de ΔUo molar de combustão do enxofre sólido nestas condições?
g) qual o valor de ΔHo molar de combustão do enxofre sólido nestas condições?
PAG Química – Termodinâmica
14. Um calorímetro foi calibrado com um aquecedor elétrico. Este aquecedor
doou 22,5 kJ de energia ao calorímetro, que teve sua temperatura aumentada
de 20o C para 23,59o C. A combustão de 1,84 g de Mg no mesmo calorímetro
levou a temperatura de 21,30o C para 28,56o C. A reação envolvida é:
Mg (s) + 1/2 O2 (g) → MgO (s)
Calcule:
a) a capacidade calorífica total (C) do calorímetro.
b) a variação da energia interna molar da reação de combustão do Mg.
Massa do magnésio: 24 g/mol
PAG Química – Termodinâmica
15. Determine a entalpia de formação do carbeto de tungstênio (WC),
sabendo os calores de combustão dos elementos e do próprio carbeto de
tungstênio:
2 W (s) + 3 O2 (g) à 2 WO3 (s)
ΔH = - 1680,6 kJ
C (s) + O2 (g) à CO2 (g)
ΔH = - 393,5 kJ
2 WC (s) + 5 O2 à 2 WO3 (s) + 2 CO2 (g) ΔH = - 2391,6 kJ
PAG Química – Termodinâmica
16. Dadas as variações de entalpia a 298 K para as reações abaixo, determine ΔHo
nesta temperatura para a reação:
3 NO2 (g) + H2O (l) → 2 HNO3 (l) + NO (g)
4 NH3 (g) + 5 O2 (g) → 4 NO (g) + 6 H2O (l)
NH4NO3 (s) → N2O (g) + 2 H2O (l)
NO (g) + 1/2 O2 (g) → NO2 (g)
3 NO (g) → N2O (g) + NO2 (g)
NH3 (g) + HNO3 (l) → NH4NO3 (s)
ΔHo = - 1169,2 kJ
ΔHo = - 125,2 kJ
ΔHo = - 56,6 kJ
ΔHo = - 155,8 kJ
ΔHo = - 145,7 kJ
PAG Química – Termodinâmica
17. É possível formar um composto interhalogenado ICl (g) a partir da
reação entre I2 (s) e Cl2 (g). Calcule o calor de formação de ICl (g),
sabendo que as energias de dissociação de ICl (g), I2 (g) e Cl2 (g) (ΔHo,
em kcal/mol) são respectivamente 50,5; 36,1 e 57,9; o calor de
sublimação de I2 (s) é 15 kcal/mol e que o iodo e o cloro atômicos só
existem em fase gasosa.
PAG Química – Termodinâmica
18. Determine ΔHo, ΔSo e ΔGo a 298 K para a reação abaixo,
P4O10 (s) + 6 PCl5 (g) → 10 POCl3 (g)
utilizando o conjunto de dados a seguir:
1/4 P4 (s) + 3/2 Cl2 (g) → PCl3 (g)
ΔHo = - 306,4 kJ
P4 (s) + 5 O2 (g) → P4O10 (s)
ΔHo = - 2967,3 kJ
PCl3 (g) + Cl2 (g) → PCl5 (g)
ΔHo = - 84,2 kJ
PCl3 (g) + 1/2 O2 (g) → POCl3 (g)
ΔHo = - 285,7 kJ
Dados: So (P4O10 (s)) = 210,2 J/molK; So (PCl5 (g)) = 364,6 J/molK; So (POCl3
(g))= 217,2 J/molK.
PAG Química – Termodinâmica
/K
PAG Química – Termodinâmica
19. O óxido de ferro(III) (ferrugem) pode ser produzido a partir do ferro e do
oxigênio numa seqüência de reações que pode ser escrita como:
2 Fe (s) + 6 H2O (l) à 2 Fe(OH)3 (s) + 3 H2 (g)
2 Fe(OH)3 (s) à Fe2O3 (s) + 3 H2O (l)
3 H2 (g) + 3/2 O2 (g) à 3 H2O (l)
a) calcule a entalpia molar padrão em cada etapa da reação, usando os dados
tabelados
b) calcule o ΔGo da primeira etapa da reação e diga se esta etapa da reação é
espontânea a 25o C.
Dados:
Fe(s)
ΔHof (kJ/mol)
So (J/mol.K)
27,13
Fe(OH)3(s)
-696,5
79,12
Fe2O3(s)
-821,37
89,87
H2(g)
130,46
O2(g)
H2O(l)
-285,57
204,83 69,87
PAG Química – Termodinâmica
PAG Química – Termodinâmica
20. Para a seguinte reação química, em que são fornecidas as entalpias
padrão de formação e as entropias absolutas padrão dos reagentes e
produtos:
2 Fe2O3 (s) + 3 C (s) → 4 Fe (s) + 3 CO2 (g)
ΔHof (kJ/mol)
-824,2
0
0
-393,5
So (J/mol)
87,4
5,7
27,3
213,6
Calcule:
a) ΔHoreação; ΔUoreação; ΔSoreação; ΔGoreação.
b) esta reação ocorre na temperatura padrão? Qual fator (entrópico ou
entálpico) contribui para que esta reação ocorra espontaneamente a 298 K?
Justifique sua resposta.
c) calcule a temperatura a partir da qual a reação ocorre, considerando que
ΔHoreação e ΔSoreação não variam significantemente com a temperatura.
PAG Química – Termodinâmica
/K
PAG Química – Termodinâmica
PAG Química – Termodinâmica
21. Para a reação de oxidação do óxido de nitrogênio abaixo representada, são
dados os seguintes parâmetros:
NO (g) + O3 (g)
à
NO2 (g) + O2 (g)
ΔHof (kJ/mol)
90,3
142,7
33,2
0
So (J/molK)
210,7 238,8
240,0
205,7
a) calcule ΔGo para esta reação a 298 K.
b) calcule ΔG para esta reação a 298 K quando as pressões parciais de todos os
gases forem iguais a 1atm. A reação é espontânea nessas condições?
c) calcule ΔG para esta reação a 298 K quando as pressões parciais de NO, O3,
NO2 e O2 forem 10, 5, 1 e 2 atm, respectivamente.
d) nas condições da alínea c, a reação está em equilíbrio? Se não estiver, em
que sentido ocorre a reação?
e) quais os valores de ΔG e Kp a 298 K nas condições de equilíbrio?
f) analisando os valores de ΔGo e Kp, esta reação é viável? Justifique sua
resposta.
PAG Química – Termodinâmica
a) ΔHo = -33,2 + 0 -90,3 – 142,7 = -199,8 kJ
ΔSo = 240,0 + 205,7 – 210,7 – 238,8 = - 3,8 J/K
ΔGo = -199,8 – 298 x 10-3 x (-3,8) = -198,67 kJ
b) ΔGo = -198,67 kJ
c) ΔG = ΔGo + RT ln Qp
ΔGo = -198,67 + 8,314 x 10-3 x 298 x ln [(1 x 2)/(10 x 5)] = -206,64 kJ
d) não, à
e) ΔG = 0, Kp = exp (-ΔGo/RT) = exp [198670/( 8,314 x 298)] = 6,68 x 1034
f) sim, muito
PAG Química – Termodinâmica
22. A amônia na presença de catalisador de platina, queima ao oxigênio
formando NO, segundo a reação 4 NH3 (g) + 5 O2 (g) → 4 NO (g) + 6
H2O (g)
Dados: ΔGof, 298 (NH3 (g)) = - 16,45 kJ/mol; ΔGof, 298 (NO (g)) = + 86,55 kJ/mol;
ΔGof, 298 (H2O (g)) = - 228,57 kJ/mol,
a) calcule ΔGo para esta reação a 298 K.
b) mostre como poderia ser calculado o valor de Kp a 298 K e comente a sua
ordem de grandeza.
c) que conclusão pode-se chegar com relação à composição do sistema no
equilíbrio. Justifique sua resposta.
d) calcule ΔG para esta reação a 298 K quando as pressões parciais da NH3,
O2, NO e H2O forem 0,6; 0,4; 0,5 e 0,4 atm respectivamente.
e) nas condições da alínea d, a reação está em equilíbrio? Se não estiver, em
que sentido ocorre a reação?
f) qual o valor de ΔG nas condições de equilíbrio?
g) analisando os resultados anteriores, você julga esta reação viável?
Justifique sua resposta.
PAG Química – Termodinâmica
PAG Química – Termodinâmica
23. Seja a reação H2 (g) + CO2 (g) à H2O (g) + CO (g), para a qual são dados:
ΔHof (kcal/mol)
0
-94.1
-57.8
-26.4
So (cal/molK)
31.2
51.1
45.1
47.3
(dados obtidos para a temperatura de 25o C)
a) explique, justificando, se a reação é espontânea, a 25o C
b) calcule a temperatura a partir da qual a espontaneidade dessa reação tem
seu sentido invertido, assumindo que ΔHo e ΔSo não variam significantemente
com a temperatura
c) calcule ΔG desta reação a 25o C quando as pressões parciais de H2, CO2,
H2O e CO forem 10; 20; 0,02 e 0,01 atm, respectivamente.
c) analisando o valor de ΔG obtido acima, a reação está em equilíbrio? Se não,
em que sentido ela ocorrerá?
d) quais os valores de ΔG e Kp nas condições de equilíbrio, a 25o C?
e) na sua opinião, esta reação é industrialmente viável? Justifique.
PAG Química – Termodinâmica
1290,3 cal
PAG Química – Termodinâmica
PAG Química – Termodinâmica
24. São dados os parâmetros termodinâmicos abaixo para a reação:
CaC2 (s) + 2 H2O (l) à
Ca(OH)2 (s) +
C2H2 (g)
ΔHof (kJ/mol)
-59,8
-285,8
-986,1
+226,7
So (J/molK)
70,0
69,9
83,4
200,9
A partir deles, calcule:
a) a energia livre padrão da reação.
b) a constante de equilíbrio da reação.
c) ΔG para esta reação quando a pressão gasosa for unitária.
d) nas condições da alínea c a reação está em equilíbrio? Se não estiver, em
que sentido ocorre a reação?
e) analisando os valores de ΔGº e Kp diga se a reação é viável industrialmente.
Justifique.
PAG Química – Termodinâmica
PAG Química – Termodinâmica
25. Para a reação abaixo são dados os seguintes parâmetros:
4 HCl (g) + O2 (g) →
2 H2O (g) +
2 Cl2 (g)
ΔHof (kJ/mol)
-92,22
0
-241,60
0
So (J/mol.K)
186,50
204,83
188,54
222,74
Usando os dados termodinâmicos, calcule:
a) a energia livre padrão da reação.
b) a constante de equilíbrio da reação.
c) ΔG para esta reação quando as pressões de todos os gases forem unitárias.
d) nas condições da alínea c a reação está em equilíbrio? Se não estiver, em que
sentido ocorre a reação?
e) analisando os valores de ΔGo e Kp diga se a reação é viável industrialmente.
Justifique.
PAG Química – Termodinâmica
PAG Química – Termodinâmica
26. a) Explique por que a entropia absoluta do ciclohexano é 71,28 cal/molK
enquanto que a de seu isômero 1-hexeno é 92,25 cal/molK
b) considere a reação A-A + B-B à 2 A-B. Se as energias de ligação A-A, B-B
e A-B forem iguais, a reação deve ou não ser espontânea? Justifique.
PAG Química – Termodinâmica
27. Explique porque cada uma das seguintes afirmações é falsa:
a) um processo não espontâneo endotérmico com ΔS positivo pode se tornar
espontâneo em baixas temperaturas.
b) o trabalho de compressão de um gás consumido em uma reação química é
uma função de estado.
c) quando uma reação química reversível atinge o equilíbrio, as
concentrações de todos os reagentes e produtos são iguais entre si.
d) uma reação exotérmica que produz mais mols de gás do que os que são
consumidos, possui energia livre padrão de reação positiva.
e) um sistema reacional reversível entra em equilíbrio químico quando sua
velocidade atinge um mínimo e sua energia livre um máximo.
PAG Química – Termodinâmica
PAG Química – Termodinâmica
28. a) Para que um processo ocorra, são necessárias determinadas
condições termodinâmicas e cinéticas. Quais são esses critérios de
espontaneidade cinético e termodinâmico de uma reação?
b) porque um sistema que reage, ao atingir o vale de Gibbs entra em
equilíbrio químico?
c) porque a constante de equilíbrio de uma reação é sempre adimensional,
mesmo quando há variação no número de mols entre reagentes e produtos?
d) o que quer dizer a expressão o equilíbrio químico é dinâmico ?
e) como se explica que a mistura de dois gases ideais seja um processo
espontâneo, uma vez que o calor trocado no processo é zero?
PAG Química – Termodinâmica
29. Abaixo são dados conjuntos de duas afirmativas, nas colunas A e B.
Para cada alínea, assinale a(s) coluna(s) que apresenta(m) a(s)
afirmativa(s) verdadeira(s) e os casos em que o termo porque está bem
aplicado. Não há necessidade de justificar.
Coluna A
Coluna B
a) em uma reação endotérmica em porque
sistema isolado, a energia cinética média
do meio externo aumenta
em uma reação endotérmica
há absorção de calor.
b) o 1o Princípio da Termodinâmica diz porque
que, o que quer que aconteça em um
sistema, a respectiva energia livre (ΔG)
não varia
ΔG é função de estado.
c) Na reação H2 (g) + 1/2 O2 (g) àH2O porque
(ΔH < 0) realizada a pressão constante, o
exterior executa trabalho sobre o sistema
a reação é endotérmica.
PAG Química – Termodinâmica
Coluna A
Coluna B
d) um sistema atinge o ponto de porque
equilíbrio químico quando sua energia
livre atinge o mínimo valor possível
este é o ponto de maior
entropia.
e) é possível decompor-se uma reação porque
em várias, cuja soma dê a reação
pretendida, sendo que o somatório de
todas as variações de energia livre será
igual à variação da energia livre da
reação pretendida.
a lei de Hess também é válida
para o cálculo de variações de
energia livre .
PAG Química – Termodinâmica
a) B - sistema isolado não troca nada com o meio externo
b) B - é ΔU
c) A - é exotérmica
d) A - é < G
e) A, B, porque.
PAG Química – Termodinâmica
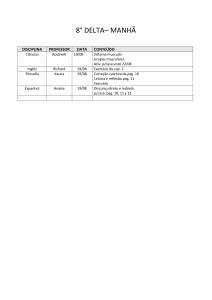
30. O seguinte gráfico apresenta a relação entre ∆G e ln Q para a reação
3 A (g) + B (g)
2 C (g), a 298 K:
Com base no gráfico apresentado, responda, justificando:
a) qual a expressão genérica que relaciona os dados da ordenada com os da abcissa?
b) explique em que regiões do gráfico este processo é espontâneo.
c) qual o valor de ∆Go ?
d) qual o valor aproximado da constante de equilíbrio?
e) calcule o valor de ∆G quando as pressões parciais de A, B e C forem de 0,003 atm;
f) calcule o valor de ∆G quando as pressões parciais de A, B e C forem de 1 atm.
PAG Química – Termodinâmica
14
- 32,0
1,20 x 106
PAG Química – Termodinâmica
31. O valor de ΔGo de formação de CO2 é - 450 kJ/mol. Esse valor é
invariável com a temperatura. Já a variação de ΔGo de formação de SiO2
(areia) com a temperatura é ΔGo = -920 + 0,2t, com ΔGo dado em kJ/mol e t
em o C.
a) por que a variação de ΔGo de formação de CO2 não varia com a
temperatura, enquanto que para SiO2 esse valor aumenta?
b) qual das reações é mais espontânea a 30o C?
c) o que acontece com a espontaneidade de cada reação com o aumento da
temperatura?
d) em que temperatura (quando isso for possível) o sentido dessas reações
pode ser invertido?
e) em que temperatura existe o equilíbrio CO2 (g) + Si (s)
SiO2 (s) + C (s)
para uma pressão parcial de CO2 de 1 atm
PAG Química – Termodinâmica
PAG Química – Termodinâmica
PAG Química – Termodinâmica
32. Considere a reação 5 A (s) + 3 B (g) 2 C (g) + D (g) + E (s). Esse sistema
está em equilíbrio a 300 K quando, num recipiente de 2 L coexistem 10 mols de
A, 4 de B, 2 de C, 8 de D e 3 de E. Preveja qual o valor de ΔG e em qual sentido
a reação deve avançar quando a temperatura for de 300 K e as pressões
parciais de cada gás forem:
a) B = 0,37 atm, C = 0,50 atm, D = 1 atm
b) B = 1,42 atm, C = 0,80 atm, D = 0,60 atm
PAG Química – Termodinâmica
PAG Química – Termodinâmica
32. Suponha que você trabalhe em um restaurante. Um cliente pede água
gelada a 5o C. Você dispõe de água a 30o C e cubos de gelo a 0o C. A água é
servida em doses de 400 mL (sem contar o volume correspondente ao gelo
derretido). Quantos gramas de gelo são necessários para servir um copo de
água a 5o C a seu cliente? Suponha que não há absorção de calor por parte
do copo.
PAG Química – Termodinâmica
33. Uma b.o.a. cerveja tem em seu rótulo a informação de que seu conteúdo
calórico é de 43,9 kcal/100 mL. Calcule a que temperatura uma garrafa (600
mL) deve ser ingerida para que seu aquecimento até a temperatura do corpo
(37º C) gaste exatamente a energia da sua combustão. Considere as
propriedades físicas (ΔHsolidificação, capacidades caloríficas, densidade) da
cerveja iguais às da água (líquida e sólida). Proceda da seguinte forma:
a) calcule a quantidade de calor liberada para levar 600 g de cerveja a partir de
37º C até 0º C.
b) agora calcule a quantidade de calor liberada para congelar esses 600 g de
cerveja a 0º C.
c) finalmente, a que temperatura devemos levar a cerveja congelada, a partir de
0º C, a fim de gastar as calorias restantes?
PAG Química – Termodinâmica