Doutora Query
Professor Challenge
Professor Kaizen
História
E
m redor do ano 1780, o cientista italião Luigi Galvani descobriu que,
quando as manipulava com uma espécie de tesoira metálica, as pernas duma
rã tinham contracções. Galvani pensou que este efeito era causado por algum
tipo de electricidade produzida pelos tecidos da rã.
Galvani contou a sua descoberta a Alessandro Volta, mas Volta não
esteve satisfeito com a explicação do seu amigo. Pensou que de alguma
maneira a electricidade era produzida pelos instrumentos metálicos com
que manipulava a rã.
cobre
Volta fiz outra descoberta: ao pôr a língua
Pano
entre duas moedas de metais diferentes,
húmido
no céu da boca sentia gosto ácido
singular. Pensou que este efeito era o
resultado de algum tipo de reacção
química que produzia corrente eléctrica.
zinco
A sua primeira pilha era feita por discos
de cobre e de zinco e entre eles colocava
pano embebido em água salgada. Esta
invenção fabulosa aconteceu em redor
do ano 1799.
Naquele tempo, não existiam instrumentos medidores da intensidade
duma corrente eléctrica. Frequentemente, a intensidade duma descarga
eléctrica se calculava pelos seus efeitos no corpo humano, em particular
no céu da boca. Volta desmontrou que ao amontoar vários elementos
de Zinco, pano húmido e Cobre, as descargas no céu da boca eram cada
vez mais intensas. O primeiro dispositivo capaz de produzir corrente
eléctrica durante muito tempo era inventado.
O Professor Challenge,
depois de várias horas
de experimentação,
verifica os efeitos na
sua língua .
52
Dentro das pilhas eléctricas,
produzem-se reacções químicas;
o resultado é excesso de electrões
num dos dois pólos (pólo -) e
carga positiva no outro pólo
(pólo +). Quando conectamos
um fio metálico à pilha, os
electrões do fio são repelidos pela
carga do pólo negativo e atraidos
pela carga do pólo positivo. Os
electrões começam a mover-se
formando corrente.
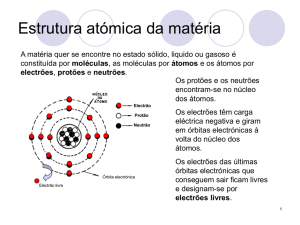
Átomos e corrente eléctrica
T
oda a matéria que nos cerca é feita
de partículas minúsculas chamadas
átomos. Cada átomo é como sistema
solar pequeno. No centro está um
“sol” ou núcleo formado de partículas
com carga positiva. Em redor do
núcleo, giram planetas pequenas
carregadas positivamente chamadas
electrões.
ÁTOMO
Partículas com
carga positiva +
No fio de cobre, os átomos são
organizados juntos, como os ovos na
sua caixa alveolada. Quando os átomos
de cobre se colocam assim, os electrões
mais distantes do núcleo deixam a sua
órbita e se movem livremente entre
1
Partículas com
carga negativa -
covertura
em plástico
átomos
electrões
fio de cobre
Agora, se conectamos o nosso fio metálico aos dois pólos duma bateria,
vemos que a nuvem de electrões se move segundo especial direcção,
como a água em canalização. Estamos em presença de corrente eléctrica.
2
electrões
corrente eléctrica
53
Iões
O
átomo de sódio
SALEIRO
mundo que te cerca
é formado por multidão
de substâncias e materiais
diferentes, porém não há
molécula
SAL
mais de 103 tipos de
de SAL
átomo de cloro
átomos diferentes,
chamados elementos
químicos. A maior parte dos materiais resultam da combinação de átomos
de elementos diferentes.
Se tomamos um pedaço de sal e o dividimos em duas partes, continuamos
tendo sal, mas se continuamos dividindo os pedaços de sal em partes
Pez abisal BIOluminiscente
cada vez mais pequenas, ao cabo dum momento,
já não temos partículas
de sal mas átomos de cloro e de sódio.
Os átomos unem-se para formar outras substâncias. Por exemplo, a água
é formada por partículas compostas de um átomo de oxigénio e dois átomos
de hidrogénio; chamamos estas uniões moléculas. No sal, átomos de cloro
e de sódio unem-se para formar cristais de sal. Se um átomo de cloro se
encontrar com um átomo de sódio, algo especial acontece: o átomo de
cloro captura dois dos electrões do átomo de sódio. Isso acontece porque
o átomo de sódio não atrai com
muita força os electrões mais
distantes do núcleo. Assim o
átomo de cloro se transforma
no que chamamos IÃO negativo
(tem electrões demais),
enquanto o sódio se transforma
em IÃO positivo (não tem
bastantes electrões). Visto que
um dos iões é carregado
positivamente e o outro é
carregado negativamente, então
ambos se atraem; como
resultado, eles ficam juntos
produzindo a substância que
chamamos sal.
Elementos químicos
54
Limão-pilha
Scortando
eparar os átomos de cloro e de sódio do sal
um grão pequeno de sal com uma faca
é trabalho impossível. Porém podemos fazer isso
fácilmente dissolvendo o sal em água. As moléculas
de água são como barras minúsculas com uma borda
positiva e uma borda negativa. Ao diluir o sal, as moléculas
de água atraem os iões de cloro e de sódio e os separam, pois os iões
podem se mover na água livremente.
Muitas substâncias ordinárias como ácidos, bases e sais produzem iões
positivos e negativos quando são dissolvidas em água. Graças a estes iões,
a água se torna ELECTRÓLITO, quer dizer, líquido condutor de
electricidade. Se, num copo de água salgada, submergimos dois fios
metálicos, e um destes fios é conectado ao pólo positivo duma pilha
eléctrica e o outro é conectado ao pólo negativo, os iões negativos de
cloro se movem até o pólo positivo e os iões positivos se movem até o
pólo negativo, produzindo corrente eléctrica.
Limão
É possível construir bateria simples e
não muito potente, submergindo
uma barra de cobre e uma barra de
¡Toc
zinco em electrólito. Mas, como
Toc
conseguir um electrólito… É
Toc!
fácil, porque muitos sumos
de frutas e de legumes são
electrólitos, isso é, são
água com substâncias
ácidas que produzem
iões positivos e
negativos. O limão é
exemplo perfeito.
Podemos ver que
não todos os
vegetais servem
para construir
baterias,
independentemente
do seu tamanho.
Abóboras
55
Pilha Seca
Grafite
+
E
m 1866, o engenheiro francês
Leclanché inventou um tipo de
bateria que não utilizava líquidos
mas uma pasta húmida. Esta bateria
estava mais segura e mais fácil de
transportar, então o seu uso se
desenvolveu rápidamente. As
baterias clássicas que utilizamos
hoje são versões melhoradas da
invenção de Leclanché.
MnO2 (+C)
Nh4Cl (+ZnCl2)
A bateria seca convencional é
formada por recipiente ou copo
de zinco que age como pólo
negativo e cujo interior está cheio
de pasta de clorato de amônio
húmida. No interior da pasta de
clorato de amônio, uma barra de
carbono serve de pólo positivo.
Zn
-
O recipiente de zinco reage com o
clorato de amônio. Nesta reacção,
os átomos de zinco perdem
electrões e transformam-se em iões positivos que se dissolvem na pasta
húmida. Como resultado, no copo de zinco temos cargas negativas demais
e na barra de carbono temos carga positiva.
Pilhómetro
(contentor para pilhas)
L
UTE
A!
ão
ão sigoso
n
s
ia
s.
er
ater . É p ri-la .
As buedos s ou ab muito s
e
m
q
a
brin ipulá-l , polue zias, lhulto
n
a
o
d
a
v
s
a
m
dis rem
um o
Alémndo foe dar a itará n o.
a
Qu es qu depos opriad
tendque as tor apr
ten
con
CA
56
Electrólise
Grafite
+-
Bateria
U
ma bateria eléctrica é um exemplo
de como algumas reacções químicas
produzem electricidade; mas também
podem fazer completamente o contrário
e utilizar a electricidade para produzir
ou controlar reacções químicas
impossíveis sem corrente eléctrica.
Cloro
Um bom exemplo de reacções
Hidrogénio
Água salgada
produzidas graças à corrente eléctrica é
a electrólise do sal: é utilizada para obter cloro, hidrogénio e também
substância corrosiva chamada soda cáustica. Para realizar este processo,
diluímos sal em recipiente e introduzimos duas barras de grafite;
conectamos uma destas duas barras de grafite ao pólo + e a outra ao
pólo - dum gerador de corrente. No pólo positivo começam a aparecer
bolhas de cloro enquanto, no pólo negativo, formam-se bolhas de
hidrogénio procedente das moléculas de água. Ao diluir o sal na água,
formam-se iões livres de cloro e de sódio. Os iões de cloro são negativos
e são atraidos pela barra conectada ao pólo positivo. Ao chegar à barra,
deixam os electrões que excedem e tornam-se átomos neutros livres.
A electrólise é o método utilizado para conseguir muitos produtos. Essa
técnica é utilizada para obter alumínio de mineral chamado bauxita ou
para obter oxigénio e hidrogénio da água.
BZZZZZZZZZ
Bateria de
hidrogénio
Em futuro não muito
distante, as baterias
de hidrogénio serão
alternativa
energética limpa e
ecológica. Podeis
ver aqui os
Professores com
protótipo adaptado
ao seu tandem de
passeio.
Livraram-se dos
pedais !
57
Galvanização
Bateria
+-
P
Cravo
Cobre
odemos utilizar corrente eléctrica para
depositar camada fina de metal resistente
à corrosão, como o cromo, o níquel ou
o ouro, em outro metal de aspecto pior
e menos resistente à corrosão, como o
aço. Este processo é chamado galvanização.
Um bom exemplo deste processo é o
cromar pedaços de carros ou
motocicletas: camada de cromo é
depositada em pedaços de aço e da–lhes
aspecto brilhante e lustroso.
agua + sulfato de cobre
Por exemplo, para recobrir um cravo de cobre (ou qualquer outra peça)
com camada de cobre, imergimos o cravo e uma barra de cobre num
recipiente com sulfato de cobre dissolvido em água. A barra de cobre é
conectada ao pólo positivo e o cravo ao pólo negativo.
Pouco a pouco se forma camada de cobre no cravo e a barra de cobre é
dissolvida. Ao diluir o sulfato de cobre em água, os iões de cobre movemse livremente e são atraidos pelo cravo conectado ao pólo negativo da
bateria. Quando chegam ao cravo, os iões
de cobre capturam electrões e
¿mmmmm
transformam-se em átomos neutros
?
que se depositam no cravo. O pólo
positivo da bateria rouba electrões
da barra de cobre: isso produz iões
positivos de cobre que são diluídos
na água.
O Professor Kaizen começa a suspeitar
que a taça século XIV, em ouro puro, que
comprou muito barato no mercado, não é
o que parece.
58
Electricidade Animal
A
lessandro Volta não foi o primeiro que gerou uma corrente eléctrica
graças a reacções químicas. Na sua época, já eram conhecidos tipos
diferentes de peixes capazes de produzir descargas eléctricas, como por
exemplo o Peixe Eléctrico que vive em alguns rios de África, e é capaz
de produzir descargas de 350 voltes; ou a Enguia Eléctrica: este peixe vive
nas águas turvas de alguns rios de América do Sul e é capaz de produzir
descargas superiores a 600 voltes.
Estes animais têm células nervosas ou musculares modificadas que agem
como baterias pequenas capazes de gerar correntes eléctricas. Estas correntes
podem ser descargas rápidas ou sucessão de descargas pequenas cuja intensidade
e frequência são controladas pelo cérebro.
Os peixes eléctricos não só produzem electricidade ; também sentem
como o seu meio ambiente modifica a electricidade que eles produzem.
Então podem se orientar em águas turvas, ou encontrar presas escondidas
debaixo da areia ou entre as algas.
O Professor Challenge em
plena experimentação: é
possível pescar peixes com
tomada de corrente?...
O que é o que pensas?
Graças às descargas fortes que podem
produzir, alguns peixes podem matar
ou atordoar as suas presas ou também
desorientar os seus possíveis inimigos.
Também é muito útil para a
reprodução.
Tomada de corrente
Enguia eléctrica
59
Pr
P
ssor Kaiz
e
f
e
ro
Até à próxima aventura!
MINILAND S.A. Ctra. Castalla, km 1. Pol. Industrial 03430 Onil. Alicante. Spain.
Tel. 34 96 556 49 50. Fax 34 96 556 54 54.
[email protected]. www.miniland.es
Desenho, criatividade e textos: Sieteleguas Ediciones S.L.
Assessor Científico: Obdulio Serrano. Licenciado em Ciências Físicas.
© Miniland, S.A. 2004
n
Trabalhador incansável e com um
desejo de superação incrível.
Metódico, exaustivo e muito
paciente. Adora pregar partidas aos
seus dois companheiros.
ora Que
t
u
r
Do
y
Se existe alguém que nunca pára de
se questionar, esse alguém é a
Doutora Query. Ela adora os
enigmas e é apaixonada por todo
o tipo de tortas e bombons.
ge
Sempre disposto a provar e
experimentar, hiperactivo e
desorientado. Somente pára de
trabalhar para tomar o chá das cinco.
Gosta muito de música popular,
principalmente de polkas.
or Challe
s
s
e
n
of