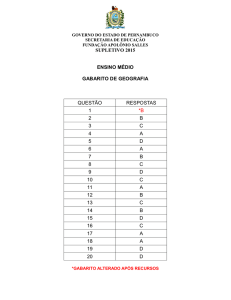
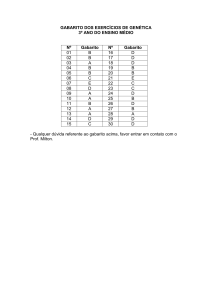
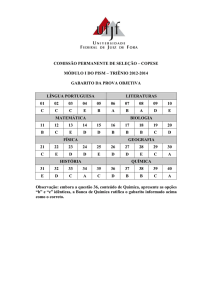
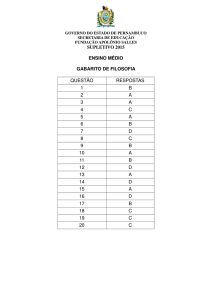
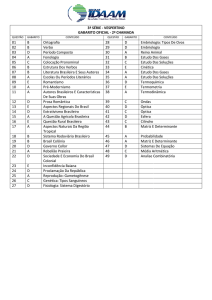
CONTEÚDO
PROGRAMÁTICO:
PORTUGUÊS
O QUE É O CDAAP
É a unidade residencial do Sistema Elite de
Ensino que visa reunir alunos oriundos do
Rio de Janeiro e de outros estados com
aspirações extraordinárias, proporcionando
um ambiente saudável de cooperação,
fraternidade e imersão nos estudos.
O QUE O CDAAP OFERECE
- Quartos
masculino e feminino isolados;
- Ambientes climatizados;
- Salas de estudo;
- Alimentação: Café da manhã, almoço,
lanche e jantar;
- Acompanhamento psicopedagógico;
- Monitoria de Matemática, Física, Química e
Inglês;
- Projeto de Redação e Escrita em Inglês
(Writing Composition);
- Treinamento para Olimpíadas de
Matemática, Física e Química;
QUANDO
20 de dezembro de 2016
9:00h – 12:00
ONDE
A Prova será realizada em 14 unidades do
Elite no Rio de Janeiro.
INSCRIÇÕES
As inscrições podem ser feitas nas
coordenações das unidades do Elite de
13/12 a 19/12.
www.sistemaeliterio.com.br
- Interpretação de texto
- Frase, oração e período
- Sintaxe
- Orações: coordenadas,
substantivas e adjetivas
- Concordância nominal e
verbal
- Regência nominal e
verbal
- Morfossintaxe do que, se
e como
MATEMÁTICA
- Conjuntos e Funções
- Produtos Notáveis e
Fatoração
- Sequências: PA e PG
- Sistemas lineares
- Análise combinatória
- Trigonometria
- Números complexos
- Polinômios e Equações
- Geometria plana
FÍSICA
- Leis de Newton
- Trabalho e Energia
- Impulso e Quantidade de
Movimento
- Termologia e Dilatação
-- Calorimetria e
Termodinâmica
- Hidrostática
- Reflexão e Refração
- Ondas
GABARITO ITA – QUÍMICA
CONSTANTES
Constante de Avogadro (NA) = 6,02 × 1023 mol–1
Constante de Faraday (F) = 9,65 × 104C·mol–1 = 9,65 × 104 A·s·mol–1 = 9,65 × 104 J·V–1 ·mol–1
Volume molar de gás ideal = 22,4 L (CNTP)
Carga elementar = 1,602 × 10–19C
Constante dos gases (R) = 8,21 × 10–2 atm·L·K–1·mol–1 = 8,31 J·K–1·mol–1 = 1,98 cal·K–1·mol–1 =
62,4 mmHg·L·K–1·mol–1
Constante gravitacional (g) = 9,81 m·s–2
Constante de Planck (h) = 6,626 × 10–34 m2·kg·s–1
Velocidade da luz no vácuo = 3,0 × 108 m·s–1
DEFINIÇÕES
Pressão de l atm = 760 mmHg = 1,01325 × 105 N·m–2 = 760 Torr 1,01325 bar
1 J = 1 N·m = 1 kg·m2·s–2
ln 2 = 0,693
Condições normais de temperatura e pressão (CNTP): 0º C e 760 mmHg
Condições ambientes: 25º C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol·L–1 (rigorosamente: atividade
unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e
temperatura em questão.
(s) = sólido. ()= líquido. (g) = gás. (aq) = aquoso. (CM)= circuito metálico. (cone)= concentrado.
(ua) = unidades arbitrárias. [X]= concentração da espécie química X em mol·L–1.
DEFINIÇÕES
Elemento
Químico
Número
Atômico
Massa Molar
(g·mol–1)
Elemento
Químico
Número
Atômico
Massa Molar
(g·mol–1)
H
1
1,01
Cl
17
35,45
He
2
4,00
K
19
39,10
Be
4
9,01
Cr
24
52,00
B
5
10,81
Mn
25
54,94
C
6
12,01
Fe
26
55,85
N
7
14,01
Ni
28
58,69
O
8
16,00
Cu
29
63,55
F
9
19,00
Zn
30
65,38
Na
11
22,99
Br
35
79,90
Mg
12
24,31
Pd
46
106,42
Al
13
26,98
Ag
47
107,87
Si
14
28,09
Xe
54
131,30
P
15
30,97
Pt
78
195,08
S
16
32,06
Hg
80
200,59
3
GABARITO ITA – 16/12/2016
Questão 1
Pode-se utilizar metais de sacrificio para proteger estruturas de aço (tais como pontes, antenas
e cascos de navios) da corrosão eletroquímica. Considere os seguintes metais:
I. Alumínio
A
B
C
D
E
( ( ( ( ( II. Magnésio
III. Paládio
IV. Sódio
V. Zinco
) Apenas I, II e V.
) Apenas I e III.
) Apenas II e IV.
) Apenas III e IV.
) Apenas V.
Gabarito: Letra A.
Dentre os metais apresentados os comunente utilizados como metais de sacrifício são alumínio,
magnésio e zinco.
Questão 2
A reação do mercúrio metálico com excesso de ácido sulfúrico concentrado a quente produz
um gás mais denso do que o ar. Dois terços deste gás são absorvidos e reagem completamente
com uma solução aquosa de hidróxido de sódio, formando 12,6 g de um sal. A solução de ácido
sulfúrico utilizada tem massa específica igual a 1,75 g · cm–3 e concentração de 80 % em massa.
Assinale a alternativa que apresenta o volume consumido da solução de ácido sulfúrico, em cm3.
A
B
C
D
E
( ( ( ( ( ) 11
) 21
) 31
) 41
) 51
Gabarito: Letra B.
Equação de oxidação do mercúrio:
Hg(l) + 2 H2SO4(aq) → Hg SO4(s) + SO2(g) + 2 H2O(l)
O SO2(g) é o gás mais denso que o ar.
4
GABARITO ITA – QUÍMICA
Equação de absorção do SO2(g):
SO2(g) + 2 NaOH(ag) → Na2SO3(aq) + H2O(l)
dela vem que:
n(SO2) = n(NaSO3) → n(SO2) =
m(Na 2SO3 )
12, 6 g
= = 0, 1 mol
MM(Na2SO3 ) 12, 6 g / mol
Se 0,1 mol de SO2 é 2 do SO2 total, então SO2 total é 3 × 0,1 mol = 0,15 mol.
3
2
Da equação de oxidação do mercúrio vem:
10 × % m / m × d 10 × 50 × 1, 75 1.400 100
=
=
=
mol / L
MM
98
98
7
Para calcular o volume, fazemos :
n
0, 3
2, 1
n= M×V⇒V=
=
=
L = 21 mol
M 100 / 7 100
M=
Questão 3
Um frasco fechado contém dois gases cujo comportamento é considerado ideal: hidrogênio
molecular e monóxido de nitrogênio. Sabendo que a pressão parcial do monóxido de nitrogênio
é igual a 3/5 da pressão parcial do hidrogênio molecular, e que a massa total da mistura é de
20 g, assinale a alternativa que fornece a porcentagem em massa do hidrogênio molecular na
mistura gasosa.
A
B
C
D
E
( ( ( ( ( ) 4%
) 6%
) 8%
) 10%
) 12%
5
GABARITO ITA – 16/12/2016
Gabarito: Letra D.
H2(g)
NO(g)
3
P
PH ⇒ NO
= 3
5
PH 2
5 2
PNO = P ⋅ X NO
P
X
3
⇒ NO = NO =
PH2 = PX H2
5
PH2
X H2
PNO =
3
+ X H2 = 1
5
nH2
5
= 3 ⇒
= ⇒ 3mH2 = 5nNO
8
nH2 + nNO
8
e X NO + X H2 = 1 ⇒ X H2
X H2 = 5
8
e X NO
3mH2
5mNO
=
2
14 + 16
⇒ 9 mH2 = mNO
⇒
Massa da mistura: 20 g
mH2 + mNO = 20 g
mH2 + 9mH2 = 20
mh2 = 2 g ⇒ mNO = 18 g
%H2 =
2
1
=
= 10%
20 10
Questão 4
A reação química genérica X → Y tem lei de velocidade de primeira ordem em relação ao reagente
X. À medida que a reação ocorre a uma temperatura constante, é ERRADO afirmar que
A
B
C
D
E
( ( ( ( ( 6
) a constante de velocidade da reação não se altera.
) o tempo de meia-vida do reagente X permanece constante.
) a energia de ativação da reação não se altera.
) a velocidade da reação permanece constante.
) a ordem de reação não se altera.
GABARITO ITA – QUÍMICA
Gabarito: Letra D.
a) Verdadeira. Considerando a reação na ausência de catalisador e sob temperatura constante,
pela lei de Arrhenius K = A · e
−EA
RT
, .a constante de velocidade K não se alterará.
b) Verdadeira. P/ reação C/ cinética de 1a ordem: T1/ 2 =
ln2
como K não altera, o tempo de
K
meia-vida não se alterará.
c)Verdadeira. Considerando a reação não-catalizada não ocorrerá alteração na energia de
ativação.
d) Falsa. P/ a reação V = K[x], assim conforme a reação ocorre a [x] diminui e a velocidade da
reação irá diminuir.
e) Verdadeira. A reação permanece c/ cinética de ordem 1 sem adição de catalisador ou outros
reagentes.
Questão 5
Barreiras térmicas de base cerâmica são empregadas em projetos aeroespaciais. Considere os
materiais a seguir:
I.BN
II.Fe2O3
III. NaN3
IV.Na2SiO3
V.SiC
Assinale a opção que apresenta o(s) material(is) geralmente empregado(s) como componente(s)
principal(is) de barreiras térmicas em projetos aeroespaciais.
A
B
C
D
E
( ( ( ( ( ) Apenas I e V.
) Apenas II.
) Apenas III.
) Apenas III eI V.
) Apenas V.
Gabarito: Letra . A
Materiais cerâmicos comumente utilizados em barreiras térmicas utilizam nitreto de boro
( T ≅ 2732º C) e carbeto de silício ( T ≅ 2700º C).
F
F
7
GABARITO ITA – 16/12/2016
Questão 6
A adição de certa massa de etanol em água diminui a temperatura de congelamento do solvente
em 18,6°C. Sabendo que a constante crioscópica da água é de 1,86°C · kg · mol–1, assinale a
porcentagem em massa do etanol nesta mistura.
A
B
C
D
E
( ( ( ( ( ) 10,0%.
) 18,6%.
) 25,0%.
) 31,5%.
) 46,0%.
Gabarito: Letra D.
Aplicando a propriedade coligativa crioscópica, temos:
DTc = Kc · W · i
Considerando o fator de Van’t Hoff cenitário, ou seja, i = 1, temos:
DTc = Kc · W
18, 6
=W
1, 86
mC2 H60
10 =
mC2 H60
mH2 O
46
mH2 O
= 460
Sabendo que a massa total será igual a 1.460 g,
logo: (%) =
8
460
= 0, 3150 = 31, 50%
1.460
GABARITO ITA – QUÍMICA
Questão 7
Na figura ao lado são respectivamente apresentadas as curvas de titulação de 50 mL de soluções
aquosas 0,1 mol · L–1 dos ácidos I, II e III, tituladas com uma solução aquosa O, 1 mol · L–1 em
NaOH. Baseado nas informações contidas na figura, assinale opção ERRADA.
A
B
C
D
E
( ( ( ( ( ) A constante de ionização do ácido III é aproximadamente 10–9.
) A região W da curva de titulação do ácido II é uma região-tampão.
) No ponto X o pH da solução I é igual ao pKa do ácido I.
) O ponto Y é o ponto de equivalência do ácido II.
) No ponto Z, para todos os ácidos o pH só depende da quantidade em excesso de OH–
adicionada.
Gabarito: Letra C.
(A) Verdadeira. O ácido III apresenta pH = 5 em concentração 0,1 mol/L. Logo, [H+] = 10–5.
Usando a aproximação Ka = ma2 e o fato que [H+] = ma, tem-se
(10−5 )2
[H+ ]2 = M × Ka ⇒ Ka =
= 10−9.
0
1
,
(B)Verdadeiro. A variação de pH é muito pequena para a adição de 20 mL de NaOH 0,1 mol/L,
o que caracteriza um tampão.
(C)Falsa. A curva de titulação do ácido I é típica de ácido forte × base forte. Ácidos fortes
apresentam Ka bastante elevado, e ionização quase total em solução 0,1 mol/L. Ou seja, pH
= 1 (observe na curva). Assim, no ponto X o pH é próximo de 7.
Se fosse pH = pKa = 7, teríamos Ka = 10–7, incompatível com ácido forte.
(D)Verdadeiro. O ácido II apresenta pH = 3 em solução 0,1 mol/L. Trabalhando de maneira
(10−3 )2
= 10−5 , corresponde a um ácido fraco.
semelhante à opção A, obtemos Ka =
0, 1
Logo, o sal formado, no ponto de equivalência, apresenta reação básica, pH = 7, como
mostra a curva.
(E)Verdadeiro. No ponto Z, teremos 80 mL de solução, geradas por 30 mL de NaOH 0,1 mol/L.
n(NaOH)excesso = 30 mL × 0,1 mol/L = 3 mmol.
3
−
[OH ] = mol/L ⇒ pOH = 1,5 pOH = 12,5, que concorda razoavelmente com o gráfico.
80
Usando uma calculadora científica, pOH = 1,43, pH = 12,57.
9
GABARITO ITA – 16/12/2016
Questão 8
Considere duas soluções, X e Y, de um mesmo soluto genérico. A solução X tem 49% em massa
do soluto, enquanto a solução Y possui 8% em massa do mesmo soluto. Quer-se obter uma
terceira solução, que tenha 20% em massa deste soluto, a partir da mistura de um volume Vx
da solução X com um volume Vy da solução Y. Considerando que todas as soluções envolvidas
exibem comportamento ideal, assinale a opção que apresenta a razão Vx/Vy CORRETA.
A
B
C
D
E
( ( ( ( ( ) 12/29.
) 29/12.
) 19/12.
) 12/19.
) 8/49.
Gabarito: Letra A.
A nova solução terá volume total Vx + Vy. Analisando as concentrações temos:
Massa total=Massa x +Massa y ⇒
(
)
0,2 Vx + Vy =0,49 Vx +0,08 Vy ⇔
0,2 Vx +0,2Vy =0,49 Vx +0,08 Vy ⇔
0,2 Vy – 0,08Vy =0,49 Vx – 0,02 Vx ⇔
0,12Vy =0,29 Vx ⇔
Vx
Vy
=
12
29
O diagrama de van Arkel-Ketelar apresenta
uma visão integrada das ligações químicas
de compostos binários, representando os três
tipos clássicos de ligação nos vértices de um
triângulo. Os vértices esquerdo e direito da
base correspondem, respectivamente, aos
elementos menos e mais eletronegativos,
enquanto o vértice superior do triângulo
representa o composto puramente iônico.
Com base no diagrama, assinale a opção que
apresenta o composto binário de maior caráter
covalente.
10
Diferença entre eletronegatividades
Questão 9
3
2
1
0
Cs
2
3
C
N
Eletronegatividade
O
F
GABARITO ITA – QUÍMICA
A
B
C
D
E
( ( ( ( ( ) CCl4
) C 3N 4
) CO2
) NO
) OF2
Gabarito: Letra . D
O composto de maior caráter covalente (menor diferença de eletronegatividade) é o óxido nítrico
(NO), de acordo com o diagrama dado( ∆ELN próximo de 0,8).
Questão 10
São feitas as seguintes proposições a respeito de reações químicas orgânicas:
I. Etanoato de etila com amônia forma etanamida e etanol.
II. Ácido etanóico com tricloreto de fósforo, a quente, forma cloreto de etanoíla.
III. n-Butilbenzeno com permanganato de potássio, a quente, forma ácido benzóico e dióxido de
carbono.
Das proposições acima, está(ão) CORRETA(S)
A
B
C
D
E
( ( ( ( ( ) apenas I.
) apenas I e II.
) apenas II.
) apenas II e III.
) I, II e III.
Gabarito: Letra E.
I. Verdadeira: Reação de formação de amida
O
O
CH3 — C — O — CH3 — CH3 + NH3 → CH3 — C — NH2 + HO — CH2 — CH3
11
GABARITO ITA – 16/12/2016
II. Verdadeira: reação espontânea
O
O
3 CH3 — C — OH + PC3 → H3PO3 + 3 CH3 — C — C
III. Verdadeira: reação de oxidação energética.
KMnO4
O
C
OH
∆
+ 3 CO2 + 4 H2O
Questão 11
Em relação às funções termodinâmicas de estado de um sistema, assinale a proposição ERRADA.
A( ) A variação de energia interna é nula na expansão de n mols de um gás ideal a temperatura
constante.
B( ) A variação de energia interna é maior do que zero em um processo endotérmico a
volume constante.
C( ) A variação de entalpia é nula em um processo de várias etapas em que os estados inicial
e final são os mesmos.
D( ) A variação de entropia é maior do que zero em um processo endotérmico a pressão
constante.
E( ) A variação de entropia é nula quando n mols de um gás ideal sofrem expansão livre
contra pressão externa nula.
Gabarito: Letra E.
a)ΔU=nCvΔT, quando a temperatura é constante
ΔU=0 ⇒ ΔU ⇒ O (Verdadeiro)
b)ΔU=ΔH - W, como o volume é constante:
W=0, como é endotérmico: ΔH>0, logo: ΔU>0 (Verdadeiro)
c) Como entalpia é função de estado: ΔH=HF-Hi
Se Hf=Hi ⇒ ΔH=0 (Verdadeiro)
12
GABARITO ITA – QUÍMICA
d)ΔU=nCvln(Tf/Ti)+nRln(VF/Vi)
PVf =nRTF Vf Tf
Como a pressão é constante:
⇒ = ⇒
Vi Ti
i
i
PV=nRT
ΔS=n(Cv+R)ln(TF/Ti),como ΔH<0 (endotérmico)
T
Então ΔT>0 ⇒ TF>Ti ⇒ F >1, logo
Ti
T
ln F > 0 ⇒ ΔS>0 (Verdadeiro)
Ti
e) ∆S = nCv ln(TF / Ti ) + nRln(VF /Vi ), quando a pressão
externa for nula, na expansão livre não necessariamente
teremos ∆S = 0 pois não sabemos como irão variar
a temperatura e o volume do gás. (Falso)
Questão 12
A 25°C, o potencial da pilha descrita abaixo é de 0,56 V. Sendo Eº(Cu2+/Cu) = + 0,34 V,
assinale a opção que indica aproximadamente o valor do pH da solução.
Pt(s)|H2(g, 1 bar), H+(aq, x mol · L–1)||Cu2+(aq, 1,0 mol · L–1 )|Cu(s)
A
B
C
D
E
( ( ( ( ( ) 6,5.
) 5,7.
) 3,7.
) 2,0.
) 1,5.
Gabarito: Letra C.
Cu+2(aq) + 2e– → Cu(1)
2 H+2(aq) + 2e– → H2(g)
E0 = + 0,34 V
E0 = + 0,00 V
Equação global: C
u+2(aq) + H2(g) → 2 H+2(aq) + Cu(1)
E0 = + 0,34 V.
13
GABARITO ITA – 16/12/2016
Aplicando a equação do Nernst, temos:
0, 0592
⋅ log Q
n
0, 0592
0, 56 = 0, 34 −
⋅ log Q.
n
E = E0 −
2
H+ ⋅ QCu
Cu+2 ⋅ PH2
0, 0592
⋅ log
0, 22 = −
n
−1
2
0, 0592
⋅ log H+ 1 bar
n
0, 0592
0, 22 = −
⋅ 2 ⋅ log H+
2
0, 22 = −
( − log
0, 22 = 0, 0592 ⋅
H+
pH
)
pH = 3, 71
Questão 13
A pressão de vapor da água pura é de 23 ,8 torr a 25 ºC. São dissolvidos 10,0 g de cloreto de
sódio em 100,0 g de água pura a 25 ºC. Assinale a opção que indica o valor do abaixamento da
pressão de vapor da solução, em torr.
A
B
C
D
E
( ( ( ( ( ) 22,4
) 11,2
) 5,6
) 2,8
) 1,4
Gabarito: Letra E.
+
–
Soluto iônico: NaC (aq) → Na(aq) + C (aq) .
Considerando que a dissociação seja igual a 100%, temos:
14
GABARITO ITA – QUÍMICA
i = 1+ (2 – 1)·1
i=2
Propriedade coligativa tonoscópica:
∆P
= kt · w · i
Po
∆P
=
Po
<MM>
solvente · n soluto
·2
solvente
1000
mkg
10
∆P
18 58, 5
·
·2
=
Po 1000 0, 10
∆P
36 · 100
36
=
=
Po 1000 · 58, 5 585
∆P
= 0, 061
Po
∆P
= 0, 061 ⇒ ∆P=1,46 torr
23, 8
Questão 14
Considere que a decomposição do N2O5, representada pela equação química global
2 N2O5
→ 4 NO2 + O2
,
apresente lei de velocidade de primeira ordem. No instante inicial da reação, a concentração de
N2O5 é de 0,10 mol · L-1 e a velocidade de consumo desta espécie é de 0,022 mol · L-1 · min-1.
Assinale a opção que apresenta o valor da constante de velocidade da reação global, em min-1.
A
B
C
D
E
( ( ( ( ( ) 0,0022
) 0,011
) 0,022
) 0,11
) 0,22
15
GABARITO ITA – 16/12/2016
Gabarito: Letra D.
Equação Química Balanceada:
2 N2 O5 (g)
→ 4 NO2 (g) + O2 (g).
1 d [N2O5 ]
1
·
= K · [N2O5 ]0
2
dt
-1
mol
mol
· (0,022)
= K· 0,10
2
L · min
L
VR = -
K=
0,011
= 0,11 min-1
0,10
Questão 15
Um motor pulso-jato é uma máquina térmica que pode ser representada por um ciclo
termodinâmico ideal de três etapas:
l. Aquecimento isocórico (combustão).
II. Expansão adiabática (liberação de gases).
III. Compressão isobárica (rejeição de calor a pressão atmosférica).
Considerando que essa máquina térmica opere com gases ideais, indique qual dos diagramas
pressão versus volume a seguir representa o seu ciclo termodinâmico.
A( )
P
P2
Pk
Patm
V
Pk = P2 2
Vk
V1 Vk
V2 = V 1
B( )
P
P2
Pk
Patm
P
P2
Pk
Patm
V
Pk = P2 2
Vk
E( )
P
P2
Pk
Patm
V
V
Pk < P2 2
Vk
V2 V1 Vk
V
V2 V1 Vk
16
D( )
V
V
Pk > P2 2
Vk
V1 Vk
V2 = V 1
V
GABARITO ITA – QUÍMICA
C
( )
P
P2
V
Pk < P2 2
Vk
Pk
Patm
V1 Vk
V2 = V 1
V
Gabarito: Letra C.
I. isocórico: linha paralela ao eixo da pressão (como aquecimento, P2>Patm)
γ
II.adiabática
γ
( PV )
=
constante
e
γ > 1⇒
γ
V
V
γ > 1, Vk > V2 ⇒ Pk = P2 2 < P2 2
Vk
Vk
V
P2 Vk
=
= Pk = P2 2
Pk V2
Vk
γ
como
III. isobárico, linha reta perpendicular ao eixo de volume.
Logo, devem ter como alternativa a letra. C.
Questão 16
Deseja-se depositar uma camada de 0,85 g de níquel metálico no catodo de uma célula eletrolítica,
mediante a passagem de uma corrente elétrica de 5 A através de uma solução aquosa de nitrato
de níquel. Assinale a opção que apresenta o tempo necessário para esta deposição, em minutos.
A
B
C
D
E
( ( ( ( ( ) 4,3
) 4,7
) 5,9
) 9,3
) 17,0
Gabarito: Letra D.
Ni+2 (NO3 )− ⇒ Nitrato de Níquel
17
GABARITO ITA – 16/12/2016
−
Reação da dissociação: Ni(NO3 )2 → Ni+2
(aq) +NO3(aq)
−
Ni+2
(aq) + 2e → Ni(s)
96500C
1 mol do Ni 58, 69g 2 mol do e − x
−
0, 85g 5 · tempo 1 mol do e
t=
164050
293, 45
1 min
= 9, 32 min
tempo = 559, 04 s ·
60s
Questão 17
Considere as seguintes proposições para espécies químicas no estado gasoso:
I. A energia de ionização do íon Be3+ é maior do que a do íon He+.
II. O momento dipolar elétrico total da molécula de XeF4 é maior do que o da molécula de XeF2.
III. A energia necessária para quebrar a molécula de F2 é maior do que a energia necessária para
quebrar a molécula de O2.
IV. A energia do orbital 2s do átomo de berílio é igual à energia do orbital 2s do átomo de boro.
Das proposições acima, está(ão) CORRETA(S)
A
B
C
D
E
( ( ( ( ( ) apenas I.
) apenas I e IV.
) apenas II.
) apenas II e III.
) apenas IV.
Gabarito: Letra A.
I. Verdadeira. Be+3(z=4) e He+(z=2) são espécies hidrogenóides com diferentes cargas
nucleares. Como o Be+3 possui maior carga nuclear então possuirá maior energia de
ionização que o He+.
II. Falsa. Ambas moléculas são apolares.
III. Falsa. A energia necessária para romper a dupla ligação em O2 é maior que para quebrar a
ligação simples em F2.
18
GABARITO ITA – QUÍMICA
IV. Falsa. Como as cargas nucleares são distintas a energia dos orbitais 2s do Be e B serão
diferentes.
Questão 18
Considere as proposições a seguir:
I. A reação do ácido butanóico com a metilamina forma N-metil-butanamida.
II. A reação do ácido propanóico com 1-propanol forma propanoato de propila.
III. 3-etil-2,2-dimetil-pentano é um isômero estrutural do 2,2,3,4-tetrametil-pentano.
V. O 2-propanol é um composto quiral.
Das proposições acima estão CORRETAS
A
B
C
D
E
( ( ( ( ( ) apenas I e II.
) apenas I, II e III.
) apenas II e III.
) apenas II, III e IV.
) apenas III e IV.
Gabarito: Letra B.
I.Correta:
O
O
CH3
H+
→
OH + CH3 – NH2 ←
NH
+ H 2O
II.Correta:
OH
OH
+
O
+
H
→
←
+ H2 O
O
O
III.Correta:
é isômero de
.
19
GABARITO ITA – 16/12/2016
IV.Incorreta:
OH
H3C — C — CH3 não apresenta carbono quiral.
H
Questão 19
Assinale a opção que indica a técnica de química analítica empregada em etilômetros (bafômetros)
que utilizam dicromato de potássio.
A
B
C
D
E
( ( ( ( ( ) Calorimetria.
) Densimetria.
) Fotometria.
) Gravimetria.
) Volumetria.
Gabarito: Letra C.
A identificação de álcool pelo bafômetro se baseia na reação redox:
2K2Cr2O7 + 3C2H5OH + 8H2SO4 → 2Cr2(SO4)3+2K2SO4 + 3CH3COOH + 11H2O.
Que ococrre com mudança de coloração (laranja → verde) que pode ter a intesidade luminosa
medida pela técnica analítica conhecida como fotometria.
Questão 20
São feitas as seguintes proposições a respeito dos hidrocarbonetos cuja fórmula molecular é
C5H10
I. Existem apenas seis isômeros do C5H10.
II. Pelo menos um dos isômeros do C5H10 é quiral.
III. Em condições ambiente e na ausência de luz todos os isômeros do C5H10 são capazes de
descolorir água de bromo.
Das proposições acima é (são) CORRETA(S)
A ( ) apenas I.
B ( ) apenas II.
C ( ) apenas III.
20
GABARITO ITA – QUÍMICA
D ( ) apenas I e III.
E ( ) apenas II e III.
Gabarito: Letra B.
I. Incorreta - existem 10 isômeros com a fórmula molecular C5H10.
pent-1-eno
pent-2-eno
2-metilbut-2-eno
metilciclobutano
2-metilbut-1-eno
3-metilbut-1-eno
etilciclopropano
ciclopentano
1,1 dimetilciclopropano 1,2 dimetilciclopropano
II. Correta - o composto 1,2-dimetilciclopropano apresenta 3 configurações estereoisômeras.
H
CH3
H
CH3
meso(cis)
opticamente inativo
CH3
H
CH3
H
H3C
H
H
CH3
d(trans)
l(trans)
enantiômeros
opticamente ativos
III. Incorreta - A adição de bromo ocorre apenas nos isômeros que são alcenos.
21
GABARITO ITA – 16/12/2016
Questão 21
Gás cloro é borbulhado em uma solução aquosa concentrada de NaOH a quente, obtendo-se
dois ânions X e Y.
a) Quais são estas espécies X e Y?
b) Com a adição de solução aquosa de nitrato de prata poder-se-ia identificar estes ânions?
Justifique sua resposta utilizando equações químicas e descrevendo as características do(s)
produto(s) formado(s).
Gabarito:
C 2 (g) borbulhando em solução aquosa concentrada e quente de NaOH produz cloreto de sódio
e clorato de sódio, além de água: 3C 2 (g) + 6NaOH(aq) ∆
→ 5NaC ( aq ) +NaCO3(aq) + 3H2O()
Escrevendo a equação iônica, já que o sódio é íon espectador, temos:
−
−
3C 2 (g)+60H(aq)
∆
→ 5C (aq)
+ CO3−( aq ) + 3H2O
A diferenciação entre os ânions cloreto (Cl–) e clorato (Cl03–) é simples, uma vez que cloreto de
prata é insolúvel (precipita), enquanto que clorato de prata é solúvel:
−
C (aq)
+ AgNO3( aq ) → AgC(s) + NO3−
−
CO3(aq
) + AgNO3( aq ) → não há reação, uma vez que o clorato de prata é solúvel.
Questão 22
Ambos os íons sulfeto e sulfito reagem, em meio ácido, com o íon bromato, provocando o
aparecimento de uma coloração no meio reacional.
a) Escreva as equações químicas balanceadas que representam as reações que provocam o
aparecimento de coloração no meio reacional.
b) Escreva a equação química balanceada que representa a reação envolvendo o sulfito quando
há excesso do agente redutor. Nestas condições, explique o que ocorre com a coloração do
meio reacional.
Gabarito:
a) O íon bromato (BrO3–) se reduz a Br2(aq). O íon bromato é o agente oxidante, e o Br2(aq) produz
+
+ 10 e − → Br2(aq) + 6H2O()
coloração castanha na água: 2BrO3−( aq ) + 12H(aq)
b) O íon sulfito (SO32–) se oxida a sulfato (S042–). O íon sulfito é o agente redutor:
22
GABARITO ITA – QUÍMICA
SO32(−aq ) + H2O() → SO24(−aq ) + 2H+ + 2e −
Assim, combinamos as duas semiequações, obtendo:
+
−
2BrO3−( aq ) + 5SO32(−aq ) + 2H(aq)
→ Br2( aq ) + 5SO24(aq)
+ H2O
Se há excesso de agente redutor, o íon sulfito, o equilíbrio é deslocado para a direita, intensificando
a coloração.
Questão 23
A reação do benzeno com cloreto de metila, catalisada por cloreto de alumínio, forma um produto
orgânico X.
a) Escreva, utilizando fórmulas estruturais, a equação química que representa a síntese de TNT
(trinitrotolueno) a partir do produto X, incluindo as condições experimentais de síntese.
b) Escreva o nome sistemático, segundo a IUPAC, do isômero mais estável do TNT.
c) Sabendo que a sensibilidade à fricção e ao impacto do TNT está relacionada à presença de
diferentes distâncias intermoleculares no sólido, em que condições e sensibilidade do TNT é
minimizada?
Gabarito:
a) Formação do composto X:
+ CH3 – Cl
AlCl3
Síntese de TNT:
O2N
NO2
HNO3
H2SO4
NO2
Condições experimentais:
– nitração em processo de 3 etapas;
– ácido sulfúrico no processo pode ser reconcentrado e reutilizado;
– o processo gera impurezas poluentes formada por sais inorgânicos (Na2 SO3 , Na2 SO4,...) e
23
GABARITO ITA – 16/12/2016
aromáticos nitratos e sulfurados;
– o TNT é purificado após lavagens c/ soluções contendo Na2 SO3;
b)2-metil-1,3,5-trinitrobenzeno
c)
– diminuição da temperatura nos locais de armazenamento;
– adição de compostos como silicato de cálcio ou serragem de madeira, diminuindo a taxa de
exsudação do explosivo, minimizando risco de detonação acidental.
Questão 24
Após inalar ar na superfície, uma pessoa mergulha até uma profundidade de 200 m, em apneia,
sem exalar. Desconsiderando as trocas gasosas que ocorrem nos alvéolos pulmonares, calcule
a pressão parcial do nitrogênio e do oxigênio do ar contido no pulmão do mergulhador.
Gabarito:
Sabendo que em média, a cada 10 metros corresponde a uma atmosfera temos que:
– calculo da pressão total:
200 m
Ptotal = 1 atm +
⋅ 1 atm
10 m
v
O2
Ptotal = 21 atm
v
v
v
Sabendo que a composição do ar corresponde 21% de O2 e 79% , temos:
v
v
PN2 = X N2 ⋅ Pt = 0,79 · 21 atm = 16,59 atm.
v
79% ,
PO2 = X O2 ⋅ Pt = 0,21 · 21 atm = 4,41 atm.
v
Questão 25
Com base no fato de que o esmalte dentário é sujeito à desmineralização, explique
a) como se forma o ácido lático na saliva humana.
b) como o ácido lático provoca a desmineralização.
c) como a uréia contida na saliva ajuda a proteger contra a desmineralização do esmalte
dentário causada pelo ácido lático.
24
GABARITO ITA – QUÍMICA
Gabarito:
a) A fermentação de carboidratos devido a presença bacteriana gera ácido lático.
b) Podemos representar a desmineralização da hidroxiapatita (principal componente do esmalte
H2O
→ Ca(+aq2 ) + 3 PO4−(3aq ) + OH(−aq ).
dentário) pela seguinte reação: Ca5 ( PO4 )3 OH( s ) ←
c) A ureia presente na saliva pode ser degradada devido a presença bacteriana em amônia, que
devido a presença de íons H+ pode fazer parte do tampão NH3/NH+4, diminuindo a taxa de
desmineralização.
Questão 26
Descreva a síntese da uréia, desenvolvida por Wõhler em 1828, a partir do cianeto de prata,
oxigênio molecular e cloreto de amônio.
Gabarito:
→ 2AgCNO
I. 2AgCN+O2 ∆
II. AgCNO+NH4 C
→ AgC+NH4 CNO
O
||
∆
III. NH4 CNO
→ H2N − C − NH2
Questão 27
Considere que a radiação de comprimento de onda igual a 427 nm seja usada no processo
de fotossíntese para a produção de glicose. Suponha que esta radiação seja a única fonte de
energia para este processo. Considere também que o valor da variação de entalpia padrão da
reação de produção de glicose, a 25 ºC, seja igual a +2808 kJ · mol–1
a) Escreva a equação que representa a reação química de produção de um mol de glicose pelo
processo de fotossíntese.
b) Calcule a variação de entalpia envolvida na produção de uma molécula de glicose,yia
fotossíntese, a 25 ºC.
c) Calcule a energia de um fóton de radiação com comprimento de onda de 427 nm.
d) Quantos destes fótons (427 nm), no mínimo, são necessários para produzir uma molécula
de glicose?
25
GABARITO ITA – 16/12/2016
Gabarito:
a) 6 CO2 + 6 H2C → C6H12O6 + 6 O2.
b) ∆H = 2808 kJ · mol–1.
Logo, para 1 molécula, temos:
2808 ⋅ 103
∆H =
⇔ ∆H ∼
= 4, 66 · 10−18 J.
23
6, 02 ⋅ 10
E = hf
hc
6, 626 · 10−34 · 3, 0 · 108
∼ 4, 66 · 10−19 J.
⇒ E= ⇒ E =
⇔ E=
c)
427 · 10−9
λ
c = λf
d)
4, 66 · 10−18
≅ 10 ⇒ no mínimo 11 fótons.
4, 66 · 10−19
Questão 28
Considere as reações químicas reversíveis I e II:
K1
→ Br − (aq) + 3 SO24 − (aq).
I. BrO3− (aq) + 3 SO32 − (aq) ←
K2
→ O3 (g).
II. O2 (g)+O(g) ←
A respeito das reações I e II responda às solicitações dos itens a e b, respectivamente:
a) Sabendo que a reação I ocorre em meio ácido e que a sua reação direta é sujeita à lei de velocidade
dada por v=k 1 BrO3− SO32 − H+ , expresse a lei de velocidade para a reação reversa.
b) Calcule a constante de equilíbrio da reação II dadas as seguintes reações e suas respectivas
constantes de equilíbrio:
hv
→ NO (g) + O(g)
NO2 (g) ←
→ NO2 (g)+O2 (g)
O3 (g)+NO(g) ←
K eq. = 4, 0 × 10−49
K eq. = 2, 0 × 10−34
Gabarito:
k1
−
2−
a) BrO3−( aq ) + 3SO32(−aq ) Br( aq ) + 3SO4( aq )
k
2
Dada a lei de velocidade da reação direta v = k 1 BrO3− SO32 − H+ pode-se inferir que a etapa
lenta seja:
k
1
2−
H+ + BrO3− + SO32 − HBrO2 + SO4 ( etapa lenta)
26
GABARITO ITA – QUÍMICA
Como se pode perceber, 1 íon SO32− é responsável por reduzir em 2 unidades o nox do Br.
Partindo desse raciocínio, a redução até Br– exige mais 2 etapas:
2−
HBrO2 + SO32 − HBrO + SO4 (etapa rápida)
−
+
2−
HBrO + SO32 − Br + SO4 + H (etapa rápida)
Encontrando o mecanismo da reação, determinar a lei de velocidade da reação inversa depende
somente de conhecer sua etapa lenta.
É sabido que estatisticamente é menos provável que 3 espécies colidam simultaneamente para
que a reação ocorra e, portanto, a última etapa escrita deve ser a lenta da reação inversa, bem
como a 1a é da reação direta.
Logo,
b) Invertendo a primeira reação química:
hv
NO(g) +O(g) NO2( g)
'
=
K eq
1
4, 0 ⋅ 10−49
Invertendo a segunda reação química:
K ''eq =
NO2(g)+O2(g) O3( g) + NO( g)
1
2, 0 ⋅ 10−34
Somando as reações:
hv
NO(g) +O(g) NO2( g)
'
=
K eq
+ NO2(g) +O2(g) O3( g) + NO( g)
1
⋅
4, 0 ⋅ 10−49
1
2, 0 ⋅ 10−34
'
''
total
K eq
= K eq
⋅ K eq
O2( g) + O( g) O3( g)
total
K eq
=
K ''eq =
1
1
4, 0 ⋅ 10−49 2, 0 ⋅ 10−34
=
10+83
8
total
K eq
= 0, 125 ⋅ 10+83 ≡ 1, 25 ⋅ 1082.
27
GABARITO ITA – 16/12/2016
Questão 29
Sobre um motor pulso jato como o apresentado na Questão 15, considere verdadeiras as
seguintes afirmações:
I. A temperatura de fusão do material que compõe a câmara de combustão é 1.500 K, e acima
de 1.200 K o material do motor começa a sofrer desgaste considerável pelos gases de
combustão;
II. O material do motor resiste a pressões de até 30 atm;
III. O motor opera, em cada ciclo termodinâmico, com 0,2 mol de uma mistura de gases com
comportamento ideal, iniciando o ciclo em pressão atmosférica e a temperatura de 300 K.
a) A partir destas informações e considerando que se deseja obter, de forma segura, o máximo
de trabalho por ciclo, quais devem ser a pressão e a temperatura no ponto de intersecção
entre os processos I e II do ciclo termodinâmico (vide Questão 15)?
b) Na mistura de gases que opera em cada ciclo há uma fração de combustível, o qual tem a
reação de combustão dada por:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g)
Qv = 45 kJ · g–1
em que Qv é o calor liberado a volume constante, por grama de metano. Considerando a
capacidade calorífica molar a volume constante da mistura de gases igual a 25 J·K–1 ·mol–1, qual
é a massa de metano utilizada pelo ciclo projetado no item anterior?
Gabarito:
P
ponto de interseção
P2
II
I
Patm
300 K
V1
V
a)O ponto de interseção, neste ciclo, é o de máxima pressão e máxima temperatura.
Analisaremos os possíveis valores considerando os limites da câmara: 1200 K e 30 atm.
28
GABARITO ITA – QUÍMICA
1o caso: P2 =30 atm
P1 V1
P2 V2
PV
1
30
= cte ⇒
=
⇒
=
⇔
T
T1
300
T2
T2
T2 = 9.000K
2o caso: T2 =1200 K
P1 V1
P2 V2
P2
PV
1
=
⇔
= cte ⇒
=
⇒
T
T1
T2
300
1.200
P2 = 4 atm
b) Calor trocado a volume constante:
Qv = nCv ∆T ⇒
Qv = 0, 2 mol ⋅ 25 J K −1 mol
−1
⋅ (1.200 − 300) K ⇔
Qv = 5.900 J ⇔ Qv = 4500 J ⇔ Qv = 4, 5 kJ
Mas, para o metano, Qv = 45 kJ ⋅ g−1 ⇒
m = 0, 1 g
Questão 30
Considere as substâncias o-diclorobenzeno e p-diclorobenzeno.
a) Escreva as fórmulas estruturais de ambas as substâncias.
b) Para ambas as substâncias, forneça um nome sistemático diferente daquele informado no
enunciado.
c) Qual das duas substâncias tem maior ponto de ebulição? Justifique sua resposta.
Gabarito:
a)
C
C
C
(o - diclorobenzeno)
C
(p - diclorobenzeno)
29
GABARITO ITA – 16/12/2016
b) Outra forma de nomear é enumerando os carbonos
C
1
C
6
2
5
3
4
6
5
C
1
2
4
3
C
(1,4 - diclorobenzeno)
(1,2 - diclorobenzeno)
c) O composto 1,2-diclorobenzeno é um composto polar e apresenta interações intermoleculares
denominadas dipolo-permanente (dipolo-dipolo). Entretanto, o composto 1,4-diclorobenzeno
é um composto apolar e apresenta interações intermoleculares denominadas dipolo induzidodipolo induzido (Forças de London).
As interações dipolo-permanente são mais intensas que as interações dipolo induzido dipolo induzido. Consequentemente, o composto 1,2-diclorobenzeno apresenta maior ponto
de ebulição.
Comentário de química
Este ano, a banca apresentou um exame com maior enfoque em Físico-Química, em detrimento
das outras grandes áreas.
Nota-se também a presença de tópicos específicos como Ciência dos Materiais (Materiais
Cerâmicos), Química Fisiológica e Analítica, e Materiais Explosivos.
O nível de dificuldade da prova foi superior aos dos últimos anos e exigiu uma análise qualitativa
mais apurada dos candidatos.
Acreditamos que este vestibular selecionará os alunos mais bem preparados.
Equipe de química
Alexandre Grillo
Bruno Berner
Eurico Dias
Jean Pierre
Jorge Ferreira
Kessy Jhonnes
Nelson Santos
30
GABARITO ITA – QUÍMICA
31