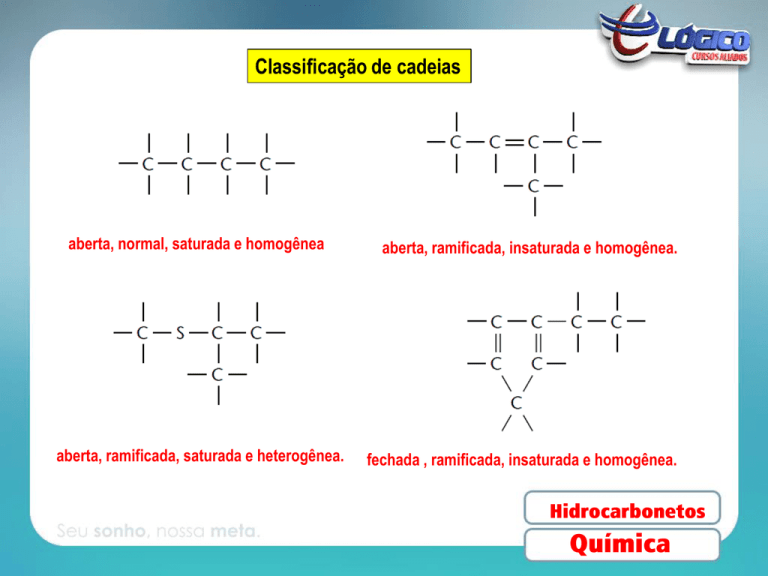
Classificação de cadeias
aberta, normal, saturada e homogênea
aberta, ramificada, saturada e heterogênea.
aberta, ramificada, insaturada e homogênea.
fechada , ramificada, insaturada e homogênea.
Aromática e mononuclear.
Aromática, polinuclear e núcleos isolados
Aromática, polinuclear e núcleos condensados
Observações :
Primário
terciário
secundário
quaternário
Quantos compostos orgânicos
existem atualmente ?
Mais de 19 milhões de
compostos orgânicos.
Não, isso seria
impossível !
Mas será que preciso
conhecer todos eles?
Compostos orgânicos
Classes orgânicas
São grupo de substâncias que apresentam certa semelhança
em sua composição e em suas propriedades químicas.
Caracterizadas pela presença de grupos funcionais
H2
C
H2
C
H3C
C
H2
Hidrocarboneto
Álcool
C
H2
C
H2
H3C
H2
C
C
H2
C
O
H
C
H2
O
H3C
CH3
H2
C
C
C
H2
C
H2
CH3
O
C C C
H2
C
OH
C
H2
C-O-C
H2
C
CH3
H2
C
O
Cetona
H2
C
C
H2
H3C
Éter
-NH2
H2
C
H3C
CH3
H2
C
H2
C
H
N
C
H2
Amina
C
H2
CeH
H2
C
H3C
H2
C
H2
C
C
H2
Ácido carboxílico
C
H2
H2 O
C
C
OH
O
C
O
H
Quais são as diferenças entre
os compostos orgânicos?
Tamanho da cadeia
Tipo de ligação
Função
Tudo isso deve ser indicado na
nomenclatura orgânica.
Princípios da nomenclatura orgânica
Prefixo
Número de
carbonos
1C – met
2C- et
3C –prop
4C –but
5C-pent
6C –hex
7C-hept
8C- oct
9C-non
Infixo
Tipo de ligação
Sufixo
Função
orgânica
AN – ligação simples
O – hidrocarboneto
EN – ligação dupla
OL – Álcool
IN – ligação tripla
AL – aldeído
DIEN – duas duplas
ONA – cetona
ÓICO- ácido carboxílico
Hidrocarbonetos?
Mais de 19 milhões de
compostos orgânicos.
O petróleo é uma
mistura de
hidrocarbonetos.
Hidrocarbonetos
Alcanos
Alcenos
acíclicos
saturados
acíclicos
Insaturados
(uma dupla)
acíclicos
Insaturados
(uma tripla)
acíclicos
Insaturados
(duas duplas)
CnH2n+2
CnH2n
CnH2n-2
CnH2n-2
CH4
metano
H 2C
CH 2
eteno
Alcadienos
Alcinos
HC C
CH3
propino
H2C
C
CH2
propadieno
H 3C
1
CH
CH CH 2
CH 2
CH 3
2
3
5
6
4
Hex-2-eno
H
C
C
C
H
C
H
C
H
2
2
3
1
2
3
4
5
Pent-1-ino
H
C
C
H
C
H
C
H
C
H
C
H
C
H
3
2
2
2
7
6
5
4
3
Hepta-1,5-dieno
2
1
Classificando os alcadienos
Acumulados
Isolados
As duas duplas
ligações estão no
mesmo carbono.
Quando as ligações duplas
estão separadas por duas ou
mais ligações simples
Conjugados
Quando
as
ligações
duplas estão separadas
por uma única ligação
simples
Hidrocarbonetos
Ciclanos
Ciclenos
cíclicos
saturados
Cíclicos Insaturados
(uma dupla)
CnH2n
CnH2n-2
ciclohexano
ciclopenteno
Hidrocarbonetos
Aromáticos
benzeno
antraceno
naftaleno
fenantreno
Hidrocarbonetos alifáticos de cadeia ramificada
C
H
C
H
3
3
H
C
C
H
C
C
H
C
H
C
H
3
2
2
3
H
C
2
C
H
3
1. Denominar a cadeia principal
2. Denominar os radicais (grupos substituintes)
3. Localizar os radicais através da numeração
Aprendendo a determinar a cadeia principal
1) maior sequência de carbonos
Cadeia principal
H3C
CH2 CH CH2 CH2 CH3
CH3
ramificação
2) A cadeia principal nem sempre está escrita na horizontal
CH2 CH3
CH2
Cadeia principal
ramificação
H3C
CH
CH CH CH2 CH3
CH2 CH3
CH3
ramificação
ramificação
3) No caso de sequências com o mesmo número de carbono, a cadeia
principal será a mais ramificada
C
H
3
C
H
3
Cadeia principal
H
C C C
HC
H
H
3
2C
3
H
C C C
HC
H
H
3
2C
3
C
H
HC
H
3C
3
C
H
HC
H
3C
3
C
H
3
C
H
3
4 ramificações
C
H
3 2 ramificações
H
C C C
HC
H
H
3
2C
3
C
H
HC
H
3C
3
C
H
3
3 ramificações
4) Podem existir duas ou mais cadeias principais equivalentes
H3C
CH
CH2 CH2 CH3
CH3
H3C
CH
CH3
CH2 CH2 CH3
5) Havendo insaturação na cadeia carbônica, ela deve estar incluída na
cadeia principal
Cadeia principal
H2C
CH
CH CH
CH2 CH3
CH2
CH3
CH2 CH2 CH3
ramificação
ramificação
Mas como
ramificada ?
nomear
uma
cadeia
Hex-2-eno
Mas como nomear uma ramificação ?
Grupos orgânicos substituintes
CH3
CH3 CH2 CH2 CH2
H
metil
CH3 CH2
CH 3 CH
etil
propil
H
isopropil
CH 2 CH 3
s-butil
CH3
CH3 CH2 CH2
CH 3 CH
butil
H
H
H
H
H3C
C
H
t-butil
CH3
CH 3
H
C
C
H
C
H
H isobutil
3
2
C
H
3
Grupos orgânicos substituintes
H
C
C
H
2
vinil
fenil
CH2
benzil
Nomeando cadeias ramificadas
5
4
3
2
CH3 CH2 CH2 CH
2-metilpentano
CH3
1
CH3
metil
Define-se a cadeia principal.
A cadeia é numerada a partir da extremidade mais próxima da
ramificação (substituinte)
Os nomes dos radicais antecedem o nome do hidrocarboneto
correspondente à cadeia principal, sendo o nome de cada grupo
substituinte antecedido pelo respectivo algarismo de posição.
4
3
CH3 CH
2
CH
1
CH3
CH3 CH3
metil
2,3-dimetilbutano
Quando dois ou mais substituintes são idênticos, usam-se os
prefixos di-, tri-, tetra
6
H 3C
metil
5
4
CH
3
CH 2 C
2
1
C
CH 3
CH 3
5-metil-hex-2-ino
A cadeia é numerada a partir da extremidade mais próxima da
insaturação , havendo mais do que uma, de modo que para o conjunto
dos substituintes resultem os números mais baixos possível.
8CH 3
Se existirem duas ou mais
substituintes
diferentes,
elas serão referidas em
ordem alfabética.
metil
7
CH2
6
CH2
3
4
CH
CH2 CH
CH2
5-etil-3-metiloctano
H3C
2
1
5
CH 2 CH3
etil
CH 3
Na colocação por ordem alfabética de substituintes não se consideram
prefixos como sec-, terc-, di-, tri-, tetra-. Porém o prefixo iso é
considerado.
De o nome oficial dos compostos a seguir:
terc-butil
metil
1
metil
2
3
4
metil
6
5
etil
4
3
6
7
2
1
3-etil-2-metil-hexano
5
metil
3-terc-butil-4,5,5-trimetil-hept-2-eno
De a fórmula estrutural dos seguintes hidrocarbonetos
a) 2,3-dimetilpent-1-eno
b) 3-isopropil-hex-1-ino
hidrocarbonetos de cadeia fechada
cicloalcanos
metilciclobutano
5
4
etil
1
3
etilciclopentano
Ordem alfabética
numeração preferêncial
2
metil
1-etil-3-metilciclopentano
1
5
4
2
3
3-etil-1,1-dimetilciclopentano
Quando existe mais de um substituinte a numeração dos carbonos do
ciclo deve começar pelo carbono que apresentar maior quantidade de
substituintes, de modo a se obterem os menores algarismos possíveis
para os carbonos nos quais existem outros substituintes.
hidrocarbonetos de cadeia fechada
cicloalcenos
4
5
3
1
2
3-etil-1-metilciclopenteno
hidrocarbonetos de cadeia fechada
benzeno
um substituinte
C
H
C
H
2
3
etilbenzeno
isopropilbenzeno
Dois substituintes
benzeno
CH 3
1
6
5
2
CH 3
1,2-dimetilbenzeno
3
4
CH 3
3
2
4
5
1
6
CH 2 CH 3
1-etil,2-metilbenzeno
para
orto
CH 3
CH 3
1
2
1
6
CH 3
5
meta
orto-dimetilbenzeno
3
4
CH 3
CH3
para-dimetilbenzeno
1
2
3
2
CH 3
meta-dimetilbenzeno
Observação:
Em estruturas mais complexas, o benzeno
considerado como uma ramificação (fenil).
6
5
4
3
2
3-fenil-2,2-dimetil-hexano
1
pode
ser
Propriedades físicas dos compostos orgânicos
Propriedades
físicas
São aquelas que podem ser observadas
sem alterar a estrutura química da
substância
São consequências diretas da estrutura de suas moléculas.
Ligações intermoleculares
Polaridade das moléculas
Classificadas como :
• Dipolo-Dipolo
• Dipolo induzido
Moléculas polares
Moléculas apolares
•Ligações de hidrogênio
Moléculas muito polares
H–FON
Intensidade das força intermoleculares
Ligações de hidrogênio > dipolo-dipolo > dipolo-induzido
Intensidade de interações
Ponto de fusão e ebulição
hidrocarbonetos
Moléculas apolares
Dipolo induzido
H3C C CH3
H2
H3C C C C CH3
H2 H2 H2
cadeia
Intensidade de
interação
Pf e Pe
Te=-42 °C
Te=−0.5 °C
Moléculas
apolares
Dipolo induzido
2,4-dimetilpentano
heptano
Qual das substâncias
apresenta um maior ponto
de ebulição?
Heptano
Por que ?
intensidade
ramificações
Superfície de
contato
interações
Pontos
Fusão/ebulição
Solubilidade
Praticamente Insolúveis em solventes polares
Quando pensamos em
hidrocarbonetos que
imagem se forma na nossa
cabeça?
Petróleo
Mas o que
petróleo ?
Petróleo, palavra derivada do latim
petroleum, ou óleo de pedra, é um
produto natural, de composição
química
variada,
formada
principalmente por hidrocarbonetos
O petróleo é formado a partir da sedimentação de matéria
orgânica, que ocorre em depressões da crosta terrestre. Essa
matéria orgânica, pela ação de microrganismos, da pressão, do
calor e do tempo é transformada em petróleo.
Mas o petróleo serve
para que ?
Fonte de
combustíveis
Fonte de matérias
primas
Processamento do
petróleo
Processamento físico
Destilação fracionada
Processamento químico
Craqueamento
Reforma catalítica
Gasolina
Octanagem
A octanagem consiste na resistência à detonação de um determinado
combustível. Quanto mais elevada a octanagem, maior será a
capacidade do combustível ser comprimido, sob altas temperaturas,
na câmara de combustão sem que ocorra a detonação.
Menor
Resistência
detonação
Maior
Resistência
detonação









