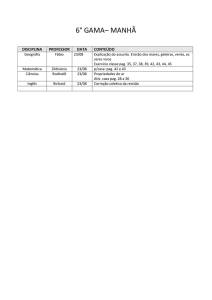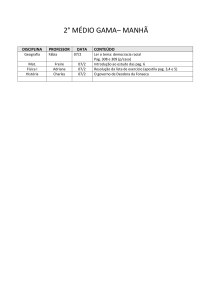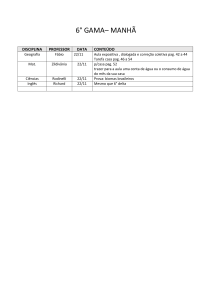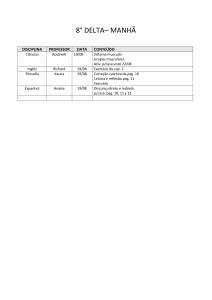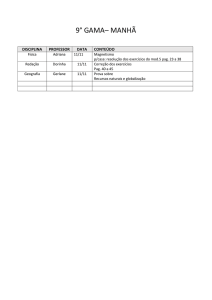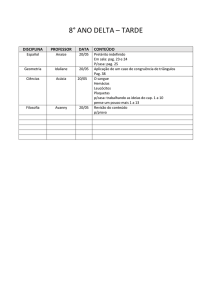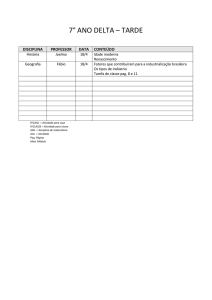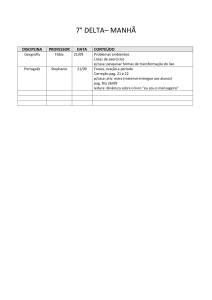
PAG Química – Cinética
1.
PAG Química – Cinética
PAG Química – Cinética
2.
PAG Química – Cinética
3.
PAG Química – Cinética
errata: a reação é em mais
de uma etapa, os gráficos
devem apresentar pelo
menos duas!!
PAG Química – Cinética
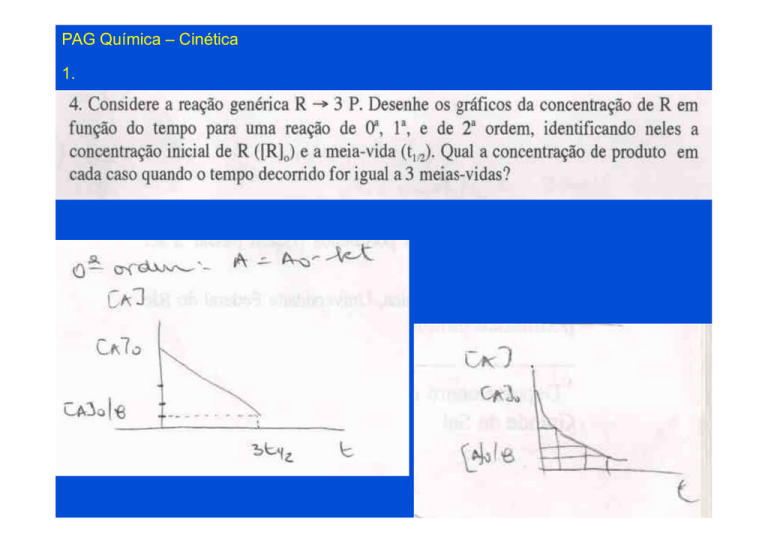
4.
PAG Química – Cinética
PAG Química – Cinética
5. Explique se cada uma das alternativas abaixo é correta ou não, para reações
químicas que ocorrem sem que haja variação de temperatura e pressão:
a) uma reação química realizada com a adição de um catalisador é denominada
heterogênea se existir uma superfície de contato visível entre os reagentes e o
catalisador.
b) a ordem de qualquer reação química em relação à concentração do catalisador é
igual a zero.
PAG Química – Cinética
c) a lei de velocidade de uma reação química realizada com a adição de um catalisador,
mantidas constantes as concentrações dos demais reagentes, é igual àquela da mesma
reação não catalisada.
d) uma reação catalisada por uma enzima, onde há um grande excesso (milhões de
vezes) de reagente em relação ao catalisador, pode ser considerada de ordem zero em
relação ao reagente.
PAG Química – Cinética
6. Os dados a seguir foram obtidos para a reação A + B + C ⎯→ Produtos:
Experimento
Concentração inicial (mol.L-1)
velocidade inicial
(mol.L-1.s-1)
[A]o
[B]o
[C]o
1
1,25
1,25
1,25
8,7
2
2,50
1,25
1,25
17,4
3
1,25
3,02
1,25
50,8
4
1,25
3,02
3,75
457
5
3,01
1,00
1,15
?
a) escreva a lei de velocidade para esta reação.
b) qual a ordem global da reação?
c) determine o valor da constante de velocidade.
d) prediga o valor da velocidade inicial para o experimento número 5.
PAG Química – Cinética
PAG Química – Cinética
PAG Química – Cinética
7. Quatro experimentos foram conduzidos para a reação
BrO3- (aq) + 5 Br – (aq) + 6 H+ (aq) → 3 Br2 (aq) + 3 H2O (l)
Experimento
[BrO3-]o (mol/L)
[Br-]o (mol/L)
[H+]o (mol/L)
vo (mol/Ls)
1
0,10
0,10
0,10
1,2 x 10-3
2
0,20
0,10
0,10
2,4 x 10-3
3
0,10
0,30
0,10
3,6 x 10-3
4
0,20
0,10
0,15
3,6 x 10-3
a) determine a ordem global e as ordens parciais em relação a cada reagente.
b) calcule a constante cinética de velocidade.
c) escreva a lei global de velocidade para essa reação.
d) esta reação deve ocorrer em um única etapa? Explique.
PAG Química – Cinética
PAG Química – Cinética
8. A reação de substituição do grupo X- pelo grupo OH- (RX + OH- → ROH + X-),
quando realizada a 32° C apresenta o seguinte diagrama (Energia x λ):
a) tendo sido determinado o fator pré-exponencial da reação (A da equação de
Arrhenius) como 850 (sendo a coordenada tempo dada em minutos), determine a lei de
velocidade da reação.
b) qual será a velocidade de formação do composto ROH quando as concentrações de
RX e OH- forem, respectivamente, 3 mol/L e 2 mol/L?
c) sabendo que as concentrações iniciais de RX e OH-, são respectivamente 5 mol/L e 4
mol/L, qual será a concentração do produto após transcorridos 20 minutos de reação?
PAG Química – Cinética
PAG Química – Cinética
9. Quatro fatores influenciam a velocidade de uma reação química: a natureza dos
reagentes, a concentração de reagentes, a temperatura e a presença de catalisador.
a) explique a influência da natureza dos reagentes através da Teoria do Estado de
Transição.
b) explique a influência da concentração de reagentes, através da Teoria das Colisões.
c) explique a influência da temperatura através de curvas de distribuição de velocidades
moleculares de Maxwell-Boltzmann.
d) explique a influência de catalisadores através de curvas de distribuição de
velocidades moleculares de Maxwell-Boltzmann.
PAG Química – Cinética
PAG Química – Cinética
10. Os seguintes dados foram obtidos numa dada temperatura para a
decomposição do acetaldeído CH3CHO (g) → CH4 (g) + CO (g)
Experimento
[CH3CHO]o (mol/L)
vo (mol.L-1.s-1)
1
0,10
9.0 x 10-7
2
0,20
36,0 x 10-7
3
0,30
81,0 x 10-7
4
0,40
144,0 x 10-7
5
0,73
?
a) escreva a lei de velocidade para a reação.
b) qual a ordem total da reação?
c) determine a constante cinética de velocidade da reação.
d) calcule a velocidade inicial da reação para o experimento 5.
e) você acredita que esta reação ocorra em uma única etapa elementar? Explique.
PAG Química – Cinética
PAG Química – Cinética
11. Na temperatura ambiente, a reação 2 H2 (g) + 2 NO (g) → 2 H2O (g) + N2 (g)
exibe a seguinte dependência de velocidade com a concentração:
Exp. no
[H2]0 (mol/L)
[NO]0 (mol/L)
V0 (mol/L.min.)
1
0,001
0,006
36 x 10-4
2
0,002
0,006
72 x 10-4
3
A
0,006
108 x 10-4
4
0,006
B
6 x 10-4
5
0,006
0,002
C
Sabe-se que a constante de velocidade tem dimensões de L2/(mol2.min). Pergunta-se:
a) essa reação pode ser realizada em uma única etapa?
b) qual a lei global de velocidade para a reação, incluindo o valor de k?
c) quais os valores de A, B e C?
Justifique todas as suas respostas.
PAG Química – Cinética
PAG Química – Cinética
PAG Química – Cinética
12. Para a reação de segunda ordem A → B + C, a concentração da espécie A
cai de 0,040 mol/L para 0,0050mol/L em 12 h.
a) qual a constante de velocidade da reação?
b) esta reação pode ocorrer em uma única etapa? Justifique.
c) se a concentração inicial de A for 0,040 mol/L, qual será a sua concentração
após 2 h?
d) quanto tempo levará para a concentração de A cair de 0,030 mol/L para 0,010
mol/L?
e) se a concentração inicial de A for 0,040 mol/L, quanto tempo é necessário
para a concentração de A decrescer de 2 meias-vidas?
PAG Química – Cinética
PAG Química – Cinética
13. O seguinte mecanismo foi proposto para a reação (endotérmica) de
destruição do ozônio na atmosfera, em presença de cloro atômico e em
fase gasosa:
Etapa 1: O3 + Cl → ClO + O2
k = 3 x 10-8
Etapa 2: ClO + O3 → Cl + 2 O2
k = 5 x 10-3
a) apresente a equação da reação global
b) apresente as unidades de k, sendo as pressões parciais medidas em
atm e o tempo em minutos
c) represente qualitativamente em um gráfico a energia potencial do
sistema contra a ordenada de reação
d) no mesmo gráfico, indique a energia de ativação de cada etapa da
reação
e) ainda no mesmo gráfico, mostre a variação da energia potencial do
sistema para a mesma reação sob a ação de um catalisador. Considere
que somente a etapa mais lenta da reação é influenciada pelo
catalisador.
PAG Química – Cinética
PAG Química – Cinética
14. Considere uma reação química endotérmica, com um mecanismo
proposto de duas etapas, sendo a primeira rápida e a segunda lenta.
a) represente um diagrama de Energia Potencial em função da Coordenada
de Reação para esta reação química.
b) assinale, no gráfico, a energia de ativação de cada etapa e a entalpia da
reação global.
c) defina complexo ativado. Assinale sua ocorrência no gráfico anterior.
d) represente a modificação que ocorre no gráfico devido à presença de um
catalisador que atue apenas na etapa lenta do mecanismo proposto. Por que
o catalisador aumenta a velocidade desta reação?
e) comente a influência de um abaixamento de temperatura sobre a
velocidade desta reação química.
PAG Química – Cinética
PAG Química – Cinética
15. Para a determinação da lei de velocidade da reação química A + B → C, foi
utilizado o método da velocidade inicial. A tabela apresenta os resultados obtidos para
5 experimentos.
Exp.
n0
[A]o (mol/
L)
[B]o
(mol/L)
vo
(mol/L.min)
1
0,125
0,200
0,0291
2
0,250
0,200
0,1164
3
0,500
0,250
0,4656
4
0,500
0,500
0,4656
5
0,375
0,375
0,2619
a) descreva, sucintamente, o método da velocidade inicial para a
determinação de lei experimental de velocidade.
b) escreva a lei de velocidade da reação acima.
c) determine a ordem parcial em relação à cada reagente e a ordem
global desta reação.
d) você acredita que esta reação ocorra em uma única etapa? Explique.
e) para o experimento no 3, qual a concentração de A após decorridos 15
minutos do início da reação?
PAG Química – Cinética
PAG Química – Cinética
16. Abaixo estão representados graficamente os resultados de um
experimento A à B, onde foram medidas diversas concentrações do
reagente A (em mol/L) em função do tempo (em s).
Com base no gráfico:
a) indique qual a ordem da reação.
b) calcule o valor da constante de velocidade.
c) determine o valor da primeira meia-vida da reação.
d) calcule a [A] após decorridos 10 minutos de reação.
Justifique suas respostas.
PAG Química – Cinética
PAG Química – Cinética
17. A decomposição do peróxido de hidrogênio aquoso é um processo
exotérmico e lento, com cinética de 2a ordem em uma única etapa:
2 H2O2 (aq) à 2 H2O (l) + O2 (g)
Entretanto, o íon brometo catalisa essa reação, sugerindo um mecanismo de
duas etapas sucessivas, ambas com Energia de Ativação mais baixa do que a
da reação não catalisada.
a) desenhe o gráfico de Epotencial x coordenada de reação (λ) para o
processo catalisado e não catalisado.
b) conceitue Energia de Ativação para uma reação química.
c) mostre, através de curvas de distribuição de Maxwell-Boltzmann, o efeito
da presença de catalisador e do aumento de temperatura sobre a velocidade
de uma reação química. Descreva os gráficos apresentados.
PAG Química – Cinética
PAG Química – Cinética
18. Observe o seguinte diagrama e responda as questões relacionadas:
a) defina, e assinale no diagrama, Energia
de Ativação.
b) desenhe no diagrama o efeito da
presença de um catalisador.
c) o processo representado é exotérmico
ou endotérmico? Justifique e assinale o ΔH
no diagrama.
d) defina Complexo Ativado e represente
no diagrama a sua localização na curva de
energia.
e) qual a relação entre as energias de
ativação das reações direta e inversa?
Justifique sua resposta.
PAG Química – Cinética
PAG Química – Cinética
19. A reação 2 C4H6 (g) → C8H12 (g) foi estudada a 326o C, e os seguintes dados
experimentais foram obtidos:
Experimento
Pinicial
(mmHg)
vinicial (mmHg/min)
1
632
26
2
316
13
3
948
39
a) qual a lei de velocidade para a reação?
b) quais as ordens parciais e a ordem global desta reação?
c) qual o valor da constante cinética da reação a 326o C?
d) considerando o experimento no 2, qual a pressão do C4H6, após
decorrida 1 hora do início da reação?
PAG Química – Cinética
PAG Química – Cinética
20. Um coquetel de medicamentos formado pelos princípios ativos A, B e C atua
no organismo de acordo com a seguinte reação, a 37º C: 2A + 2B + C à 3G + 4F
Exp. n0
[A]0 (mol/L)
[B]0 (mol/L)
[C]0 (mol/L)
v0 (mol/L.s)
1
10 x 10-3
100 x 10-3
700 x 10-3
2,0 x 10-3
2
20 x 10-3
100 x 10-3
300 x 10-3
4,0 x 10-3
3
20 x 10-3
200 x 10-3
200 x 10-3
16,0 x 10-3
4
10 x 10-3
100 x 10-3
400 x 10-3
2,0 x 10-3
5
4,62 x 10-3
0,18 x 10-3
12,4 x 10-3
?
a) qual a Lei Global de Velocidade para a reação?
b) quais as ordens parciais e a ordem total da reação?
c) qual o valor da Constante de Velocidade?
d) preveja a velocidade inicial de reação no experimento 5.
e) determine a energia de ativação da reação a 25º C (dado: parâmetro de
Arrhenius = 1,5 X 1010, na mesma unidade da constante de velocidade).
f) você acredita que esta reação ocorra em uma única etapa? Explique.
PAG Química – Cinética
PAG Química – Cinética
21. A decomposição do peróxido de hidrogênio tem k = 0,0410 min-1 e
segue a reação:
2 H2O2 (aq) → 2 H2O (l) + O2 (g)
a) esta reação pode ocorrer em uma única etapa? Justifique.
b) se a concentração inicial de H2O2 for 0,40 mol/L, qual será a sua
concentração após 10 minutos?
c) em quanto tempo a concentração de H2O2 cairá de 0,40 mol/L para
0,10 mol/L?
d) se a concentração inicial de H2O2 for de 0,40 mol/L, quanto tempo é
necessário para a concentração de H2O2 decrescer de duas meiasvidas?
PAG Química – Cinética
PAG Química – Cinética
PAG Química – Cinética
22. O seguinte mecanismo foi proposto para a reação (endotérmica) de
hidrogenação do cloreto de iodo, em fase gasosa:
Etapa 1:
ICl + H2 → HI + HCl
k1 = 3 x 10-8
Etapa 2:
HI + ICl → HCl + I2
k2 = 5 x 10-3
a) apresente a equação da reação global;
b) apresente as unidades de k, sendo as pressões parciais medidas em
atm e o tempo em minutos;
c) identifique todos os intermediários;
d) represente qualitativamente em um gráfico a energia potencial do
sistema contra a coordenada de reação;
e) no mesmo gráfico, indique a energia de ativação de cada etapa da
reação e o ΔH da reação global.
f) desenhe um novo gráfico, no mesmo sistema cartesiano, mostrando a
variação da energia potencial do sistema para a mesma reação sob a
ação de um catalisador. Considere que somente a etapa mais lenta da
reação é influenciada pelo catalisador.
PAG Química – Cinética
PAG Química – Cinética
23.
PAG Química – Cinética
24.
PAG Química – Cinética
PAG Química – Cinética
25.
PAG Química – Cinética