ESCOLA SECUNDÁRIA DE SANTA MARIA MAIOR
FÍSICA E QUÍMICA A – 10ºANO (2015/2016)
Ficha de Trabalho nº 2.1
Domínio 2: Propriedades e Transformações da Matéria
M
Subdomínio 4:
4 Ligações químicas
1. Na figura está representado um gráfico que mostra como varia a energia
energia potencial, Ep, de dois átomos de
hidrogénio, em função da distância entre os seus núcleos, r.
1.1 Indique o que representam os valores re= 74 pm e Ep= -436 kJ.mol-1
1.2 Utilize as letras A, B, C e D da figura, de modo a indicar a situação em que:
a) a atração é dominante.
b) a repulsão é dominante.
c) o conjunto dos dois átomos atinge o mínimo de energia potencial.
d) se forma a molécula de H2.
1.3 Selecione a opção correta.
(A) A molécula de H2 é menos estável que cada
c
um dos átomos de
hidrogénio separados.
(B) Atinge-se
se a estabilidade máxima da molécula de hidrogénio quando o valor da energia potencial é 0 kJ.mol-1
(C) Quanto maior a energia potencial da molécula de hidrogénio, maior a sua estabilidade.
estabilidade.
(D) A energia para separar a molécula de hidrogénio designa-se
designa se por energia de dissociação da ligação e tem o
-19
valor de 7,24 x 10 J.
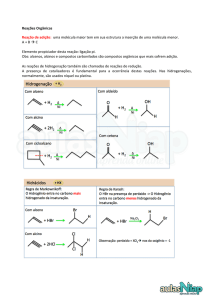
2. O ácido etanoico, vulgarmente conhecido por ácido acético, é um dos componentes do
vinagre. A sua fórmula de estrutura é apresentada à direita.
2.1 Que tipo de ligação se estabelece em cada ligação carbono-oxigénio?
carbono
2.2 Indique o número de eletrões não partilhados que existem nesta molécula.
2.3 Quantos pares eletrónicos de valência contribuem para
para a ligação química em cada molécula de ácido
acético?
2.4 Complete corretamente as frases com os termos ‘maior que o’, ‘menor que o’ e ‘igual
igual ao’.
ao
a) O número de eletrões partilhados na molécula do ácido acético é ________________ número de pares
ligantes.
b) O número de eletrões partilhados nesta molécula é ________________ número de eletrões ligantes.
c) O número de eletrões não partilhados nesta molécula é ________________ número de eletrões partilhados.
3. Complete corretamente
mente as frases seguintes com os termos ‘maior’ e ‘menor’.
a) Quanto ________________ a energia de uma ligação ________________ o comprimento dessa ligação.
b) Quanto ________________ o número de eletrões ligantes ________________ a ordem de ligação.
ção.
c) Quanto menor o número de eletrões partilhados entre dois átomos, numa molécula, ________________ é a
energia de ligação e ________________ é a estabilidade da molécula.
4. Selecione a opção correta.
(A) As moléculas constituídas por três
ês átomos são sempre maiores que as moléculas constituídas por dois átomos.
(B) Os eletrões de valência são os que estão mais fracamente ligados ao núcleo.
(C) Para dissociar uma molécula X2 consome-se
se mais energia do que a energia que é libertada
liber
quando a
molécula X2 se forma.
(D) Nos gases nobres há eletrões disponíveis para serem simultaneamente partilhados por dois núcleos.
5. Dois átomos de nitrogénio, 7 N , ligam-se
ligam para formar a molécula N2.
5.1 Escreva a fórmula de estrutura
rutura de Lewis da molécula N2.
5.2 De entre os eletrões de valência dos átomos de nitrogénio, quantos vão, efetivamente, participar na ligação
química?
5.3 Quantos pares de eletrões não-ligantes
ligantes constituem a molécula N2?
5.4 Selecione
ne a opção que completa corretamente a frase seguinte. A ligação estabelecida é uma…
(A) ligação covalente simples.
(B) ligação covalente dupla.
(C) ligação covalente tripla.
(D) ligação iónica.
6. Selecione a opção correta.
(A) Uma ligação covalente dupla é assegurada por dois eletrões de valência ligantes.
(B) Uma molécula de oxigénio possui menos pares de eletrões ligantes que uma molécula de cloro.
(C) Todas as moléculas diatómicas com ligações covalentes triplas entre os seus átomos possuem igual número de
eletrões de valência ligantes.
(D) A ordem de ligação da molécula de flúor é diferente da ordem de ligação da molécula de bromo, porque são
formadas por átomos de elementos diferentes.
7. O cloro, o bromo e o iodo pertencem, tal como o flúor, ao grupo 17 da Tabela Periódica e todos formam moléculas
diatómicas: F2, Cl2, Br2 e I2.
7.1 Que relação existe entre o número de eletrões de valência de cada uma destas moléculas? Justifique.
Ju
7.2 Escreva as fórmulas de estrutura das moléculas de cloro, bromo e iodo.
7.3 Os comprimentos de ligação destas moléculas são os seguintes: re (Cl2)= 199 pm, re (Br2) = 228 pm;
re(I2)=267 ppm. A que se deve a diferença
nça nos comprimentos de ligação?
7.4 De entre estas moléculas qual é a que apresenta menor energia de ligação? Justifique.
8. Os átomos de nitrogénio e de carbono podem ligar-se
ligar se entre si através de uma ligação covalente simples, – ,
ou de uma ligação covalente tripla, C≡N. O valor médio da energia de uma das ligações é de 276 kJ.mol-1,
enquanto o valor médio da energia da outra ligação é de 891 kJ.mol-1. O comprimento médio de uma dessas
ligações é 116 pm e o de outra é 143 pm. Indique, justificando,
jus
o valor médio da energia e do comprimento de
ligação para cada uma das ligações.
9. O metano (CH4) e o monóxido de carbono (CO) são dois componentes vestigiais da atmosfera, sendo as suas
fórmulas de estrutura as seguintes:
Página 2 de 8
9.1 Selecione a opção correta.
(A) Na molécula de metano as ligações carbono-hidrogénio têm diferentes comprimentos.
(B) Na molécula de monóxido de carbono existem quatro eletrões não-ligantes.
(C) O ângulo de ligação na molécula CO é inferior ao ângulo de ligação na molécula CH4.
(D) Na molécula de metano existem quatro eletrões partilhados.
9.2 Selecione a opção correta.
(A) Na molécula de monóxido de carbono são três os eletrões partilhados.
(B) Na molécula de metano todos os eletrões de valência são ligantes.
(C) Na molécula de metano existem oito eletrões ligantes e oito eletrões não-ligantes.
(D) As moléculas de metano e de monóxido de carbono são polares.
9.3 A energia de ligação carbono-oxigénio numa molécula CO é 1,79 x 10-19 J.
9.3.1 Exprima a energia de ligação carbono-oxigénio em kJ.mol-1.
9.3.2 Determine a energia necessária para dissociar, nos átomos respetivos, uma amostra de monóxido de
carbono com a massa 7,00 g.
10. Considere as seguintes moléculas:
A. N2H4
B. N2
Nestas duas moléculas, os átomos de nitrogénio estão ligados entre si.
10.1 Deduza a fórmula de estrutura de Lewis de cada uma destas moléculas.
10.2 Ordene estas moléculas por ordem decrescente de comprimento de ligação nitrogénio-nitrogénio.
10.3 Em qual destas moléculas a energia de ligação nitrogénio-nitrogénio é maior? Justifique.
11. Faça a correspondência correta entre as colunas I, II e III.
I
Molécula
II
Ângulo de ligação
III
Geometria espacial
(A) BH3
a. 109,5°
1. Linear
(B) NH3
b. 104,5°
2. Triangular plana
(C) CH4
c. 180°
3. Angular
(D) H2O
d. 120°
4. Tetraédrica
(E) CO2
e. 107°
5. Piramidal trigonal
12. Considere a molécula de amoníaco, NH3.
12.1 Escreva a fórmula de estrutura da molécula de amoníaco.
12.2 Por que razão o ângulo de ligação na molécula de amoníaco é aproximadamente igual ao da molécula
de metano, CH4?
13. Selecione a opção correta.
(A) A ligação iónica é uma ligação entre átomos por partilha de eletrões.
(B) Numa ligação covalente tripla existem seis pares eletrónicos partilhados por dois átomos.
(C) Na ligação metálica os eletrões livres movem-se no interior do metal, sendo partilhados por todos os
átomos formando uma nuvem eletrónica.
(D) Quanto menor a ordem de ligação, maior a estabilidade da molécula.
Página 3 de 8
14. Considere os elementos X, Y e Z da Tabela Periódica, em que as letras não correspondem a símbolos químicos.
X: pertence ao grupo 2 e ao 3.o período;
Y: possui carga nuclear +9;
Z: possui três valores de energia de remoção e seis eletrões de valência.
14.1 Escreva as configurações eletrónicas de X, Y e Z.
14.2 Os iões provenientes de X, Y e Z são isoeletrónicos. Justifique esta afirmação.
14.3 Coloque por ordem crescente de raios iónicos os iões referidos na alínea 14.2.
14.4 De entre os elementos Y e Z indique, justificando, qual apresenta maior tendência para captar eletrões.
14.5 Indique qual o tipo de ligação que se estabelece
estabelec entre:
a) X e X.
b) X e Y.
c) Y e Y.
d) Z e Z.
14.6 Represente em notação de Lewis:
a) as ligações entre X e Y.
b) as ligações entre Z e Z.
15.Considere as fórmulas moleculares dos seguintes hidrocarbonetos.
a. C3H8
b. C2H4
c. C2H6
d. C3H4
e. C4H6
15.1 Considere as afirmações de I a V.
I. Todos os hidrocarbonetos são saturados.
II. Os hidrocarbonetos b e e sãoo alcenos.
III. O nome do hidrocarboneto d é propino.
IV. Os hidrocarbonetos a, c e e são saturados e os hidrocarbonetos b e d são insaturados.
V. Os hidrocarbonetos b, d e e são insaturados e os hidrocarbonetos a e c são saturados.
Selecione a opção correta.
(A) Todas as afirmações são corretas.
(B) São corretas as afirmações I, II e IV.
(C) São corretas as afirmações II, III e V.
(D) São corretas as afirmações III e V.
15.2 Escreva
eva o nome dos hidrocarbonetos.
15.3 Escreva as fórmulas de estrutura e as fórmulas racionais dos hidrocarbonetos a, b e d.
16. Indique o nome dos compostos orgânicos representados pelas seguintes fórmulas de estrutura.
A
B
C
D
E
17. Escreva as fórmulas racionais dos seguintes hidrocarbonetos:
a) Hexano.
b) 2,3-Dimetilbutano.
c) 3-Metilbut-1-eno.
Página 4 de 8
d) 3-Etil-2-metilpentano.
e) 1-Cloro-1,2-difluoroetano
18. A fórmula de estrutura
tura representada é de um hidrocarboneto.
18.1 Assinale, na fórmula de estrutura, a cadeia carbonada principal.
18.2 Escreva o nome deste hidrocarboneto.
19. Relativamente aos hidrocarbonetos, selecione a opção correta.
(A) Um alcano com três
rês átomos de carbono pode ser ramificado.
(B) A ordem de ligação carbono-carbono
carbono no etano é maior do que a ordem de ligação carbono
carbono-carbono no
eteno.
(C) A fórmula molecular do 1,1,2-tricloroetano
tricloroetano é C2H3Cl3.
(D) O comprimento da ligação carbono-carbono
carbono carbono no etino é maior do que o comprimento da ligação carbonocarbono
-carbono no eteno.
20. Considere os seguintes hidrocarbonetos:
I. C3H8
II. C2H4
III. C2H6
IV. C2H2
Selecione a opção correta.
(A) Na molécula de C2H4 existem dez eletrões de valência.
(B) O número de eletrões ligantes em C2H2 é três.
(C) De entre os hidrocarbonetos referidos o que apresenta maior energia de ligação carbonocarbono-carbono é C3H8.
(D) A ordem de ligação carbono-carbono
carbono em C2H4 é dois.
21.Considere as moléculas de monóxido de nitrogénio (NO) e de nitrogénio gasoso N2. O monóxido de nitrogénio quando
congelado forma N2O2 com a seguinte fórmula de
d estrutura:
21.1 Escreva a fórmula de estrutura de Lewis do nitrogénio.
21.2 Com base na fórmula de estrutura da molécula de N2O2, selecione a opção incorreta.
(A) O número de eletrões de valência da molécula
molécul é 22.
(B) O número de pares eletrónicos ligantes é 5.
(C) A ligação mais forte na molécula é a ligação nitrogénio-oxigénio
nitrogénio oxigénio e, por isso, o seu comprimento de ligação
é maior que o comprimento de ligação nitrogénio-nitrogénio.
nitrogénio
(D) É mais difícil romper a ligação nitrogénio-oxigénio
nitrogénio
do que romper a ligação nitrogénio-nitrogénio.
nitrogénio.
21.3 De entre as moléculas N2 e N2O2, qual é a quimicamente mais reativa? Justifique.
22. A espécie química O 2+ obtém-se a partir da molécula
mol
de O2. A energia
nergia envolvida neste processo de ionização
das moléculas de oxigénio é 624 kJ.mol
mol-1.
22.1 Qual é a energia necessária paraa ionizar uma molécula de O2?
22.2 A ordem de ligação da espécie química
q
O 2+ é maior, menor ou igual a 2?
22.3 Relativamente ao comprimento de
d ligação O 2+ , selecione a opção correta.
(A) é maior do que 148 pm.
(B) é menor do que 121 pm.
(C) encontra-se entre 121 pm e 148 pm.
Página 5 de 8