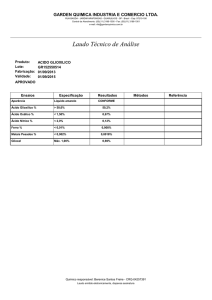
Unifesp
ETAPA
QUESTÃO 09
Certo produto utilizado como “tira-ferrugem” contém solução aquosa de ácido oxálico,
H2C2O4, a 2% (m/V). O ácido oxálico é um ácido diprótico e em suas soluções aquosas
ocorrem duas reações de dissociação simultâneas, representadas pelas seguintes equações
químicas:
Primeira dissociação: H2C2O4 (aq) E HC2O4– (aq) + H+ (aq) ; Ka = 5,9 × 10–2
1
–
2–
Segunda dissociação: HC2O4 (aq) E C2O4
+
(aq) + H (aq) ; Ka = 6,4 × 10–2
2
2–
+
Equilíbrio global: H2C2O4 (aq) E C2O4 (aq) + 2H (aq) ; Ka = ?
a) Expresse a concentração de ácido oxálico no produto em g/L e em mol/L.
b) Escreva a expressão da constante Ka do equilíbrio global e calcule seu valor numérico a
partir das constantes Ka e Ka .
1
2
Resposta
a) Cálculo da concentração de ácido oxálico no produto (g/L):
C=
2 g H2 C2 O4
100 mL produto
$
103 mL produto
= 20 g/L
1 L produto
Cálculo da concentração molar de ácido oxálico no produto (mol/L):
20 g H2 C2 O4 1 mol H2 C2 O4
M=
, 0,22 mol/L
$
1 L produto
90 g H2 C2 O4
14 4 4
424 4 4
43 144442
44443
concentração
m. molar
b) A expressão da constante Ka do equilíbrio global é
Ka =
[C2O 42– ] $ [H +] 2
,
[H2C2O4]
e ela pode ser calculada pela seguinte expressão:
Ka = Ka1 ⋅Ka2 = 5,9 ⋅ 10–2 ⋅ 6,4 ⋅ 10–2 , 3,8 ⋅ 10–3