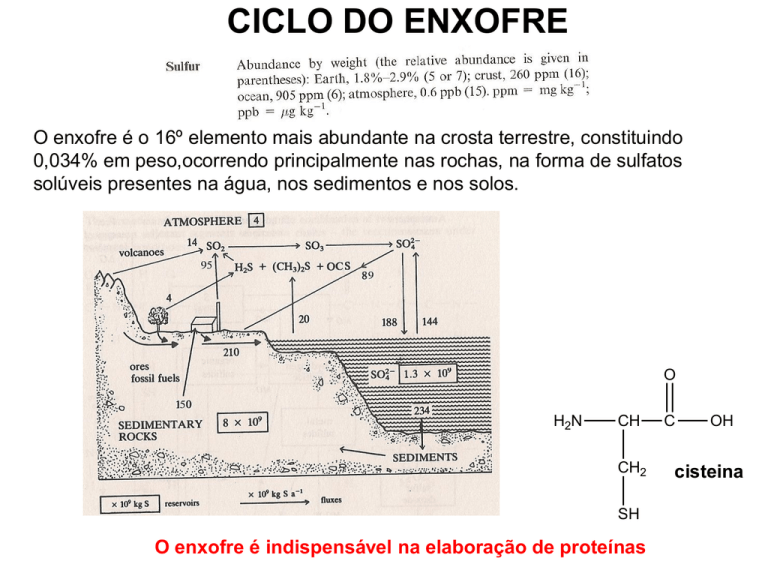
CICLO DO ENXOFRE
O enxofre é o 16º elemento mais abundante na crosta terrestre, constituindo
0,034% em peso,ocorrendo principalmente nas rochas, na forma de sulfatos
solúveis presentes na água, nos sedimentos e nos solos.
O
H2N
CH
CH2
SH
O enxofre é indispensável na elaboração de proteínas
C
OH
cisteina
A versatilidade do enxofre deriva, em parte, da propriedade que apresenta
em comum com o nitrogênio: múltiplos estados estáveis de oxidação e
envolvimento de microorganismos para as suas transformações.
O enxofre é um elemento essencial à vida na Terra, sendo alguns de seus
compostos de grande importância biológica: organismos vivos, incluindo
plantas, assimilam espécies de enxofre, enquanto que ao mesmo tempo,
várias formas de enxofre são emitidas como produto final de seus
metabolismos. O enxofre representa aproximadamente 0,5% da massa
seca de plantas e microrganismos e 1,3% do tecido animal.
- S reduzido é nutriente-chave para manutenção da vida (ex.: integridade
estrutural de proteínas)
- S no estado oxidado (SO42-) é o segundo ânion mais abundante nos rios
e oceanos
- Principal agente causador de acidez em água de chuva H2SO4
- Forma substâncias insolúveis com metais (FeS2) em solos, sedimentos e
minerais
-O ciclo do S é o mais intensamente perturbado pelo homem
→ combustão de carvão mineral, uso de fertilizante (sulfato de
amônio), mineração (drenagem ácida), etc...
Estados de Oxidação do enxofre
Enxofre nos Compartimentos
Fluxos Globais de enxofre
Litosfera
A litosfera é o maior reservatório de enxofre, com um tempo de permanência da
ordem dos 1010anos. Dentro das rochas sedimentares, os evaporitos incluem
sulfatos como o gesso (CaSO4) e outros. Outros tipos de rochas, de natureza
sedimentar ou ígnea, incluem sulfetos metálicos (pirites, blenda, galena, etc.).
O enxofre encontra-se ainda, na forma nativa, junto a fontes hidrotermais e em
depósitos vulcânicos, à superfície ou no subsolo. Alguns depósitos de
elementos sulfurosos, incluindo sulfetos metálicos como a pirite, são de origem
biogénica.
Oceanos
O enxofre encontra-se na água dos oceanos sob a forma de íon sulfato, SO42– ,
o 2º ânion aí mais abundante, e também como sulfeto de hidrogênio H2S
dissolvido, enxofre elementar e substâncias resultantes do metabolismo das
plantas marinhas, de que releva o sulfeto de dimetilo (CH3)2S (DMS).
O enxofre existente no oceano e nos sedimentos resulta na maior parte da
meteorização das rochas. Os sais dissolvidos pelo escoamento da água são
transportados pelos rios (cerca de 213×1012 g.ano–1) e acabam depositados
nas bacias continentais e nos oceanos.
As algas marinhas produzem dimetil-sulfonico-propionato (DMSP), que se
degrada emsulfureto de dimetilo (DMS), em parte libertado para a atmosfera,
num total estimado em 40×106 toneladas de enxofre por ano, e que
majoritariamente regressa ao mar com a precipitação.
Solos
Os solos contêm minerais e matéria orgânica com enxofre na sua composição,
e sulfatos e outros compostos na água do solo. As principais fontes são a
meteorização das rochas, a deposição dos compostos de enxofre presentes na
atmosfera, que atingem o solo sob a forma de sulfato, a decomposição de
matéria orgânica e origens antrópicas direta como fertilizantes, pesticidas e
água de irrigação.
As principais formas de enxofre inorgânico no solo são o sulfato, formas
reduzidas como dióxido de enxofre (SO2–), sulfito (SO32-),enxofre elementar (S0)
e sulfeto (S2–).
Em ambientes aeróbios, o composto inorgânico de enxofre mais estável é o
sulfato, que é solúvel em água. Assim, em solos bem drenados, as formas
reduzidas são facilmente oxidadas a sulfato, SO42– sendo esta a forma
inorgânica aí predominante e através da qual o enxofre é absorvido pelas
plantas via sistema radicular.
As formas reduzidas, principalmente H2S e outros sulfetos, estão mais
presentes em solos alagados ou em condições anaeróbicas onde, devido á sua
baixa solubilidade, normalmente permanecem inertes
Atmosfera
A atmosfera contém pequenas quantidades de dióxido de enxofre (SO2), de
ácido metanosulfónico (CH3SO3H) e de sulfureto de carbonila (COS). Destes, o
COS é o composto gasoso de enxofre com maior tempo de permanência.
Grandes fluxos de partículas de sal marinho e poeira terrestre, contendo
sulfatos, são adicionados à atmosfera, mas a sua abundância restringe-se a
altitudes inferiores a um quilômetro. Estas partículas têm tempos de
permanência de 1 a 7 dias apenas, o que evidencia o seu controlo pela
precipitação.
As erupções vulcânicas ejetam compostos de enxofre, atingindo algumas a
estratosfera, onde os tempos de permanência do enxofre são muito superiores.
A queima do carvão mineral produz grande quantidade de SO2 que se
transforma em H2SO4 produzindo a famosa chuva ácida.
Papel do enxofre nos organismos vivos
O enxofre é um dos seis constituintes principais dos organismos vivos, estando
presente na estrutura de diversos aminoácidos na forma de grupos tiol (-SH),
além de ser um componente essencial de várias enzimas, co-enzimas (os sítios
catalíticos da urease e da coenzima A, contêm enxofre), vitaminas, hormonas e
outros compostos orgânicos. Os aminoácidos cisteína, metionina,
homocisteína e taurina, contêm enxofre, formando as pontes de dissulfeto nas
proteinas entre os polipeptídeos, ligações de grande importância para a
formação das estruturas das proteínas.
Taurina
Metionina
Homocisteína
Cisteína
Papel do enxofre nos organismos vivos
As plantas absorvem o íon sulfato, SO42– , por redução assimilativa e
incorporação de enxofre ligado a carbono nos aminoácidos cisteína e
metionina. Quando as concentrações de sulfato são elevadas, as plantas
acumulam-no nas folhas.
Transformações biológicas do enxofre: Ciclo biológico do enxofre
Os seres vivos oxidam e reduzem diferentes compostos de enxofre, inorgânicos
e orgânicos,definindo um ciclo: Plantas e bactérias absorvem sulfatos e
produzem aminoácidos. Outros seres vivos alimentam-se delas. Outras
bactérias decompõem os aminoácidos com enxofre nos restos de animais e
plantas, produzindo sulfeto de hidrogênio. Outras oxidam o sulfeto a enxofre
elementar e esse enxofre a sulfato.
Formação de pirita nos sedimentos
Muitas jazidas de sulfetos têm origem bioquímica. Nos sedimentos forma-se
pirite, precipitada por ação de bactérias que reduzem o sulfato a sulfeto. Este
vai reagir com o ferro dissolvido ou com minerais de ferro reativos para formar
FeS amorfo (triolita). Este sulfureto é instável e transforma-se em pirita FeS2.
Drenagem ácida de minas
Drenagem ácida de minas
O problema do SO2 →
CHUVA ÁCIDA
1970
1908
Efeitos da precipitação ácida sobre
uma floresta na Alemanha
1983
1968
FORMAÇÃO DO ÁCIDO SULFÚRICO
combustão
S em carvão ou diesel
SO2
O carvão natural
Mineral contem 1-9
% de enxofre
Estrutura do carvão mineral (Laurendal, 1978)
Compostos sulfurados em águas
O íon sulfato é um dos íons mais abundantes em águas naturais.
As suas principais origens são:
- Origem geológica (dissolução de gessos, oxidação de pirita, erosão de granito e
basalto)
- Utilização de fertilizantes (sulfato de amônio)
- Infiltração de águas do mar;
- Chuva ácida resultante da presença de óxidos de enxofre (dos combustíveis
fósseis).
- Tratamento de águas (p.e. com o coagulante sulfato de alumínio)
Problemas associados à presença de elevado teor de sulfatos na água:
- Efeito laxante → Valor Máximo Permitido em água de consumo=250mg/L de sulfato
- Formação de incrustações em caldeiras e em permutadores de calor;
- Corrosão de tubagens de concreto nos esgotos - bactérias infectam as paredes das
tubagens e, na presença de oxigênio transformam ácido sulfídrico em ácido sulfúrico
que ataca o concreto; DQO alta em esgoto favorece a redução dos sulfatos em H2S.
Problemas associados à presença de elevado teor de H2S na água:
-Mau cheiro em esgoto - pela redução do sulfato em ácido sulfídrico.
→
Controlando o pH é possível reduzir o problema do cheiro (pH>8)
MINISTÉRIO DA SAÚDE
PORTARIA N.º 518, DE 25 DE MARÇO DE 2004
Estabelece os procedimentos e responsabilidades relativos ao controle
e vigilância da qualidade da água para consumo humano e seu padrão
de potabilidade, e dá outras providências.
Art. 16. A água potável deve estar em conformidade com o padrão de
aceitação de consumo expresso na Tabela 5, a seguir:
Tabela 5 - Padrão de aceitação para consumo humano
Valor Máximo Permitido=
Sulfato mg/L 250
Sulfeto de Hidrogênio mg/L 0,05