MECANISMO DE AÇÃO DOS HERBICIDAS E SUA RELAÇÃO COM A RESISTÊNCIA DE
PLANTAS DANINHAS A HERBICIDAS
JOSÉ CLAUDIONIR CARVALHO1
RAMIRO F. LOPEZ OVEJERO2
PEDRO J. CHRISTOFFOLETI3
1. Introdução
O uso de herbicidas é a prática dominante no controle de plantas daninhas. A seleção de
populações de plantas daninhas resistentes a herbicidas surgiram com maior intensidade a partir dos
anos 80, com o desenvolvimento de produtos altamente eficientes e seletivos, porém sensíveis ao
problema da resistência, como os inibidores da ALS e ACCase. O mecanismo de ação é a forma
específica pela qual um herbicida interfere de modo significativo em determinado processo biológico
(Kissmann, 2003). A seguir são discutidos os mecanismos de ação dos herbicidas que apresentam alto
e médio risco de seleção de biótipos resistentes.
GRUPO A - Herbicidas inibidores da síntese de lipídeos (inibidores da ACCase)
Os ariloxifenoxipropionatos e ciclohexanodionas são dois grupos químicos de herbicidas
utilizados para o controle de gramíneas perenes e anuais, em condições de pós-emergência. Esses
herbicidas são geralmente recomendados para culturas pertencentes à classe das dicotiledôneas (Vidal
& Fleck, 1997; Christoffoleti, 2001). Apresentam como mecanismo de ação a inibição ACCase (Acetil
Coa carboxilase), que é uma das enzimas responsável pela síntese de ácidos graxos. A enzima atua na
fase inicial da síntese de ácidos graxos, que são constituintes dos lipídios que ocorrem nas membranas
de células e organelas. Esses lipídios regulam a permeabilidade seletiva (Kissmann, 2003). Os
herbicidas deste grupo são inibidores reversíveis e não competitivos da enzima ACCase (Vidal &
Merotto, 2001). Neste grupo os herbicidas podem desenvolver resistência cruzada, porém isso nem
sempre acontece. Por exemplo, os produtos como sethoxydim e tepraloxidim não tem apresentado
resistência cruzada. Assim o grupo deveria ser subdividido em A1 e A2 (Kissmann, 2003). No mundo,
foram encontrados 32 biótipos resistentes a esse grupo de herbicidas (Weed Science, 2003).
GRUPO B - Inibidores da acetolactato sintase (ALS)
Segundo Christoffoleti (1997), os herbicidas inibidores da acetolactate synthase (ALS) ou
acetohydroxyacid synthase (AHAS) pertencem a diversos grupos químicos, dentre eles as
sulfoniluréias, imidazolinonas e triazolopirimidinas e pirimidiloxitiobenzoatos. Estes herbicidas
apresentam como mecanismo de ação a inibição da síntese dos aminoácidos alifáticos de cadeia
1
Eng. Agr., Dr., Departamento de Pesquisa e Desenvolvimento da Dow AgroSciences, Vice-Presidente Educacional da Associação Brasileira
de Ação a Resistência de Plantas a Herbicidas (HRAC-BR) . E-mail: [email protected]
Professor Associado, Universidade de São Paulo, Escola Superior de Agricultura “Luiz de Queiroz” (USP/ESALQ), Departamento de
Produção Vegetal, Área de Biologia e Manejo de Plantas Daninhas; Endereço: USP/ESALQ – Dep. Produção Vegetal – Caixa Postal 09 –
CEP 13.418-900 – Piracicaba – SP; e-mail: [email protected].
2
Eng. Agr., M.Sc., Doutorando do Curso de Agronomia, Área de Concentração Fitotecnia, da Universidade de São Paulo, Escola Superior
de Agricultura “Luiz de Queiroz” (USP/ESALQ), Departamento de Produção Vegetal. E-mail: [email protected]
lateral: valina, leucina e isoleucina (Trezzi & Vidal, 2001). A via biossintética desses três aminoácidos
apresenta em comum o uso de uma enzima chamada ALS, que participa na fase inicial do processo
metabólico, catalizando uma reação de condensação (Christoffoleti, 2001). Os herbicidas inibidores da
ALS impedem que esta reação de condensação aconteça provocando, como conseqüência, o bloqueio
na produção dos aminoácidos valina, leucina e isoleucina. Quando o herbicida encontra-se presente
dentro da célula de uma planta susceptível, ocorre uma inibição não competitiva pelo herbicida com o
substrato, de tal maneira que não ocorre a formação do acetolactato, indispensável, para que as demais
reações prossigam resultando na formação dos aminoácidos. A paralização na síntese dos aminoácidos
leva a uma interrupção na divisão celular e paralização do crescimento (Kissmann, 2003). Um biótipo
de planta daninha é resistente aos herbicidas inibidores da ALS devido a uma alteração do gene
responsável pela codificação desta enzima (Shaner, 1991). No mundo, foram encontrados 79 biótipos
resistentes a esse grupo de herbicidas (Weed Science, 2003).
GRUPO C - Herbicidas inibidores do fotossístema II
Os herbicidas atualmente em uso e que apresentam mecanismo de ação de inibição da
fotossíntese são pertencentes a três principais grupos químicos: triazinas, uréias substituídas e uracilas.
O local de ação destes herbicidas é na membrana do cloroplasto, onde ocorre a fase luminosa da
fotossíntese, mais especificamente no transporte de elétrons (Christoffoleti, 1997). Uma planta é
susceptível aos herbicidas inibidores da fotossíntese se o herbicida se acoplar ao composto QB
componente do sistema fotossintético e, assim, impossibilitar a ocorrência do transporte do elétron até
a plastoquinona. Dessa forma não existe a produção de ATP, pois o transporte de elétrons é
interrompido, bem como a produção de NADPH2. Já numa planta daninha resistente há um processo
de mutação no composto QB de tal maneira que o herbicida não consegue acoplar-se ao composto,
impedindo o transporte de elétrons. Portanto, uma planta resistente aos herbicidas inibidores da
fotossíntese consegue efetuar o transporte de elétrons na fase luminosa da fotossíntese mesmo na
presença do herbicida (Christoffoleti, 1997). No mundo, foram encontrados 64 biótipos resistentes ao
grupo C1, 20 ao grupo C2 e 1 ao grupo C3 (Weed Science, 2003). O mecanismo de ação das uréias
substituídas é o mesmo do grupo das triazinas/triazinonas, porém o sítio de ação no composto QB é
diferenciado, portanto normalmente não existe resistência cruzada entre eles (Christoffoleti, 2001).
GRUPO D - Inibidores do fotossistema I (formadores de radicais livres)
Os herbicidas paraquat e diquat são herbicidas do tipo bipiridiluns, que apresentam como local
de ação o fotossistema I, na fase luminosa da fotossíntese; portanto, na membrana do cloroplasto.
Quando o elétron é transferido da ferrodoxina para o NADP ocorre a ação dos herbicidas biripidiluns.
Sendo estes herbicidas cátions muito fortes desviam o elétron destinado ao NADP para o herbicida,
reduzindo o mesmo (seriam utilizados para reduzir o NADP para NADPH2). O herbicida no estado
reduzido é instável, de tal maneira que volta ao seu estado normal reduzido, cedendo o elétron para
uma molécula de O2. A molécula de O2 juntamente com o elétron cedido pelo paraquat reduzido é
chamada de radical livre (superóxido). O superóxido rapidamente se condensa com uma molécula de
água, formando H2O2 (água oxigenada), sendo a água oxigenada um potente destruidor de membrana,
através da peroxidação dos lipídeos (Christoffoleti, 1997).
GRUPO E - Inibidores da Protox (inibidores da formação do tetrapirol)
A Protox está presente na rota de síntese da clorofila e de citocromos, também chamada de
rota de síntese de porfirinas ou de tetrapirroles (Merotto & Vidal, 2001). O mecanismo de ação dos
herbicidas inibidores da Protox está baseado na inibição da reação de transformação do
protoporfirinogeno em protoporfirina. Esta reação é catalizada pela protoporfirinogeno oxidase
(PROTOX). Com a inibição desta enzima, presente no cloroplasto, existe um acúmulo de
protoporfirinogeno que se desloca do cloroplasto para o citoplasma e em contato com o oxigênio, na
presença de luz, forma radicais livres e provoca a peroxidação de lipídeos das membranas. Até o
momento foi detectado um biótipo de planta daninha resistente a estes herbicidas na agricultura,
portanto, a probabilidade de seleção é restrita (Weed Science, 2003).
GRUPO F - Herbicidas inibidores da biossíntese de caroteno
Os herbicidas deste grupo provocam a inibição da síntese de carotenóides, com posterior
geração de estresse oxidativo, que destrói as membranas das células, levando assim as plantas à morte
(Kruse, 2001). O caroteno é um pigmento das plantas responsável, dentre outras funções, pela
proteção da clorofila da foto-oxidação; portanto, as plantas suscetíveis têm como sintomatologia o
albinismo ("branqueamento") dos tecidos fotossintéticos. Com relação a possibilidade de
desenvolvimento de biótipos resistentes é necessário dividir os herbicidas com este mecanismo de
ação em três grupos: a) inibidores dos diterpenos (clomazone, Grupo F3); b) inibidores da enzima
hidroxifenil-piruvato-dioxigenase (isoxaflutole, Grupo F2) e c) inibidores da fitoeno desaturase
(norflurazon, Grupo F1) (Christoffoleti et al., 2001). No mundo, foram encontrados dois biótipos
resistentes a esse grupo de herbicidas (Weed Science, 2003).
GRUPO G – Inibidores da EPSPs (glifosate)
O primeiro sintoma observado após tratamento com glifosate é a inibição de crescimento,
seguido por clorose dos tecidos tratados. O mecanismo de ação é a inibição da biossíntese de
aminoácidos aromáticos (fenilalanina, tirosina e triptofano), através da inibição da enzima EPSPs (5enolpiruvinilshikimate-3-fosfato-sintase) na via do shikimato. Sobre a razão do aparecimento de
plantas daninhas resistentes a glifosate pairam muitas dúvidas, mas o que se sabe é que a acumulação
de shikimato não ocorre, assim EPSPs aparentemente não é inibida. A teoria aceita atualmente é que o
glifosate nas plantas daninhas resistentes não se move para o sítio de ação no cloroplasto. O
surgimento de plantas daninhas resistentes a glifosate é um evento muito difícil de ocorrer, sendo
relatados apenas quatro biótipos até o momento (Weed Science, 2003).
GRUPO K1 - Herbicidas inibidores da formação dos microtúbulos
Trifluralina e pendimethalin são herbicidas utilizados nas culturas e que apresentam
mecanismo de ação da inibição da divisão celular, impedindo a formação dos microtúbulos durante a
formação do fuso de divisão celular. Os microtúbulos são compridos, cilíndricos e ocos e responsáveis
pela movimentação dos cromossomos durante a divisão celular (Vidal & Fleck, 2001). Durante o
processo da mitose (prófase e metáfase) existe a formação do fuso de divisão cromossômica, para que
na anáfase ocorra uma separação cromossômica do processo de divisão celular. Este fuso de divisão
celular é formado de uma proteína chamada de tubulina (Christoffoleti, 2001). No mundo, foram
encontrados 10 biótipos resistentes a esse grupo de herbicidas (Weed Science, 2003).
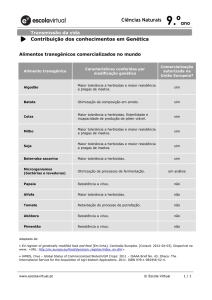
5. Classificação dos herbicidas (vide Tabela 1 no final do texto)
Existem muitos critérios para agrupar herbicidas, sendo que, o mais utilizado é segundo o
mecanismo de ação. As tabelas agrupam produtos com mecanismo de ação semelhantes. As mesmas
são úteis para a seleção de herbicidas diferentes.
Bibliografia citada
CHRISTOFFOLETI, P.J. Resistência de plantas daninhas aos herbicidas. In: I SIMPÓSIO SOBRE
HERBICIDAS E PLANTAS DANINHAS, Dourados – MS, EMBRAPA, 1997, p. 75-94.
CHRISTOFFOLETI, P.J.; CORTEZ, M.G.; MONQUEIRO, P.A.. Bases da Resistência de Plantas
Daninhas aos Herbicidas. In: III Seminário Nacional sobre Manejo e Controle de Plantas
Daninhas em Plantio Direto, 2001, Passo Fundo, RS. Resumo de Palestras. Editora Aldeia
Norte, Passo Fundo, RS. p.39-53, 2001.
KISSMANN, K.G. Resistência de plantas daninhas a herbicidas. Disponível: http://www.hracbr.com.br/arquivos/texto_reisitencia_herbicidas.doc. 01/05/2003.
KRUSE, N.D. Inibidores da síntese de carotenóides. Herbicidologia/Vidal, R.A., Merotto Jr,
A.(Editores) –Porto Alegre: 2001. p.113 - 122.
MEROTTO Jr, A.; VIDAL, R.A. Herbicidas inibidores de PROTOX. Herbicidologia/Vidal, R.A.,
Merotto Jr, A.(Editores) –Porto Alegre: 2001. p.69 – 86.
SHANER, D.L. Mechanisms of resistance to acetolactate synthase/acetohydroxyacid synthase
inhibitors. In: CASELEY, J.C.; CUSSANS, G.W.; ATKIN, R.K. Herbicide resistance in
weeds and crops. Oxford: Butterworth-Heinemann, 1991. p.27-43.
TREZZI, M.M.; VIDAL, R.A. Herbicidas inibidores da ALS. Herbicidologia/Vidal, R.A., Merotto Jr,
A.(Editores) –Porto Alegre: 2001. p. 25 – 36.
VIDAL, R.A.; FLECK, N.G. Herbicidas: mecanismos de ação e resistência de plantas. Porto
Alegre:Palotti, 1997. 165p.
VIDAL, R.A.; FLECK, N.G. Inibidores de crescimento da parte aérea. Herbicidologia/Vidal, R.A.,
Merotto Jr, A.(Editores) –Porto Alegre: 2001. p.123 – 130a.
VIDAL, R.A.; FLECK, N.G. Inibidores de polimerização de tubulina. Herbicidologia/Vidal, R.A.,
Merotto Jr, A.(Editores) –Porto Alegre: 2001. p.131 – 137.
VIDAL, R.A.; MEROTTO Jr, A. Herbicidas inibidores de ACCase. Herbicidologia/Vidal, R.A.,
Merotto Jr, A.(Editores) –Porto Alegre: 2001. p.15 – 24.
WEED
SCIENCE.
International
survey
of
herbicide
resistant
weeds.
Disponível:
http://www.weedscience.org/in.asp. 01/05/2003.
Tabela 1. Mecanismo de ação dos principais grupos químicos de herbicidas comercializados no Brasil
(adaptado de HRAC, 2001).
Inibidores da ACCase (Acetil Coa carboxilase). Grupo A
Ariloxifenoxipropiônicos: Quizalofop-p-ethyl, propaquizafop, fluozifop-p-butyl, haloxyfop-p-methyl,
clodinafop propargyl, cyalofop-butyl, diclofop-methyl, fenoxaprop-p-ethyl. Ciclohexanodionas:
butroxydim, alloxydim, clefoxydim, clethodim, tralkoxydim, tepraloxydin, sethoxydim, cicloxydim.
Inibidores da ALS (acetohidroxiácidosintase). Grupo B
Sulfoniluréias: chlorimuron-ethyl, etoxysulfuron, metsulfuron-methyl, flazasulfuron, pirasulfuronethyl, halosulfuron, nicosulfuron, oxasulfuron, foramsulfuron + iodosulfuron. Imidazolinonas:
imazamox, imazethapyr, imazapic, imazaquin, imazapyr. Triazolopirimidina: flumetsulam, diclosulan,
chloransulan-methyl. Pirimidiloxibenzoatos: pyrithiobac-sodium, bispyribac-sodium.
Inibidores da fotossíntese (fotossistema II). Grupo C
Grupo C1: Triazinas: atrazine, ametryne, simazine, cyanazine, prometryne. Triazinonas: metribuzin,
hexazinone.
Grupo C2: Uréias substituídas: diuron, linuron e tebuthiuron. Amidas: propanil.
Grupo C3: Benzotiadiazoles: Bentazona
Inibidores da fotossíntese (fotossistema I). Grupo D
Bipiridiluns: Paraquat e Diquat
Inibidores da Protox (PPO) (Protoporfirinogen oxidase). Grupo E
Difenileteres: acifluorfen sodium, oxyfluorfen, diclofop-methyl, fomesafen, lactofen. Ftalimidas:
fumiclorac-pentil, flumioxazin. Oxadiazoles: oxadiazon. Triazolinone: sulfentrazone, carfentrazone,
azefendim.
Inibidores da biossíntese de caroteno (PDS). Grupo F
Grupo F1: Pyridazinone: norflurazon.
Grupo F2: Isoxazol Isoxaflutole Tricetonas: mesotrione.
Grupo F3: Isoxazolidinona: clomazone.
Inibidores da EPSPs. Grupo G
Derivados da glicina: Glyphosate e sulfosate.
Inibidores da GS (Glutamina sintetase). Grupo H
Ácidos fosfínicos: Glufosinate.
Inibição da formação dos microtúbulos. Grupo K1
Dinitroanilinas: trifluralin, pendimenthalin, oryzalin.
Piridazinas: dithiopyr, thiazopyr.
Ácidos benzóicos: DCPA.
Inibidores da divisão celular. Grupo K3
Cloroacetamidas: alachlor, metolachlor, acetochlor, butachlor e dimethanamid. Acetamidas:
napropamide e diphenamid.
Auxinas sintéticas. Grupo O
Ácidos fenoxiacéticos: 2,4-D, MCPA. Ácidos benzóicos: Dicamba. Piridinas: quinclorac; Ftalimidas:
fluroxipyr, triclopyr, picloran.
Desconhecidos. Grupo Z
Organoarsenicais: MSMA; Outros
Observações: 1. Cada família química de herbicidas pode conter um ou até vários herbicidas
diferentes. É importante que no momento da seleção do herbicida seja identificado a que família
química o herbicida pertence, e portanto, o mecanismo de ação. 2. Alguns grupos/subgrupos não
foram incluídos nesta tabela pois não existem produtos comercializados no Brasil, por exemplo K2 e
L.