PAPEL FISIOLÓGICO DO NÍQUEL:
ESSENCIALIDADE E TOXIDEZ EM PLANTAS
André Rodrigues dos Reis1
Bruna Wurr Rodak2
Fernando Ferrari Putti3
Milton Ferreira de Moraes4
NÍQUEL NO SOLO
de Goiás, principalmente no município de Niquelândia, valores
extremamente elevados, de 618 a 14.390 mg kg-1.
O
metal de transição níquel (Ni) é o vigésimo terceiro
elemento mais abundante na crostra terrestre, com
teor médio de 20 mg kg-1. A concentração total
de Ni nos solos varia de 4 a 2.000 mg kg-1, com valor médio de
29 mg kg-1 (KABATA-PENDIAS e PENDIAS, 2011). Entretanto,
solos derivados de rochas ultramáficas, ricas em minerais do grupo
serpentina, podem apresentar concentrações de até 7.100 mg kg-1
(BROOKS, 1987). Em pesquisas sobre o teor Ni em solos naturais
de várias partes do mundo, Massoura et al. (2006) observaram teores
altos, variando de 500 a 12.000 mg kg-1, em amostras de material
geológico derivado de serpentina e peridotito, ambos constituintes
de rochas ultramáficas.
Levantamentos dos teores totais em solos brasileiros ainda
são escassos, sendo quantificados valores variando de < 0,014 a
1.167,52 mg kg-1 de Ni (ROVERS; CAMARGO; VALADARES,
1983; MINEROPAR, 2005a, 2005b; LICHT et al., 2006; MELO
et al., 2007; CAIRES, 2009; BIONDI, 2010; PAYE et al., 2010;
SANTOS, 2011; BUSCHLE, 2013). Entretanto, Reeves et al. (2007)
verificaram, em amostras de solos ultramáficos da região central
Os teores de Ni nos solos apresentam elevada variabilidade
e são altamente dependentes da composição do material de origem,
com destaque, de maneira geral, para as classes Cambissolos e
Calcisols (calcários, sem correspondência no Sistema Brasileiro
de Classificação dos Solos – SiBCS).
Os teores disponíveis correspondem a 0,001% dos teores totais
(UREN, 1992), na maior parte das vezes, segundo Vanselow (1966),
com teores abaixo de 1 mg dm-3 de Ni. Em solos brasileiros, estudos
isolados na Bahia, Goiás, Maranhão, Mato Grosso, Rio Grande do
Sul e São Paulo mostraram teores disponíveis variando de < 0,013 a
1,4 mg dm-3, extraídos em DTPA, < 0,1 a 0,27 mg dm-3, em Mehlich-1,
e teor médio de 0,35 mg dm-3, em Mehlich-3 (ROVERS; CAMARGO;
VALADARES, 1983; MELO et al., 2007; RODAK, 2014). O estado
no qual os estudos estão mais adiantados em relação à disponibilidade
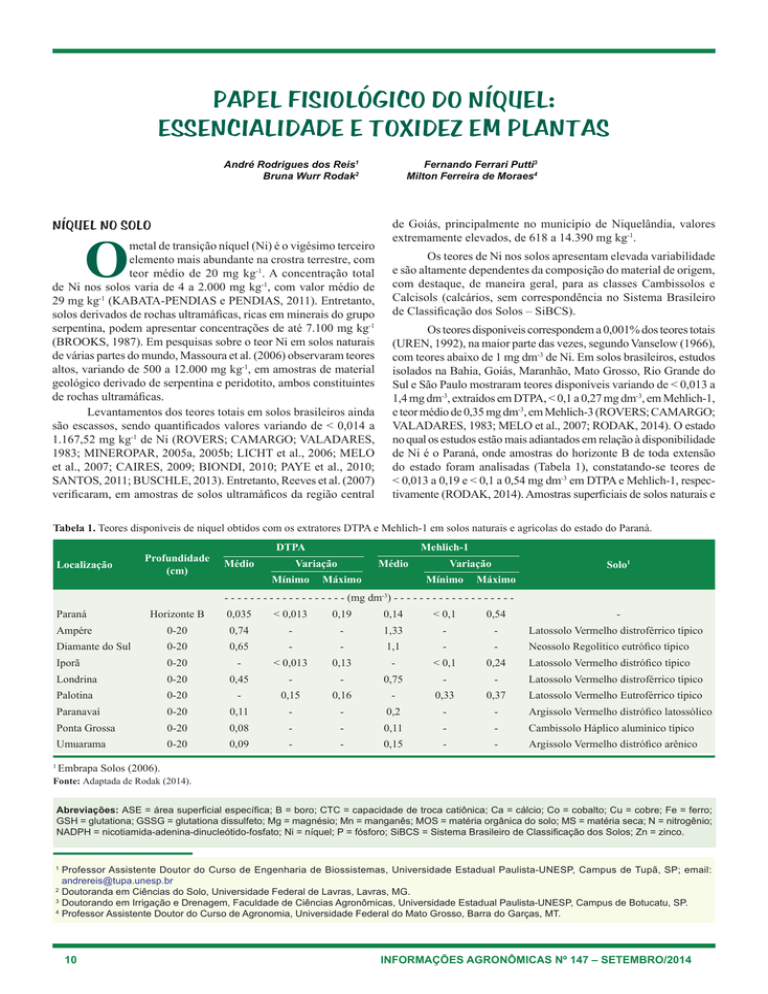
de Ni é o Paraná, onde amostras do horizonte B de toda extensão
do estado foram analisadas (Tabela 1), constatando-se teores de
< 0,013 a 0,19 e < 0,1 a 0,54 mg dm-3 em DTPA e Mehlich-1, respectivamente (RODAK, 2014). Amostras superficiais de solos naturais e
Tabela 1. Teores disponíveis de níquel obtidos com os extratores DTPA e Mehlich-1 em solos naturais e agrícolas do estado do Paraná.
Localização
Profundidade
(cm)
Mehlich-1
DTPA
Médio
Médio
Variação
Mínimo
Máximo
Solo1
Variação
Mínimo
Máximo
-3
- - - - - - - - - - - - - - - - - - - (mg dm ) - - - - - - - - - - - - - - - - - - -
1
Paraná
Horizonte B
0,035
< 0,013
0,19
0,14
< 0,1
0,54
-
Ampére
0-20
0,74
-
-
1,33
-
-
Latossolo Vermelho distroférrico típico
Diamante do Sul
0-20
0,65
-
-
1,1
-
-
Neossolo Regolítico eutrófico típico
Iporã
0-20
-
< 0,013
0,13
-
< 0,1
0,24
Latossolo Vermelho distrófico típico
Londrina
0-20
0,45
-
-
0,75
-
-
Latossolo Vermelho distroférrico típico
Palotina
0-20
-
0,15
0,16
-
0,33
0,37
Latossolo Vermelho Eutroférrico típico
Paranavaí
0-20
0,11
-
-
0,2
-
-
Argissolo Vermelho distrófico latossólico
Ponta Grossa
0-20
0,08
-
-
0,11
-
-
Cambissolo Háplico alumínico típico
Umuarama
0-20
0,09
-
-
0,15
-
-
Argissolo Vermelho distrófico arênico
Embrapa Solos (2006).
Fonte: Adaptada de Rodak (2014).
Abreviações: ASE = área superficial específica; B = boro; CTC = capacidade de troca catiônica; Ca = cálcio; Co = cobalto; Cu = cobre; Fe = ferro;
GSH = glutationa; GSSG = glutationa dissulfeto; Mg = magnésio; Mn = manganês; MOS = matéria orgânica do solo; MS = matéria seca; N = nitrogênio;
NADPH = nicotiamida-adenina-dinucleótido-fosfato; Ni = níquel; P = fósforo; SiBCS = Sistema Brasileiro de Classificação dos Solos; Zn = zinco.
1
Professor Assistente Doutor do Curso de Engenharia de Biossistemas, Universidade Estadual Paulista-UNESP, Campus de Tupã, SP; email:
[email protected]
2
Doutoranda em Ciências do Solo, Universidade Federal de Lavras, Lavras, MG.
3
Doutorando em Irrigação e Drenagem, Faculdade de Ciências Agronômicas, Universidade Estadual Paulista-UNESP, Campus de Botucatu, SP.
4
Professor Assistente Doutor do Curso de Agronomia, Universidade Federal do Mato Grosso, Barra do Garças, MT.
10
INFORMAÇÕES AGRONÔMICAS Nº 147 – SETEMBRO/2014
agrícolas em áreas pontuais do Paraná também foram estudadas e os
teores variaram de < 0,013 a 0,74 e < 0,1 a 1,33 mg dm-3 em DTPA
e Mehlich-1, respectivamente (RODAK, 2014). Ressalta-se que os
maiores teores, para ambos os extratores, ocorreram em solos derivados de derrames de rochas basálticas, que são rochas ultrabásicas
ricas em Ni, evidenciando, mais uma vez, a relação direta com o
material de origem.
Diversos fatores podem afetar os teores de Ni disponíveis
no solo, como classe textural, matéria orgânica do solo (MOS),
óxidos de ferro (Fe) e manganês (Mn), pH, reações de complexação e competições pelos sítios de adsorção (KABATA-PENDIAS
e PENDIAS, 2011).
De maneira geral, os horizontes superficiais do solo apresentam maior disponibilidade de Ni, fato que ocorre, em parte,
devido à presença de MOS, a qual forma complexos estáveis e
solúveis com o elemento (UREN, 1992). Entretanto, o conteúdo
de Ni na MOS é considerado baixo. Estudos de Cheshire et al.
(1977) com metais-traço, entre eles o Ni, constataram que apenas 0,59 mg kg-1 e 0,57 mg kg-1 do total de 35 mg kg-1 de Ni no
solo encontrava-se na fração de ácidos húmicos e fúlvicos, o que
representa apenas 1,7% e 1,6% dos teores totais, respectivamente,
ou seja, valores inferiores a 4%. Ressalta-se que o papel da MOS é
mais efetivo quando são efetuadas aplicações de resíduos ao solo,
como lodo de esgoto – material rico em metais pesados, incluindo
Ni (SAUVé; HENDERSHOT; ALLEN, 2000; SMITH, 2009).
Os teores totais de Ni, por outro lado, não apresentam comportamento definido em profundidade, podendo diminuir, aumentar,
manter-se ou mesmo variar. Rovers et al. (1983) sugerem que tais
teores acompanham as variações dos teores de Fe no perfil.
A classe textural do solo é fator importante no comportamento
do Ni, pois os teores de argila se relacionam positivamente com os de
Ni, porém, a relação é negativa com a fração areia. As partículas mais
finas têm concentrações mais altas de Ni devido à maior área superficial
específica (ASE) e maior quantidade de cargas negativas na superfície,
ou seja, maior capacidade de troca catiônica (CTC) (BETTINELLI
et al., 2000; SENWO e TAzISONG, 2004; CARIDAD-CANCELA;
PAz-GONzÁLEz; ABREU, 2005; RAjAIE et al., 2008). Portanto,
o aumento do teor de Ni com a diminuição do diâmetro das frações
do solo indica que o comportamento desse nutriente é governado por
processos de adsorção, principalmente com os óxidos de Fe e Mn,
que apresentam alta capacidade de reter o Ni (MASSOURA et al.,
2006; HARMSEN, 2007; QUANTIN et al., 2008; RAJAIE; KARIMIAN; YASREBI, 2008; ALVES et al., 2011). Desse modo, o Ni
no solo encontra-se principalmente na forma mineral, o que explica,
provavelmente, sua baixa mobilidade e disponibilidade.
Entretanto, o fator que mais afeta o comportamento do Ni
no solo é o pH, pois são variáveis inversamente proporcionais. Trabalho de Siebielec e Chaney (2006) constatou redução dos teores
disponíveis de Ni, ou seja, maior adsorção, com o aumento do pH,
com reduções drásticas da disponibilidade do elemento em pH acima
de 6,5. Em estudo semelhante, Ponizovsky et al. (2008) analisaram
dez solos ácidos da União Européia, com pH na faixa de 3,6 a 6,7,
e verificaram que a disponibilidade de Ni foi menor em maiores
valores de pH, com deslocamento de cálcio (Ca), magnésio (Mg) e
sódio (Na) para a solução em proporções semelhantes à da adsorção
de Ni. Ressalta-se que o aumento dos teores disponíveis de Ni em
decorrência da redução do pH ou da influência de outros fatores, como
por exemplo a adubação, pode levar a uma competição direta pelos
sítios de reação do solo com outros cátions, principalmente Fe, cobre
(Cu) e zinco (zn), que apresentam similaridades químicas com o Ni,
como valência e raio iônico hidratado (UREN, 1992).
INFORMAÇÕES AGRONÔMICAS Nº 147 – SETEMBRO/2014
NÍQUEL NA PLANTA
A primeira constatação da essencialidade do Ni para os seres
vivos foi realizada por Dixon et al. (1975), quando demonstraram
que a enzima urease apresentava dois átomos de Ni na sua composição estrutural. A essencialidade do Ni nas plantas superiores
foi evidenciada por Eskew, Welch e Cary (1983), cultivando soja
(Glycine max L. Merrill) em solução nutritiva, a qual apresentou
necrose na extremidade dos folíolos devido ao acúmulo de ureia em
concentrações tóxicas, consequência da baixa atividade da urease
decorrente da deficiência de Ni (Figura 1). Trabalhos posteriores
de Eskew, Welch e Norvell (1984) e Brown, Welch e Cary (1987),
com feijão (Vigna unguiculata L.) e cevada (Hordeum vulgare L.),
confirmaram a essencialidade do Ni, e ele foi inserido na lista de
micronutrientes após os pesquisadores verificarem que as sementes
das plantas de cevada cultivadas em solução nutritiva com ausência
de Ni, após três gerações, eram inviáveis e não germinavam adequadamente. Posteriormente, outras funções do Ni nas plantas também
foram constatadas: na produção de etileno (SMITH e WOODBURN, 1984), na resistência das plantas a doenças (GRAHAM,
WELCH, WALKER, 1985), na germinação de sementes (BROWN;
WELCH; CARY, 1987), como componente estrutural da enzima
hidrogenase (EVANS et al., 1987) e na conservação pós-colheita
de frutos (ZHENG et al., 2006).
Figura 1. Sintomatologia de deficiência de níquel em trifólios de soja
(Glycine max L. Merrill) cultivadas em condições controladas.
Fonte: Eskew et al. (1983).
O Ni é absorvido pelas plantas preferencialmente como
cátion divalente (Ni2+), também sendo absorvido na forma de
quelatos com compostos orgânicos e metalóforos. Ressalta-se que
o mecanismo de contato preferencial desse micronutriente com o
sistema radicular ainda não foi elucidado. Após entrar em contato
com o sistema radicular, o Ni é absorvido, principalmente, por
processo ativo, em canais não específicos, bem como por difusão
passiva (YUSUF et al., 2011). A forma e o processo de absorção
predominante depende dos teores de Ni no solo e, sobretudo, do
efeito do pH sobre sua disponibilidade. Por exemplo, plantas de
Lathyrus sativus L. absorveram maior quantidade de Ni até pH 5,0,
e à medida que os valores de pH foram aumentando ocorreu redução
da absorção, principalmente com valores ≥ 8,0 (PANDAA et al.,
2007). Kabata-Pendias e Pendias (2011) mostraram claramente
esse comportamento em estudos realizados com diferentes espécies
vegetais (Figura 2). Yusuf et al. (2011) observaram que a absorção
de Ni também pode ocorrer pelas folhas, quando radioisótopos de
63
Ni foram aplicados em folhas de girassol (Helianthus annus L.) e
11
Folha
*
Raiz
Ni2+
Quelante
*
Figura 2. Teores de níquel em plantas em função dos teores no solo. (a) folhas
de Alyssum sp., acumuladora de Ni; (b) folhas de A. montanum,
não acumuladora de Ni; (c) folhas de trigo (Triticum aestivum L.);
(d) grãos de cevada (Hordeum vulgare L.); (e) raízes de cenoura
(Daucus carota L.); (f) raízes de rabanete (Raphanus sativus L.).
Influência do pH do solo sobre os teores de Ni em (g) grãos de
aveia (Avena sativa L.). (*Os teores no solo, folhas e raízes são
dados em potência de dez).
Fonte: Adaptada de Kabata-Pendias e Pendias (2011).
aproximadamente 36% do elemento foi translocado para os demais
órgãos. Tendência similar foi observada também em folhas de aveia
(Avena sativa L.), soja e tomate (Lycopersicon lycopersicum L.)
pulverizadas com solução de sais de Ni.
Após a absorção, o Ni é transportado no xilema na forma
iônica, em decorrência da transpiração das plantas, sendo o transporte facilitado com a formação de quelatos com ácidos orgânicos,
tais como citrato, malato e peptídios (WHITE, 2012), bem como
com aminoácidos, com destaque para a histidina (KRAMER et al.,
1996), resultando em maior mobilidade do elemento no xilema
(WHITE, 2012). Sem a formação de quelatos, o movimento do Ni
é severamente retardado devido à elevada CTC na parede celular
do xilema. O mecanismo de absorção e redistribuição de Ni nas
plantas está ilustrado na Figura 3.
Em estudos iniciais, o Ni foi considerado um elemento imóvel ou parcialmente móvel no floema, porém, Cataldo, Garland, Wildung (1978), estudando o comportamento do Ni em plantas de soja,
constataram que o micronutriente apresentava elevada mobilidade
ao verificar que, no estádio de senescência, aproximadamente 70%
do Ni presente nas folhas tinham sido remobilizados para as sementes. Em estudo similar com plantas de trigo (Triticum aestivum L.),
Page e Feller (2005) observaram que, após a absorção, o Ni diminuiu
rapidamente nas partes mais velhas das raízes, redistribuindo-se para
as partes recém-formadas do sistema radicular e, posteriormente,
acumulou-se temporariamente nas folhas em desenvolvimento.
Estes estudos sugerem que o Ni é redistribuído, ou seja, apresenta
alta mobilidade no tecido vegetal, com tendência a acumular-se nos
órgãos em desenvolvimento, bem como nas sementes.
12
Figura 3. Distribuição do níquel nas plantas. Mais de 50% do elemento
ficam retidos nas raízes e 80% do total retido na raiz ficam
localizados no cilindro vascular. O níquel no caule e nas folhas
encontra-se principalmente nos vacúolos, paredes celulares
e tricomas epidermais associados a quelantes, tais como: nicotianamina (NA), histidina (His), citrato, ácidos orgânicos e
proteínas com várias funções importantes, incluindo permeases,
metalotioneinas (MT), metalochaperonas e proteínas YS1-like
(YSLs).
Abreviações na figura: parede celular (CW), cloroplastos (Chl),
córtex (Co), citoplasma (Cp), endoderme (En), tricoma epitelial
(Ep), epiderme abaxial (LEp), núcleo (N), parênquima paliçádico
(PP), floema (P), feixes vasculares (Pi), raízes pelíferas (Rh),
parênquima esponjoso (SP), epiderme adaxial (UEp), vacúolos
(Va), cilindro vascular (VC), xilema (X).
Fonte: Chen, Huang e Liu (2009).
Plantas cultivadas em solos não contaminados apresentaram
teores foliares que variam entre 0,05 e 5 mg kg-1 de Ni (BROOKS,
1980; WELCH, 1981). Teores adequados para o suprimento das plantas variam de 0,01 a 10 mg kg-1 (GERENDÁS et al., 1999; BROWN;
WELCH; CARY, 1987), apresentando grande amplitude de variação
se comparados aos demais nutrientes essenciais. Essas variações
estão relacionadas, principalmente, com as diferenças na absorção,
transporte e redistribuição de Ni entre espécies vegetais ou mesmo
entre genótipos/cultivares (REBAFKA; SCHULz; MARSCHNER,
1990), bem como com os teores disponíveis no solo. Os teores adequados para germinação de sementes de cevada, e que proporcionam
melhor desenvolvimento de aveia, cevada, trigo, tomate, arroz (Oryza
sativa L.) e abobrinha (Cucurbita pepo L.), são de aproximadamente
100 ng g-1 MS (BROWN; WELCH; CARY, 1987; GERENDAS e
SATTELMACHER, 1997). Na Tabela 2 é apresentado um resumo
dos estudos sobre o teores de Ni nas plantas cultivadas.
Há espécies, entretanto, que toleram níveis excepcionalmente altos de Ni no substrato e no tecido, sem que ocorra toxidez
– as hiperacumuladoras. Estima-se que um grande número de
plantas, aproximadamente 317 taxons e 37 famílias, com destaque
para os gêneros botânicos Alyssum e Thlaspi (Brassicaceae), pode
acumular teores maiores que 1.000 mg kg-1 de Ni na matéria seca
(MS) (KUPPER et al., 2001; POLLARD et al., 2002). Entre as
plantas estudadas em solos ricos em Ni na região central de Goiás,
INFORMAÇÕES AGRONÔMICAS Nº 147 – SETEMBRO/2014
Tabela 2. Teores de níquel em plantas alimentícias cultivadas.
Planta
Variação
Média
-1
- - - - - (mg kg ) - - - - Soja (Glycine max L. Merrill), folhas
0,08-0,62
-
Soja, grãos
0,39-2,09
-
Trigo (Triticum aestivum L.), grãos
0,17-0,67
0,34
Cevada (Hordeum vulgare L.), grãos
0,10-0,67
0,41
Aveia (Avena sativa L.), grãos
0,20-8,0
1,28
Ervilha (Pisum sativum L.) e
feijão (Phaseolus vulgaris L.), sementes
0,2-0,25
-
Couve (Brassica oleracea L.), folhas
0,6-3,3
1,03
Cenoura (Daucus carota L.), raízes
0,26-0,98
-
Cebola (Allium cepa L.), bulbos
0,59-0,4
-
Tomate (Lycopersicon lycopersicum L.),
frutos
0,43-0,48
-
Pepino (Cucumis sativus L.), frutos
1,3-2,0
-
Batata (Solanum tuberosum L.), tubérculos
0,29-1,0
-
-
0,06
Laranja (Citrus sinensis L. Osbeck), frutos
-
0,39
Avelã (Corylus avellana L.) e pecã (Carya
illinoinensis), frutos
1,6-1,7
-
5-10
-
Maça (Pyrus malus L.), frutos
Cacau (Theobroma cacao L.), em pó
Fonte: Adaptada de Kabata-Pendias e Pendias (2011).
principalmente do município de Niquelândia, verificou-se cerca de
40 espécies hiperacumuladoras, apresentando teores entre 7 e
10.610 mg kg-1 de MS (REEVES et al., 2007). Teores foliares
excessivos/tóxicos ocorrem geralmente entre 10 e 50 mg kg-1 de
Ni para espécies não acumuladoras (WELCH, 1981).
SINTOMATOLOGIA DA DEFICIÊNCIA E TOXIDEZ
DE NÍQUEL EM PLANTAS
Sintomas foliares e dossel da planta
Figura 5. À direita, sintomatologia da deficiência de níquel em galhos
de pecã (Carya illinoinensis); à esquerda, galhos submetidos a
uma aplicação de 100 mg L-1 de sulfato de Ni (NiSO4.6H2O),
via foliar, sem sintomas de deficiência.
Fonte: Wood, Reilly e Nyezepir (2004a; 2004b).
(Figura 5). Segundo os autores, condições do solo como baixo
teor disponível de Ni, excesso de fósforo (P), Cu e zn, estiagens
prolongadas, pH do solo acima de 6,5, doses excessivas ou tardias
de nitrogênio (N), calagem excessiva e presença de nematoides
podem afetar a disponibilidade de Ni e provocar deficiência. Os
sintomas em Betula nigra foram semelhantes aos verificados em
plantas de pecã, nas quais os caules apresentavam entrenós mais
curtos, com folhas pequenas, enrugadas, em alguns casos com
coloração verde-escuro, em formato arredondado e com margens
necróticas (RUTER, 2005).
Estudando o efeito do Ni sobre o metabolismo do N, em
solução nutritiva, Khoshgoftarmanesh, Hosseinib e Afyunia (2011)
verificaram necrose nas extremidades das folhas de alface (Lactuca
sativa L.). De acordo com os autores, os sintomas são devido ao
acúmulo de ureia no tecido vegetal, decorrente da deficiência de Ni.
Basicamente, os principais sintomas visuais da deficiência
de Ni são:
1) Clorose
O sintoma inicial da deficiência de Ni é a palidez ou amarelecimento das folhas durante o crescimento foliar ou crescimento
precoce do dossel das plantas. Essa clorose pálida tende a ser
uniforme na folha. Esse sintoma visual de clorose não é um bom
parâmetro para avaliar a deficiência de Ni, pois a deficiência de
outros nutrientes, como enxofre e ferro, também causa clorose foliar.
Os sintomas peculiares da deficiência de Ni nas folhas
de pecã (Carya illinoinensis) e de algumas outras plantas são
denominados vulgarmente “orelha-de-rato”, pois a ponta das
folhas novas apresentam manchas escuras em formato
arredondado, o que lhes confere um aspecto parecido
com o da orelha de um rato (WOOD; REILLY; NYEzEPIR, 2004a; 2004b; 2006) (Figura 4), entretanto, a
deficiência em condições de cultivo a campo, até o presente momento, foram relatadas apenas para duas espécies
vegetais: pecã (WOOD; REILLY; NYEzEPIR, 2006) e
Betula nigra (RUTER, 2005). Vários trabalhos descrevem
o sintoma de deficiência de Ni como a formação da orelha
de rato das folhas, mas outros sintomas morfológicos ainda
são desconhecidos (WORLEY, 1979; GRAUKE; MORRIS;
KOWALCzUK, 1983; WOOD e REILLY, 2007).
Wood, Reilly e Nyezepir (2004a, 2004b, 2006)
identificaram pela primeira vez a deficiência de Ni em
Figura 4. Sintomatologia da deficiência de níquel em pecã (Carya illinoinensis)
condições de campo nos pomares de pecã dos Estados
cultivada em condições de campo na Costa do Golfo e nas Planícies
Unidos. Em trabalhos posteriores foram verificadas resCosteiras dos estados da Georgia e Flórida (Estados Unidos), denomipostas visíveis das plantas ao fornecimento de Ni, quando
nada, popularmente, orelha-de-rato.
os teores disponíveis no solo eram de 0,2 e 0,7 mg dm-3
Fonte: Wood, Reilly e Nyezepir (2006).
INFORMAÇÕES AGRONÔMICAS Nº 147 – SETEMBRO/2014
13
2) Redução do tamanho e formato alterado da folha
O indicador visual mais claro e apurado para detectar a
deficiência de Ni nas folhas são a redução do tamanho foliar e
o embotamento das pontas das folhas ou folíolos (Figura 4). A
intensidade do embotamento da ponta das folhas ou folíolos varia
de acordo com a intensidade da severidade da deficiência de Ni.
O ápice foliar apresenta característica morfológica obtusa.
Em folhas de pecã, a região apical de folhas normais com formato
agudo torna-se obtusa (Figura 4). Esse embotamento abrupto da
região apical de folhas ou folíolos (geralmente folhas fisiologicamente mais velhas) em certos ramos pode ocorrer de maneira
uniforme no dossel das plantas. Em casos claros de deficiência
severa de Ni, em condições de campo, o aparecimento da orelhade-rato ocorre mais frequentemente no topo do dossel. No campo
experimental do Departamento de Agronomia, nos Estados Unidos, teores foliares de pecã abaixo de 0,85 mg kg-1 promoveram
disfunção morfológica e acarretaram na formação da orelha-de-rato
(NYCzEPIR; WOOD; REILLY, 2006).
A redução da superfície foliar diminui proporcionalmente
com o aumento da deficiência foliar de Ni. Essa redução varia entre
10% e 75% em árvores adultas. Essas folhas deficientes tendem a
aumentar no topo do dossel das plantas (WOOD e REILLY, 2007).
3) Região verde-escuro nas pontas foliares
Folhas deficientes em Ni apresentam região verde-escuro
na parte apical da folha, como demonstrado na Figura 4. Essa
característica é muito comum aparecer após poucas semanas da
emissão das folhas ou folíolos, o que torna muito claro o sintoma
visual característico da deficiência de Ni.
4) Necrose apical foliar
A deficiência severa de Ni provoca necrose na região apical
das folhas, como ilustrado na Figura 4. A região necrosada da folha
tende a aumentar com a idade e a proporção da deficiência. Aparentemente, a região das células mortas é consequência do acúmulo de
ureia (ácidos láctico e oxálicos), devido à baixa atividade da enzima
urease. A deficiência de Ni é mais pronunciada na região meristemática ou nas regiões de crescimento da folha. Essas características
são excelentes indicadoras da deficiência de Ni nas plantas.
5) Curvatura e enrugamento da região apical foliar
A região de expansão celular nas margens foliares é reduzida ao ponto de curvar e aparecer o enrugamento da região apical
(Figura 4). Folhas afetadas são mais finas e flexíveis e tendem ser
quebradiças. Esse sintoma também é um bom indicador da deficiência de Ni em plantas lenhosas.
6) Ausência do desenvolvimento laminar
Em folhas ou folíolos severamente deficientes, o desenvolvimento laminar é completamente interrompido e apresenta arranjo
vascular reduzido e desprovido de lâminas internervais. Em casos
extremos, a área foliar pode ser extremamente reduzida ou nula e
isso ocorre principalmente nos primeiros anos de implantação da
cultura. Essa redução foliar ocorre concomitantemente com o alongamento anormal e afinamento das gemas. Ambas as características
são bons indicadores da deficiência de Ni.
A HISTÓRIA DA ORELHA-DE-RATO E A RELAÇÃO
COM A DEFICIÊNCIA DE NÍQUEL EM PLANTAS
O primeiro relato da orelha-de-rato foi feito por Marz (1918).
Inicialmente, foi encontrada em árvores de quintais e viveiros na
Flórida, Mississipi e na Georgia. Na época, a desordem morfológica foi atribuída a injúrias do frio e alguns anos depois atribuída a
14
doenças provocadas por patógenos (DEMARE, 1926). Na década
de 1930, a orelha-de-rato foi observada em pomares de pecã e
Gammon e Sharpe (1956) suspeitavam que o problema era causado
por deficiência de Mn, no entanto, aplicações via solo ou foliar de
elemento não erradicaram a orelha-de-rato.
Durante a formação de pomares de pecã na Costa do Golfo
na Georgia, a severidade da orelha-de-rato era tão grande que muitas
plantas morreram (WOOD; REILLY; NYEzEPIR, 2004a). Muitas
plantas foram replantadas e mesmo assim morreram, o que provocou
um problema econômico na época. A sintomatologia descrita por
Wood, Reilly e Nyezepir (2004a) indicava a deficiência de algum
micronutriente ou o desbalanceamento entre os micronutrientes
como a causa principal da orelha-de-rato. Aplicações de Cu durante
o transplantio corrigiam os sintomas de orelha-de-rato de um ano
agrícola para o outro, mas os mesmos sintomas apareciam no ano
seguinte. Aplicações foliares de Cu não tinha nenhum efeito sobre
os sintomas da orelha-de-rato (WOOD; REILLY; NYEzEPIR,
2004b). Wood, Reilly e Nyezepir (2004a) também observaram
uma forte correlação entre Cu e zn na incidência da severidade da
orelha-de-rato. Cátions divalentes, como zn, Cu e Ni, presentes
na solução do solo, usam o mesmo canal de íons para entrada no
sistema radicular de plantas (KOCHIAN, 1991), o que acarretou
a ideia da possibilidade da orelha-de-rato estar relacionada ao Ni.
Finalmente, em 2004, a equipe do Dr. Bruce Wood relatou que a
principal causa da orelha-de-rato em pecã era a deficiência de Ni
(WOOD; REILLY; NYEzEPIR, 2004c). Pulverizações foliares
com 100 mg L-1 (na forma de NiSO4.6H2O) foram suficientes para
erradicar a orelha-de-rato (Figura 5). Após a aplicação de Ni, as
folhas de pecã voltaram a se desenvolver normalmente. De acordo
com os autores, a aplicação foliar de Ni não apresentou fitotoxicidade visual nas folhas. O Ni absorvido pelas folhas foi acumulado
em regiões de reserva da planta e posteriormente translocado para
regiões dormentes, brotos e meristemas apicais. A quantidade de
Ni translocado na planta foi suficiente para corrigir os sintomas de
deficiência e eliminar a orelha-de-rato.
Wood, Reilly e Nyezepir (2004a) submeteram uma planta de
pecã com sintomas de deficiência de Ni nos galhos a uma aplicação
de 100 mg L-1 de sulfato de Ni (NiSO4.6H2O) via foliar, em condições
de campo. Nas folhas que receberam pulverização com solução de
Ni, o teor do elemento era de aproximadamente 7 mg kg-1, comparado a 0,5 mg kg-1 nas folhas controle, as quais exibiam o sintoma
de deficiência de Ni ou orelha-de-rato (Tabela 3). Em outras árvores
do pomar que não apresentavam orelha-de-rato o teor foliar médio
de Ni era de aproximadamente 4 mg kg-1. Aparentemente, houve o
efeito da época de aplicação do Ni nas folhas de pecã. O teor foliar
de Ni nas folhas tratadas durante a primavera (julho) era quase quatro
vezes maior (26 mg kg-1) em relação ao das plantas que receberam
pulverização de Ni no outono.
TOXIDEZ DE NÍQUEL: SINTOMAS FOLIARES E NOS GRÃOS
Sintomas de deficiência de Ni dificilmente são detectados
em plantas nas condições de campo, porém, o efeito fitotóxico do
Ni é conhecido já há muito tempo. Uren (1992) cita trabalhos nos
quais são relatados que teores de 2 mg kg-1 de Ni foram suficientes
para inibir o crescimento de raízes. Também relatam que foram
observados sintomas de toxicidade em trigo quando o teor de Ni
no solo era de 8 mg kg-1, enquanto a aveia não apresentou qualquer sintoma quando o teor de solo era de 147 mg kg-1. Com base
nessas observações, conclui-se que a toxicidade de Ni é função da
espécie vegetal, sendo esta toxicidade normalmente associada à
deficiência de cobalto (Co) (McGRATH e SMITH, 1990). Poulik
INFORMAÇÕES AGRONÔMICAS Nº 147 – SETEMBRO/2014
Tabela 3. Teor foliar de níquel em plantas de pecan que apresentavam
severo sintoma de orelha-de-rato e plantas com a deficiência
corrigida após aplicação foliar de solução de níquel.
Tratamento1
Severidade da
orelha-de-rato2
(a)
Teor foliar de
Ni3
- - - - - - - - - (mg kg-1) - - - - - - - - Plantas normais - controle
1,0 b4
4,0 b
Orelha-de-rato - controle
Orelha-de-rato + Ni (outono)
7,4 a
1,0 b
0,5 c
7,0 a
Plantas normais - controle
1,0 b
5,0 b
Orelha-de-rato - controle
7,7 a
0,4 c
Orelha-de-rato - controle + Ni
(primavera)
1,0 b
26,0 a
Tratado com sal de sulfato de Ni utilizando ureia e surfactante não iônicos.
Os tratamentos foram aplicados nas folhas em outubro (outono) e em
abril, aproximadamente 10 dias após a abertura dos brotos (primavera).
2
A severidade da orelha-de-rato foi baseada na seguinte escala: 1 = sem
sintomas; 2 = entre 1% e 25% de folhas ou folíolos que apresentaram
embotamento; 3 = 26% a 50% de folhas ou folíolos que apresentaram
embotamento; 4 = mais de 50% de folhas ou folíolos que apresentaram
embotamento; 5 = engruvinhamento da parte embotoada da região apical
foliar; 6 = necrose das pontas foliares; 7 = região verde-escuro próximo à
região apical foliar; 8 = atrofiamento da parte aérea da planta; 9 = aparecimento de múltiplas novas partes aéreas (envassouramento); 10 = morte
do dossel. Nota-se que a severidade da orelha-de-rato + tratamento de Ni
na primavera foi contada após os tratamento das folhas.
3
O teor foliar de Ni foi determinado na massa seca de plantas coletadas
em julho, após o tratamento de Ni entre outubro e abril.
4
Médias seguidas por letras diferentes são estatisticamente significativas
a 5% de probabilidade pelo teste de Tukey-Kramer.
0
0,2
0,4
0,8
1,0
5,0 mg dm-3 Ni
1,0
5,0 mg dm-3 Ni
(b)
1
0
0,2
0,4
0,8
Figura 6. Plantas de soja no início do florescimento (R1), cultivadas em solo
(a) franco arenoso e (b) muito argiloso, submetidos a doses de Ni.
Fonte: Rodak (2014).
Fonte: Wood, Reilly, Nyezepir (2004a).
(1997) observou que plantas de aveia com teor de 168 mg kg-1 de Ni
apresentaram sintomas de toxicidade e morreram. Por outro lado, o
teor de Ni no solo menor do que 56 mg kg-1 aumentou a produção de
espigas. O sintoma visual da toxicidade de Ni pode ser confundido
com o da deficiência de outros elementos essenciais (PAIVA et al.,
2003), tal como a clorose causada pela deficiência de Mn ou Fe.
De maneira geral, a sintomatologia da toxidez inclui clorose,
devido à menor absorção de Fe, crescimento reduzido das raízes e da
parte aérea (Figura 6), em casos mais severos, deformação de várias
partes da planta e manchas peculiares nas folhas (CHEN; HUANG;
LIU, 2009). Entretanto, ressalta-se que em estudo recente de Rodak
(2014), plantas de soja submetidas a 5,0 mg dm-3 de Ni, em condições
controladas, apresentaram sintomas de toxidez nas folhas, com teores
em torno de 2 mg kg-1 de Ni a partir do estádio de desenvolvimento
R5 (Figura 7). No estádio de desenvolvimento R1 observou-se
comportamento semelhante ao verificado para a massa seca total,
no qual as plantas de soja cultivadas em solo muito argiloso, na
dose de 5 mg dm-3 de Ni, apresentaram menor desenvolvimento.
Sintomas de toxidez foram visíveis nas folhas a partir do
estádio de desenvolvimento R5 (Figura 7), fato não observado
nas plantas cultivadas no solo franco-arenoso (RODAK, 2014).
Esses sintomas de toxidez de Ni são semelhantes aos relatados na
literatura: as plantas apresentam amarelecimento entre as nervuras,
semelhante à deficiência de Mn, crescimento reduzido das raízes
e da parte aérea, podendo, em casos mais severos, apresentar
deformação de várias partes da planta, e manchas peculiares nas
folhas (MISHRA e KAR, 1974). Os estudos de Rodak (2014) ainda
revelaram que os teores de Ni nos grãos de soja apresentaram
comportamento inverso ao observado nas folhas, ou seja, maiores
INFORMAÇÕES AGRONÔMICAS Nº 147 – SETEMBRO/2014
Figura 7. Sintomatologia de toxidez de níquel em soja (Glycine max L.
Merrill) cultivar BRS 360 RR cultivada em um Latossolo Vermelho eutroférrico típico submetido à aplicação de 5,0 mg dm-3
de Ni, sob condições controladas.
Fonte: Rodak (2014).
teores de Ni foram verificados nos grãos de soja cultivada no solo
muito argiloso, que variaram de 0,42 a 13,56 mg kg-1, enquanto
na soja cultivada no solo franco-arenoso a variação foi de 0,39 a
4,28 mg kg-1. A maior translocação de Ni observada nas plantas
cultivadas no solo muito argiloso se deve ao maior crescimento
das plantas nesse solo, resultando em maiores valores de acúmulo
de Ni: de 3 a 20 μg/planta, enquanto nas plantas cultivadas no solo
franco-arenoso variaram de 1,3 a 10 μg/planta. Com base nesses
resultados, sugere-se que ocorra translocação do Ni para os grãos,
corroborando com os dados de Cataldo, Garland e Wildung (1978),
os quais constataram que, a partir do início da senescência, as
plantas de soja translocam aproximadamente 70% do Ni para os
grãos. Rodak (2014) ressalta que o teor médio de 13,56 mg dm-3
de Ni nos grãos das plantas cultivadas no solo muito argiloso, com
fornecimento de 5,0 mg dm-3 de Ni, excede os valores comumente
relatados na literatura como adequados, podendo ser a causa dos
sintomas de toxidez verificados nos grãos de soja, ou seja, menor
desenvolvimento e enrugamento, como ilustrado na Figura 8.
15
0,4
0,8
1,0
5,0 mg dm-3 Ni
(b)
0
0,2
0,4
0,8
1,0
5,0 mg dm-3 Ni
Figura 8. Aspecto visual de grãos de soja cultivada em solo (a) francoarenoso e (b) muito argiloso, submetidos a doses de níquel.
Fonte: Rodak (2014).
São escassas as informações referentes aos teores de Ni
nas sementes de soja, logo, com o intuito de compreender o comportamento dos teores nas sementes, Rodak (2014) efetuou um
breve estudo exploratório no qual os principais genótipos de soja
atualmente cultivados no Brasil foram avaliados quanto ao teor de
Ni. Notou que os genótipos de soja diferiram grandemente quanto
aos teores do elemento na semente, variando de 0,5 a 2,09 mg kg-1.
O local de cultivo, em razão do teor disponível no solo, influencia
grandemente os teores nas sementes; por exemplo, o cultivar BRS
360 RR apresentou maiores teores de Ni nas sementes quando os
teores disponíveis no solo eram mais elevados.
LEIS BRASILEIRAS E CRITÉRIOS DE
ADUBAÇÃO COM NÍQUEL
O Ni foi inserido na legislação brasileira de fertilizantes na
Instrução Normativa N° 05, de 23 de fevereiro de 2007 (MAPA, 2014)
e os estudos a respeito de sua exigência pelas culturas em condições
de campo e forma de utilização na agricultura se encontram em fase
inicial. A fonte de Ni mais empregada e estudada na agricultura é
o sulfato de níquel (NiSO4.6H2O), entretanto, insumos como os
termofosfatos não são considerados fontes, embora contenham quantidade significativa desse micronutriente, com teores médios de até
330 mg kg-1 (GABE, 1998). Outras fontes, além das mencionadas,
vêm sendo comercializadas, como quelados e fertilizantes foliares,
entretanto, ainda são escassos os estudos científicos sobre as mesmas.
Excluindo-se os trabalhos em soluções nutritivas, os critérios
de adubação foram definidos, basicamente, para as culturas de pecã e
soja. A aplicação foliar de 100 mg L-1 de sulfato de Ni (NiSO4.6H2O)
foi eficiente para minimizar os sintomas de deficiência em pecã
(WOOD; REILLY; NYEzEPIR, 2006). Para soja, a adição de até
0,02 mg dm-3 de Ni proporcionou incrementos de produtividade
(BERTRAND, 1973). Martins (comunicação pessoal), citado por
Moraes et al. (2010), cultivando soja a campo, em condições brasileiras, verificou que o fornecimento de 50 g ha-1 de Ni proporcionou
aumento de até 6,2 sc ha-1, aventando que o Ni estaria atuando no
controle de doenças fúngicas e, assim, aumentando a produtividade da
soja de forma indireta. Entretanto, ressalta-se que, para soja, trabalhos
de Alovisi et al. (2011) e Rodak (2014) não verificaram incremento
nos componentes de produtividade em função do fornecimento de
16
Sem ureia foliar
Com ureia foliar
Baixo teor de
Ni na semente
0,2
Médio teor de
Ni na semente
0
Ni via foliar e solo, respectivamente. Entretanto, aspectos fisiológicos das plantas foram potencializados com a aplicação da dose
em torno de 0,5 mg dm-3 de Ni no solo. A princípio, teores foliares
de 0,3 a 0,8 mg kg-1, teores disponíveis de 0,2 a 0,6 mg dm-3 em
DTPA e 0,4 a 0,8 mg dm-3 em Mehlich-1 podem ser tomados como
sugestão aproximada de níveis de referência para Ni em solos e
folhas-diagnóstico de soja (RODAK, 2014).
A falta de resposta dos componentes de produtividade à adubação com Ni em condições de campo, mesmo em solos com teores
disponíveis iniciais baixos, provavelmente se deve ao teor inicial
de Ni na semente. Brown, Welch e Cary (1987), cultivando cevada
em solução nutritiva, verificaram que apenas o conteúdo de Ni da
semente foi suficiente para suprir até três gerações precedentes sem
que houvesse deficiência do mesmo. Em trabalho de Rodak (2014), os
teores na semente supriram de 0,75% a 18,88% da quantidade total
de Ni acumulado em plantas de soja, sendo esse um dos principais
fatores que justificam a ausência de resposta em produtividade.
Em trabalhos recentes, Kutman, Kutman e Kakmak (2012,
2014) estudaram as reservas de Ni em sementes de soja, juntamente
com o fornecimento foliar desse micronutriente e de fertilizantes
nitrogenados em solução nutritiva. Constataram respostas à adubação com Ni e ureia quando os teores iniciais nas sementes eram
baixos e médios, principalmente no metabolismo do N, porém,
sem acréscimos de produtividade. Foram verificados redução dos
danos foliares decorrentes da pulverização com uréia bem como
aumento da biomassa aérea e do conteúdo de clorofila em função
dos teores iniciais de Ni nas sementes e de seu fornecimento via
foliar (Figura 9, Figura 10 e Figura 11), evidenciando, portanto,
que as reservas na semente exercem influência direta sobre a
resposta das plantas à adubação com Ni.
Alto teor de
Ni na semente
(a)
Figura 9. Plantas de soja (Glycine max cv. Nova), aos 29 dias, cultivadas
a partir de sementes com baixo, médio e alto teor de níquel e
submetidas à aplicação foliar de ureia e de 0 e 0,2 μM de Ni
(-Ni e +Ni, respectivamente), em solução nutritiva.
Fonte: Kutman, Kutman e Kakmak (2012).
INFORMAÇÕES AGRONÔMICAS Nº 147 – SETEMBRO/2014
Médio teor de Ni
na semente
Alto teor de Ni
na semente
+ Ni
- Ni
Baixo teor de Ni
na semente
Figura 10. Sintomatologia de toxidez nas folhas jovens de soja (Glycine
max cv. Nova) aos 28 dias após a aplicação foliar de ureia. As
plantas foram cultivadas a partir de sementes com baixo, médio
e alto teor de Ni e submetidas à aplicação foliar de 0 e 0,2 μM
de níquel, -Ni e +Ni, respectivamente. (†1 teor médio de Ni nas
folhas; †2 n.d. = abaixo do limite de detecção, < 1 mg kg-1).
As primeiras observações sobre a possível necessidade de
Ni no cafeeiro durante o ciclo de desenvolvimento dos frutos foram
descritas por Reis et al. (2009). Mesmo sem aplicar Ni no solo, os
teores de Ni aumentaram gradativamente nas folhas e nos frutos.
Ressalta-se que a área experimental foi adubada com termofosfatos,
os quais são fontes de Ni para as plantas. Reis et al. (2011) verificaram
que os teores de Ni nas folhas e nos grãos diminuem em função da
adubação nitrogenada na forma de ureia. Isso provavelmente ocorre
devido ao fator de diluição, consequência do crescimento do dossel
e dos frutos na presença de N. Contudo, os autores afirmam que os
teores adequados de Ni para o cafeeiro são de aproximadamente
2 a 3 mg kg-1 em frutos verdes e de 5 a 10 mg kg-1 em frutos cereja.
O aumento crescente do teor de Ni no fruto em função do desenvolvimento da planta ainda não está esclarecido. Mais pesquisas
devem ser conduzidas para explicar o fenômeno. Provavelmente,
o cafeeiro adubado com ureia como fonte nitrogenada pode necessitar de uma pulverização com Ni durante o desenvolvimento dos
frutos para formar sementes de boa qualidade, como já observado
em algumas culturas e descrito por Brown, Welch e Cary (1987).
Fonte: Kutman, Kutman e Kakmak (2012).
Figura 11. Efeito dos teores de níquel na semente (alto e baixo) em (a) folhas primárias
e (b) trifólios de soja (Glycine max cv. Nova) aos 22 dias, em função do
fornecimento de 2×10-7 M de Ni e de 2×10-3 M de N como ureia e nitrato,
em solução nutritiva.
Fonte: Kutman, Kutman e Kakmak (2014).
INFORMAÇÕES AGRONÔMICAS Nº 147 – SETEMBRO/2014
O PAPEL DO NÍQUEL NA FISIOLOGIA E NA
BIOQUÍMICA DAS PLANTAS
Brown, Welch e Cary (1987) consideram o Ni
um micronutriente essencial em certas espécies vegetais,
especialmente quando cultivadas com ureia, pois é parte
da enzima urease (DIXON et al., 1975), e sua deficiência
leva à redução da atividade enzimática em tecidos de
soja [Glycine max (L.) Merr.], arroz (Oryza sativa L.) e
fumo (Nicotiana tabacum L.), resultando em acúmulo
excessivo de ureia, tornando-a fitotóxica (POLACCO,
1977; POLACCO e HOLLANDO, 1993).
A urease (EC 3.5.1.5; urea amidohidroxilase) é
uma metaloenzima que catalisa a hidrólise da ureia para
formar NH3 e CO2 (DIXON et al., 1975), como ilustrado na Figura 12. é encontrada em vários organismos,
incluindo plantas, fungos e bactérias (HIRAYAMA et
al., 2002). A função principal da urease é permitir aos
organismos o uso da ureia gerada externa ou internamente
como fonte de N (MOBLEY e HAUSINGER, 1989;
MOBLEY; ISLAND; HAUSINGER, 1995; ANDREWS;
BLAKELEY; zERNER, 1984; TEzOTTO et al., 2012).
Nas plantas, uma quantidade significativa do
fluxo do N ocorre através da ureia (47% N), o qual é
reciclado somente pela ação da urease (POLLACCO
e HOLLAND, 1993). A ureia pode também ser gerada
pelo catabolismo de ureídeos (alantoato e alantoína). Tem
sido demonstrado que o ureídeo-glicolato, um produto
da degradação do alantoato, é um precursor da ureia
(TODD e POLLACCO, 2004; MUÑOz et al., 2006).
Bloqueios genéticos e químicos da atividade da
urease nas folhas causam um tipo de necrose foliar, associado ao acúmulo de ureia, o que promove alterações no
ciclo da ornitina (KROGMEIER, 1989; POLLACCO e
HOLLAND, 1993). Nas plantas, a urease tem função na
assimilação da ureia derivada de ureídeos ou arginina
(POLLACCO e HOLLAND, 1993). A arginina é um
dos aminoácidos livres predominantes no caule de plantas
perenes, especialmente durante o inverno, e é considerada
o principal composto de armazenamento de N. De fato, a
arginina se acumula na casca durante o outono e diminui
gradualmente durante a primavera seguinte (SUzUKI,
17
O Ni possui alta mobilidade na planta,
encontrando-se em todos os tecidos e, principalmente, nas sementes (MALAN e FARRANT,
1998). O acúmulo ocorre de modo diferencial entre
os tecidos e ao longo do ciclo vital da planta, sendo
maior nos grãos, nas folhas e nas partes jovens. O
Ni é capaz de modificar a absorção e o transporte
do nitrato, alterando a atividade das enzimas nitrato
redutase e glutamina sintetase, essenciais para a
síntese de aminoácidos (PALACIOS e MATAIX,
1999).
FLORESCIMENTO DO CAFEEIRO E A
IMPORTÂNCIA DO NÍQUEL NESSE
PROCESSO
Figura 12. Origem e destino da ureia na planta.
1984). No entanto, a relevância fisiológica da urease bem como
a variação sazonal de aminoácidos do ciclo da ornitina não estão
esclarecidas.
Quando a atividade da urease é baixa, devido ao inadequado
suprimento de Ni, a ureia pode se acumular em níveis consideráveis, especialmente em plantas tratadas com ureia, o que pode
eventualmente levar a alterações nos compostos intermediários
do ciclo da ornitina (GERENDÁS e SATTELMACHER, 1997).
Os autores verificaram, ainda, que o Ni aumentou significativamente a atividade da urease em diversas espécies. Além disso, a
deficiência de Ni afetou o metabolismo dos aminoácidos em feijãocaupi (WALKER et al., 1985), reduziu a atividade da urease, induziu
a deficiência no metabolismo do N e afetou os aminoácidos (glicina,
asparagina, arginina, ornitina e citrulina) em diversas espécies
(GERENDÁS e SATTELMACHER, 1997). Folhas deficientes em
Ni exibem relativamente alto nível de xantina, ácido alantóico e
ureídeo-glicolato – três intermediários da cadeia do catabolismo de
ureídeos. O acúmulo desses intermediários indica reduzida atividade enzimática nas três últimas fases do catabolismo dos ureídeos
(BAI; REILLY; WOOD, 2006).
A principal rota geradora de ureia nas plantas é a reação da
arginase (Figura 12). Quando a atividade da urease é reduzida por um
suprimento inadequado de Ni, uma perturbação no metabolismo do N
pode ser antecipada sempre que for adicionada ureia externa ou ocorrer
a liberação de ureia pela reação da arginase (BAI; REILLY; WOOD,
2006). Como a demanda de N pelas plantas é altamente dependente da
hidrólise da ureia, a deficiência de Ni resulta em paralisação do metabolismo do N, o que provoca acúmulo de ureia e diminuição na síntese
de aminoácido (GERENDÁS e SATTELMACHER, 1997; 1999).
A essencialidade do Ni somente ganhou aspecto prático após
a constatação, e posterior correção, da deficiência de Ni em pomares de pecã nos Estados Unidos (WOOD; REILLY; NYEzEPIR,
2004a, 2004b, 2004c). A literatura recente sobre nutrição mineral
de plantas já trata o Ni como micronutriente (MARSCHNER,
2012). Dentre outros aspectos positivos do Ni, destacam-se a sua
influência no complexo enzimático hidrogenase, que aumenta a
eficiência da fixação do N por leguminosas (KLUCAS, 1983), e a
sua participação na síntese de fitoalexinas, aumentando a resistência
das plantas às doenças (WALKER et al., 1985).
18
O processo de florescimento do cafeeiro
compreende várias etapas, como: indução floral;
iniciação floral; diferenciação, crescimento e desenvolvimento das peças florais do botão; dormência
do botão floral e florada (abertura da flor ou antese).
Cada uma dessas fases é afetada por fatores exógenos e endógenos particulares que determinam diferentes padrões
de crescimento e desenvolvimento dos órgãos florais, de acordo
com a variedade/cultivar e as condições ambientais predominantes
(ALVES e GUIMARãES, 2010).
A maior parte das pesquisas sobre floração do cafeeiro
restringe-se a eventos que ocorreram na pré-florada ou na florada. Entretanto, informações reunidas nas áreas de fisiologia do
florescimento ainda são escassas. Grande parte dos estudos nessa
fase da floração se restringe aos efeitos negativos da seca e da alta
temperatura. Em recentes estudos envolvendo o efeito do déficit
hídrico sobre o abortamento de flores e frutos em café arábica
foi constatado um aumento de 50% para 83% na queda total de
flores/frutos (ALVES e GUIMARãES, 2010). Esse abortamento
foi elevado para 93% em rosetas com flores anormais (estrelinhas),
em resposta à temperatura elevada.
Uma vez que em condições de campo normalmente
ocorrem longos veranicos na fase de florescimento do cafeeiro,
alguns pesquisadores, além do uso de irrigação, estudam meios para
evitar o abortamento das flores, principalmente pela pulverização
de caldas contendo Ca e boro (B). Considerando que os resultados
encontrados até agora são contraditórios, novas alternativas têm
sido pesquisadas, entre elas o uso de Ni como forma de garantir o
pegamento das flores.
Malavolta et al. (2006) observaram que metade do total
do Ni presente nos citros estava nas flores e destacaram que possivelmente esta alta demanda do micronutriente pelas flores se deve
ao seu papel de ativador da urease (DIXON et al., 1975) que, ao
agir sobre a ureia, libera amônia (NH3) e dióxido de carbono (CO2).
Há algum tempo se utiliza a pulverização de citros com ureia como
meio de aumentar o teor de NH3 nas folhas. Lovatt et al. (1988)
propuseram que o aumento dos níveis de NH3 nas folhas durante
o estádio de indução floral leva a incrementos na iniciação floral
via síntese de várias poliaminas, como putrescina, espermidina e
espermina (Figura 12). Desse modo, Malavolta et al. (2006) supõem
que o alto conteúdo de Ni nas flores poderia aumentar a atividade de
urease e, portanto, a produção de amônia endógena. Entretanto, não
se sabe, ainda, se a aplicação de Ni, via solo ou folha, em cafeeiros
bem nutridos com N aumenta o florescimento e, proporcionalmente,
o pegamento das flores.
INFORMAÇÕES AGRONÔMICAS Nº 147 – SETEMBRO/2014
(GRATãO et al., 2005). A ascorbato peroxidase, a glutationa redutase e a GSH são componentes importantes do ciclo ascorbatoglutationa, responsável pela remoção do H2O2 em diferentes compartimentos celulares (FOYER e NOCTOR, 2005, GRATãO et
al., 2005). A GSH é, também, o substrato para a biossíntese de
fitoquelatinas, que estão envolvidas na desintoxicação de metais
pesados (INOUHE, 2005). Vários resultados de pesquisa referentes
ao efeito no Ni na atividade enzimática da rota fotossintética, na
rota do N e sobre as enzimas antioxidativas estão compilados na
Tabela 4. Dependendo da concentração de Ni no solo ou na solução
nutritiva, a atividade enzimática de diferentes culturas pode ser
aumentada ou diminuída de acordo com a fisiologia de cada planta.
RESPOSTAS ANTIOXIDATIVAS À APLICAÇÃO DE NÍQUEL
Estudos sobre os efeitos do Ni no metabolismo das plantas
demonstraram que o metal pode induzir à produção de espécies reativas de oxigênio - EROs (O2•–) (FOYER et al., 1997). As espécies
reativas de oxigênio demonstraram induzir a peroxidação lipídica
de membranas celulares, e o nível de peroxidação lipídica, medido
pela quantidade de substâncias reativas ao ácido tiobarbitúrico
(TBARS), tem sido utilizado como um índice do efeito tóxico do
estresse oxidativo (DEUNER et al., 2011).
As espécies reativas de oxigênio mostraram ser produzidas
como uma resposta geral a distintas condições abióticas estressantes
(ANZA; RIGA; GARBISU, 2005; FIDALGO et al., 2004; ALVES
et al., 2012). A destruição eficiente das espécies reativas de oxigênio
requer a ação de várias enzimas antioxidantes, como superóxido
dismutase, catalase, ascorbato peroxidase, glutationa redutase e
guaiacol peroxidase. As superóxido dismutases são consideradas a
primeira linha de defesa contra as espécies reativas de oxigênio, sendo
responsáveis pela dismutação do O2•–, gerando H2O2 e O2. A catalase,
a ascorbato peroxidase e a guaiacol peroxidase são enzimas que
catalisam a conversão do H2O2 em água e O2 (GRATãO et al., 2005).
A glutationa redutase catalisa a redução dependente de nicotiamidaadenina-dinucleótido-fosfato (NADPH) da glutationa dissulfeto
(GSSG), forma oxidada, para glutationa (GSH), a forma reduzida
Além disso, o Ni induz a produção de fitoquelatinas, mas a
ligação de metais com fitoquelatinas foi apenas demonstrada para Cu,
Pb e Cd (KUKKOLA, 2000). Além disso, plantas naturalmente tolerantes a metais não elevam a produção de fitoquelatinas como parte
de sua defesa contra o Ni (FREEMAN et al., 2004). Entretanto, o Ni
pode formar complexo estável com a GSH (RAO e SRESTY, 2000).
Apesar das informações da relação entre metais pesados e
estresse oxidativo disponíveis em anos recentes, continua difícil
estabelecer uma conclusão geral sobre as concentrações críticas de
metais tóxicos nos solos (ROMERO-PUERTAS et al., 2004). O O2
molecular é relativamente não reativo em seu estado natural, mas
Tabela 4. Efeito do Ni nas atividades enzimáticas.
Enzima
Processo
Rubisco
Fixação de CO2
0,5 - 1,0
↓
Cajanus cajan
Sheoran et al. (1990)
Gliceraldeído 3-fosfato
dehidrogenase
Ciclo de Calvin
0,5 - 1,0
↓
Cajanus cajan
Sheoran et al. (1990)
AT1
Espécie
Referência
3-fosfoglicerol quinase
Ciclo de Calvin
0,5 - 1,0
↓
Cajanuscajan
Sheoran et al. (1990)
Aldolase
Ciclo de Calvin
0,5 - 1,0
↓
Cajanus cajan
Sheoran et al. (1990)
Frutose 1,6-bisfosfatase
Ciclo de Calvin
0,5 - 1,0
↓
Cajanus cajan
Sheoran et al. (1990)
NADP e NAD dependente de
fosfogliceraldeído dehidrogenase
Ciclo de Calvin
0,5 - 1,0
↓
Cajanus cajan
Sheoran et al. (1990)
Redutase do nitrato
Redução do nitrato
1
↓
Beta vulgaris
Kevresan et al. (1998)
Redutase do nitrato
Redução do nitrato
< 0,4 (mg dm-3)
↑
Glycine max
Rodak (2014)
Redutase do nitrato
Redução do nitrato
> 0,4 (mg dm )
↓
Glycine max
Rodak (2014)
Redutase do nitrato
Redução do nitrato
0,1
↓
Triticum aestivum
Gajewska e Sklodowska (2009)
H+-ATPase
Transporte de íons
0,5
↑
Oryza sativa
ROS et al. (1990)
-3
Glutamina sintetase
Síntese de glutamina
1
↓
Beta vulgaris
Kevresan et al. (1998)
Glutamina sintetase
Síntese de glutamina
0,1
↓
Triticum aestivum
Gajewska e Sklodowska (2009)
Fd-GOGAT
Síntese de glutamato
0,1
↓
Triticum aestivum
Gajewska e Sklodowska (2009)
NAD-GOGAT
Síntese de glutamato
> 0,1
↑
Triticum aestivum
Gajewska e Sklodowska (2009)
Transformação de alanina
em piruvato
0,2
↓
Glycine max
El-Shintinawy e El-Ansary
(2000)
IAA oxidase
Oxidação do IAA
< 0,05
↑
Oryza sativa
DAS et al. (1978)
IAA oxidase
Oxidação do IAA
> 0,05
↓
Oryza sativa
DAS et al. (1978)
Glutationa redutase
Redução da glutationa
0,01-1
↑
Alyssum maritimum
Schicker e Caspi (1999)
Ascorbato oxidase
Oxidação do ascorbato
< 0,05
↑
Oryza sativa
DAS et al. (1978)
Ascorbato oxidase
Oxidação do ascorbato
> 0,05
↓
Oryza sativa
DAS et al. (1978)
Superóxido dismutase
Deativação do O2.
0,01
↓
Alyssum maritimum
Schicker e Caspi (1999)
Superóxido dismutase
Deativação do O2.–
0,1
↑
Alyssum maritimum
Schicker e Caspi (1999)
Degradação do H2O2
< 0,05
↑
Oryza sativa
DAS et al. (1978)
Degradação do H2O2
> 0,05
↓
Oryza sativa
DAS et al. (1978)
Oxidação de polifenóis
1-40
↑
Triticum aestivum
Pandolfini et al. (1992)
Alanina aminotransferase
Catalase
Catalase
Peroxidase
1
[Ni], mM
–
AT = atividade enzimática, ↓ = diminui, ↑ = aumenta.
INFORMAÇÕES AGRONÔMICAS Nº 147 – SETEMBRO/2014
19
a produção de espécies reativas de oxigênio, como o superóxido,
peróxido de hidrogênio, radical hidroxil e o oxigênio “singlet”, é
uma consequência inevitável do metabolismo aeróbico. Sob condições normais de crescimento, a produção de espécies reativas
de oxigênio nas células ocorre em baixa taxa, entretanto, fatores
ambientais adversos que perturbam a homeostase celular aumentam
a produção de espécies reativas de oxigênio, levando ao estresse
oxidativo (GRATãO et al., 2005).
APLICAÇÃO DO NÍQUEL E RELAÇÕES COM
DOENÇAS E PATÓGENOS
O Ni tem efeito direto ou indireto sobre microrganismos
que promovem doenças em plantas, incluindo viroses (PENNAzIO
e ROGGERO, 1988), bactérias (WANG; zENG; KANG, 2000) e
fungos (DUBEY e DWINVEDI, 1988; SINGH; SHUKLA; DWINVEDI, 1992). Sais de Ni são especialmente efetivos nas doenças
causadas por fungos (KISHORE; PANDE; RAO, 2001; SUGHA e
SINGH, 1990) e nematoides (KAHN e SALAM, 1990). A inibição
direta de micróbios por pulverizações com Ni ocorre na concentração aproximada de 200 mg L-1, porém, essa concentração pode ser
tóxica para algumas plantas.
A resistência induzida, ou efeito indireto, ocorre pela produção de fitoalexinas nas plantas hospedeiras susceptíveis ao patógeno
(SINHA, 1995). A aplicação de sais de Ni em baixas concentrações
reduz a indicidência de doenças causadas por Helminthosporium
oryzae no arroz, Pyricularia oryzae em plântulas de arroz e ferrugem
no amendoim (WOOD e REILLY, 2007). Essa indução de resistência
é caracterizada pela aplicação de Ni em concentrações não tóxicas
para a planta hospedeira. Estudo realizado por Reilly, Crawford e
Buck (2005) mostrou a resposta da incidência de Puccinia hemorocallidis em Hemerocallis em função da aplicação de Ni. A ferrugem é
a principal doença em Hemorocallis e traz muitos danos econômicos.
Hemerocallis é uma planta ornamental também conhecida como
lírio-de-um-dia. Apesar do nome, não são lírios verdadeiros (Lilium,
Liliaceae). As flores da maior parte das espécies desabrocham pela
manhã e murcham à noite, sendo estas substituídas por uma ou mais
na mesma inflorescência no dia seguinte. Observou-se que uma aplicação de Ni foi suficiente para eliminar a ferrugem, como ilustrado
na Figura 13. A ferrugem desapareceu completamente 15 dias após
a aplicação de sulfato de Ni, porém, ocorreu fitotoxidade na dose de
400 mg L-1. Nesse estudo, a germinação dos urediósporos em placas
de Petri não foi afetada em dose de até 200 mg L-1. Essa dose não
afetou a germinação do urediósporo do fungo, o que permite afirmar
que o Ni aumentou a resistência da planta.
A ferrugem causada pelo fungo Fusicladosporium caryigenum é a principal doença da cultura da pecã, provocando perdas na
produtividade e danos econômicos. A aplicação de Ni, além de corrigir os sintomas de orelha-de-rato, promove resistência contra o fungo,
como ilustrado na Figura 14. A germinação dos esporos do fungo
Fusicladosporium caryigenum foi significativamente afetada pelas
doses de Ni utilizadas no estudo. Isso sugere que o Ni, além de atuar
como indutor de resistência nas plantas, apresenta também a função
de fungicida. No entanto, são necessárias pesquisas relacionando a
aplicação de Ni em culturas tropicais e a indução de resistência a
microrganismos, patógenos e pragas nas condições brasileiras.
As plantas, em geral, possuem quatro estratégias de defesa
contra os patógenos: 1) alta produção de cutina, suberina e cera;
2) produção de produtos secundários contendo N; 3) produção de
compostos fenólicos e 4) produção de terpenos. A produção de
cutinas, compostos secundários, compostos fenólicos e terpenos
20
200 ppm Ni2+
100 ppm Ni2+
0 ppm Ni2+
Figura 13. Efeito do níquel na incidência da ferrugem (Puccinia hemerocallidis) em Hemerocallis.
Fonte: Cortesia do Dr. Bruce Wood (USDA - Department of Agriculture, Agricultural
Research Service, USA).
0 ppm Ni2+
25 ppm Ni2+
50 ppm Ni2+
100 ppm Ni2+
150 ppm Ni2+
200 ppm Ni2+
Figura 14. Efeito da concentração de níquel na incidência da ferrugem em
pecã (Fusicladosporium caryigenum).
Fonte: Cortesia do Dr. Bruce Wood (USDA - Department of Agriculture, Agricultural
Research Service, USA).
pela via do ácido mevalônico é altamente dependente da acetil
CoA oriunda do piruvato. Bai et al. (2006) demonstraram em seus
estudos que a deficiência de Ni afeta o metabolismo do carbono nas
plantas. Plantas deficientes em Ni acumulam ácido lático nas folhas
devido à baixa atividade da acetil CoA sintase e, consequentemente,
acumulam altos teores de triptofano, valina, leucina e glicina. A
correta pulverização de Ni nas plantas, além de ativar a síntese
de fitoalexinas, aumenta a atividade da acetil CoA sintase, o que
proporciona maior produção de compostos secundários e, consequentemente, maior tolerância das plantas ao ataque de patógenos.
REFERÊNCIAS
AHMADA, M. S. A.; ASHRAF, M.; HUSSAINA, M. Phytotoxic effects of
nickel on yield and concentration of macro-and micro-nutrients in sunflower
(Helianthus annuus L.) achenes. Journal of Hazardous Materials, v. 185,
p. 1295-1303, 2011.
ALI, M. A.; ASHRAF, M.; ATHAR, H. R. Influence of nickel stress on growth
and some important physiological/biochemical attributes in some diverse
INFORMAÇÕES AGRONÔMICAS Nº 147 – SETEMBRO/2014
canola (Brassica napus L.) cultivars. Journal of Hazardous Materials,
v. 172, p. 964-969, 2009.
ALOVISI, A. M. T.; MAGRI, J.; DUTRA, J. E.; MAGRI, E.; SANTOS,
M. J. G.; ALOVISI, A. A. Adubação foliar com sulfato de níquel na cultura
da soja. Ensaios e Ciência: Ciências Biológicas, Agrárias e da Saúde,
v. 15, n. 2, p. 25-32, 2011.
ALVES, J. D.; GUIMARãES, R. J. Sintomas de desordens fisiológicas
em cafeeiro. In: GUIMARãES, R. J.; MENDES, A. N. G.; BALIzA, D. P.
(Org.). Semiologia do cafeeiro: sintomas de desordens nutricionais, fitossanitárias e fisiológicas. 1. ed. Lavras: Editora UFLA, 2010. p. 169-215.
ALVES, S.; TRANCOSO, M. A.; GONÇALVES, M. L. S.; SANTOS,
M. M. C. A nickel availability study in serpentinised areas of Portugal.
Geoderma, v. 164, p. 155-163, 2011.
ALVES, J. D.; zANANDREA, I.; DEUNER, S.; GOULART, P. F. P.;
SOUzA, K. R. D.; SANTOS, M. O. Antioxidative responses and morphoanatomical adaptations to waterlogging in Sesbania virgata. Trees, v. 27,
n. 3, p. 717-728, 2012.
ANDREEVA, I. V.; GOVORINA, V. V.; YAGODIN, B. A.; DOSIMOVA,
O. T. Dynamics of nickel accumulation and distribution in oat plants.
Agrokhimiya, v. 4, p. 68-71, 2000.
ANDREWS, R. K.; BLAKELEY, R. L.; zERNER, B. Urea and urease.
Advances in inorganic biochemistry, v. 6, p. 245-283, 1984.
ANzA, M.; RIGA, P.; GARBISU, C. Time course of antioxidant response of Capsicum annuum subjected to progressive magnesium deficiency.
Annals of Applied Biology, v. 146, p. 123-134, 2005.
BAI, C.; REILLY, C. C.; WOOD, B. W. Nickel deficiency disrupts metabolism of ureides, amino acids, and organic acids of young pecan foliage.
Plant Physiology, v. 140, n. 2, p. 433-443, 2006.
BERTRAND, D. Importance du nickel, comme oligo-élément, pour les
Rhizobium des nodosités des legumineuses. Comptes Rendus Hebdomadaires des Seances de L´Academie des Sciences, v. 276, n. 12,
p. 1855-1858, 1973.
BETTINELLI, M.; BEONE, G. M.; SPEzIA, S.; BAFFI, C. Determination
of heavy metals in soils and sediments by microwave-assisted digestion
and inductively coupled plasma optical emission spectrometry analysis.
Analytica Chimica Acta, v. 424, p. 289-296, 2000.
BIONDI, C. M. Teores naturais de metais pesados nos solos de referência do estado de Pernambuco. 2010. 58 p. Tese (Doutorado) - Universidade Federal Rural de Pernambuco, Recife, 2010.
BROOKS, R. R. Accumulation of nickel by terrestrial plants. In: NRIAGU, J. O. (Ed). Nickel in the environment. New York: John Wiley, 1980.
p. 407-430.
BROOKS, R. R. Serpentine and its vegetation: a multidisciplinary
approach. London: Croom Helm, 1987. 454 p.
BROWN, P. H.; WELCH, R. M.; CARY, E. E. Nickel: a micronutrient
essential for higher plants. Plant Physiology, v. 85, n. 3, p. 801-803, 1987.
BUSCHLE, B. N. Valores de referência de qualidade para elementos-traço em solos da Planície Litorânea do Estado do Paraná. 2013. 49 p.
Dissertação (Mestrado) – Universidade Federal do Paraná, Curitiba, 2013.
CAIRES, S. M. Determinação dos teores naturais de metais pesados
em solos do Estado de Minas Gerais como subsídio ao estabelecimento
de Valores de Referência de Qualidade. 2009. 304 p. Tese (Doutorado)
– Universidade Federal de Viçosa, Viçosa, 2009.
CARIDAD-CANCELA, R.; PAz-GONzÁLEz, A.; ABREU, C. A. Total
and extractable nickel and cadmium contents in natural soils. Communications in Soil Science and Plant Analysis, v. 36, p. 241-252, 2005.
CATALDO, D. A.; GARLAND, T. R.; WILDUNG, R. E. Nickel in plants:
II. Distribution and chemical form in soybean plants. Plant Physiology,
v. 62, p. 566-570, 1978.
CHEN, C.; HUANG, D.; LIU, J. Functions and toxicity of nickel in plants:
recent advances and future prospects. Clean, v. 37, n. 4-5, p. 304-313, 2009.
CHESHIRE, M. V.; BERROW, M. L.; GOODMAN, B. A.; MUNDIE,
C. M. Metal distribution and nature of some Cu, Mn and V complexes
INFORMAÇÕES AGRONÔMICAS Nº 147 – SETEMBRO/2014
in humic and fulvic acid fractions of soil organic matter. Geofhimica et
Cosmochlmica Acta, v. 41, p. 1131-1138, 1977.
DALTON, D. A.; EVANS, H. J.; HANUS, F. J. Stimulation by nickel of
soil microbial urease activity and urease and hydrogenase activities in soybeans growth in a low-nickel soil. Plant and Soil, v. 88, p. 245-258, 1985.
DEMAREE, J. B. Little leaf disease of pecans. Phytopathology, v. 16,
p. 277-283, 1926.
DEUNER, S.; ALVES, J. D.; zANANDREA, I.; GOULART, P. F. P.; SILVEIRA, N. M.; HENRIQUE, P. C.; MESQUITA, A. C. Stomatal behavior
and components of the antioxidative system in coffee plants under water
stress. Scientia Agricola, v. 68, n. 1, p. 77-85, 2011.
DIXON, N. E.; GAzzOLA, C.; BLAKELEY, R. L.; zERNER, B. Jack
bean urease (EC 3.5.1.5) a metalloenzyme: simple biological role for
nickel. Journal of the American Chemical Society, v. 97, n.14, p. 41314133, 1975.
DUBEY, R. C.; DWINVEDI, R. S. Effect of heavy stress metals on growth
and survival of Macrophomina phaseolina (Tassi). Biology and Fertility
of Soils, v. 6, p. 311-314, 1988.
EL-SHINTINAWY, F.; EL-ANSARY, A. Differential effect of Cd2+ and
Ni2+ on amino acid metabolism in soybean seedlings. Biologia Plantarum,
v. 43, p. 79-84, 2000.
EMBRAPA. EMPRESA BRASILEIRA DE PESQUISA AGROPECUÁRIA. Sistema brasileiro de classificação de solos. 2. ed. Rio de Janeiro:
Embrapa Solos, 2006. 306 p.
ESKEW, D. L.; WELCH, R. M.; CARY, E. E. Nickel: an essential micronutrient for legumes and possibly all higher-plants. Science, v. 222,
n. 4624, p. 621-623, 1983.
ESKEW, D. L.; WELCH, R. M.; NORVELL, W. A. Nickel in higher
plants: further evidence for an essential role. Plant Physiology, v. 76,
n. 3, p. 691-693, 1984.
EVANS, H. J.; HARKER, A. R.; PAPEN, H.; RUSSELL, S. A.; HANUS, F. J.; zUBER, M. Physiology, biochemistry and genetics of the
uptake hydrogenase in rhizobia. Annual Review of Microbiology, v. 41,
p. 335-361, 1987.
EWAIS, E. A. Effects of cadmium, nickel and lead on growth, chlorophyll
content and proteins of weeds. Biologia Plantarum, v. 39, p. 403-410, 1997.
FIDALGO, F.; SANTOS, A.; SANTOS, I.; SALEMA, R. Effects of long
term salt stress on antioxidant defence systems, leaf water relations and
chloroplast ultrastructure of potato plants. Annals of Applied Biology,
v. 145, p. 185-192, 2004.
FOYER, C. H.; NOCTOR, G. Redox homeostasis and antioxidant signaling: A metabolic interface between stress perception and physiological
responses. The Plant Cell, v. 17, p. 1866-1875, 2005.
FOYER, C. H.; LOPEz-DELGADO, H.; DAT, J. F.; SCOTT, I. M. Hydrogen peroxide and glutathione-associated mechanism of acclimatory stress
tolerance and signalling. Physiologia Plantarum, v. 100, p. 241-254, 1997.
FREEMAN, J. L.; PERSANS, M. W.; NIEMAN, K.; ALBRECHT, C.;
PEER, W.; PICKERING, I. J.; SALT, D. E. Increased glutathione biosynthesis plays a role in nickel tolerance in Thlaspi nickel hyperaccumulators.
The Plant Cell, v. 16, p. 2176-2191, 2004.
FUENTES, I. I.; ESPADAS-GIL, F.; TALAVERA-MAY, C.; FUENTES, G.;
SANTAMARÍA, J. M. Capacity of the aquatic fern (Salvinia minima Baker)
to accumulatehigh concentrations of nickel in its tissues, and its effect on
plantphysiological processes. Aquatic Toxicology, v. 155, p. 142-150, 2014.
GAJEWSKA, E.; SKLODOWSKA, M. Nickel-induced changes in nitrogen metabolism in wheat shoots. Journal of Plant Physiology, v. 166,
p. 1034-1044, 2009.
GABE, U. Teor e disponibilidade para a soja de micronutrientes e
elementos potencialmente tóxicos em fertilizantes minerais e calcários.
1998. 84 p. Tese (Doutorado) – Escola Superior de Agricultura Luiz de
Queiroz, Universidade de São Paulo, Piracicaba, 1998.
GAMMON, N., SHARPE, R. H. Mouse-ear: A manganese deficiency of
pecans. Proceedings of the American Society for Horticultural Science,
v. 68, p. 195-200, 1956.
21
GERENDÁS, J., SATTELMACHER, B. Influence of Ni supply on growth,
urease activity and nitrogen metabolites of Brassica napus grown with
NH4NO3 or urea as N source. Annals of Botany, v. 83, p. 65-71, 1999.
GERENDÁS, J.; SATTELMACHER, B. Significance of Ni supply for growth, urease activity and the concentrations of urea, amino acids and mineral
nutrients of urea-grown plants. Plant and Soil, v. 190, p. 153-162, 1997.
GERENDÁS, J.; zHU, z.; SATTELMACHER, B. Influence of N and Ni
supply on nitrogen metabolism and urease activity in rice (Oryza sativa
L.). Journal of Experimental Botany, v. 49, n. 326, p. 1545-1544, 1998.
GERENDÁS, J.; POLACCO, J. C.; FREYERMUTH, S. K.; SATTELMACHER, B. Significance of nickel for plant growth and metabolism.
Journal of Plant Nutrition and Soil Science, v. 162, p. 241-256, 1999.
GRAHAM, R. D.; WELCH, R. M.; WALKER, C. D. A role for nickel
in the resistance of plants to rust. In: AUSTRALIAN AGRONOMY
CONFERENCE, 3., 1985, Hobart. Annals... Hobart: Australian Society
of Agronomy, 1985. 337 p.
GRATãO, P. L.; POLLE, A.; LEA, P. J.; AzEVEDO, R.A. Making the life
of heavy metalstressed plants a little easier. Functional Plant Biology,
v. 32, p. 481-494, 2005.
GRAUKE, L. J.; MORRIS, H. J.; KOWALCzUK, J. G. Mouse-ear: A
symptom of nutrient imbalance. Proc. Southeastern Pecan Growers
Association, v. 76, p. 141-147, 1983.
HARMSEN, J. Measuring bioavailability: from a scientific approach to standard methods. Journal of Environmental Quality, v. 36, p. 1420-1428, 2007.
HIRAYAMA, C.; SUGIMURA, M.; SAITO, H.; NAKAMURA, M. Purification and properties of urease from leaf of mulberry. Morus alba,
Phytochemistry, v. 53, p. 325-330, 2002.
INOUHE, M. Phytochelatins. Brazilian Journal of Plant Physiology,
v. 17, p. 65-78, 2005.
KABATA-PENDIAS, A.; PENDIAS, H. Trace elements from soil and
plant. 4. ed. New York: CRC Press, Taylor and Francis Group, 2011. 576 p.
KEVRESAN, S.; PETROVIC, N.; POPOVIX, M.; KANDRAC, J. Effect
of heavy metals on nitrate and protein metabolism in sugar beet. Biologia
Plantarum, v. 41, p. 235-240, 1998.
KHAN, M. W.; SALAM, M. A. Interactions of Meloidogyne javanica, Fusarium udum and Rihizobium on pigeon pea in the presence of nickel and
cobalto as pollutants. Annals of Applied Biology, v. 116, p. 549-556, 1990.
KHOSHGOFTARMANESHA, A. H.; HOSSEINIB, F.; AFYUNIA, M.
Nickel supplementation effect on the growth, urease activity and urea and
nitrate concentrations in lettuce supplied with different nitrogen sources.
Scientia Horticulturae, v. 130, p. 381-385, 2011.
KISHORE, G. K.; PANDE, S.; RAO, J. N. Control of foliar diseases of
groundnut using inorganic and metal salts. International Arachis Newsletter, v. 21, p. 33-35, 2001.
KLUCAS, R. V. Nickel, a micronutrient for hydrogen dependent growth
of Rhizobium japonicum and for expression of urease activity in soybean
leaves. Proceedings of the National Academy of Sciences of uSA,
v. 80, p. 2253-2257, 1983.
KOCHIAN, L. V. Mechanisms of micronutrient uptake and translocation
in plants. In: LUXMOORE, R. J. (Ed.). Micronutrients in agriculture.
2. ed. Madison, Wis.: Ed. Soil Sci. Soc. Amer. Inc., 1991. p. 229-296.
KOVACEVIC, G.; KASTORI, R.; MERKULOC, L. J. Dry matter and leaf
structure in young wheat plants as affected by cadmium, lead and nickel.
Biologia Plantarum, v. 42, p. 119-123, 1999.
KRAMER, U.; COTTER-HOWELLS, J. D.; CHARNOCK, J. M.; BAKER,
A. J. M.; SMITH, A. C. Free histidine as a metal chelator in plants that
accumulate nickel. Lett. Nature, v. 379, p. 635-638, 1996.
KRAMER, U.; SMITH, R. D.; WENzEL, W. W.; RASKIN, I.; SALT, D.
E. The role of metal transport and tolerance in nickel hyperaccumulation
by Thlaspi goesingense. Plant Physiology, v. 115, p. 1641-1650, 1997.
KROGMEIER, M. J.; McCARTY, G. W.; BREMNER, J. M. Phytotoxicity
of foliar-applied urea. Proceedings of National Academy of Science,
v. 86, p. 8189, 1989.
22
KUKKOLA, E.; RAUTIO, P.; HUTTUNEN, S. Stress indications in
copper- and nickel-exposed Scots pine seedlings. Environmental and
Experimental Botany, v. 43, p. 197-210, 2000.
KUPPER, H.; LOMBI, E.; zHAO, F. J.; WIESHAMMER, G.; McGRATH, S. P. Cellular compartmentation of nickel in the hyperaccumulators
Alyssum lesbiacum, Alyssum bertolonii and Thlaspi goesingense. Journal
of Experimental Botany, v. 52, p. 2291-3000, 2001.
KUTMAN, B. Y.; KUTMAN, U. B.; CAKMAK, I. Effects of seed nickel
reserves or externally supplied nickel on the growth, nitrogenmetabolites
and nitrogen use efficiency of urea- or nitrate-fed soybean. Plant and Soil,
v. 376, p. 261-276, 2014.
KUTMAN, B. Y.; KUTMAN, U. B.; CAKMAK, I. Nickel-enriched seed
and externally supplied nickel improve growth and alleviate foliar urea
damage in soybean. Plant and Soil, v. 1007, p. 1-15, 2012.
LICHT, O. A. B.; XUEJING, X.; QIN, z.; MIYAzAWA, M.; FERREIRA,
F. J. F.; PLAWIAK, R. A. B. Average reference values of geochemical and
geophysical variables in stream sediments and soils, state of Paraná, Brazil.
Boletim Paranaense de Geociências, v. 58, p. 59-87, 2006.
LOVATT, C. J.; zHENG, Y.; HAKE, K.D. Demonstration of a change in
nitrogen metabolism influencing flower initiation in Citrus. Israel Journal
of Botany, v. 37, p. 181-188, 1988.
MALAN, H. L.; FARRANT, J. M. Effects of the metal pollutants cadmium
and nickel on soybean seed development. Seed Science Research, v. 8,
p. 445-453, 1998.
MALAVOLTA, E.; LEãO, H. C.; OLIVEIRA, S. .; LAVRES JÚNIOR,
L.; MORAES, M. F.; CABRAL, C. P.; MALAVOLTA, M. Repartição de
nutrientes nas flores, folhas e ramos da laranjeira cultivar Natal. Revista
Brasileira de Fruticultura, v. 2, n. 3, p. 506-511, 2006.
MAPA. MINISTéRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO. Instrução Normativa MAPA 5/2007 (D.O.u. 01/03/2007).
Disponível em: <http://www.agricultura.gov.br/vegetal/sanidade-vegetal/
legislacao>. Acesso em: 31 julho de 2014.
MARz, J. Diseases and insect pests of pecans. Fla. Agr. Expt. Sta. Bul.,
v. 147, p. 135-163, 1918.
MARSCHNER, P. Mineral nutrition of higher plants. 3. ed. London:
Academic Press, 2012. 64351 p.
MASSOURA, S. T.; ECHEVARRIA, G.; BECQUER, T.; GHANBAJA,
J.; LECLERC-CESSAC, E.; MOREL, J. L. Control of nickel availability
by nickel bearing minerals in natural and anthropogenic soils. Geoderma,
v. 136, p. 28-37, 2006.
McGRATH, S. P.; SMITH, S. Nickel. In: ALLOWAY. B. J. Heavy metals
in soils. New York: John Wiley, 1990. p. 125-50.
MELO, W. J.; AGUIAR, P. S.; MELO, G. M. P.; MELO, V. P. Nickel in a
tropical soil treated with sewage sludge and cropped with maize in a longterm field study. Soil Biology and Biochemistry, v. 39, p. 1341-1347, 2007.
MILOSEVIC, N.; GOVEDARICA, M.; KASTORI, R.; PETROVIC, N.
Effect of nickel on wheat plants, soil microorganisms and enzymes. Studia
universitatis Babes-Bolyai Biologia, v. 47, n. 1, p. 79-84, 2002.
MINEROPAR. MINERAIS DO PARANÁ S. A. Geoquímica de solo horizonte B: relatório final de projeto. Curitiba, v. 1, 2005a. 408 p.
MINEROPAR. MINERAIS DO PARANÁ S. A. Geoquímica de solo horizonte B: relatório final de projeto. Curitiba, v. 2, 2005b. 449 p.
MISHRA, D., KAR, M. Nickel in plant growth and metabolism. The
Botanical Review, v. 40, p. 395-452, 1974.
MOBLEY, H. L. T.; HAUSINGER, R. P. Microbial ureases: significance,
regulation, and molecular characterization. Microbiological Reviews,
v. 53, n. 1, p. 85-108, 1989.
MOBLEY, H. L. T.; ISLAND, M. D.; HAUSINGER, R. P. Molecular
biology of microbial ureases. Microbiological Reviews, v. 59, n. 3,
p. 451-480, 1995.
MONTARGÈS-PELLETIER, E.; CHARDOT, V.; ECHEVARRIA, G.; MICHOT, L. J.; BAUER, A.; MOREL, J. L. Identification of nickel chelators
in three hyperaccumulating plants: an X-ray spectroscopic study. Phytochemistry, v. 69, p. 1695-1709, 2008.
INFORMAÇÕES AGRONÔMICAS Nº 147 – SETEMBRO/2014
MORAES, M. F.; ABREU JUNIOR, C. H.; LAVRES JUNIOR, J. Micronutrientes. In: PROCHNOW, L. I.; CASARN, V.; STIPP, S. R. (Ed.). Boas
práticas para uso eficiente de fertilizantes. Piracicaba: International Plant
Nutrition Institute, v. 2., 2010. p. 205-278.
RHAMANM, H.; SABREEN, S.; ALAM, S.; KAWAI, S. Effects of
nickel on growth and composition of metal micronutrients in barley
plants grown in nutriente solution. Journal of Plant Nutrition, v. 28,
p. 393-404, 2005.
MUÑOz, A.; RASO, M. J.; PINEDA, M.; PIEDRAS, P. Degradation of
ureidoglycolate in French bean (Phaseolus vulgaris) is catalysed by a ubiquitous ureidoglycolate urea-lyase. Planta, v. 224, n. 1, p. 175-184, 2006.
REBAFKA, F. P.; SCHULz, R.; MARSCHNER, H. Erhebungsuntersuchungen zur pflanzenverfügbarkeit von nickel auf böden mit hohen
geogenen nickelgehalten. Angewandte Botanik, v. 64, p. 317-328, 1990.
NETO, A. P. Metabolismo do nitrogênio e concentração de nutrientes
no cafeeiro irrigado em razão da dose de nitrogênio. 94 p. 2009.
Dissertação (Mestrado) – Escola Superior de Agricultura “Luiz de Queiroz”, Universidade de São Paulo, Piracicaba, 2009.
REEVES, R. D.; BROOKS, R. R.; MacFARLANE, R. M. Nickel uptake
by californian Streptanthus and Caulanthus with particular reference to
the hyperaccumulator S. polygaloides Gray (Brassicacea). American
Journal of Botany, v. 68, p. 708-712, 1981.
NYCzEPIR, A. P.; WOOD, B. W.; REILLY, C. C. Association of Meloidogyne partityla with mouse-ear disorders of pecan in Georgia. Journal
of Nematology, v. 4, p. 272, 2006.
PALACIOS, G.; MATAIX, J. The influence of organic amendment and nickel pollution on tomato fruit yield and quality. Journal of Environmental
Science and Health, Part B, v. 34, p. 133-150, 1999.
PAGE, V.; FELLER, U. Selective transport of zinc, manganese, nickel,
cobalt and cadmium in the root system and transfer to the leaves in young
wheat. Annals of Botany, v. 96, p. 425-434, 2005.
PANDAA, G. C.; DASA, S. K.; BANDOPADHYAYB, T. S.; GUHA, A.
K. Adsorption of nickel on husk of Lathyrus sativus: behavior and binding
mechanism. Colloids Surf B: Biointerfaces, v. 57, p. 135-142, 2007.
PANDOLFINI, T.; GABBRIELI, R.; COMPARINI, C. Nickel toxicity
and peroxidase activity in seedlings of Triticum aestivum L. Plant Cell
Enviroment, v. 15, p. 719-725, 1992.
PAIVA, H. N.; CARVALHO, J. G.; SIQUEIRA, J. O.; FERNANDES, A.
R.; MIRANDA, J. R. P. Efeito da aplicação de doses crescentes de níquel
sobre o teor e o conteúdo de nutrientes em mudas de ipê-roxo (Tabebuia
impetiginosa (Mart) Standley). Scientia Forestalis, n. 63, p. 158-166, 2003.
PAYE, H. S.; MELLO, J. W. V.; ABRAHãO, W. A. P.; FERNANDES FILHO, E. I.; DIAS, L. C. P.; CASTRO, M. L. O.; MELO, S. B.; FRANÇA,
M. M. Valores de referência de qualidade para metais pesados em solos
no Estado do Espírito Santo. Revista Brasileira de Ciência do Solo,
v. 34, p. 2041-2051, 2010.
PENNAzIO, S., ROGGERO, P. Effects of trace elements on the natural
resistance of asparagus bean to tobacco necrosis virus and ethylene production. Advances in Horticultural Science, v. 2., 23-26, 1988.
PONIEDzIAŁEK, M.; SĘKARA, A.; CIURA, J.; JĘDRSzCzYK, E.
Nickel and manganese accumulation and distribution in organs of nine
crops. Folia Horticulturae, v. 17, n. 1, p. 11-22, 2005.
PONIzOVSKY, A. A.; THAKALI, S.; ALLEN, H. E.; DI TORO, D. M.;
ACKERMAN, A. J.; METzLER, D. M. Nickel partitioning in acid soils
at low moisture content. Geoderma, v. 145, p. 69-76, 2008.
POLACCO, J. C. Nitrogen metabolism in soybean tissue culture. Plant
Physiology, v. 59, p. 827-830, 1977.
POLLACCO, J. C.; HOLLAND, M. A. Roles of urease in plant cells.
International Review of Cytology, v. 145, p. 65-103, 1993.
POLLARD, A. J.; POWELL, K. D.; HARPER, H. A.; SMITH, J. Á. C.
The genetic basis of metal hyperaccumulation in plants. Critical Reviews
in Plant Sciences, v. 21, p. 539-566, 2002.
POULIK, z. The danger of accumulation of nickel in cereals oncontaminated soil. Agriculture, Ecosystems and Environment, v. 63, p. 25-29, 1997.
QUANTIN, C.; ETTLER, V.; GARNIER, J.; SEBEK, O. Sources and
extractibility of chromium and nickel in soil profiles developed on Czech
serpentinites. Comptes Rendus Geoscience, v. 340, p. 872-882, 2008.
REEVES, R. D.; BAKER, A. J. M.; BECQUER, T.; ECHEVARRIA, G.;
MIRANDA, z. J. G. The Xora and biogeochemistry of the ultramafic soils
of Goiás state, Brazil. Plant and Soil, v. 293, p. 107-119, 2007.
REILLY, C.; CRAWFORD, M.; BUCK, J. Nickel suppresses daylily
rust, Puccinia hemerocallidis on susceptible daylilys, Hemerocallis in
greenhouse and field trials. (Abstr.). Phytopathology, v. 95, p. S88S88, 2005.
REIS, A.R.; FAVARIN, J. L.; GALLO, L. A.; MALAVOLTA, E.; MORAES,
M. F.; LAVRES JUNIOR, J. Nitrate reductase and glutamine synthetase
activity in coffee leaves during fruit development. Revista Brasileira de
Ciência do Solo, v. 33, p. 315-324, 2009.
REIS, A. R.; FAVARIN, J. L.; GALLO, L. A.; MORAES, M. F.; TEzOTTO, T.; LAVRES JUNIOR, J. Influence of nitrogen fertilization on nickel
accumulation and chemical composition of coffee plants during fruit
development. Journal of Plant Nutrition, v. 34, p. 1853-1866, 2011.
REVOREDO, M. D.; MELO, W. J. Disponibilidade de níquel em solo
tratado com lodo de esgoto e cultivado com sorgo. Bragantia, v. 65,
n. 4, p. 679-685, 2006.
RIESEN, O.; FELLER, U. Redistribution of nickel, cobalt, manganese,
zinc, and cadmium via the phloem in young and maturing wheat. Journal
of Plant Nutrition, v. 28, p. 421-430, 2005.
RODAK, B. W. Níquel em solos e na cultura de soja. 2014. 101 p.
Dissertação (Mestrado) – Universidade Federal do Paraná, Curitiba, 2014.
ROMERO-PUERTAS, M. C.; RODRIGUEz-SERRANO, M.,; CORPAS,
F. J.; GÓMEz, M.; DEL RIO, L. A.; SANDALIO, L. M. Cadmium-induced
subcellular accumulation of O2•- and H2O2 in pea leaves. Plant, Cell and
Environment, v. 27, p. 1122-1134, 2004.
ROVERS, H.; CAMARGO, O. A.; VALADARES, J. M. A. S. Níquel total
e solúvel em DTPA em solos do estado de São Paulo. Revista Brasileira
de Ciência do Solo, v. 7, n. 3, p. 217-220, 1983.
ROS, R.; COOKE, D. T.; BURDEN, R. S.; JAMES, C. S. Effects of the
herbicide MCPA, and the heavy metals cadmium and nickel on lipids
composition, Mg2+- ATPase activity and fluidity of plasma membrane from
rice, Oryza sativa (cv. Bahia) shoots. Journal of Experimental Botany,
v. 41, p. 457-462, 1990.
RUBIO, M. I.; ESCRIG, I.; MARTINEz-CORTINA, C.; LOPEz-BENET,
F. J.; SPANz, A. Cadmium and nickel accumulation in rice plants. Effects
on mineral nutrition and possible interaction of abscisic and gibberellic
acids. Plant Growth Regulations, v. 14, p. 151-157, 1994.
RUTER, J. M. Effect of nickel applications for the control of mouse ear
disorder on river birch. Journal of Environmental Horticulture, v. 23,
n. 1, p. 17-20, 2005.
SABIR, M.; GHAFOOR, A.; SAIFULLAH, M.; REHMAN, z. U.; AHMAD, H. R.; AzIz, T. Growth and metal ionic composition of Zea mays as
affected by nickel supplementation in the nutrient solution. International
Journal of Agriculture and Biology, v. 13, n. 2, p. 186-190, 2011.
RAJAIE, M.; KARIMIAN, N.; YASREBI, J. Nickel transformation in
two calcareous soil textural classes as affected by applied nickel sulfate.
Geoderma, v. 144, p. 344-351, 2008.
SAGNER, S.; KNEER, R.; WANNER, G.; COSSON, J. P.; DEUSNEUMANN, B.; zENK, M. H. Hyperaccumulator, complexation and
distribution of nickel in Sebertia acuminata. Phytochemistry, v. 47, n. 3,
p. 339-343, 1998.
RAO, K. V. M.; SRESTY, T. V. S. Antioxidative parameters in seedling of
pige on pea (Cajanus cajan L.) Millspaugh to zn and Ni stress. Plant
Science, v. 157, v. 1, p. 113-128, 2000.
SAJWAN, K. S.; ORNES, W. H.; YOUNGBLOOD, T. V.; ALVA, A. K.
Uptake of soil applied cadmium, nickel and selenium by bush beans. Water,
Air, Soil Pollution, v. 91, p. 209-217, 1996.
INFORMAÇÕES AGRONÔMICAS Nº 147 – SETEMBRO/2014
23
SANTOS, S. N. Valores de referência de metais pesados em solos de
Mato Grosso e Rondônia. 2011. 101 p. Dissertação (Mestrado) – Escola
Superior de Agricultura “Luiz de Queiroz”, Universidade de São Paulo,
Piracicaba, 2011.
SAUVé, S.; HENDERSHOT, W.; ALLEN, H. E. Solid-solution partitioning of metals in contaminated soils: dependence on pH, total metal
burden and organic matter. Environmental Science and Technology,
v. 34, p. 1125-1131, 2000.
SCHICKLER, H.; CASPI, H. Response of antioxidative enzymes to nickel and cadmium stress in hyperaccumulator plants of Genus, Alyssum.
Physiologia Plantarum, v. 105, p. 39-44, 1999.
SENWO, z. N.; TAzISONG, I. A. Metal contents in soils of Alabama.
Communications in Soil Science and Plant Analysis, v. 35, p. 28372848, 2004.
SERENGIN, I. V.; KOzHEVNIKOVA, A. Physiological role of nickel and
its toxic effects on higher plants. Russian Journal of Plant Physiology,
v. 53, n. 2, p. 257-277, 2006.
SERVENE, B. C. Nickel accumulation by Hybanthus floribundus. Nature,
v. 248, p. 807-808, 1974.
SHEORAN, I. S.; SINGAL, H. R.; SINGH, R. Effect of cadmium and
nickel on photosynthesis and the enzymes of the photosynthetic carbon reduction cycle in pigeonpea (Cajanus cajan L.). Photosynhtesis
Research, v. 23, p. 345-351, 1990.
SIEBIELEC, G,; CHANEY, R. L. Manganese fertilizer requirement to
prevent manganese defi ciency when liming to remediate Ni-phytotoxic
soils. Communications in Soil Science and Plant Analysis, v. 37,
p. 1-17, 2006.
SINHA, A. K. Possible role of phytoalexins inducers chemicals in plant
disease control. In: DANIEL, M.; PURKAYASTHA, R. P. (Ed.). Hanbook of phytoalexin metabolism and action. New York: Marcel Dekker,
1995. p. 555-591.
SINGH, R. K.; SHUKLA, R. R.; DWINVEDI, R. S. Effect of cádmium,
cobalt and nickel salts on the survivability of sclerotia and plant infection
by Sclerotium rolfsii causing root-rot disease of barley. Tropical Science,
v. 332, p. 269-274, 1992.
TAYLOR, G. J.; CROWDER, A. A. Copper and nickel tolerance in Typha
latifolia clones from contaminated and uncontaminated environments.
Canadian Journal of Botany, v. 62, p. 1304-1308, 1984.
TEzOTTO, T.; FAVARIN, J. L.; AzEVEDO, R. A.; ALLEONI, L. R. F.;
MAzzAFERA, P. Coffee is highly tolerant to cadmium, nickel and zinc:
plant and soil nutritional status, metal distribution and bean yield. Field
Crops Research, v. 125, p. 24-34, 2012.
TODD, C. D.; POLLACCO, J. C. Soybean cultivars ‘Williams 82’ and
‘Maple Arrow’ produce both urea and ammonia during ureide degradation.
Journal of Experimental Botany, v. 55, n. 398, p. 867-877, 2004.
UREN, N. C. Forms, reaction and availability of nickel in soils. Advances
in Agronomy, v. 48, p. 141-203, 1992.
VANSELOW, A. P. Nickel. In: CHAPMAN, H. D. (Ed.). Diagnostic
criteria for plants and soils. Riverside: University of California, 1966.
p. 302-309.
VELIKOVA, V.; TSONEV, T.; LORETO, F.; CENTRITTO, M. Changes in
photosynthesis, mesophyll conductance to CO2, and isoprenoid emissions in
Populus nigra plants exposed to excess nickel. Environmental Pollution,
v. 159, p. 1058-1066, 2011.
WALKER, C. D.; GRAHAM, R. D.; MADISON, J. T.; CARY, E. E.; WELCH, R. M. Effects of Ni deficiency on some nitrogen metabolites in cowpeas
(Vigna unguiculata L. Walp.). Plant Physiology, v. 79, p. 474-479, 1985.
WANG, H.; zENG, F.; KANG, J. Resistance to bacterial blight induced by
nickel nitrate in rice seedling. Journal of Hunan Agriculture university,
v. 26, p. 119-121, 2000.
WANG, S.; NAN, z.; LIU, X.; LI, Y.; QIN, S.; DING, H. Accumulation and
bioavailability of copper and nickel in wheat plants grown in contaminated
soils from the oasis, northwest China. Geoderma, v. 152, p. 290-295, 2009.
WELCH, R. M. The biological significance of nickel. Journal of Plant
Nutrition, v. 3, p. 345-356, 1981.
WHITE, P. J. Long-distance transport in the xylem and phloem. In: MARSCHNER, P. (Ed.). Mineral nutrition of higher plants. 3. ed. United States
of America: Elsevier, 2012. p. 49-70.
SINGH, S.; KAYASTHA, A. M.; ASTHANA, R. K.; SINGH, S. P. Response of garden pea to nickel toxicity. Journal of Plant Nutrition, v. 27,
p. 1543-1560, 2004.
WOOD, B. W.; REILLY, C. C. Nickel and plant disease. In: DATNOFF, L. E.; ELMER, W. H.; HUBER, D. M. (Ed.). Mineral nutrition
and plant disease. The American Phytopathological Society, 2007.
p. 215-231.
SMITH, S. R. A critical review of the bioavailability and impacts of heavy
metals in municipal solid waste composts compared to sewage sludge.
Environment International, v. 35, p. 142-156, 2009.
WOOD, B. W.; REILLY, C. C.; NYCzEPIR, A. P. Field deficiency of nickel in trees: symptoms and causes. Acta Horticulturae, v. 721, p. 83-97,
2006.
SMITH, N. G.; WOODBURN, J. Nickel and ethylene involvement in
the senescence of leaves and flowers. Naturwissenschaften, v. 71, n. 4,
p. 210-211, 1984.
WOOD, B. W.; REILLY, C. C.; NYCzEPIR, A. P. Mouse-ear of pecan:
I. Symptomatology and occurrence. HortScience, v. 39, n. 1, p. 87-94,
2004a.
SRESTY, T. V. S.; MADHAVA RAO, K. V. Ultrastructural alterations in
response to zinc and nickel stress in the root cells of Pigeonpea. Environmental and Experimental Botany, v. 41, p. 3-13, 1999.
WOOD, B. W.; REILLY, C. C.; NYCzEPIR, A. P. Mouse-ear of pecan:
II. Influence of nutrient applications. HortScience, v. 39, n. 1, p. 95-100,
2004b.
STANKOVIC, z.; PAJEVIC, S.; VUCKOVIC, M.; STOJANOVIX, S.
Concentrations of trace metals in dominat aquatic plants of the lake Provala.
Biologia Plantarum, v. 43, p. 583-585, 2000.
WOOD, B. W.; REILLY, C. C.; NYEzEPIR, A. P. Mouse-ear of pecan: A
nickel deficiency. HortScience, v. 39, n. 6, p. 1238-1242, 2004c.
SUGHA, S. K.; SING, B. M. Comparative efficacy of fungicides against
blister blight of tea (Exobasidium vexans Masee). Indian Journal of
Mycology and Plant Pathology, v. 20, p. 211-219, 1990.
WORLEY, R. E. Pecan cultivars differ in leaf elemental concentration
of normal and mouse-ear leaf tissue. HortScience, v. 14, p. 51-52, 1979.
SUzUKI, T. Total nitrogen and free amino acids in Morus alba stems
from autumn through spring. Physiologia Plantarum, v. 60, p. 473, 1984.
YANG, X. E.; BALIGAR, V. C.; FOSTER, J. C.; MARTENS, D. C.
Accumulation and transport of nickel in relation to organic acids in ryegrass and maize grown with different nickel level. Plant and Soil, v. 196,
p. 271-276, 1997.
TABATABAEI, S. J. Supplements of nickel affect yield, quality, and
nitrogen metabolism when urea or nitrate is the sole nitrogen source for
cucumber. Journal of Plant Nutrition, v. 32, p. 713-724, 2009.
YUSUF, M.; FARIDUDDIN, Q.; HAYAT, S.; AHMAD, A. Nickel: an
overview of uptake, essentiality and toxicit in plants. Bulletin of Environmental Contamination and Toxicology, v. 86, p. 1-17, 2011.
TAN, X. W.; IKEDA, H.; ODA, M. Effects of nickel concentration in
the nutrient solution on the nitrogen assimilation and growth of tomato
seedlings in hydroponic culture supplied with urea or nitrate as the sole
nitrogen source. Scientia Horticulturae, v. 84, p. 265-273, 2000.
zHENG, Q. L.; NAKATSUKA, A.; MATSUMOTO, T.; ITAMURA, H.
Pre-harvest nickel application to the calyx of ‘Saijo’ persimmon fruit
prolongs postharvest shelf-life. Postharvest Biology and Technology,
v. 42, p.98-103, 2006.
24
INFORMAÇÕES AGRONÔMICAS Nº 147 – SETEMBRO/2014












