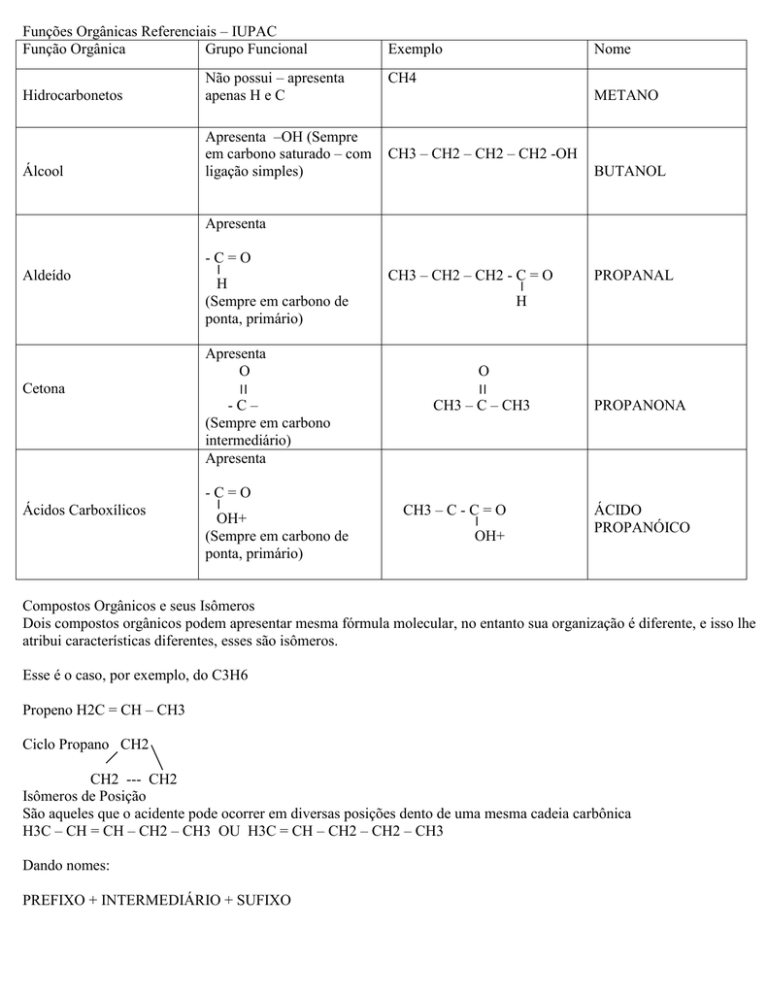
Funções Orgânicas Referenciais – IUPAC
Função Orgânica
Grupo Funcional
Exemplo
Não possui – apresenta
apenas H e C
CH4
Hidrocarbonetos
CH3 – CH2 – CH2 – CH2 -OH
Álcool
Apresenta –OH (Sempre
em carbono saturado – com
ligação simples)
Nome
METANO
BUTANOL
Apresenta
Aldeído
Cetona
Ácidos Carboxílicos
-C=O
׀
H
(Sempre em carbono de
ponta, primário)
Apresenta
O
׀׀
-C–
(Sempre em carbono
intermediário)
Apresenta
-C=O
׀
OH+
(Sempre em carbono de
ponta, primário)
CH3 – CH2 – CH2 - C = O
׀
H
O
׀׀
CH3 – C – CH3
CH3 – C - C = O
׀
OH+
PROPANAL
PROPANONA
ÁCIDO
PROPANÓICO
Compostos Orgânicos e seus Isômeros
Dois compostos orgânicos podem apresentar mesma fórmula molecular, no entanto sua organização é diferente, e isso lhe
atribui características diferentes, esses são isômeros.
Esse é o caso, por exemplo, do C3H6
Propeno H2C = CH – CH3
Ciclo Propano CH2
CH2 --- CH2
Isômeros de Posição
São aqueles que o acidente pode ocorrer em diversas posições dento de uma mesma cadeia carbônica
H3C – CH = CH – CH2 – CH3 OU H3C = CH – CH2 – CH2 – CH3
Dando nomes:
PREFIXO + INTERMEDIÁRIO + SUFIXO
Prefixo (indica número de
C)
1 - Met
2 – Et
3 – Prop
4 – But
5 – Pent
6 – Hex
7 – Hept
8 – Octa
9 – Non
10 – Dec
11 - Undec
Intermediário (tipo de ligação entre C)
Alcanos: - AN (apenas simples)
Alquenos: - EN (1 dupla)
Anquinos: - IN (1 tripla)
- DIEN (2 duplas)
- ENIN (1 dupla e 1 tripla)
Sufixo (a função orgânica da qual
pertence)
- O (HIDROCARBONETOS)
- OL (ALCOOL)
- AL (ALDEÍDOS)
- ONA (CETONA)
- ÓICO ( ÁCIDOS CARBOXÍLICOS
Utilizam-se os prefixos:
- mono, - bi, - tri, - tetra
Para indicar o número de acidentes
Numeração: Regra do Espelho ou dos menores números
1
2
3
4
1
2
3
CH3 – CH2 – CH2 – CH3
OH – CH2 – CH2 – CH3(os números que indicam acidente devem ser os menores)
4
3
2
1
3
2
1
1) Numerar átomos de C que constituem uma cadeia carbônica principal a partir do carbono inicial mais próximo do
acidente prioritário (grupo funcional > insaturação > ramificação)
2) Posicionar o acidente com o número relativo ao C em que ele se encontra, no interior da nomenclatura,
precedendo sua caracterização (intermediário para ligações e sufixo para grupo funcional)
OBS: No caso de um único acidente, o mesmo será posicionado no inicio da nomenclatura. Ramificações são sempre
posicionadas no inicio da nomenclatura.
Quando na presença de isômeros de posição, os acidentes devem ser posicionados obedecendo a regra dos menores
números ou dos espelhos, no interior da nomenclatura. Sempre na ordem de prioridade.
Butenos:
CH2 = CH – CH2 – CH3 1 – Buteno ou But-1-eno
CH3 – CH = CH – CH3 2 – Buteno ou But-2-eno
Alcanos ou Parafinas e seus isômeros
Alcanos CnH2n+2
Eles são hidrocarbonetos derivados do petróleo, que somente apresentam ligações simples. Eles são apolares.
Ex: Metano (1C – lig. simples – HC), Etano (2C – lig. simples – HC) ...
Podem ser de cadeia carbônica normal ou ramificada, e esses podem apresentar isômeros naqueles com n>3
Prefixo para isômeros
n – normal (cadeia normal) não é necessário colocar esse.
Iso – 1eiro isômero (ramificada com carbono terciário (se liga três vezes))
Neo – novo isômero (ramificada com carbono quartenário (se liga quatro vezes))
Alcenos ou Alquenos
Hidrocarbonetos que apresentam uma dupla entre C (são insaturados), e são apolares.
Alquenos: CnH2n o numero que indica a insaturação deve ser o menor possível
Ex: Eteno ou etileno (2C – lig. dupla – HC), Prop-1-eno (3C – lig. dupla no C 1 – HC)
Alcinos ou Alquinos
Hidrocarbonetos que apresentam uma tripla entre C (são insaturados), e são apolares
Alquinos: CnH2n-2
Ex: etino ou acetileno (2C – lig. tripla – HC)
Também seguem a regra de numeração dos menores números.
Alcadienos ou dienos
Hidrocarbonetos com 2 duplas entre C.
Dienos: CnH2n-2 (isômeros dos alquinos)
Ex: buta-1,2-dieno ( 4C – 2 lig. duplas – HC)
Ciclanos ou Cicloalcanos
São hidrocarbonatos cíclicos saturados, que também são apolares.
Ciclanos: CnH2n (isômeros dos alquenos)
Ex: Ciclopropano (Cadeia fechada de 5C – lig. simples – HC)
Cicloalquenos
São hidrocarbonetos cíclicos insaturados por uma dupla entre C.
Clicloalquenos: CnH2n-2 (isômeros dos alquinos e dos dienos)
Ex: Ciclo Propeno (Cadeia fechada de 3C – lig. dupla – HC)
Hidrocarbonetos Aromáticos
São aqueles que apresentam pelo menos 1 anel benzênico ou aromático. Eles são obtidos através do petróleo.
Antes, utilizavam a hulha, um tipo de carvão mineral para obter esses HC.
Através da destilação da hulhas produziam-se 3 fases
1) Sólida – constituída pelo C – coque
2) Liquida – águas amoniacais (HOH + NH3) e o alcatrão, material rico em aromáticos)
3) Gasosa: CO (monóxido de carbono), H2, CH4 (metano)
Aromáticos:
Benzeno (C6H6): Rum núcleo aromático e apresenta ressonância entre ligações duplas e simples
Ramificados do benzeno: CnH2n-6
Naftaleno (C10H8): dois núcleos aromáticos condensados
Ramificados do naftaleno: CnH2n-12
Antraceno (C14H10): três núcleos aromáticos condensados
Ramificados do antraceno: CnH2n-18
Cisão: é o termo empregado para caracterizar a quebra de uma ligação química
Cisões para produção de:
Íons Cisão Heterolítica (heterólise um fica com o elétron)
A *---* B (mais eletronegativo) A+ + BCátion
Anion
Produção de Radicais Livres Cisão Homolítica (homólise cada um fica com seu elétron)
A*---*B A*-- +
B*-- (valências livres)
Homólise ocorre mais em moléculas com ligações apolares
Heterólise ocorre mais em moléculas com ligações polares
Radicais Orgânicos – são provenientes da homólise de uma ligação molecular
-1H
Hidrocarboneto
Radical de hidrocarbonetos
Os radicais recebem designações particulares:
- Derivados de Alcanos
R – H -1H Radicais Alquil(a)
- Derivados de Aromáticos
Ar – H -1H Radicais Aril (a)
Alquil(a)
Formula Geral: Cnh2n+1 --Nomenclatura: Prefixo + il(a)
n
1
2
Alcano
CH4 – METANO
C2H6 – ETANO
3
C3H8 – PROPANO
4
C4H10 – BUTANO
ISOBUTANO
Alquil(a)
CH3 -C2H5 -CRH7 --
C4H9 --
Cadeia
CH3 – (METIL)
CH3 – CH2 – (ETIL)
CH3 – CH2 – CH2 – (PROPIL)
CH3 – CH2 – CH3
׀
(ISOPROPIL OU SECPROPIL)
CH3 – CH2 – CH2 – CH2 – (BUTIL OU N-BUTIL)
CH3 – CH2 – CH – CH3 (SECBUTIL)
׀
CH3 – CH – CH2 – (ISOBUTIL)
׀
CH3
׀
CH3 – C – CH3 (TERC-BUTIL)
׀
CH3 – CH2 – CH2 – CH2 – CH2 – (PENTIL)
CH3 – CH – CH2 – CH2 -- (ISOPENTIL)
׀
CH3
5
C5H12 – PENTANO
ISOPENTANO
NEOPENTANO
CH3 – CH – CH2 – CH2 -- (SECISOPENTIL)
׀
׀
CH3
C2H11 --
׀
CH3 – C – CH3 (TERC-PENTIL)
׀
CH3
CH3
׀
CH3 – C – CH3 (NEOPENTIL)
׀
CH3
Radicais Aril(a) – derivados benzênicos
Fórmula Geral: CnH2n-7
Benzeno -1H FENIL ou FENILA (NÃO É O BENZIL)
Tolueno
CH3
CH2 --
BENZIL(A)
O tolueno pode ter valência livre nos pontos mais próximos do metil (orto), dos intermediários (meta) ou no mais
afastado (para). E segundo esses os radicais ficam: O-TOLUIL, M-TOLUIL, P-TOLUIL
Derivados do Naftaleno Fórmula Geral: C10H13--
α
α
β
β
β
β
α
α
Aqueles radicais onde a valência ta no α, são o α – naftil
Aqueles radicais onde a valência ta no β, são o β – naftil
O radical do etileno é o vinil (a)
O radical do Propeno é o alil(a)
O radical do propino é o propargil(a)
Nomeando Cadeias Ramificadas
1) Identificar a cadeia carbônica principal, que é a mais extensa, desde que apresente o maior numero de acidentes
prioritários
2) Aplicar a regra dos menores números ou do espelho, numerar átomos de carbono que constituem a cadeia
carbônica principal a partir do carbono de ponto mais próximo do acidente
3) Posicionar as ramificações de dar nome da substância que constitui a cadeia principal. Ordenar as ramificações
por ordem crescente de complexidade ou alfabética, empregando prefixos numéricos quando houver mais de uma
Exercícios páginas 480 – 505
Fenol – composto que apresenta –OH (hidroxila) ligado diretamente ao anel aromático
OH
OH
OH
OH
-- CH3
-- CH3
Fenol
2-metilfenol
3-metilfenol
CH3
4-metilfenol
O Fenol é orto-para-dirigente ou seja, por meio de reações, os grupos vão em sua grande maioria para as posições para e
orto. Isso se deve ao fato de o composto (a hidroxila) ser saturada.
Compostos que possuem insaturações, como um ácido, são meta-dirigentes, ou seja, outros radicais se ligarão nas
posições meta.
Os fenóis possuem caráter ácido
Reação de neutralização:
--OH
+ NaOH
Ácido
base
O- Na+
sal
+ H2O
água
Verificando a ocorrência:
Indicador de base,
fenolftaleína (+ ROSA)
FENOL
Fenol
neutralizou
a solução.
NaOH
Presente: na MACONHA: droga que fica no organismo por até 1 semana, para alguém que fuma pela primeira vez.
Causa relaxamento extremo, secura na boca, olhos vermelhos, alteração de humor. Intoxicação química á longo prazo
ansiedade, depressão, desconforto físico, dificuldades de coordenação motora. Uso medicinal para cura p/ câncer.
Remédio derivado da cannabis (planta da qual se produz maconha e haxixe) será utilizado em pacientes com esclerose
múltipla.
A oxidação do cumeno (isopropilbenzeno) é um método industrial para a produção de fenol e acetona (propanona)
1 Cumeno + 1 O2 1 Fenol + 1 Acetona
Exercício de calculo estequiométrico
1) M acet = 58g/mol
DENSIDADEacet = 0,8gml
Calcule a quantidade de cumeno (em mol) que deve ser oxidade para obter 145mL de acetona.
Proporção:
1:1 1:1
1mol de cumeno -------- 1 mol de acetona
1 mol de cumeno ------- 58 g de acetona
0,8g ------ 1 mL
58g --------- x
x = 72,5mL
1 mol de cumeno ------- x mL de acetona
1 mol de cumeno ------- 72,5 mL de acetona
Y mol de cumeno ------- 145 mL de acetona
Y = 2 mol
Éster
Ácido + Álcool --------- Esterificação Éster + H2O
Hidrólise
R–C=O
׀
OH
+ H-O-R
R–C=O
׀
O-R
+ H2O
Nomenclatura dos Ésteres
O ácido terminado em ICO passa para o ânion terminado em ATO + nome do radical que substitui o H (álcool)
Ácido etanóico + butan-1-ol etanoato de butila
Ácido Butanóico + etanol butanoato de etilaa
Ácido etanóico + etanol etanoato de etila (ou acetato de etila)
Ésteres são utilizados como flavorizantes e solventes
Éter – solvente utilizado para produzir cocaína
R – O – R’
Nomenclatura
Prefixo que indica número de carbonos do menor grupo + oxi + hífen + nome do hidrocarboneto do maior grupo
Ou
Éter + 1eiro grupo orgânico (ordem alfabética) + ico e 2ndo grupo orgânico + ico
Ex:
Metoxi-propano
Ou Éter metílico e propílico
Metóxi Metano
Ou Éter dimetílico
Formação de Éter por Desidratação INTERMOLECULAR (entre moléculas)
R – OH
R’ – OH
H2SO4 concentrado (catalisador) R – O – R’
Outro exercício de calculo estequiométrico
Quantas gramas de açúcar para 50L de etanol?
C12 H22 O11 + H2O 4 C2 H5 OH + 4 CO2
Proporção: 1:1 4:4
1 mol de açúcar ---- 4 mol de etanol
342g de açúcar – 4X46g de etanol
X
------ 50L
Resolução 1:
0,8g ------ 1mL
X g -------- 50000mL
X = 40000g
X = 4*104 g
342g de açúcar -----4X46g de etanol
Y
--------- 4*104 g de etanol
1cm3 ---- 1mL
1 dm3 ----1L
1L -----1000mL
Y = 7,4*104g
Y = 74kg
Amina – funções nitrogenadas
-H + R R – NH2 AMINA PRIMÁRIA
NH3 -2H + 2R R – NH – R’ AMINA SECUNDÁRIA
-3H + 3R R – N – R’
׀
R”
AMINA TERCIÁRIA
Presentes nos:
Alcalóides: aminas obtidas a partir de plantas. Provocam efeitos psicológicos diversos, podem curar doenças, gerar
dependência química ou provocar a morte por envenenamento.
Cafeína – estimulante brando presente no nosso dia-dia
Nicotina – estimulante presente no cigarro que provoca dependência química em fumantes
Cocaína: grande poder estimulante por aproximadamente 30min seguidos de intensa depressão
Metanfetamina – estimulante que causa terríveis danos ao sistema nervoso. Tira apetite, grande perda de peso, mudança
de comportamento extrema.
Nomenclatura:
Nome(s) do(s) grupo(s) segundo ordem alfabética + amina
Metilamina
Dimetilamina
Etilisopropilamina
Fenilamina
*** dos prefixos somente o –iso entra na ordem alfabética
Amidas – possuem CARBONILA
O
׀׀
-- C – NH2
Nomenclatura
Nome do hidrocarboneto correspondente (ligado ao carbono) + amida
Atanamida
Pentanamida
4,4-dimetilpentanamida
PS: Uréia
O
׀׀
NH2 -- C – NH2
diamida – adubos nitrogenados
Compostos Orgânicos contendo ao menos um halogênio (-F, -Cl, -Br, -I)
Nomenclatura
Nome do halogênio + nome do hidrocarboneto correspondente
Por questões sonoras o flúor passa a ser fluoro
Ex: clorometano, 2-bromobutano, 2-iodo-2-metil-hexano, 1,3-difluorobenzeno.
O clorofórmio era utilizado em xaropes e produtos farmacêuticos e em cirurgias.
CFC – aerossóis – quebra de O3
DDT – inseticidas – acumulo no corpo












