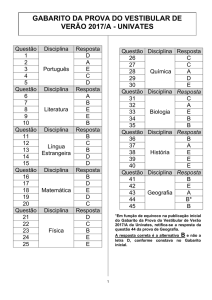
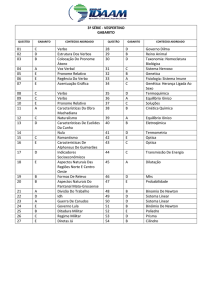
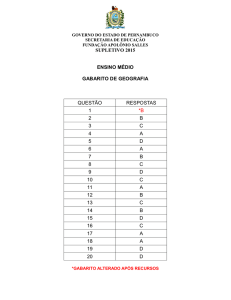
Gabarito das Questões do Projeto – 17/03/2017
1. (Fac. Albert Einstein - Medicin 2017) A temperatura de fusão de compostos iônicos está
relacionada à energia reticular, ou seja, à intensidade da atração entre cátions e ânions na
estrutura do retículo cristalino iônico.
A força de atração entre cargas elétricas opostas depende do produto das cargas e da
distância entre elas. De modo geral, quanto maior o produto entre os módulos das cargas
elétricas dos íons e menores as distâncias entre os seus núcleos, maior a energia reticular.
Considere os seguintes pares de substâncias iônicas:
I. MgF2 e MgO
II. KF e CaO
III. LiF e KBr
As substâncias que apresentam a maior temperatura de fusão nos grupos I, II e III são,
respectivamente,
a) MgO, CaO e LiF.
b) MgF2 , KF e KBr.
c) MgO, KF e LiF.
d) MgF2 , CaO e KBr.
2. (Espcex (Aman) 2016) Compostos iônicos são aqueles que apresentam ligação iônica. A
ligação iônica é a ligação entre íons positivos e negativos, unidos por forças de atração
eletrostática.
(Texto adaptado de: Usberco, João e Salvador, Edgard, Química: química geral, vol 1, pág 225,
Saraiva, 2009).
Sobre as propriedades e características de compostos iônicos são feitas as seguintes
afirmativas:
I. apresentam brilho metálico.
II. apresentam elevadas temperaturas de fusão e ebulição.
III. apresentam boa condutibilidade elétrica quando em solução aquosa.
IV. são sólidos nas condições ambiente (25 C e 1 atm).
V. são pouco solúveis em solventes polares como a água.
Das afirmativas apresentadas estão corretas apenas
a) II, IV e V.
b) II, III e IV.
c) I, III e V.
d) I, IV e V.
e) I, II e III.
3. (Ulbra 2016) No capítulo O Jardim de Mendeleiev, Sacks discorre sobre uma de suas
paixões, a Tabela Periódica. Segundo suas palavras, “A Tabela Periódica era incrivelmente
bela, a coisa mais bela que eu já vira. Eu nunca seria capaz de analisar adequadamente o que
‘beleza’ significava neste caso para mim – simplicidade? Coerência? Ritmo? Inevitabilidade?
Ou talvez a simetria, a abrangência do fato de cada elemento estar firmemente encerrado em
seu lugar, sem lacunas, sem exceções, cada coisa subentendendo todo o resto.” (SACKS, O.
Tio Tungstênio: Memórias de uma infância química. São Paulo: Cia. das Letras, 2002).
Usando a Tabela Periódica dos Elementos, indique se cada afirmação abaixo é Verdadeira ou
Falsa.
Professor JEFFERSON SILVA
Gabarito das Questões do Projeto – 17/03/2017
I. O metal alcalino do terceiro período e o calcogênio de menor massa atômica formam um
composto iônico de fórmula Na2O.
II. O ferro forma dois cátions estáveis: Fe2 e Fe3 . As fórmulas dos cloretos desses cátions
são, respectivamente, Fe2Cl e Fe3Cl.
III. Os elementos carbono, hidrogênio, oxigênio e nitrogênio formam diversos compostos
covalentes, como, por exemplo, a ureia, representada pela fórmula estrutural abaixo.
IV. A fórmula C2H6 O pode representar compostos diferentes como o etanol e o metóximetano.
A sequência correta é:
a) I. Falsa; II. Verdadeira; III. Verdadeira; IV. Falsa.
b) I. Falsa; II. Falsa; III. Verdadeira; IV. Falsa.
c) I. Falsa; II. Verdadeira; III. Falsa; IV. Verdadeira.
d) I. Verdadeira; II. Verdadeira; III. Falsa; IV. Falsa.
e) I. Verdadeira; II. Falsa; III. Verdadeira; IV. Verdadeira.
4. (Ufjf-pism 1 2015) O óxido nitroso (N2O(g) ), também conhecido como gás hilariante, foi o
primeiro anestésico utilizado em cirurgias. Hoje, também pode ser utilizado na indústria
automobilística para aumentar a potência de motores de combustão interna. Abaixo, está
representada uma possibilidade da estrutura de Lewis dessa molécula.
De acordo com a fórmula apresentada, marque a opção que descreve CORRETAMENTE as
ligações existentes no N2O.
a) Uma ligação iônica e duas ligações covalentes simples.
b) Duas ligações covalentes, sendo uma tripla e uma simples.
c) Duas ligações covalentes simples.
d) Duas ligações iônicas.
e) Duas ligações covalentes, sendo uma dupla e uma simples.
5. (Cefet MG 2015) Para a realização de uma determinada atividade experimental, um
estudante necessitou de um material que possuísse propriedades típicas de substâncias
dúcteis, maleáveis, insolúveis em água e boas condutoras térmicas. Um material com essas
propriedades resulta da ligação entre átomos de
a) Cu e Zn.
b) Na e C .
c) Fe e O.
d) F e Xe.
e) C e Si.
6. (Uel 2015) Desde os primórdios da humanidade, há uma busca por entender questões
acerca da origem, do funcionamento e da organização do Universo. Na tentativa de propor
explicações, os cientistas elaboram modelos. Considerando que as propriedades físicoquímicas da matéria, os tipos de ligações e as geometrias moleculares podem ser explicados
Professor JEFFERSON SILVA
Gabarito das Questões do Projeto – 17/03/2017
por meio de modelos atômicos, modelos de ligações e modelos de moléculas, relacione a
coluna da esquerda com a da direita.
II. A água é uma substância molecular,
polar e considerada solvente
universal.
III. O benzeno é uma substância apolar
e líquida em temperatura ambiente.
A. Geometria linear, ligação covalente e
forças intermoleculares do tipo dipolodipolo.
B. Geometria linear, molécula apolar e forças
intermoleculares do tipo dipolo-induzido
dipolo-induzido.
C. Composto aromático e forças do tipo
dipolo-induzido dipolo-induzido.
IV. O HC é um gás em temperatura
ambiente.
D. Alto ponto de fusão e ebulição, composto
formado por ligação iônica.
V. O CO 2 é um gás em temperatura
ambiente.
E. Ligações de hidrogênio e geometria
angular.
I. O NaC é um sólido em temperatura
ambiente.
Assinale a alternativa que contém a associação correta.
a) I-B, II-A, III-C, IV-E, V-D.
b) I-B, II-A, III-E, IV-D, V-C.
c) I-D, II-C, III-E, IV-B, V-A.
d) I-D, II-E, III-C, IV-A, V-B.
e) I-C, II-E, III-B, IV-A, V-D.
7. (Cefet MG 2015) Em uma aula prática, um béquer com uma solução concentrada de ácido
nítrico foi deixado próximo a outro contendo hidróxido de amônio. Entre os béqueres, foi
observada a formação de uma fumaça branca que se depositou sobre a bancada. Sobre o
sólido branco obtido, afirma-se, corretamente, que
a) é insolúvel em água.
b) possui caráter básico.
c) apresenta N com número de oxidação 3 e 5.
d) tem temperatura de ebulição menor que o HNO3 .
e) resulta da condensação do NH4OH e evaporação do HNO3 .
TEXTO PARA A PRÓXIMA QUESTÃO:
Leia o texto para responder à(s) questão(ões).
A história do seriado Breaking Bad gira em torno de um professor de Química do ensino médio,
com uma esposa grávida e um filho adolescente que sofre de paralisia cerebral. Quando é
diagnosticado com câncer, ele abraça uma vida de crimes, produzindo e vendendo
metanfetaminas.
O uso de drogas pode desestabilizar totalmente a vida de uma pessoa, gerando consequências
devastadoras e permanentes. Muitas vezes, toda a família é afetada.
As metanfetaminas são substâncias relacionadas quimicamente com as anfetaminas e são um
potente estimulante que afeta o sistema nervoso central.
(http://tinyurl.com/pffwfe6. Acesso em: 13.06.2014. Adaptado)
8. (Fatec 2015) Considere os elementos químicos e seus respectivos números atômicos,
representados na figura.
Professor JEFFERSON SILVA
Gabarito das Questões do Projeto – 17/03/2017
Esses elementos podem formar o composto
a) molecular, BaBr.
b) molecular, BaBr2 .
c) iônico, BaBr.
d) iônico, BaBr2 .
e) iônico, Ba2Br.
9. (Unimontes 2014) O caráter iônico de determinadas substâncias, em função da diferença de
eletronegatividade, está apresentado a seguir.
Em análise do gráfico, a alternativa CORRETA é:
a) O iodeto de lítio é o sal de maior caráter iônico.
b) O cloreto de césio tem predominante caráter covalente.
c) O ácido fluorídrico apresenta menor força ácida.
d) A maior diferença de eletronegatividade deve-se ao HI.
10. (Uece 2014) Considere quatro elementos químicos representados por: G, J, X e Z.
Sabendo-se que os elementos J e G pertencem ao mesmo grupo da tabela periódica, e que os
elementos J, X e Z apresentam números atômicos consecutivos, sendo X um gás nobre, é
correto afirmar-se que
a) os elementos J e G apresentam potenciais de ionização idênticos por possuírem o mesmo
número de elétrons no último nível.
b) o composto formado por J e Z é iônico e sua fórmula química é ZJ.
c) o composto formado por G e Z é molecular e sua fórmula química é ZG 2.
Professor JEFFERSON SILVA
Gabarito das Questões do Projeto – 17/03/2017
d) o composto JX apresenta ligação coordenada.
11. (Unesp 2014) Três substâncias puras, X, Y e Z, tiveram suas condutividades elétricas
testadas, tanto no estado sólido como no estado líquido, e os dados obtidos encontram-se
resumidos na tabela.
Substância
X
Y
Z
Conduz corrente elétrica no estado
sólido
líquido
Sim
Sim
Não
Sim
Não
Não
Com base nessas informações, é correto classificar como substância(s) iônica(s)
a) Y e Z, apenas.
b) X, Y e Z.
c) X e Y, apenas.
d) Y, apenas.
e) X, apenas.
12. (Espcex (Aman) 2012) A tabela abaixo apresenta alguns dos produtos químicos existentes
em uma residência.
Sal de cozinha
Um dos componentes
do produto
Cloreto de sódio
Açúcar
Sacarose
Refrigerante
Ácido Carbônico
H2CO3
Limpa-forno
Hidróxido de sódio
NaOH
Produto
Fórmula do
componente
NaC
C12H22O11
Assinale a alternativa correta:
a) O cloreto de sódio é um composto iônico que apresenta alta solubilidade em água e, no
estado sólido, apresenta boa condutividade elétrica.
b) A solução aquosa de sacarose é uma substância molecular que conduz muito bem a
corrente elétrica devido à formação de ligações de hidrogênio entre as moléculas de
sacarose e a água.
c) O hidróxido de sódio e o cloreto de sódio são compostos iônicos que, quando dissolvidos em
água, sofrem dissociação, em que os íons formados são responsáveis pelo transporte de
cargas.
d) Soluções aquosas de sacarose e de cloreto de sódio apresentam condutividade elétrica
maior que aquela apresentada pela água destilada (pura), pois existe a formação de
soluções eletrolíticas, em ambas as soluções.
e) O ácido carbônico é um diácido, muito estável, sendo considerado como ácido forte, não
conduz corrente elétrica.
13. (Upe 2012) Em uma feira de ciências, apresentou-se um vídeo que mostrava,
simultaneamente, três experimentos diferentes (I, II e III), conforme indicados a seguir. Em
cada recipiente, havia: I – Solução de cloreto de sódio; II - Cloreto de sódio sólido; III – Cloreto
de sódio fundido.
Professor JEFFERSON SILVA
Gabarito das Questões do Projeto – 17/03/2017
Passados alguns instantes, percebeu-se que se acendeu (acenderam) apenas a(s) lâmpada(s)
a) I.
b) II.
c) III.
d) I e II.
e) I e III.
14. (Ufmg 2009) Certo produto desumidificador, geralmente encontrado à venda em
supermercados, é utilizado para se evitar a formação de mofo em armários e outros ambientes
domésticos.
A embalagem desse produto é dividida, internamente, em dois compartimentos - um superior e
um inferior. Na parte superior, há um sólido branco iônico - o cloreto de cálcio, CaCℓ2.
Algum tempo depois de a embalagem ser aberta e colocada, por exemplo, em um armário em
que há umidade, esse sólido branco desaparece e, ao mesmo tempo, forma-se um líquido
incolor no compartimento inferior.
As duas situações descritas estão representadas nestas figuras:
Considerando-se essas informações e outros conhecimentos sobre os materiais e os
processos envolvidos, é correto afirmar que:
a) O CaC 2 passa por um processo de sublimação.
b) O
CaC
2
tem seu retículo cristalino quebrado.
c) O líquido obtido tem massa igual à do
d) O líquido obtido resulta da fusão do
CaC
CaC
2
2
.
.
15. (Udesc 2009) Os atributos químicos são índices importantes que caracterizam a qualidade
da água. Os principais são: a medida de compostos iônicos, a medida da avaliação da
produtividade de nutrientes e os conteúdos orgânicos.
Assinale a alternativa CORRETA em relação aos compostos iônicos.
a) O KCℓ é um óxido por isso não se dissolve em água.
b) O KCℓ quando dissolvido em água não conduz a corrente elétrica, é considerado um não
eletrólito.
Professor JEFFERSON SILVA
Gabarito das Questões do Projeto – 17/03/2017
c) O KCℓ não é um composto iônico.
d) O KCℓ quando dissolvido em água conduz a corrente elétrica, é considerado um eletrólito
forte.
e) O KCℓ é considerado uma base, pois sofre dissociação quando solubilizado em água.
16. (Pucmg 2007) Para o estudo das relações entre o tipo de ligação química e as
propriedades físicas das substâncias X e Y, sólidas à temperatura ambiente, foram realizados
experimentos que permitiram concluir que:
- A substância X conduz corrente elétrica no estado líquido, mas não no estado sólido.
- A substância Y não conduz corrente elétrica em nenhum estado.
Considerando-se essas informações, é CORRETO afirmar que:
a) a substância X é molecular e a substância Y é iônica.
b) a substância X é iônica e a substância Y é metálica.
c) a substância X é iônica e a substância Y é molecular.
d) as substâncias X e Y são moleculares.
Professor JEFFERSON SILVA
Gabarito das Questões do Projeto – 17/03/2017
Gabarito:
Resposta da questão 1:
[A]
Como a energia reticular é diretamente proporcional ao produto dos módulos das cargas dos
íons e inversamente proporcional às distâncias entre os núcleos, assim, os produto dos
módulos das cargas:
Produto dos módulos
das cargas
2 1 2
MgF2 :
Grupo I
MgO :
22 4
KF:
Grupo I
CaO :
1 1 1
22 4
Como flúor e oxigênio pertencem ao mesmo período e potássio e cálcio também, eles
apresentam o mesmo número de camadas eletrônicas e a diferença entre seus raios é muito
pequena, então, irão apresentar as maiores temperaturas de fusão em seus respectivos
grupos, de acordo com os cálculos acima: o MgO e o CaO.
Produto dos módulos
das cargas
LiF :
Grupo III
KBr :
1 1 1
1 1 1
Para o grupo III, o brometo de potássio apresentam raio maior que o fluoreto de lítio, pois, a
distância entre os núcleos será menor no LiF e este composto apresenta maior temperatura de
fusão.
Resposta da questão 2:
[B]
[I] Incorreta. Não apresentam brilho metálico.
[II] Correta. Apresentam elevadas temperaturas de fusão e ebulição devido às forças
eletrostáticas.
[III] Correta. Apresentam boa condutibilidade elétrica quando em solução aquosa ou fundidos.
[IV] Correta. São sólidos nas condições ambiente (25 C e 1 atm).
[V] Incorreta. São solúveis em solventes polares como a água, sendo que esta solubilidade
pode variar muito.
Resposta da questão 3:
[E]
[I] Verdadeira.
Metal alcalino do 3ºP Na.
Calcogênio de menor massa O.
Composto: Na2O
[II] Falsa. As fórmulas dos cloretos desses cátions serão: FeC
2
e FeC 3 .
[III] Verdadeira. Por apresentarem 4e , 1e , 6e e 5e , respectivamente, esses elementos
formam diferentes compostos covalentes (tendência a compartilhar elétrons), no caso do
Professor JEFFERSON SILVA
Gabarito das Questões do Projeto – 17/03/2017
hidrogênio, ele tende a compartilhar 1e- para ficar semelhante ao gás nobre He, que
estabiliza com apenas 2e , os demais tendem a ficar com 8e- na camada de valência.
[IV] Verdadeira. A fórmula molecular: C2H6 O, poderá formar compostos como o etanol (álcool)
e o metóxi-metano (éter), formando isômeros de função.
H3C CH2 OH e H3C O CH3
(e tanol)
(éter)
Resposta da questão 4:
[B]
Resposta da questão 5:
[A]
[A] Correta. A mistura dos metais cobre e zinco, por ligação metálica, forma o latão, que é
insolúvel em água, porém, um bom condutor térmico, dúctil e maleável (25 C e 1 atm).
[B] Incorreta. A ligação entre sódio e cloro forma o composto iônico cloreto de sódio (NaC ),
um sólido solúvel em água que não é bom condutor térmico, nem dúctil e nem maleável
(25 C e 1 atm).
[C] Incorreta. A ligação entre ferro e oxigênio, forma o composto Fe2 O3 , um sólido iônico não
condutor de eletricidade, não dúctil e não maleável (25 C e 1 atm).
[D] Incorreta. O flúor e xenônio formam o hexafluoreto de xenônio (XeF6 ), um composto
molecular cristalino que não é bom condutor térmico, nem dúctil, nem maleável (25 C e
1 atm).
[E] Incorreta. Carbono e silício ligados formam compostos sólidos covalentes ou moleculares
que não apresentam as propriedades citadas no texto (25 C e 1 atm).
Resposta da questão 6:
[D]
[I] O NaC é formado por ligações iônicas, explicando o fato de possuir altos pontos de fusão e
ebulição. (D)
[II] A água é uma substância formada por ligações covalentes do tipo ligações de hidrogênio,
com geometria angular, sendo considerada um solvente universal. (E)
[III] O benzeno (composto aromático) é uma substância apolar (dipolo induzido-dipolo induzido)
e líquido a temperatura ambiente. (C)
[IV] O HC é um gás à temperatura ambiente, possui geometria linear, apresenta ligações
covalentes polares do tipo dipolo-dipolo. (A)
[V] O CO 2 é um gás em temperatura ambiente, possui geometria linear, com ligações
covalentes apolares do tipo dipolo-induzido dipolo-induzido. (B)
Resposta da questão 7:
[C]
Professor JEFFERSON SILVA
Gabarito das Questões do Projeto – 17/03/2017
HNO3(aq) NH4OH(aq) NH4NO3(aq) H2O( )
[A] Incorreta. O nitrato de amônio, formado na reação é solúvel (todos os nitratos são solúveis
em água);
[B] Incorreta. Como o sal formado é derivado de um ácido forte e uma base fraca, o sal
formado, possui caráter ácido;
[C] Correta.
NH4
x 1(4) 1
x 3
NO3
x 6 1
x 5
[D] Incorreta. O ácido nítrico é um ácido volátil, formado por ligações covalentes, portanto,
possui temperatura de ebulição menor que o nitrato de amônio, que é um composto iônico.
[E] Incorreta. O sólido formado é resultado da reação entre o NH4 OH e o HNO3 .
Resposta da questão 8:
[D]
Os elementos bromo (Br) e bário (Ba) podem formar o composto iônico BaBr2 .
2
2
6
2
6
2
10
4p6 5s2 4d10 5p6 6s2
56 Ba : 1s 2s 2p 3s 3p 4s 3d
2
: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
56 Ba
2
2
6
2
6
2
10
4p5
35 Br : 1s 2s 2p 3s 3p 4s 3d
2
2
6
2
6
2
10
4p6
35 Br : 1s 2s 2p 3s 3p 4s 3d
Ba2Br Br (BaBr2 )
Resposta da questão 9:
[C]
[A] Incorreta. O sal de maior caráter iônico é o fluoreto de lítio.
[B] Incorreta. O cloreto de césio, de acordo com o gráfico, possui um alto caráter iônico.
[C] Correta. Entre os ácidos ilustrados no gráfico, o fluorídrico possui a menor força entre eles.
[D] Incorreta. A maior diferença de eletronegatividade é aquele que possui o maior caráter
iônico.
Resposta da questão 10:
[B]
J e G pertencem ao mesmo grupo da tabela periódica, logo apresentam o mesmo número de
elétrons de valência.
Os elementos J, X e Z apresentam números atômicos consecutivos, sendo X um gás nobre:
J z 1 (grupo 17 Halogênio)
X (gás nobre) z (grupo 18)
Z z 1 (grupo 1 Metal alcalino)
Professor JEFFERSON SILVA
Gabarito das Questões do Projeto – 17/03/2017
O composto formado por um metal alcalino (Z) e um halogênio (J) é iônico e sua fórmula pode
ser representada por: [Z ][J ] ou ZJ.
Resposta da questão 11:
[D]
Com base nessas informações, é correto classificar como substância iônica apenas Y, pois
compostos iônicos conduzem corrente no estado líquido, mas não no estado sólido, pois neste
caso os íons ficam retidos na rede cristalina.
Resposta da questão 12:
[C]
Análise das alternativas:
a) Incorreta. O cloreto de sódio é um composto iônico que apresenta alta solubilidade em água
e, no estado sólido, não apresenta condutividade elétrica, pois os íons ficam retidos na rede
cristalina.
b) Incorreta. A solução aquosa de sacarose é uma substância molecular que não conduz a
corrente elétrica, pois não ocorre dissociação iônica.
c) Correta. Teremos as seguintes dissociações iônicas do hidróxido de sódio e do cloreto de
sódio em água:
NaOH(aq) Na (aq) OH (aq)
NaC (aq) Na (aq) C (aq)
Os íons são responsáveis pelo transporte de cargas.
d) Incorreta. Não existe a formação de soluções eletrolíticas, em ambas as soluções, pois a
solução de sacarose não sofre dissociação iônica.
e) O ácido carbônico é um diácido instável, sendo considerado como ácido fraco.
Resposta da questão 13:
[E]
Soluções de cloreto de sódio e cloreto de sódio fundido apresentam íons livres, logo conduzem
eletricidade.
No cloreto de sódio sólido, os íons ficam retidos no retículo cristalino e o circuito não é fechado.
Resposta da questão 14:
[B]
O
CaC
2
tem seu retículo cristalino quebrado pela ação da água absovida do ambiente.
Resposta da questão 15:
[D]
Resolução:
Análise das alternativas:
a) Alternativa incorreta. O KCℓ é um sal de metal alcalino e se dissolve em água.
b) Alternativa incorreta. O KCℓ quando dissolvido em água conduz a corrente elétrica, por isso é
considerado um eletrólito.
+
c) Alternativa incorreta. O KCℓ é um composto iônico formado pelos íons K e Cl .
d) Alternativa correta. O KCℓ quando dissolvido em água conduz a corrente elétrica, é
considerado um eletrólito forte. Observe a figura a seguir.
Professor JEFFERSON SILVA
Gabarito das Questões do Projeto – 17/03/2017
e) Alternativa incorreta. O KCℓ é considerado um sal comum ou normal.
Comentário:
Quando misturamos um ácido com uma base ocorre uma reação química denominada
neutralização ou salificação. Nesta reação ocorre a formação de água e de outra substância
que é composta por um cátion derivado da base e por um ânion derivado do ácido. Observe e
esquema a seguir.
Esta outra substância formada (CA), além da água, é denominada sal.
ÁCIDO + BASE ÁGUA + SAL
Na verdade podemos dizer que a formação do sal é decorrência da neutralização do cátion H
+
derivado do ácido pelo ânion OH derivado da base, ou seja, H + OH HOH.
+
Resposta da questão 16:
[C]
Professor JEFFERSON SILVA
Gabarito das Questões do Projeto – 17/03/2017
Resumo das questões selecionadas nesta atividade
Data de elaboração:
Nome do arquivo:
13/03/2017 às 23:01
Liessin_Projeto_UERJ
Legenda:
Q/Prova = número da questão na prova
Q/DB = número da questão no banco de dados do SuperPro®
Q/prova Q/DB
Grau/Dif.
Matéria
Fonte
Tipo
1 ............. 165612 ..... Elevada ......... Química ......... Fac. Albert Einstein - Medicin/2017
escolha
Múltipla
2 ............. 148598 ..... Média ............ Química ......... Espcex (Aman)/2016 ........... Múltipla escolha
3 ............. 155932 ..... Média ............ Química ......... Ulbra/2016 ........................... Múltipla escolha
4 ............. 158404 ..... Baixa ............. Química ......... Ufjf-pism 1/2015 ................... Múltipla escolha
5 ............. 140448 ..... Elevada ......... Química ......... Cefet MG/2015..................... Múltipla escolha
6 ............. 136823 ..... Média ............ Química ......... Uel/2015............................... Múltipla escolha
7 ............. 140450 ..... Média ............ Química ......... Cefet MG/2015..................... Múltipla escolha
8 ............. 157042 ..... Média ............ Química ......... Fatec/2015 ........................... Múltipla escolha
9 ............. 134213 ..... Elevada ......... Química ......... Unimontes/2014 ................... Múltipla escolha
10 ........... 129447 ..... Elevada ......... Química ......... Uece/2014............................ Múltipla escolha
11 ........... 128373 ..... Média ............ Química ......... Unesp/2014.......................... Múltipla escolha
12 ........... 117003 ..... Média ............ Química ......... Espcex (Aman)/2012 ........... Múltipla escolha
13 ........... 112302 ..... Média ............ Química ......... Upe/2012 ............................. Múltipla escolha
14 ........... 106858 ..... Não definida .. Química ......... Ufmg/2009 ........................... Múltipla escolha
15 ........... 87123 ....... Não definida .. Química ......... Udesc/2009 .......................... Múltipla escolha
16 ........... 74814 ....... Não definida .. Química ......... Pucmg/2007 ......................... Múltipla escolha
Professor JEFFERSON SILVA