AVALIAÇÃO HISTOLÓGICA DO TRATO INTESTINAL DO ASTYANAX
BIMACULATUS ALIMENTADO COM RAÇÃO SUPLEMENTADA COM
PROBIÓTICO
Autores: Klayton MORAES1, Gabriel F. A. JESUS2 Adolfo JATOBÁ3.
Identificação autores: 1 – Bolsistas PIBIC/NPq, 3 – Pesquisador da UFSC; 4 – Orientador IFC-Campus Araquari.
Introdução
O conhecimento em sanidade é um dos aspectos mais importantes na produção
de organismos aquáticos, pois, um meio no qual a disseminação de patógenos ocorre
com alta velocidade, riscos quanto à morbidade e mortalidade aumentam, e
consequentemente ocasionam grandes perdas na piscicultura (MARTINS, 1995;
ROMANO, 1995).No Brasil, o crescimento da piscicultura intensiva vem associado ao
aumento da incidência de doenças nos sistemas de produção (COSTA, 2003).
Entre os agentes causadores de enfermidades, os parasitas têm destaque por
serem oportunistas e abrirem portas para micro-organismos oportunistas. Seus surtos de
mortalidade estão diretamente relacionados com a não realização de manejos sanitários,
assim como, má qualidade de água e erro no manejo alimentar (AUSTIN, 2007).
Atualmente, os probióticos são ferramentas utilizadas na prevenção de diversas
enfermidades, principalmente de origem bacteriana. Na aquicultura, para fins didáticos,
podem ser divididos em três grandes grupos: leveduras, bactérias Gram negativas e
Gram positivas. Dentre as bactérias Gram positivas, há o interesse no uso das bactérias
ácido-lácticas devido a sua capacidade de inibir o crescimento de bactérias patogênicas
pela produção de compostos antibacterianos, como os ácidos orgânicos (FULLER,
1989), sua ação imunoestimulante (VIEIRA et al., 2008), e sua capacidade de produzir
enzimas digestivas, como protease e fitase (BOGATYRENKO et al., 2010).
Entre os efeitos benéficos observados aos peixes alimentados com dietas
probióticas pode se destacar a alteração na microbiota intestinal dos animais, melhoria
no sistema hemato-imunológico (CARNEVALI et al, 2006; JATOBA et al.,2008;
VIEIRA et al 2008), assim como a alteração na ultraestrutura do trato intestinal dos
peixes, como observados em trabalhos anteriores em diferentes espécies como Tilápia
do Nilo (MELLO et al.,2013) e com os Surubins híbridos (JESUS, 2014).
O objetivo deste trabalho foi avaliar as alterações histológicas, no trato
digestório, do lambari do rabo amarelo (A. bimaculatus) alimentados com dieta
probiótica (Lactobacillus sp.).
Material e Métodos
Foi utilizada uma cepa de bactérias ácido-lática presente no cepário do
Laboratório de Aquicultura do Instituto Federal Catarinense, campus Araquari. A cepa
foi isolada e selecionada de acordo com o projeto intitulado: “Seleção de probióticos
para lambari e sua especificidade com os hospedeiros” aprovados em edital 081/2012
PIBI-TI/PIBIC/PIBIC-Af/CNPq/IFC. E 24 juvenis de lambari do rabo amarelo
(Astyanax bimaculatus) provenientes do IFC Araquari.
As dietas experimentais foram preparadas de acordo com os protocolos
estabelecidos por Jatobá et al. (2008; 2011), sendo que as dietas probióticas receberam
um inóculo de 10% (meio de cultura mais bactéria), enquanto as dietas controles
receberam apenas o meio estéril.
Os 24 lambaris foram distribuídos em oito caixas de polietileno (22 L), 3
peixes cada, equipadas com sistema de recirculação de água e filtro biológico. E
distribuídos em dois tratamentos (peixes alimentados com dieta suplementada com
probiótico e peixes alimentados com dieta sem suplementação), em delineamento
inteiramente ao acaso, com quatro repetições.
O oxigênio dissolvido e temperatura foram mensurados duas vezes ao dia, e
pH semanalmente. Os peixes foram alimentados quatro vezes ao dia com 3% da sua
biomassa.
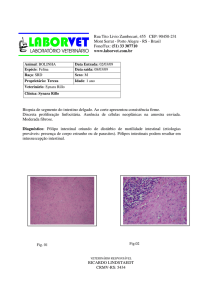
Para avaliação histológica, amostras da região anterior do intestino médio dos
lambaris, região de maior absorção de nutrientes, foram extirpadas a partir de três
peixes por unidade experimental (da Silva et al., 2010). As amostras dos diferentes
tratamentos, fragmentos dos trato foram fixados em solução de paraformaldeído 2.5 %
em tampão fosfato 0.1 M, pH 7.2, overnight (Schmidt et al., 2009). Após a fixação, as
amostras foram lavadas e desidratadas em séries crescentes de etanol. Após a
desidratação, as amostras foram infiltradas em historesina (LeicaHistoresin, Heidelberg,
Alemanha). Secções com 5 μm de espessura foram corados com H&E, e fotografados
com o microscópio Epifluorescent (Olympus BX 41), equipado com o sistema de
captura Imagem Q Capture Pro 5.1 Software (Qimaging Corporation, Austin, TX,
Estados Unidos da América). Utilizando as imagens, foram mensurados: comprimento,
largura e perímetro das vilosidades (μ); número de vilos e número de células
caliciformes por vilosidade.
Os dados foram submetidos a análise de Bartlett e ao teste “t”, todas as
análises com 5% de probabilidade
Resultados e discussão
Na microscopia óptica, o grupo probiótico mostrou diferenças morfológicas
em comprimento, largura e perímetro das vilosidades em comparação com o grupo não
suplementado (Tabela 1). Todas as seções intestinais examinados pareciam normais e
saudáveis, sem sinais de enterócitos destacados e necrose. O mesmo efeito foi
verificado por Gisbert et al. (2013), que suplementou alevinos de truta arco-íris
(Oncorhynchusmy beijo) com Bacillus cereus por 93 dias. Estes peixes apresentaram
vilosidades maiores do que aqueles alimentados com a dieta controle.
A suplementação com probióticos podem melhorar comprimento das
vilosidades e/ou perímetro. Uma relação perímetro maior indica maior área de
superfície, resultados em relação à absorção de nutrientes podem ser encontrados em
outro estudo em que a tilápia (Oreochromis niloticus) foi alimentada com Lactobacillus
rhamnosus durante 30 dias (Pirarat et al. 2011).
Aumento morfometria intestinal pode estar relacionado com a capacidade das
bactérias probióticas de inibir a adesão de bactérias patogênicas com epitélio intestinal,
protegendo, desta forma as vilosidades e as superfícies absorventes contra toxinas
irritantes produzidos por micro-organismos patogénicos (Ukena et al., 2007) .
Tabela 1. Comprimento, largura e perímetro do vilo do Lambari do rabo
amarelo (Astyanax bimaculatus) suplementado com Lactobacillus sp.
Suplementado (probiótico) e controle (dieta não suplementada).
Tratamento
Comprimento (mm) Largura (mm) Perímetro (mm)
Controle
189,0 ± 6,6
67,6 ± 4,8
418,9 ± 12,4
Probiótico
201,3 ± 3,6*
74,9 ± 2,2*
459,0 ± 26,0*
Significância (p)
0,023701
0,038026
0,038026
*Indica diferença significativa entre os tratamentos no teste “t”.
Conclusão
O probiótico (Lactobacillus sp.) alterou positivamente a microbiota do lambari
do rabo amarelo (Astyanax bimaculatus).
Referências
AUSTIN, Brian; AUSTIN, Dawn A. Bacterial fish pathogens: disease of farmed and
wild fish. Springer Science & Business Media, 2007.
BOGATYRENKO, E. A.; BUZOLEVA, L. S.; CHI, Z. Potential probiotics of the Far
Eastern trepang Apostychopus japonicus producing digestive enzymes. Microbiology,
v. 79, n. 2, p. 173-177, 2010.
COSTA, Andréa Belém. Caracterização de bactérias do complexo Aeromonas
isoladas de peixes de água doce e sua atividade patogênica. 2003. Tese de
Doutorado. Universidade de São Paulo.
Food and Agriculture Organization of the United Nations (FAO), 2015. The state of
world fisheries and aquaculture, Rome, Italia, 230 pp.
FULLER, Ray. A review. J. appl. Bacteriol, v. 66, p. 365-378, 1989.
GISBERT, E. et al. var. promotes growth, affects the histological organization and
microbiota of the intestinal mucosa in rainbow trout fingerlings. Journal of animal
science, v. 91, n. 6, p. 2766-2774, 2013.
JATOBÁ, Adolfo et al. Diet supplemented with probiotic for Nile tilapia in polyculture
system with marine shrimp. Fish physiology and biochemistry, v. 37, n. 4, p. 725-732,
2011.
JATOBÁ, Adolfo et al. Lactic-acid bacteria isolated from the intestinal tract of Nile
tilapia utilized as probiotic. Pesquisa Agropecuária Brasileira, v. 43, n. 9, p. 12011207, 2008.
JESUS, Gabriel Fernandes Alves. Weissella cibaria e sua ação probiótica no trato
intestinal de surubins híbridos. 2014. 88 f. Dissertação (Mestrado) -Curso de
Aquicultura, Universidade Federal de Santa Catarina, Florianópolis, 2014
MARTINS, M. L. EFFECT OF ASCORBIC-ACID DEFICIENCY ON THE
GROWTH, GILL FILAMENT LESIONS AND BEHAVIOR OF PACU FRY
(PIARACTUS-MESOPOTAMICUS HOLMBERG, 1887). Brazilian Journal of
Medical and Biological Research, p. 563-568, 1995.
MELLO, Hurzana de et al. Efeitos benéficos de probióticos no intestino de juvenis de
Tilápia-do-Nilo. Pesquisa Veterinária Brasileira, p. 724-730, 2013.
Ministério da pesca e aquicultura (MPA). Participação da aquicultura no setor
pesqueiro nacional. Agosto de 2011. Disponível em: <http://www.mpa.gov.
br/index.php/aquiculturampa/informacoes/producao.html.>. Acesso em 15/02/2015.
PIRARAT, N. et al. Modulation of intestinal morphology and immunity in nile tilapia
(Oreochromis niloticus) by Lactobacillus rhamnosus GG.Research in veterinary
science, v. 91, n. 3, p. e92-e97, 2011.
PORTO-FORESTI, Fabio et al. . Biologia e criação do lambari-do-rabo-amarelo
(Astyanax altiparanae). In: BALDISSEROTTO, Bernardo; GOMES, Levy de Carvalho.
Espécies Nativas Para Piscicultura No Brasil. Santa Maria: Ufsm, 2010. p. 101-115.
ROMANO, L.A.Imunologia, hematologia y patologia hemolinfóide de vertebrados
aquáticos. Fundacion Bar-Ilan, p.15, 1995.
SILVA, Lilian Carolina Rosa da et al. Productive performance and intestinal
morphology of
Nile
tilapia
juvenile
fed diets with
L-glutamine
and
L-
glutamate. Revista Brasileira de Zootecnia, v. 39, n. 6, p. 1175-1179, 2010.
UKENA, Sya N. et al. Probiotic Escherichia coli Nissle 1917 inhibits leaky gut by
enhancing mucosal integrity. PloS one, v. 2, n. 12, p. e1308, 2007.
VIEIRA, Felipe do Nascimento et al. Time-related action of Lactobacillus plantarum in
the
bacterial
microbiota
of
shrimp
digestive
tract
and
its
action
immunostimulant. Pesquisa Agropecuária Brasileira, v. 43, n. 6, p. 763-769, 2008.
as