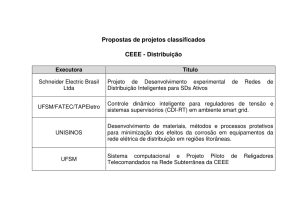
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
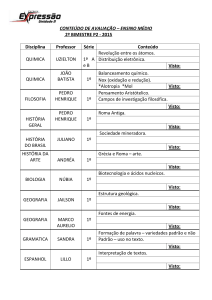
QUIMICA ORGÂNICA BÁSICA
Enolatos & Enaminas
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Formação de um ânion enolato
• Aníons Enolatos são formados por tratar com base
um aldeído, uma cetona ou éster a qual tenha pelo
menos um hidrogênio a,
O
CH3 -C- H + N aOH
O Na +
O
H C C-H + H 2 O
H C C-H
H
H
Ânion
enolato
An
enolate
anion
– A carga negativa (densidade eletrônica )
do enolato está no oxigênio.
oxigênio
Carbono reativo
www.ufsm.br/quimica_organica
2
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Anion Enolato
• Aníons Enolatos são nucleófilos em reações SN2 e
em reações de adição a carbonila
O
SN2
– R
R
R
AnEnolato
enolate
Ânion
anion
Adição a
carbonila
+ R'
R R
Haleto
de alquila
A 1° haloalkane
ouor
sulfonato
sulfonate
– R +
R
Ânion
An
enolate
anion
Enolato
R' + Br
R
SN 2
O
R
Br
O
Substituição
nucl
eophil ic
Nucleofílica
substitution
R'
Adição
nucl
eophil ic
Nucleofílica
addition
O
R'
A
ketone
Cetona
O
O
R
R'
R'
R R
A
tetrahedral tetraédrico
carbonyl
Intermediário
addition intermediate
www.ufsm.br/quimica_organica
3
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
A Reação Aldólica
• A mais importante reação do ânion enolato é
adição nucleofílica ao grupo carbonila de
outra molécula de composto iguais ou
diferentes.
– Catálise: Catálise Base é mais comum, embora o
ácido também funciona. Ânions enolatos só
existem em meio básico.
www.ufsm.br/quimica_organica
4
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
A Reação aldólica
•
O produto de uma reação aldólica:
– b-hidroxialdeído.
ácido
OH
O
O
H
O
a
N aOH
b
CH3 - C-H + CH2 - C-H
CH3 - CH- CH 2 -C- H
Acetaldehyde
Acetaldehyde
3-Hydroxybutanal
(a b-hydroxyal dehyde;
– ou b-hidroxicetona.
ácidoracemic )
O
H
O
CH3 -C-CH3 + CH2 -C-CH3
Acetone
Acetone
OH
O
b a
CH3 -C-CH2 -C-CH3
CH3
4-Hydroxy-4-meth yl-2-p entanone
(a b-hydroxyketone)
Ba(OH) 2
www.ufsm.br/quimica_organica
5
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Mecanismo: reação aldólica, meio básico
• Reação aldólica catalisada por base (bom nucleófilo)
Etapa 1: Formação de um ânion enolato estabilizado por ressonância.
H- O
O
+ H- CH2 - C-H
p Ka 20
(weaker aci d)
H- O-H +
O
CH2 - C-H
pK a 15.7
(stronger aci d)
O
CH2 = C- H
An
enolate
anion
Aníon
enolato
Etapa 2: Adição de carbonila dá um ânion intermediário.
O
O
O
O
CH3 -C-H +
CH2 -C-H
CH3 -CH-CH2 -C-H
A tetrahed al carbon yl
additiona intermediate
Etapa 3: Transferência de prótons para -O- completa
reação aldólica.
www.ufsm.br/quimica_organica
6
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Mecanismo: a reação aldólica: catálise ácida
• Antes indicar o mecanismo lembrar que é necessário:
– Em uma molécula o carbono b deve ter características nucleofílicas
para fornecer um par de elétrons.
– Em uma segunda molécula o grupo carbonila deve funcionar como
eletrófilo.
– Uma ou outra molécula devem ser suficientemente reativas.
www.ufsm.br/quimica_organica
7
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Mecanismo: a reação aldólica e a catálise ácida
• Reação aldólica catalisada por ácido (bom eletrófilo)
– Etapa 1: Catalisada por ácido equilíbrio de formas ceto e enol.
O
CH3 - C-H
OH
HA
CH2 = C- H
Carbono
Nucleofílico
– Passo 2: transferência de Próton HA, ao grupo carbonila de uma
segunda molécula de aldeído ou cetona.
O
CH3 -C-H + H A
H
O
CH3 -C-H + A
Carbonila Reativa
baixa Energia LUMO (p* C=O)
www.ufsm.br/quimica_organica
8
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Mecanismo: a reação aldólica e catálise ácida
– Etapa 3: Ataque do enol de uma molécula no grupo carbonila
protonada da outra molécula.
H
H
O
O
CH3 -C-H + CH2 =C-H + :A-
OH
O
CH3 -CH-CH2 -C-H + H-A
racêmico
(racemic)
– Etapa 4: Transferência de prótons para A- completa a reação.
Isto pode parecer um pouco estranho, mas comparar com
Etapa lenta
www.ufsm.br/quimica_organica
9
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Os produtos da reação Aldol: Desidratação de alceno
– Produtos da reação aldólica são muito facilmente
desidratados para aldeídos ou cetonas a,b-insaturados
OH
O
CH3 CHCH 2 CH
Aquecimento
em
warm
in either
meio ácido ou básico
aci d or base
O
b
a
CH3 CH= CH CH + H2 O
An
ab-unsaturated
Aldeído
a,b-insaturado
aldehyde
– Reações aldólicas são reversíveis e muitas vezes a b-hidroxicarbonila está presente em pequena concentração no
estado de equilíbrio.
– A Keq para a desidratação é geralmente grande.
– Se as condições de reação favorecem a desidratação, bom
rendimento de produto pode ser obtido.
www.ufsm.br/quimica_organica
10
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reações aldólicas cruzadas
• Em uma reação aldólica cruzada, um tipo de molécula
fornece o ânion enolato e outro tipo fornece o grupo
carbonila.
O
O
NaOH
CH3 CCH3 + HCH
Ha ácido
Não tem
Ha ácido
O
CH3 CCH2 CH2 OH
4-Hyd roxy-2-b utanone
www.ufsm.br/quimica_organica
11
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reações aldólicas cruzadas
• Reações aldólicas cruzadas são mais bem sucedidas se
– um dos reagentes não tiver hidrogênio a e,
consequentemente, não forma um aníon enolato,
O
CHO
HCH
Formaldeído
Benzaldeído
Formald
ehyde Benzaldehyde
CHO
a
CHO
O
2,2-Dimetilpropanalanal
Furfural
Furfural
2,2-Dimethylprop
– Um reagente com um hidrogênio mais ácido que o outro
(próximo slide)
– Outro exemplo é um aldeído que tenha um grupo
carbonila mais reativo.
www.ufsm.br/quimica_organica
12
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reações aldólicas cruzadas, Nitro ativação
• Grupos nitro podem ser introduzidos através de uma reação aldólica
usando um nitroalcano.
O
O
+ H-CH2 -N
HO
O
H-O-H + CH2 -N
O
Nitrometano
N itromethane
pKapK
10,2
a 10.2
Ácido
forteacid)
(stronger
CH2 =N
O
O
ânion
Água
Water
Resonance-stabilized
an ion
estabilizado
por
ressonância
pKa
15,7
p Ka 15.7
Ácido
fraco
(w eaker
acid)
– Grupos nitro podem ser reduzidos a aminas 1ª.
O
HO
+ CH3 NO2
HO
CH2 NO2
CH2 NH2
H2 , Ni
NaOH
( aldol)
Cyclohex- Nitrometano
N itroCicloexanona
an on e
meth ane
1-(N
itromethyl)1-(nitrometil)
cyclohexanol
cicloexanol
www.ufsm.br/quimica_organica
1-(A
min omethyl)1-(Aminometil)
cycloh
exanol
cicloexanol
13
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reações aldólicas intramolecular
– Reações aldólicas intramolecular são bem sucedidas na
formação de anéis de cinco e seis membros.
– Considerar 2,7-octadiona, que tem 2 Carbonos a
a
O
a
O
O
a
-H2 O
KOH
O
2,7-octadiona
2,7-Octanedione
O
HO
Produto
obtido
(formed)
O
a
O
-H2 O
KOH
OH
O
(n otformada
formed)
Não
www.ufsm.br/quimica_organica
14
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Síntese: Análise Retrosintética
Dois padrões para avaliar
b-hidroxi-carbonila
Carbonila ab-insaturada
R1 a R4 = alquila, arila, H.
Produto de reação aldólica
Padrão: Reconhecer
Carbonila ab-insaturada
R1 a R4 = alquila, arila, H.
Análise
Molécula alvo
racêmico
www.ufsm.br/quimica_organica
reagentes
15
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Exemplo:
Analise Retrosintética
Molécula alvo
Aldol Misto
reagentes
racêmico
Benzaldeído
(sem H a )
www.ufsm.br/quimica_organica
16
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Condensação de Claisen, substituição de éster
• Ésteres também formam ânions enolato que participam na
substituição nucleofílica.
O
2 CH3 COEt
Ethyl
ethan
oate
Acetato
de Etila
(Ethyl acetate)
O
O
+ EtOH
CH3 CCH2 COEt
2 . H2 O, HCl
Eth
yl 3-oxobutanoate
Ethanol
Etanol
Acetoacetato
de Etila
(Ethyl acetoacetate)
-
1 . EtO Na
+
– O produto de uma condensação de Claisen é um b-cetoéster.
C
O
O
b a
C C C
OR
Reconhecimento
A b-cetoéster
b -ketoest er
www.ufsm.br/quimica_organica
17
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Condensação de Claisen
– Claisen condensação do propanoato de etila
O
O
OEt
Ethyl de
Propanoato
propan oate
etila
+
-
OEt
1 . Et O Na
+
O
OEt + EtOH
2 . H2 O, HCl
Ethyl
Propanoato
de
propan
oate
etila
O
Eth yl 2-methyl-32-Metil-3-oxopentanoato
oxopen tan oate
de etila
(racemic)
Esta é a parte do enolato do éster que
substitui o grupo alcoxi da molécula de éster.
(racêmico)
Rainer Ludwing Claisen
Nasceu 04/01/1851-Colonia, Alemanha
Faleceu 05/01/1930 (78 anos)
Condensação e rearranjo sigmatrópico
www.ufsm.br/quimica_organica
18
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Condensação de Claisen
Etapa 1: Formação de um ânion enolato.
Et O -
O
+ H CH -COEt
2
pK =22
pKa
a = 22
(w eaker
acid)
Ácido
fraco
OO
EtOH + CH2 -COEt
CH2 =COEt
pK a 15.9 Res on ance-s tab ilized enolate anion
pKa = 16
Aníon estabilizado por
(stronger
Ácido
ressonância
acid )forte
Passo 2: Ataque do ânion enolato em um carbono carbonila
forma um intermediário tetraédrico.
O
CH 3 -C- OEt +
O
CH 2 -COEt
O
-
O
CH3 - C-CH2 -C- OEt
OEt
A tetrahedral carbo ny l
add itio n in term ediate
www.ufsm.br/quimica_organica
19
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Condensação de Claisen
Etapa 3: intermediário dá uma b-cetoéster e um íon alcóxido.
O
O
CH3 -C-CH2 -C-OEt
O
O
CH3 -C-CH2 -C-OEt + Et O
OEt
Passo 4: Uma reação ácido-base leva ao produto.
Este consumo de base deve ser neutralizado.
O
O
Et O + CH3 -C-CH-C-OEt
H
pKaa=10.7
10,7
pK
Ácido
(stron
gerforte
acid)
O
O
CH3 -C-CH-C-OEt + Et OH
www.ufsm.br/quimica_o rganica
pKa15.9
= 16
pK
a
Ácido fraco
(weaker
acid)
20
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Condensação de Claisen intramolecular:
- Condensação de Dieckman
O
Et O
-
1 . Et O Na
OEt
O
Di ethyl hexanedioate
Adipato de Dietila
(Diethyl adipate)
+
2 . H2 O, HCl
O
O
OEt
Ácido
+
Et OH
Ethyl 2-oxocyclo2-oxociclopentacarboxilato
pentanecarboxylate
de etila
Walter Dieckman
Nasceu 8 Outubro 1869 -Hamburgo, Alemanha
Faleceu 12/01/1925 (55 anos) em Munich
Instituição : BASF
www.ufsm.br/quimica_organica
21
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Condensação cruzada de Claisen
• Condensação de Claisen cruzadas entre dois ésteres
diferentes, as duas contendo hidrogênios-a, forma mistura de
produtos e geralmente não é usada.
• Mas se o éster não tem um hidrogênio-a a reação de Claisen
cruzada é usada.
O
HCOEt
O
EtOCOEt
Carbonato
Formiato
Eth yl de D
ieth yl
de Dietila
Dietila
formate
carbonate
OO
EtOC-COEt
Oxalato
de Dietila
D iethyl
ethaned
ioate
(D iethyl oxalate)
O
COEt
Benzoato
de etila
Ethyl
ben zoate
sem hidrogênio-a
www.ufsm.br/quimica_organica
22
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Condensação cruzada de Claisen
– O éster sem hidrogênio-a é geralmente usado em excesso.
O
Ph
O
OCH3
+
Benzoato de
Meth yl
Metila
benzoate
Usado em excesso
-
1 . CH3 O Na
OCH3 2 . H2 O, HCl
Propanoato
Meth yl
de Metila
p ropan oate
www.ufsm.br/quimica_organica
O
+
Ph
O
OCH3
2-metil-3-oxo-3-fenilMethyl
2-meth yl-3-oxoPropanoato
de Metila
3-ph enylprop
anoate
(racemic)
23
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Condensação de Claisen
• Condensação de Claisen é uma rota para obter cetonas através de
descarboxilação
Reactions
1 Claisen
& 2: Claisen
condensation
lowed
by acidification.
Reação
decondensation
Claisen
seguida
de
acidificação
Reactions
11:&Condensação
condensation
fol lowed
byfol
acidification.
Reactions
12:&
2: Claisen
fol
lowed
by acidification.
O
O O
+O O O O O O
++
1
.
Et
O
Na
1 . Et O Na
1 . Et O Na
+ Et OH
OEt OEt
OEt + Et OH
OEt+ Et
OH
2
.
H
O,
HCl
OEt 222. . HH2O,
OEt
O,HCl
HCl
2
Reactions 3 & 4: Saponi fication and acidification
Reação
2: Saponificação
efication
acidificação
Reactions
Saponi
ficationand
and
acidification
Reactions
33&&4:4:Saponi
acidification
O O
O O
O
O OO 3 . Na OH, H O, he a t
OO
OOH
O
2
+
Et
OEt
D he
3. .Na
NaOH,
OH,H2HO,
a ta t OH
2 O,he
+ OH
Et OH
+ Et
4OEt
. H32 O,
HCl
OHOH
OEt
HCl
44. .HH
O,O,HCl
22
Reaction 5: Thermal decarboxylation.
Reação
térmica
Reaction
5:Thermal
Thermaldecarboxylation.
decarboxylation.
Reaction
5:
O 3:ODescarboxilação
O
O
OO
O OH
5 . he at
Datat
55. .he
he
OH
OH
+
CO
O O2
+ +
COCO
2 2
www.ufsm.br/quimica_organica
24
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Condensação de Claisen
O Produto da condensação de Claisen, consta de saponificação,
acidificação e descarboxilação e forma uma cetona.
from the ester
from the ester
Parte
do éstering
quethe
reagiu
Partefurnish
do éster ing
que reagiu
the
furnish
fornecendo
enolato
fornecendo
grupo
carbonila
carbonyl
group
enolateânion
anion
s everal
O
O
O
steps
R-CH2 -C-CH2 -R + 2 HOR' + CO2
R-CH2 -C + CH2 -C-OR'
OR' R
Notar que esta reação de Claisen (não cruzada) a cetona obtida é simétrica.
Claisen Cruzada produz cetonas não simétricas.
www.ufsm.br/quimica_organica
25
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Lembrando aminas primárias reagem com carbonilas formando
bases de Schiff (iminas), RN=CR2.
Amina Primária
Mas aminas secundárias reagem formando enaminas
Amina Secundária
Enaminas e iminas, são bases de Schiff
Hugo Schiff
Nasceu 26/04/1834 -Frankfurt, Alemanha
Faleceu 08/09/1915 (81 anos) em Florence, Itália
Foi orientado de Wöhler
www.ufsm.br/quimica_organica
26
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Formação de Enaminas
•
Enaminas são formadas pela reação entre uma amina 2° e o
grupo carbonila de aldeído ou cetona.
– A amina 2° geralmente usada para preparar enaminas são
pirrolidina e morfolina.
O
N
H
Pyrrolidine
Pirrolidina
N
H
Morpholine
Morfolina
www.ufsm.br/quimica_organica
27
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Formação de Enaminas
– Exemplos:
O
H
+
+
+
N
N
H
-H2 O
OH
H
An enamine
– Enamina
Pirrolidina
O
O
O
+
N
H
Morfolina
H
N
O
+
+
N
OH
H
-H2 O
N
en amin e
– An
Enamina
www.ufsm.br/quimica_organica
28
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Enaminas – Alquilação na posição a.
• O valor de enaminas é que o carbono a é nucleofílico.
– Enaminas reagem SN2 com metila e haloalcanos 1°,
a-halocetonas e a-haloesteres.
– Tratamento da enamina com um equivalente do agente
alquilante forma um halo-imínio.
O
O
••
N
+
The morph olin e
en amin e of
cyclohexan on e
Br
SN2
3-Bromopropene
(Allyl bromide)
N
Br
An iminiu m
bromid e
(racemic)
www.ufsm.br/quimica_organica
29
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Compare os mecanismos da reação aldólica catalisada por ácido
e da enamina
H
H
OH
O
O
CH3 -C-H + CH2 =C-H + :A-
O
CH3 -CH-CH2 -C-H + H-A
(racemic)
racêmico
O
O
••
N
+
The morph olin e
en amin e of
cyclohexan on e
Br
SN2
3-Bromopropene
(Allyl bromide)
N
Br
An iminiu m
bromid e
(racemic)
www.ufsm.br/quimica_organica
30
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Enaminas – Alquilação
– Hidrólise do haleto do íon imínio forma um aldeído ou
uma cetona alquilada.
O
+
N Br-
O
O
HCl/ H 2 O
+
+
N ClH
H
2-alillyl cyclo2-Al
Morphol
inium
Cloridrato
cicloexanona
morfolinio
hexanone
chloride
Em geral o processo utiliza o carbonos alfa da cetona como
nucleófilos nas reações de substituição
www.ufsm.br/quimica_organica
31
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Enaminas – Acilação na posição a
– Enaminas sofrem acilação quando tratados com cloretos de
ácido e anidridos de ácidos.
N
Isto poderia ser feito através de uma
reação de Claisen cruzada seguido de
descarboxilação.
O
+
CH3 CCl
Acetyl
Cloretochdeloride
acetila
+
Cl N
-
O
O
O
HCl
+
H2 O
A n iminium
Cloreto
de Imínio
chlorid e
(racêmico)
(racemic)
+
N ClH H
2-acetil
2-Acetylcyclocicloexanona
hexan on e
(racêmico)
(racemic)
www.ufsm.br/quimica_organica
32
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Ester Acetoacético
• A síntese de éster acetoacético (AAE) é útil para a preparação de
cetonas mono e disubstituídas dos seguintes tipos:
O
O
CH3 CCH2 COEt
de Etila
EthylAcetoacetato
acetoacetate
(Acetoacetic ester)
RX
O
CH3 CCH2 R A mon
os ubs tituted
Acetona
acetone
monosubstituída
O
CH3 CCHR
R'
Acetona
A dis
ubs tituted
Disubstituída
acetone
Principais pontos:
Hidrogênio ácido, proporcionando um centro nucleofílico.
Carboxila para ser removida termicamente
Derivado de um haleto
www.ufsm.br/quimica_organica
33
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Ester Acetoacetico
• A estratégia de síntese do éster malônico (EM) é idêntica a síntese do
éster acetoacético, exceto que a matéria-prima é um a-diéster, ao invés
de um a-cetoéster
O
CH3 CCH2 R A mon
os ubs tituted
Acetona
O
O
acetone
monosubstituída
RX
CH3 CCH2 COEt
O
Ethyl
acetoacetate
Acetona
CH3 CCHR A disAcetona
ubs tituted
(Acetoacetic
ester)
Disubstituída
Disubstituída
acetone
R'
Principais pontos
Hidrogênio ácido, proporcionando um centro nucleofílico.
Carboxila para ser removido termicamente
Derivado de um haleto
www.ufsm.br/quimica_organica
34
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Ester Malônico
• Considere a síntese da molécula alvo:
O
These
two carbons
2 Carbonos
do Malonato
are from
diethyl malon ate
de Dietila
MeO
OH
5-Methoxyp
entanoic acid
Ácido 5-metoxipentanoico
Reconhecer como ácido acético substituído.
Síntese de éster Malônico
www.ufsm.br/quimica_organica
35
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Ester Malônico
1. Trate o éster malônico com um alcóxido de metais alcalinos.
Na+
COOEt
+
COOEt
D ieth ylde
malon
ate
Malonato
Dietila
pKa 13,3pK a 13.3
(s tronger
Ácido
forte acid)
-
EtO Na
+
Sodiu
mde
Etóxido
ethoxide
sódio
COOEt
+
EtOH
COOEt
Etanol
Sodiu
m s alt of
Eth anol
sal
de sódio
dieth
yl malonate pKap 15,9
Ka 15.9
do Malonato
(ác.
fraco)acid)
(w eaker
2. Alquilação com um haleto de alquila.
Na
MeO
Br
+
COOEt
+
SN2
MeO
COOEt
www.ufsm.br/quimica_organica
COOEt +
Na+ BrCOOEt
36
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Ester Malônico
3. Hidrolisar e acidificar.
MeO
COOEt 3. NaOH, H2 O
4. HCl, H2 O
COOEt
MeO
COOH + 2EtOH
COOH
4. Descarboxilação.
MeO
COOH heat
COOH
COOH + CO
2
MeO
Ácido
5-metóxido pentanóico
5-Methoxypentanoic
acid
www.ufsm.br/quimica_organica
37
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reação de Michael, com carbonilas a-insaturados
• Reação de Michael : a adição nucleofílica de um ânion enolato
de uma carbonila a-insaturados.
Exemplo:
EtOOC
O
+
COOEt
Buten-2-ona
Malonato
de yl
dietila
Dieth
3-Buten-2-one
prop anedioate
(Methyl vinyl
Padrão:
(D iethyl malonate)
k eton e)
-
O
+
Et O Na
EtOOC
EtOH
COOEt
Nucleófilo –C–C–CO (nitrila ou nitro)
Arthur Michael
Nasceu 07/08/1853 –New York, USA
Faleceu 08/02/1942 (88 anos) em Orlando
atuou nos laboratórios de August Wilhelm Hofmann, (Berlin)
Robert Bunsen, Würtz e Dimitri Mandeleiv in St Pitsburg
www.ufsm.br/quimica_organica
38
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reação de Michael
These Types of ab-Unsaturated
Compostosare
ab-insaturados
Compounds
Nucleophil e
Aceptores
de
Michael
Acceptors in Michael Reactions
O
CH2 = CHCH
O
CH2 = CHCCH3
O
CH2 = CHCOEt
O
CH2 = CHCNR2
CH2 = CHC N
CH2 = CHN O2
Aldeído
Aldehyde
Cetona
Ketone
Éster
Ester
Amide
Amida
Nitrila
Ni trile
Nitro
Ni tro Composto
compound
These Types of Compounds
Compostos
Nucleofílicos
Provi de Effective
Nucl eophil es
Na
Michael
forReação
MichaeldeReactions
O
O
CH3 CCH2 CCH 3
O
O
CH3 CCH2 COEt
O
CH3 CCH2 CN
O
O
Et OCCH2 COEt
N
CH3 C= CH2
b-Diketone
b-Dicetona
b-Ketoester
b-Cetoéster
b-Ketonitri
le
b-Cetonitrila
b-Diéster
b-Diester
Enamina
Enamine
Amina
N H3 , RNH2 , R2 NH Amine
www.ufsm.br/quimica_organica
39
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reação de Michael meio básico
Exemplo:
O
O
-
EtO Na
+
O
+
O
EtOH
COOEt
Eth
yl 3-oxobutanoate
Acetoacetato
de etila
(Ethyl acetoacetate)
2-Cyclohexen
on e
2-Cicloexenona
COOEt
– A ligação dupla, de carbonila a b-insaturados é ativado para
ataque pelo Nucleófilo.
O
O
O
+
+
Carbono mais positivo
www.ufsm.br/quimica_organica
40
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Mecanismo: Reação de Michael
• Mecanismo
1: Nucleófilo; Transferência de próton para a
base.
N u-H + :B
Base
N u: + H- B
2: Adição de Nu: - ao carbono b do composto
carbonílico insaturados.
O
Nu
+
C C C
O
Nu C C
C
Nu C C
O
C
Resonance-stabilized enolate anion
www.ufsm.br/quimica_organica
41
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reação de Michael
Etapa 3: Transferência de prótons de HB forma um enol.
1
O
Nu C C C
O-H
+
4
H-B
3 2
Nu C C C
+
B
A n enol
Etapa 4: Tautomerismo da forma(amenos
dodition)
enol para a
p rodu ctestável
of 1,4-ad
forma ceto mais estável.
O-H
Nu C C C
Enol:
forma
menos
Less
stable
enestável
ol form
H
Nu C C
O
C
Ceto:
forma
mais
estávelform
More
stab
le keto
www.ufsm.br/quimica_organica
42
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reação de Michael: 1,4 vs 1,2
– Enaminas e ânions enolato estabilizados por ressonância são bases
fracas, reagem lentamente com um compostos carbonílicos abinsaturados e formam produtos de adição 1,4.
– Reagentes Organolítios e Grignard, por outro lado, são bases
fortes, se adiciona rapidamente aos grupos carbonilicos dando
principalmente 1,2-adição.
-
O
+
Ph O Li
PhLi +
4-metil-3Phenyl4-Methyl-3Fenil-lítio
lithiu m
penpenten-2-ona
ten-2-one
www.ufsm.br/quimica_organica
Ph OH
H2 O
HCl
4-Methyl-2-phen
4-metil-2-fenil- yl3-penten -2-ol
3-penten-2-ol
43
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reação de Michael: Termodinâmica x Cinética
O
C C C
rápido
fast
-
ROH
+ ROC C C
Nu
adiçãoition
1,2
1,2-Add
(menos
(les s stab
leestável
prod)uct)
Nu
O
- +
Nu:
C C C
s low
lento
OH
-
O
Nu C C C
ROH
H
O
Nu C C C
+
-
RO
1,4-Add
ition
adição 1,4
(more(mais
stable
p)rodu ct)
estável
Adição do nucleófilo é irreversível quando carbonos nucleófilos são fortemente
básicos (produto cinético)
www.ufsm.br/quimica_organica
44
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reação Michael-Aldol combinada
a b-insaturado
Carbanion
O
O 1 . Na OEt , Et OH
+
(Michael
reaction)
(Reação de
Michael )
COOEt
Ethyl 2-oxocyclohex2-oxocicloexano
anecarboxylate
carboxilato
de etila
3-Buten-2-one
3-buten-2-ona
(Methyl vinyl
ketone)
O
O
COOEt
O
2 . Na OEt , Et OH
(Aldol reaction)
(Reação
Aldol)
Dieckman
www.ufsm.br/quimica_organica
COOEt
45
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reação Michael-Aldol combinada
O
O 1 . Na OEt , Et OH
+
(Michael reaction)
COOEt
2-oxocicloexano
Ethyl
2-oxocyclohexcarboxilato
de etila
anecarboxylate
3-buten-2-ona
3-Buten-2-one
(Methyl vinyl
ketone)
O
O
COOEt
(Reação de Michael )
O
2 . Na OEt , Et OH
(Reação
Aldol)
(Aldol
reaction)
COOEt
Anelação de Robson
Robert Robinson
Nasceu 13/09/1886 –Derbyshire, Inglaterra
Faleceu 08/02/1975 (88 anos) em Buckinghamshire
Foi orientado de Willian H Perkin
www.ufsm.br/quimica_organica
46
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reação de Michael
– Enaminas também participam em reações de Michael.
O
N
1 . CH2 =CHCN
CN
2 . H2 O, HCl
Pyrrolidin
e enamine
Pirrolidina
enamina
Da cicloexanona
of cycloh
exanone
+
N
+
H
-
Cl
H
(racemic)
(racêmico)
www.ufsm.br/quimica_organica
47
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reagentes de Gilman x outros organometálicos
• Reagentes de Gilman submetem-se a adição conjugada
em aldeídos e cetonas insaturados. Reação intimamente
relacionada com a reação de Michael.
O
O
1 . ( CH3 ) 2 CuLi, Éter,
eth er,-78ºC
-78°C
CH3
3-Methyl-2cyclohexenone
2 . H2 O, HCl
CH3
CH3
3,3-D imethylcyclohexanone
– Reagentes de Gilman são únicos entre os compostos
organometálicos em que eles dão quase exclusivamente adição 1,4.
– Outros compostos organometálicos, incluindo reagentes de
Grignard, se adicionam ao carbono carbonílico em adição 1,2.
www.ufsm.br/quimica_organica
48
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reações de Enolatos usando LDA
• Com uma base forte o suficiente, a formação do ânion
enolato pode ser conduzida à conclusão.
• A base mais comumente usada para essa finalidade é a
diisopropilamida de lítio, LDA.
• LDA é preparado dissolvendo-se diisopropilamina em THF e
tratando a solução com Butil lítio.
[ ( CH3 ) 2 CH] 2 N H + CH3 ( CH2 ) 3 Li
Di
isopropyl amine
Diisopropilamida
Butyllithium
Butil
lítio
(pK
40
(pKa 40) a
(stronger
base
forte base)
(stronger
Ácido
forte aci d)
[ ( CH3 ) 2 CH] 2 N - Li + + CH3 ( CH2 ) 2 CH 3
Lítio dii sopropylamde Butano
Butane
Lithium
pK a 50
Diisopropilamida
(weaker base)
(pKa 50)
(weaker aci d)
Ácido fraco
LDA
www.ufsm.br/quimica_organica
49
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reações de Enolatos usando LDA
• A reação aldólica cruzada entre acetona e um aldeído pode ser realizada
com sucesso pela adição de acetona para um equivalente de LDA para préforma completamente seu ânion enolato, que depois é tratada com o
aldeído.
O
Acetone
Acetona
LDA
-78°C
O
O Li 1.C H CH CH
6 5
2
-
OH O
+
Lithium
Enolato
enolLítio
ate
de
C6 H5
2. H 2O 4-Hydroxy-5-phenyl-2-pentanone
4-hidroxi-5-fenil-2-pentanona
(racemic)
(racêmico)
www.ufsm.br/quimica_organica
50
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Exemplos usando LDA
Aldol cruzada
Michael
Alquilação
Acilação
www.ufsm.br/quimica_organica
51
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reações de Enolatos usando LDA
– Quando 2-metil cicloexanona é tratada com um ligeiro excesso de LDA, o
enolato é quase que inteiramente o ânion enolato menos substituído.
O
Pequeno
excesso
slight excess
de base
of base
+ LDA
O - Li +
O - Li +
0°C
+
+
(racemic)
(racêmico)
99%99%
[ ( CH3 ) 2 CH] 2 N H
1%
1%
– Quando 2-metil cicloexanona é tratada com LDA, e a cetona em ligeiro
excesso, o produto é mais rico no enolato mais substituído.
Pequeno
excesso
slight
excess
daketone
Cetona
of the
O - Li +
O - Li +
O
+ LDA
0°C
+
+
(racemic)
(racêmico)
10%
10%
[ ( CH3 ) 2 CH] 2 N H
90
%
90%
www.ufsm.br/quimica_organica
52
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reações de Enolatos usando LDA
• O fator mais importante para a determinação da composição
da mistura de ânion enolato é se a reação está sob controle
cinético (velocidade) ou controle termodinâmico (equilíbrio).
• Controle termodinâmico: Condições experimentais que
permitem o estabelecimento de equilíbrio entre dois ou mais
produtos de uma reação. A composição da mistura é
determinada pela estabilidade relativa dos produtos.
www.ufsm.br/quimica_organica
53
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Reações de Enolatos usando LDA
– Equilíbrio termodinâmico entre ânions enolato é
estabelecido quando a cetona esta em ligeiro excesso, uma
condição sob a qual é possível para reações com
transferência de próton entre um enolato e um hidrogênio
de uma cetona que não tenha reagido. Assim, o equilíbrio
é estabelecido entre ânions enolatos alternativos.
O Li+
O
O - Li +
H
CH3 +
(racemic)
(racêmico)
O
+
Lessenolato
stable
Ânion
enol
ateestável
anion
menos
(racêmico)
(racemic)
More stable
Ânion enolato
enol
ate anion
mais estável
www.ufsm.br/quimica_organica
(racemic)
(racêmico)
54
Enolatos: Reação de Condensação
Prof. Hugo Braibante-UFSM
Exemplos
1. 1.01 mol LDA, controle cinético
2. ácido
majoritário
minoritário
2. 0.99 mol LDA, controle termodinâmico.
2. ácido
minoritário
www.ufsm.br/quimica_organica
majoritário
55