ROTEIRO DE RECUPERAÇÃO
Nome:
Nº
Data: / /2012
Professor(a): Nina e Sandra
3ª série EM
Turma:
Disciplina: Química
Conteúdos
1ºTrimestre (avaliação 2)
•
•
•
•
•
•
Cálculo estequiométrico.
Cálculo de velocidade de reações.
Fatores que alteram a velocidade das reações.
Pilhas.
Classificação de cadeias.
Hidrocarbonetos: alcanos, alcenos, alcinos, alcadienos e aromáticos.
Orientações gerais:
• A partir de seu material (caderno, livro didático e avaliações já realizadas) retome os conceitos e a
solução de exercícios ou problemas referentes aos conteúdos acima.
• Os exercícios previstos neste roteiro de recuperação final não serão validados como nota, servirão
apenas como base para seus estudos. Em caso de dúvidas, procure o plantão, conforme horário
disponível no site www.marcelinas.com.br.
Exercícios:
1) Quais os fatores que alteram a rapidez (velocidade) de uma reação química? Explique.
2) Esboce um gráfico que demonstre a interferência de um catalisador sobre a velocidade de uma
reação química.
3) Por que 100 gramas de carne moída estragam mais rapidamente que 100 gramas da mesma carne
em bife se ambas estiverem sob uma pia?
4) Por que devemos guardar os alimentos na geladeira?
5) Por que um pedaço de palha de aço, cujo componente principal é o ferro, enferruja mais rapidamente que prego?
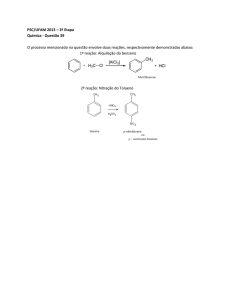
6) A reação geral da fotossíntese pode ser representada pela equação química:
CO2 + H2O ↔ C6H12O6 + O2
Em um recipiente foram introduzidos 4 mols de dióxido de carbono gasoso a cada 3 horas. O recipiente foi fechado e mantido a temperatura constante. Qual a massa de glicose produzida em um mês?
Dados: massa molar (g/mol) – C= 12 e O =16.
7) Num experimento foram utilizados 148 g de hidróxido de cálcio com 80% de pureza e quantidade
suficiente de ácido clorídrico, considerando essas informações e a reação abaixo,
HCℓ +
Ca(OH)2
→
CaCℓ2 +
H2O
responda as questões a seguir:
a) Qual a massa, em gramas, obtida de cloreto de cálcio, segundo a equação não balanceada apresentada abaixo e sabendo-se que as massas molares em, g/mol, dos átomos são: H = 1; O = 16; Cl =
35,5 e Ca = 40?
b) Se o rendimento dessa reação fosse de 95%, qual a massa, em gramas do cloreto de cálcio obtida?
8) Numa industria o fósforo vermelho,P4, pode ser obtido pela reação representada pela equação:
Ca3((PO4)2 + 6 SiO2 + 10 C → P4 + 6 CaSiO3 + 10 CO
Quantos gramas desse fósforo são obtidos a partir de 5 t de fosfato de cálcio com pureza de 95%,
sabendo-se que o rendimento dessa reação foi de 80%.
Dados: massa molar (g/mol) – C= 12; O =16 e P = 31.
9) Esboce um esquema de uma pilha Na/Na1+//Cu2+/Cu com suas respectivas partes e reações.
10) Para uma pilha foram fornecidas as seguintes semirreações de redução e seus respectivos potenciais:
Cℓ2(g) + 2e → 2 Cℓ (aq)
E0 = +1,36 V
Ni2+(aq) + 2e- → Ni(s)
E0 = -0,24 V
Considerando essas reações responda as questões a seguir.
a) Quais espécies migram para o cátodo?
b) Qual espécie se reduz no cátodo?
c) Equacione a semi reação que ocorre no cátodo.
d) Quais espécies migram para o ânodo?
e) Qual espécie se oxida no ânodo?
f) Equacione a semi reação que ocorre no ânodo.
g) Qual a reação global dessa pilha?
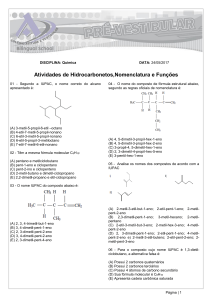
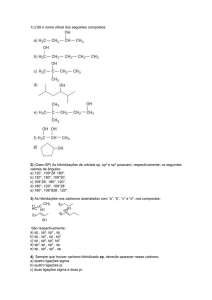
10) a) Indique a fórmula do composto orgânico formado por 9 carbonos e 20 hidrogênios e que possui
2 carbonos terciários e 1 carbono quaternário.
b) Classifique a cadeia carbônica desse composto.
c) Dê sua nomenclatura oficial.
11) A estrutura dos compostos orgânicos começou a ser desvendada em meados do séc. XIX, com
os estudos de Couper e Kekulé, referentes ao comportamento químico do carbono. Dentre as idéias
propostas, três particularidades do átomo de carbono são fundamentais, sendo que uma delas é referente ao encadeamento.
Escreva a fórmula estrutural (contendo o menor número de átomos de carbono possível) de hidrocarbonetos apresentando cadeias carbônicas com as seguintes particularidades:
a) acíclica, normal, saturada, homogênea
b) acíclica, ramificada, insaturada etênica (dupla ligação), homogênea
c) aromática, mononuclear, ramificada.
12) Complete o quadro abaixo.
Radical
metil
Fórmula
Etil
Propil
Isopropil
Butil
Secbutil
Tercbutil
Isobutil
13) Dispõe-se de cada um dos líquidos listados a seguir:
I - Água
II - Ácido sulfúrico concentrado
III - Benzeno
IV - Etanol
V – Tolueno
Ao misturar volumes iguais de dois desses líquidos, qual é o par que forma uma solução cujo volume
final mais se aproxima da
soma dos volumes individuais dos líquidos misturados?
(A) I e II.
(B) I e III.
(C) II e IV.
(D) III e IV.
(E) III e V.
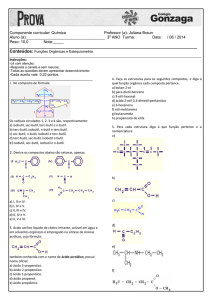
14) No composto de fórmula:
Os radicais circulados 1, 2, 3 e 4 são, respectivamente:
a) isobutil, sec-butil, terc-butil e n-butil.
b) terc-butil, isobutil, n-butil e terc-butil.
c) sec-butil, n-butil, isobutil e terc-butil.
d) terc-butil, sec-butil, isobutil e n-butil.
e) n-butil, terc-butil, sec-butil e isobutil.
15) (UERJ) Um mistura de hidrocarbonetos e aditivo compõe o combustível denominado gasolina.
Estudos revelaram que, quanto maior o número de hidrocarbonetos ramificados, melhor é a performance da gasolina e o rendimento do motor. Observe as estruturas dos hidrocarbonetos a seguir:
O hidrocarboneto mais ramificado é o de número.
a) I.
b) II.
c) III.
d) IV.
e) II e III.
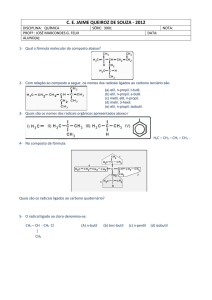
16) (UFPR-PR) Determine a nomenclatura das moléculas abaixo e numere a coluna da direita de acordo com a coluna da esquerda.
17) Nas indústrias de couro, encontram-se presentes alguns agentes químicos potencialmente nocivos, dentre eles os representados abaixo:
Os nomes oficiais desse compostos, na ordem dada, são:
a) benzeno, xileno e tolueno.
b) benzeno, tolueno e p-xileno.
c) toluol, benzil e fenol.
d) benzil, toluol e m-xileno.
e) benzeno, metilbenzeno e p-dimetil-benzeno.
18) (Unisinos-RS) Considere o seguinte composto:
Sua nomenclatura correta é:
a) 1, 2 – etil – 3 – propil benzeno.
b) 1, 2 – dimetil – 3 – propil benzeno.
c) 1 – propil – 2, 3 – dimetil benzeno.
d) o – metil – m – propil benzeno.
e) m – dimetil – o – propil benzeno.
19) Os nomes corretos para os compostos abaixo são, respectivamente: