UniABC – Laboratório Química dos Elementos – Profa. Claudia P R Morcelli
1
OBTENÇÃO DO GÁS OXIGÊNIO
I. OBJETIVOS
Produzir e verificar algumas propriedades do gás oxigênio.
II. INTRODUÇÃO TEÓRICA
O oxigênio é o elemento que existe em maior quantidade na natureza.
Em condições ambientes, o oxigênio (O2) é um gás incolor, sem sabor e inodoro.
É um pouco mais pesado do que o ar.
O oxigênio (O2) apresenta relativa solubilidade em água. 100 volumes de água, à
o
0 C, dissolvem aproximadamente 5 volumes de O2.
O ar contém, normalmente, 21% de O2.
A reatividade do oxigênio é insignificante à temperatura ambiente, mas com o
aquecimento, ele aumenta rapidamente.
No laboratório, o oxigênio é obtido pela decomposição de alguns óxidos
(exemplo: HgO) ou sais oxigenados (exemplo:KClO3), ao aquecê-los em presença de
um catalisador (exemplo: MnO2) para diminuir a velocidade de reação. A reação de
decomposição do clorato de potássio pode ser representada por:
2 KClO3
MnO2
2 KCl + 3 O2
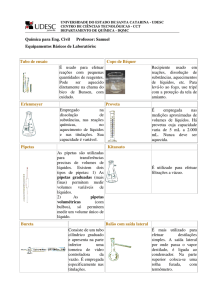
III. MATERIAIS E REAGENTES
Tubos de ensaio
Estante para tubo de ensaio
Becker de 100 mL ou cuba de
vidro
Bico de Bunsen
Clorato de potássio - KClO3 (sólido)
Dióxido de manganês - MnO2 (sólido)
Suporte universal com garra
Rolha de borracha
Vareta de vidro
Furador de rolhas
Fósforos
IV. PROCEDIMENTO EXPERIMENTAL
.
Montar a aparelhagem conforme a Figura 1.
Colocar 1,2g de KClO3 e 0,6g MnO2 (proporção 2:1) no tubo de ensaio e
misturá-los com cuidado.
O TUBO DEVE ESTAR SECO.
Fechar o tubo com a rolha que possui o tubo de vidro.
Colocar a ponta da mangueira na cuba ou becker de 1000mL contendo
água e sabão.
UniABC – Laboratório Química dos Elementos – Profa. Claudia P R Morcelli
2
Aquecer a mistura de KClO3 e MnO2 diretamente com uma chama
FRACA do bico de bunsen.
Observar a formação de bolhas.
Acender um fósforo próximo às bolhas formadas, observar.
Água e sabão
Figura 1 – Montagem para produção gás oxigênio
V. QUESTÕES
1.
2.
3.
4.
O oxigênio é um combustível ou comburente?
Qual a função do MnO2 no processo de obtenção do O2?
Quantos moles de O2 se formam na combustão completa de 1,2g de KClO3?
Descreva o que observou na realização do experimento. Baseando-se no que foi
observado, como podemos saber se o gás presente na bolha é oxigênio?
5. Completar as seguintes reações:
H2
+
O2
Fe
+
H2SO4
C
+
O2
HgO
Bibliografia
Este experimento contém alterações do método original que pode ser
encontrado em:
Trindade, D. F et al. Química - básica experimental. Cone, São Paulo, 1998.
UniABC – Laboratório Química dos Elementos – Profa. Claudia P R Morcelli
3
Cálculo experimental da densidade da água
Pese uma proveta de 25 mL. Adicione 100 gotas de água destilada utilizando
um conta-gotas, pese novamente e leia o volume. Determine a massa e o
volume de uma gota e a massa equivalente a 1 mL de água. Esse
procedimento deverá ser feito em triplicata, ou seja, repita a medida 3 vezes.
Verifique a temperatura da água.
(Expresse os resultados obtidos; médias e os desvios padrão. Você
obteve um dado amplamente conhecido na literatura (qual?). Compare o
dado obtido experimentalmente com o descrito no livro texto. Discuta a
semelhança ou a disparidade do dado experimental obtido com aquele
reportado na literatura.
BICO DE BUNSEN
CHAMA : uma mistura quente e luminosa de gases que estão queimando.
A reação química numa chama são principalmente reações em cadeia de
radicais livres e a luz provém da fluorescência de moléculas excitadas ou
de íons ou ainda da incandescência de pequenas partículas(carbono).
CHAMA OXIDANTE : é a chama azul, de um bico de Bunsen, por exemplo,
que libera maior quantidade de calor (temperatura em torno de 1550 oC),
menos luminosa (quase invisível), onde os gases sofrem combustão
completa.
CHAMA REDUTORA : é a chama amarela, de um bico de Bunsen, por
exemplo, libera menor quantidade de calor, temperatura entre 530 oC e
1540oC mais luminosa, região onde os gases sofrem combustão
incompleta.
A combustão é uma reação de uma substância (combustível) com o oxigênio
(O2) (comburente) presente na atmosfera, com liberação de energia.
A combustão completa de qualquer combustível orgânico (que possui átomos
de carbono) leva a formação de gás carbônico ou também chamado de dióxido
de carbono (CO2) e água (H2O).
A falta de oxigênio durante a combustão leva à chamada ‘combustão
incompleta’ que produz monóxido de carbono (CO). Note que o CO tem um
oxigênio a menos que o CO2, o que caracteriza a deficiência de oxigênio, ou a
UniABC – Laboratório Química dos Elementos – Profa. Claudia P R Morcelli
4
ineficiência da reação. Este gás é muito tóxico para o ser humano, pois este
dificulta a função da hemoglobina, que é responsável pela renovação do
oxigênio no nosso sangue. Pequenas concentrações de monóxido de carbono
já provocam tonturas e dores de cabeça. Outro produto indesejável da
combustão incompleta é a fuligem (C), que não tem oxigênio na sua
constituição. A porção mais fina da fuligem pode impregnar nos pulmões e
causar problemas respiratórios.
Manuseio de bico de Bunsen
Acenda o bico de Bunsen e observe a combustão incompleta do gás. Abra
gradativamente as janelas do bico de Bunsen e observe as modificações
sofridas pela chama. Regule a altura da chama através da torneira de entrada
da linha de gás. Distinga a chama oxidante da redutora.
MANUSEIO DO BICO DE BUNSEN
O aquecimento em laboratório é feito, geralmente, utilizando-se queimadores
de gases combustíveis sendo o mais simples deles o bico de Bunsen (figura 2).
Outro desses queimadores é o bico de Meker, o qual é uma modificação do
bico de Bunsen. Este queimador é maior que o de Bunsen e possui uma grelha
que ajuda na formação de uma chama mais quente e mais distribuída.
Figura 2. Bico de bunsen.
De uma maneira geral, o gás entra no queimador pela sua base e seu fluxo é
regulado por uma torneira externa na parte inferior do bico. À medida que o gás
sobe pelo tubo do queimador, o ar é injetado através de orifícios situados um
pouco acima da base. A quantidade de ar pode ser controlada girando-se o
anel que fica sobre os orifícios. A etapa inicial para se acender um bico de gás
é fechar a entrada de ar e posicionar o queimador longe de objetos inflamáveis.
UniABC – Laboratório Química dos Elementos – Profa. Claudia P R Morcelli
5
A seguir, devese abrir o gás e acender o queimador. A chama obtida apresenta
uma cor amarela brilhante e é bastante grande. Esta chama é "fria" e
inadequada ao uso porque a mistura é pouco oxidante. Para que uma chama
mais quente seja obtida, deve-se deixar o ar entrar gradualmente no sistema,
até que sua coloração se tome azulada. Nota-se então, duas regiões cônicas
distintas, como mostradas na Figura: a interna, mais fria, chamada de zona
redutora, e a externa, quase invisível, chamada de zona oxidante. A região
mais quente, com temperatura em tomo de 1560ºC, está situada logo acima do
cone interno.