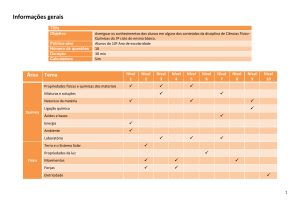
PONTIFÍCIA UNIVERSIDADE CATÓLICA DE GOIÁS
Departamento de Matemática e Física
Coordenação de Química
EXPERIÊNCIAS
DE LABORATÓRIO
em
TRASFORMAÇÕES QUÍMICAS
MAF 1176
Goiânia, 2011
1
Sumário
Orientações ao estudante.............................................................................................................2
Relatório Técnico-Científico........................................................................................................3
Normas e técnicas de segurança em laboratório.....................................................................6
Análise das propriedades de reagentes químicos.................................................................12
Técnicas de trabalho com material volumétrico.....................................................................15
Propriedades físicas e mudanças de estado das substâncias...............................................20
Métodos de separação de misturas heterogêneas..................................................................23
Métodos de separação de misturas homogêneas...................................................................26
Condutividade elétrica das soluções.......................................................................................30
Preparação de soluções e cálculos de concentração..............................................................34
Padronização de solução e estequiometria de reação...........................................................37
Reações químicas em solução aquosa.....................................................................................42
Reações de oxidação e redução................................................................................................45
Reatividade química dos metais...............................................................................................48
APÊNDICE
Tabela Periódica.........................................................................................................................51
ORIENTAÇÃO PARA AS ATIVIDADES DAS AULAS DE LABORATÓRIO
NORMAS A SEREM
LABORATÓRIO:
OBSERVADAS DURANTE AS AULAS DE
Para participar das aulas com segurança o aluno necessariamente deverá:
1- Estar de jaleco ou avental (comprimento no mínimo até os joelhos);
2- Cada grupo deverá ter no mínimo dois pipetadores de borracha (pêra);
3- Usar calçado fechado;
4- Cabelos longos deverão estar presos;
5- Não é permitido comer dentro do laboratório e nem provar nenhuma substância;
6- Alunos com problemas alérgicos devem comunicar tal fato ao professor;
7- Alunas grávidas devem comunicar ao professor,
8- Alunos que fazem uso de lentes de contato deverão optar pelo uso de óculos
com lentes corretivas durante a realização das atividades experimentais,
9- Após 15 minutos do início da aula, não será permitida a entrada de alunos no
laboratório.
APROVEITE
AO
MÁXIMO
O
MOMENTO
DAS
AULAS
EXPERIMENTAOS, ELAS SÃO FUNDAMENTAIS PARA A FORMAÇÃO
DE CONCEITOS.
EQUIPE DE PROFESSORES DA ÁREA DE QUÍMICA
Transformações Químicas
Relatório Técnico-Científico
1
Relatório Técnico-Científico
1. Título
Normas de relatório das aulas experimentais de Transformações Químicas.
2. Objetivos
Este roteiro apresenta as normas para apresentação dos relatórios técnico-científico, afim
de que o leitor compreenda o trabalho experimental.
3. Corpo do Relatório
O relatório técnico-científico deverá ser escrito no passado e no impessoal e deverá
apresentar os seguintes tópicos:
3.1. Capa
A capa deve ser escrita em uma única página, onde deverá conter: o local onde foi
executado o experimento; o nome do experimento; o (s) autor (es) e a data de realização do
experimento.
3.2. Introdução e Objetivos
A introdução deve dar ao leitor a informação necessária para entender de qual assunto
trata o seu relatório, sem precisar recorrer a outras fontes. Para ajudar você a escrever a
introdução, observe qual é o assunto que trata o seu relatório, por que é importante tratar esse
assunto e qual (is) é (são) o (s) objetivo (s) do seu relatório. Não se deve copiar a introdução do
roteiro da aula e sim pesquisar em outras fontes sobre o assunto do tema.
3.3. Materiais e Métodos
No item materiais e métodos você deve dar informação suficiente para que outro
pesquisador possa reproduzir seu trabalho. Isto porque só é considerado científico o trabalho que
é passível de reprodução. Mas, para que possa ser reproduzido por colega de igual competência,
seu trabalho precisa ser bem descrito. Comece descrevendo os materiais utilizados. Enfim,
convêm descrever:
a. material, reagentes e equipamentos utilizados;
b. descrição das técnicas, quantidade, fonte ou método de preparação utilizados;
3.4. Cálculos e Resultados
Comece apresentando os dados sem, no entanto, descrever os métodos, pois já foram
descritos no item materiais e métodos. Ou seja, faça apenas uma rápida apresentação. E não
sobrecarregue seu leitor com pormenores desnecessários. Se você fez poucas determinações,
coloque-as no texto. Se você fez muitas determinações, arranje-as em tabelas e gráficos. Não
esqueça de colocar os números e legendas nas figuras (em baixo) e das tabelas (em cima).
Cuidado com unidades, exatidão e precisão dos resultados.
3.5. Reações Químicas
Escrever as reações envolvidas devidamente balanceadas e identificadas.
3.6. Discussão
3
Transformações Químicas
Relatório Técnico-Científico
A discussão é, de longe, o item mais difícil de escrever, porque é nele que você explica
seus resultados. Para ajudar você na redação desse item, aqui está uma sugestão: escreva
procurando dar respostas às seguintes perguntas:
a. Que significam seus dados?
b. Até que ponto seu resultados estão de acordo com os resultados apresentados na
literatura científica? Se possível faça uma comparação entre os resultados experimentais e
os teóricos.
c. Que razões tem você para acreditar que seus resultados comprovam determinada
teoria?
d. Que tendências e generalizações sugerem seus dados?
3.7. Conclusão
A conclusão é a finalização do seu relatório. Neste item você deve deixar claro se o
objetivo foi alcançado, ou seja, apresentar respostas à problemática do experimento realizado.
Deve ser claro, preciso, conciso e de acordo com a discussão do relatório. Não se deve apresentar
dados neste item.
3.8. Referências Bibliográficas
É de grande importância, a citação de referências bibliográficas sugeridas e lidas que
foram utilizadas como fonte de consulta. As referências podem ter ordenações alfabéticas,
cronológicas e sistemáticas (por assunto). Entretanto, sugerimos a adoção da ordenação
alfabética ascendente.
Aspectos Gráficos:
Espaçamento: as referências devem ser digitadas, usando espaço simples entre as linhas e espaço
duplo para separá-las.
Margem: as referências devem estar justificadas.
Pontuação:
Usa-se ponto após o nome do autor/autores, após o título, edição e no final da referência;
Os dois pontos são usados antes do subtítulo, antes da editora e depois do termo In;
A vírgula é usada após o sobrenome dos autores, após a editora, entre o volume e o número,
páginas da revista e após o título da revista;
O ponto e vírgula seguida de espaço são usados para separar autores;
O hífen é utilizado entre páginas (ex.: 10-15) e, entre datas de fascículos seqüenciais (ex.: 19981999);
A barra transversal é usada entre números e datas de fascículos não seqüenciais (ex.: 7/9,
1979/1981);
Elaboração de referências: livros, dicionários, atlas, enciclopédias e homepage.
Indicar o sobrenome, em caixa alta, seguido de prenome, abreviado ou não desde que haja
padronização neste procedimento, separados entre si por ponto e vírgula seguidos de espaço.
Indicar título da obra e subtítulo, número da edição, local de publicação, editor, ano de
publicação, número de páginas ou volume. (NBR 6023).
Livros:
E. Scütz. Reengenharia mental: reeducação de hábitos e programação de metas. Florianópolis:
Insular, 1997.
4
Transformações Químicas
Relatório Técnico-Científico
Nota: Quando houver mais de três autores, indicar apenas o primeiro, acrescentando-se a
expressão et al.
E.V. Brito et al., Imposto de renda das pessoas físicas: livro prático de consulta diária. 6ª
edição, São Paulo: Frase Editora, 1996.
Dicionários:
C. Aulete. Dicionário contemporâneo da Língua Portuguesa. 3ª edição, Rio de Janeiro: Delta,
1980.
Atlas:
R.R.F. Mourão. Atlas Celeste. 5ª edição, Petrópolis: Vozes, 1984.
Enciclopédias:
THE NEW Encyclopedia Britannica: micropaedia. Chicago: Encyclopaedia Britannica, 1986.
Homepage:
http://www.ucg.br. Acesso em: 24 de janeiro de 2005.
5
Transformações Químicas
1
Normas e Técnicas de Segurança
Normas e Técnicas de Segurança em Laboratório
1. Introdução
Atividades profissionais completamente isentas de riscos para a saúde do homem não
existem. Assim, é importante que cada trabalhador conheça os perigos a que está exposto em
uma determinada atividade e que tome as medidas necessárias para evitá-los ou minimizá-los.
Em um laboratório de Química, os riscos mais comuns são aqueles que envolvem o uso do
fogo, da eletricidade, de sistemas com pressões diferentes da atmosférica, do manuseio de
material de vidro e exposição a substâncias químicas nocivas a radiações, tais como, ultravioleta,
infravermelha, microondas, raios X, etc.
A presença de agentes químicos e físicos no ambiente de trabalho oferece riscos, mas o
fato de se trabalhar com estes agentes não implica necessariamente, que tais profissionais
desenvolverão doenças ou sofrerão acidentes.
No caso de agentes químicos, por exemplo, para que eles causem danos à saúde, é
necessário que sua concentração no meio ambiente esteja acima de um determinado valor, limite
de tolerância, e que o tempo de exposição nesta condição seja suficiente para uma ação nociva
ao homem.
A possibilidade de ocorrerem explosões, incêndio, intoxicações ou outros acidentes não
pode ser ignorada, mas pode ser controlada se os profissionais verificarem constantemente as
condições dos materiais e equipamentos utilizados bem como conhecerem as normas de
segurança.
2. Objetivos
Esta aula tem como objetivos discutir as principais regras de segurança e apresentar as
principais vidrarias e equipamentos usados em um laboratório de Química.
3. Normas de Segurança
A ocorrência de acidentes em laboratório, infelizmente, não é tão rara como possa parecer.
Com a finalidade de diminuir a freqüência e a gravidade desses acidentes torna-se absolutamente
imprescindível que durante os trabalhos realizados se observe uma série de normas de segurança:
1. O laboratório é um lugar de trabalho sério. Trabalhe com atenção, método e calma.
2. Siga rigorosamente as instruções específicas do professor. Experiências não autorizadas são
proibidas.
3. Localize os extintores de incêndio e familiarize-os com o seu uso.
4. Não fume no laboratório.
5. Prepare-se para realizar cada experiência, lendo antes os conceitos referentes ao experimento
e o roteiro da prática.
6. Use um avental (jaleco) apropriado.
7. Evite conversas desnecessárias no laboratório.
6
Transformações Químicas
Normas e Técnicas de Segurança
8. Nunca deixe frascos contendo solventes inflamáveis próximos à chama.
9. Evite contato de qualquer substância com a pele. Seja particularmente cuidadoso quando
manusear substâncias corrosivas como ácidos e bases concentrados.
10. Todas as experiências que envolvam a liberação de gases e/ou vapores tóxicos devem ser
realizadas na câmara de exaustão (capela).
11. Sempre que proceder a diluição de um ácido concentrado, adicione-o lentamente, sob
agitação sobre a água, e não o contrário.
12. Ao aquecer um tubo de ensaio contendo qualquer substância, não volte a extremidade aberta
do mesmo para si ou para uma pessoa próxima.
13. Não jogue nenhum material sólido dentro da pia ou nos ralos.
14. Não trabalhe com material imperfeito.
15. Comunique ao seu professor qualquer acidente, pôr menor que seja.
16. Antes de utilizar qualquer reagente, verifique a toxicidade da substância no rótulo do frasco
ou na literatura apropriada.
17. Leia com atenção o rótulo de qualquer frasco de reagentes antes de usá-lo. Leia duas vezes
para ter certeza de que pegou o frasco certo. Algumas fórmulas e nomes químicos podem
diferir apenas de uma letra ou de um número.
18. Quando for testar um produto químico pelo odor, não coloque o frasco sob o nariz. Desloque
com a mão, para a sua direção, os vapores que se desprendem do frasco.
19. Dedique especial atenção a qualquer operação que necessite aquecimento prolongado ou que
desenvolva grande quantidade de energia.
20. Conserve seus equipamentos e mesa limpos. Evite derramar líquido, mas se o fizer, lave
imediatamente o local com bastante água.
21. Ao se retirar do laboratório, verifique se não há torneiras (água ou gás) abertas. Desligue
todos os aparelhos, deixe todo o equipamento limpe e lave as mãos.
22. Se tiver dúvidas, pergunte.
4. Símbolos de Identificação
Figura 1.1: Pictogramas baseados em padrões largamente aceitos.
5. Equipamentos básicos de laboratório
A execução de qualquer experimento na Química envolve, geralmente, a utilização de uma
variedade de equipamentos de laboratório, a maioria muito simples, porém com finalidades
específicas. O emprego de um dado equipamento ou material depende dos objetivos e das
condições em que a experiência será realizada. Contudo, na maioria dos casos, a seguinte
correlação pode ser feita:
7
Transformações Químicas
Normas e Técnicas de Segurança
5.1. Material de vidro
1. Tubo de ensaio: utilizado principalmente para efetuar reações químicas em pequena escala.
2. Béquer: recipiente com ou sem graduação utilizado para o preparo de soluções, aquecimento
de líquido, recristalização, pesagem, etc.
3. Erlenmeyer: frasco utilizado para aquecer líquidos ou para efetuar titulações.
4. Kitassato: frasco de paredes espessas, munido de saída lateral e usado em filtração sob
sucção.
5. Funil: utilizado na transferência de líquidos de um frasco para outro ou para efetuar
filtrações simples.
6. Bureta: equipamento calibrado para medida precisa de volume de líquidos. Permite o
escoamento do líquido e é muito utilizada em titulações.
1
2
3
7
8
9a
4
9b
5
10
6
11
7. Balão volumétrico: recipiente calibrado, de precisão, destinado a conter um determinado
volume de líquido, a uma dada temperatura; utilizado no preparo de soluções de concentração
definidas.
8. Proveta ou cilindro graduado: frasco com graduação, destinado a medidas aproximadas de
volume de líquidos.
9. Pipeta: equipamento calibrado para medida precisa de volume de líquidos. Existem dois
tipos de pipetas: (a) pipeta graduada e (b) pipeta volumétrica. A primeira é utilizada para
escoar volumes variáveis e a segunda para escoar volumes fixos de líquidos.
10. Bastão de vidro: usado na agitação e transferência de líquidos. Quando envolvido em uma
de suas extremidades por um tubo de látex, é chamado de policial e é empregado na remoção
quantitativa de precipitados.
11. Cuba de vidro ou cristalizador: recipiente geralmente utilizado para conter misturas
refrigerantes, e finalidades diversas.
8
Transformações Químicas
Normas e Técnicas de Segurança
12. Dessecador: utilizado no armazenamento de substâncias quando se necessita de uma
atmosfera com baixo teor de umidade. Também pode ser utilizado para manter as substâncias
sob pressão reduzida.
13. Condensador: equipamento destinado à condensação de vapores, em (a) destilação ou (b)
aquecimentos sob refluxo.
14. Funil de separação: equipamento para separar líquidos não miscíveis.
15. Funil de adição: equipamentos para adição de soluções em sistemas fechados.
12
13a
13b
14
15
16. Pesa-filtro: recipiente destinado à pesagem de sólidos.
17. Balão de fundo chato: frasco destinado a armazenar líquidos.
18. Balão de fundo redondo: recipiente utilizado para aquecimento de soluções em destilações
e aquecimentos sob refluxo.
19. Termômetro: instrumento de medidas de temperatura.
20. Vidro de relógio: usado geralmente para cobrir béqueres contendo soluções e finalidades
diversas.
16
17
18
19
20
5.2. Material de porcelana
21. Funil de Büchner: utilizado em filtração por sucção, devendo ser acoplado a um kitassato.
22. Cápsula: usada para efetuar evaporação de líquidos.
23. Cadinho: usado para a calcinação de substâncias.
24. Almofariz e pistilo: destinados à pulverização de sólidos. Além de porcelana, podem ser
feitos de ágata, vidro ou metal.
21
22
23
24
9
Transformações Químicas
Normas e Técnicas de Segurança
5.3. Material metálico
25. Suporte (a) e garra (b): peças metálicas usadas para montar aparelhagens em geral.
26. Bico de gás (Bunsen): fonte de calor destinado ao aquecimento de materiais não
inflamáveis.
27. Tripé: usado como suporte, principalmente de telas e triângulos.
28. Plataforma elevatória: usado para ajustar altura de aparelhagens em geral.
29. Tela de amianto: tela metálica, contendo amianto, utilizada para distribuir uniformemente o
calor, durante o aquecimento de recipientes de vidro à chama de um bico de Bunsen.
30. Triângulo de ferro com porcelana: usado principalmente como suporte em aquecimento de
cadinhos.
25a
25b
26
27
28
29
30
5.4. Material elétrico
31. Balança: instrumento para determinação de massa.
32. Estufa: equipamento empregado na secagem de materiais, por aquecimento, em geral até
200C.
33. Manta elétrica: utilizada no aquecimento de líquidos inflamáveis, contidos em balão de
fundo redondo.
34. Chapa elétrica: utilizada no aquecimento de líquidos inflamáveis, contidos em béqueres ou
erlenmeyer.
35. Centrífuga: instrumento que serve para acelerar a sedimentação de sólidos em suspensão em
líquidos.
31
32
33
34
35
10
Transformações Químicas
Normas e Técnicas de Segurança
5.5. Materiais diversos
36. Suporte para tubos de ensaio.
37. Pisseta: frascos geralmente contendo água destilada, álcool ou outros solventes, usados para
efetuar a lavagem de recipientes ou materiais com jato do líquido nele contido.
36
37
6. Exercícios Pós-Laboratório
1. Os produtos químicos não podem ser armazenados e manipulados aleatoriamente devido às
suas propriedades. Dessa forma, como deve proceder um analista ao manipular os seguintes
produtos químicos e como deve proceder em caso de acidentes com os mesmos?
(a) Ácido clorídrico;
(b) Hidróxido de sódio;
(c) Acetona (Substância inflamável);
(d) Benzeno (Substância tóxica).
2. Pesquise procedimentos de segurança para as seguintes situações:
a) incêndio a partir de bico de gás (bico de Bunsen)
b) incêndio a partir de curto-circuito em fiação elétrica
c) intoxicação por inalação de gases
d) queimaduras com fogo
7. Referências
A. M. P. Felicíssimo et al. Experiência de Química: técnicas e conceitos básicos. PEQ-Projeto
de Ensino de Química/Coordenador Ernesto Giesbrecht, São Paulo: Editora Moderna, 1979.
F. Cienfuergos. Segurança no Laboratório. Rio de Janeiro: Editora Interciência Ltda, 2001.
D. F. Trindade et al. Química básica experimental. 2ª edição. São Paulo:Ícone, 1998.
8. Anotações
11
Transformações Químicas
2
Propriedades de Reagentes Químicos
Análise das Propriedades de Reagentes Químicos
1. Introdução
O trabalho em laboratório de Química tem como principais objetivos à aquisição de
conhecimentos fundamentais sobre as operações práticas e o relacionamento das experiências
com os conceitos teóricos.
As experiências de laboratório estimulam a curiosidade, desenvolvem as habilidades de
observação, registro e interpretação de dados, assim como oferecem a oportunidade de um bom
treinamento na manipulação de diversos materiais e equipamentos.
O sucesso de uma experiência está diretamente relacionado com o interesse, organização e
cuidado na sua execução. Assim, o respeito às normas de segurança é fundamental para se evitar
acidentes, devidos aos riscos inerentes dos trabalhos desenvolvidos.
O cuidado e a adoção de medidas de segurança é de responsabilidade de cada indivíduo no
laboratório. Se existir qualquer dúvida quanto à segurança de uma experiência, deve-se pedir a
opinião de uma pessoa experiente ao invés de esperar que nada de mal aconteça. Cada um que
trabalhe deve ter responsabilidade no seu trabalho e evitar atitudes imprudentes, de ignorância ou
pressa que possam acarretar num acidente e possíveis danos. Deve prestar atenção à sua volta e
se prevenir contra perigos que possam surgir do seu trabalho, bem como de outras pessoas.
Nenhum produto químico deve ser manipulado no laboratório sem que se saiba exatamente
o seu comportamento. Os rótulos devem conter sempre informações necessárias para a perfeita
caracterização, bem como indicações de riscos, medidas de prevenção para o manuseio e
instruções para o caso de eventuais acidentes. Dessa forma é fundamental que o químico saiba
diferenciar as propriedades, a qualidade e os eventuais riscos na manipulação de reagentes
químicos.
2. Objetivos
Esta aula tem como objetivos analisar os reagentes químicos quanto as suas propriedades
físicas e químicas, a forma correta de manipulá-los e como proceder em casos de acidentes.
3. Materiais
Catálogos de diferentes empresas
4. Reagentes (sugestão)
Ácidos inorgânicos: HCl, H2SO4, HNO3
Ácidos orgânicos: Acético e Cítrico
Hidróxidos: NaOH e NH4OH
Solventes: Hexano e Acetona
Sais: Sulfato de cobre e Nitrato de ferro (III)
Óxidos: óxido de crômio
5. Procedimento Experimental
Você encontrará sobre a bancada alguns produtos químicos. Analise seis frascos, leia o rótulo e
organize as seguintes informações na tabela abaixo.
12
Transformações Químicas
Propriedades de Reagentes Químicos
6. Resultados
Tabela 2.1: Análise dos reagentes
Nome do
Reagente
Fórmula
Empresa
Estado Físico
Ponto de
Fusão (°C)
Ponto de
Ebulição (°C)
Densidade
(g/cm3)
Massa
Molecular
(g/mol)
% das
principais
impurezas
Riscos de
Manipulação
Preço de 1L
ou 1kg ($)
Forma de
Descarte
13
Transformações Químicas
Propriedades de Reagentes Químicos
7. Exercícios Pós-Laboratório
1. Das substâncias estudadas quais são orgânicas e quais são inorgânicas.
2. Porque um analista deve anotar as informações contidas no rótulo de um reagente?
3. Pesquise sobre os danos que cada produto exposto pode causar e a maneira correta de
manipulá-lo.
4. Preencha a tabela de resultados desta aula. As informações não obtidas devem ser
pesquisadas na Internet ou em catálogos de empresas de produtos químicos.
8. Referências
Catálogo de reagentes: MercK, Aldrich, Sigma e Fluka.
M. Tókio; R. M. V. Assumpção. Manual de Soluções: reagentes e solventes. 2ª. edição. São
Paulo: Editora Edgard Blücher, 1981.
F. Cienfuergos. Segurança no Laboratório. Rio de Janeiro: Editora Interciência Ltda, 2001.
9. Anotações
14
Transformações Químicas
3
Material Volumétrico
Técnicas de Trabalho com Material Volumétrico
1. Introdução
A Química é uma ciência experimental e um dos procedimentos mais utilizados no
laboratório é a medição. Medir significa determinar com base em uma determinada escala, a
quantidade de uma grandeza. Muitas vezes a prática química não exige medidas precisas, isto é,
quando a medida é qualitativa. No entanto, muitas vezes é necessário saber com exatidão e
precisão a massa ou o volume de uma substância. Para determinarmos a massa, utilizamos
balanças. Para medirmos o volume, utilizamos vários recipientes que nos ajudam a realizar
medidas, com diferentes níveis de precisão.
Muitas vezes o resultado de uma determinada prática depende fundamentalmente do grau
de precisão com que foram realizadas as medidas, por isso é importante que você conheça os
recipientes volumétricos, saiba lidar com eles e esteja ciente dos erros que podem acontecer para
procurar evitá-los.
2. Objetivos
Esta aula tem como objetivos reconhecer os principais recipientes volumétricos, estudar
suas características e especificações de utilidade, as técnicas de limpeza e manipulação.
3. Técnicas de Leitura
A prática de análise volumétrica requer a medida de volumes líquidos com elevada
precisão. Erros nas medidas acarretam em erros nos resultados finais da análise, os quais devem
ser evitados. A não observação dos cuidados necessários à medição conduz a resultados
equivocados, mesmo quando todas as outras regras de operação são realizadas com precisão.
A medida de volumes está sujeita a uma série de erros devidos à ação da tensão superficial
sobre superfícies líquidas, dilatações e contrações provocadas pelas variações de temperatura,
imperfeita calibração dos aparelhos volumétricos e erros de paralaxe.
Medir volumes de líquidos em um recipiente significa comparar a sua superfície com a
escala descrita no recipiente utilizado. Essa superfície é denominada menisco. Os líquidos têm a
propriedade de reduzir ao máximo a sua superfície. Esta propriedade denomina-se tensão
superficial e está relacionada com a força na qual as moléculas de um líquido se atraem
mutuamente. Se no interior de um líquido as forças de atração estão saturadas, na superfície está
compensada só uma parte delas. Por isso as moléculas da superfície sofrem uma atração
recíproca especialmente forte, é como se o líquido estivesse coberto por uma película
autotensora. Essa força que contrai a superfície do líquido é o que chamamos de tensão
superficial e varia para cada líquido, dependendo do caráter da interação intermolecular.
O menisco é a superfície do líquido que estaremos medindo. Para a água, a força de coesão
entre as moléculas é parcialmente superada pelas de adesão entre ela e o vidro, e o menisco é
côncavo, sendo que sua parte inferior (vértice) deverá coincidir com a linha de aferição (Figura
3.1). No mercúrio, ao contrário, as forças de coesão são bastante maiores que as de adesão entre
o mercúrio e o vidro, e o menisco é convexo, sendo considerado para leitura sua parte superior
(Figura 3.2).
15
Transformações Químicas
Material Volumétrico
Para líquidos que apresentam concavidade e são transparentes ou levemente coloridos, a
parte inferior do menisco deverá coincidir com a linha de aferição (Figura 3.3). Se for fortemente
colorido, isto é, se não for possível verificar o menisco, deve-se considerar sua parte superior
(Figura 3.4).
Figura 3.1: Superfície côncava
Figura 3.3: Menisco inferior
Figura 3.2: Superfície convexa
Figura 3.4: Menisco superior
Outra técnica importante é a posição do olho do observador. Este deverá estar sempre no
mesmo nível da marca de aferição do recipiente (Figura 3.5). Se o observador estiver olhando
por cima do menisco, observará um valor superior ao verdadeiro. Se estiver olhando por baixo
do menisco, observará um valor inferior. Estes erros são conhecidos como erros de paralaxe.
Figura 3.5: Posição do observador. Erro de paralaxe.
16
Transformações Químicas
Material Volumétrico
4. Limpeza e secagem de material volumétrico
Os aparelhos volumétricos devem estar perfeitamente limpos, para que os resultados das
medidas possam ser reprodutíveis. Recomenda-se limpar o material com solução detergente,
enxaguá-lo várias vezes com água da torneira e depois com jatos de água destilada. Verifica-se a
limpeza, deixando escoar a água. Se a película líquida, inicialmente formada nas paredes, escorre
uniformemente, sem deixar gotículas presas, a superfície está limpa. Qualquer sujeira aderida às
paredes dos recipientes altera o resultado final da medida.
Caso seja necessária limpeza mais drástica, existem soluções especiais, tais como solução
sulfocrômica (dicromato de potássio em ácido sulfúrico concentrado). Esta solução é corrosiva e
exige muito cuidado em seu emprego. Outras soluções utilizadas são a alcoólica de hidróxido de
potássio, mistura álcool e éter; solução básica de permanganato de potássio.
Para a secagem de material volumétrico, pode-se utilizar: secagem comum, por evaporação
à temperatura ambiente; secagem em corrente de ar, por exemplo, ar aspirado por meio de uma
bomba de vácuo.
Uma secagem rápida pode ser obtida após enxaguar o material com álcool ou acetona.
Caso não se disponha de tempo para secar pipetas ou buretas, deve-se enxaguá-las repetidas
vezes com pequenas porções do líquido que será usado para enchê-las. Material volumétrico não
deve ser seco em estufa, nem deve ser aquecido.
5. Materiais
Bastão de vidro
Erlenmeyer de 250mL
Béquer de 50mL (4)
Bureta de 50mL
Béquer de 250mL
Balão volumétrico de 50mL
Proveta de 10mL (2)
Balão volumétrico de 100mL
Proveta de 25mL
Pipeta volumétrica de 5mL
Proveta de 50mL
Pipeta graduada de 5mL (4)
Proveta de 100mL
Pipetador de borracha (5)
Erlenmeyer de 125mL
Suporte universal com garras
6. Procedimento Experimental
Observação: Todos os alunos deverão executar os experimentos.
6.1. Comparação entre proveta e béquer
Utilizando o bastão de vidro, preencha a proveta de 25mL com água destilada e acerte o traço de
aferição. Transfira esse volume cuidadosamente para um béquer de 50mL com cuidado.
Compare o volume final. Anote a sua observação na tabela de resultados.
6.2. Comparação entre proveta e erlenmeyer
Utilizando o bastão de vidro, preencha a proveta de 50mL com água destilada e acerte o traço de
aferição. Transfira para um erlenmeyer de 125mL limpo e seco. Compare o volume final. Anote
a sua observação na tabela de resultados.
6.3. Comparação entre béquer e erlenmeyer
17
Transformações Químicas
Material Volumétrico
Utilizando o bastão de vidro, adicione 200mL de água destilada num béquer de 250mL.
Transfira para um erlenmeyer de 250mL limpo e seco. Compare o volume final. Anote a sua
observação na tabela de resultados.
6.4. Comparação entre proveta e balão volumétrico
Utilizando o bastão de vidro, preencha a proveta de 100mL com água destilada e acerte o traço
de aferição. Transfira para um balão volumétrico de 100mL. Limpo e seco. Compare o volume
final. Anote a sua observação na tabela de resultados.
6.5. Comparação entre bureta e balão volumétrico
Fixe uma bureta de 50mL no suporte universal. Feche a torneira de controle de escoamento.
Coloque um béquer de 100mL em baixo da bureta. Com auxílio de um béquer de 50mL, encha a
bureta com água destilada e observe se há vazamento. Verifique se há bolhas entre a torneira e a
extremidade inferior da bureta. Caso tenha, abra a torneira rapidamente até removê-la. Em
seguida, encha a bureta com água destilada e acerte o menisco com o traço de aferição (zero),
que fica na parte superior. Segure a torneira com a mão esquerda e usando os dedos polegar e
médio dessa mão, inicie o escoamento. Transfira 50mL de água da bureta, para um balão
volumétrico de 50mL limpo e seco. Compare o volume final. Anote a sua observação na tabela
de resultados.
6.6. Técnica de pipetagem
Segure uma pipeta graduada de 5 ou 10mL e acople o pipetador de borracha na sua parte
superior. Retire o ar de dentro do pipetador, apertando simultaneamte o botão superior e o
pipetador. Mergulhe a extremidade inferior da pipeta em um béquer de 50mL contendo água
destilada. Faça a sucção apertando o botão inferior, até acertar no zero da pipeta. Puxe devagar,
para que o líquido não entre no pipetador. Para escoar o líquido, aperte o botão lateral inferior e
deixe escoar lentamente a água de 1 em 1mL. Repita o procedimento até não mais encontrar
dificuldades.
Não se deve nunca pipetar com a boca líquidos TÓXICOS, VOLÁTEIS E CORROSIVOS.
Deve-se sempre utilizar o pipetador de borracha (pêra) acoplado a extremidade superior da
pipeta, na capela com exaustor ligado.
6.7. Comparação entre pipeta graduada e volumétrica
Meça 5mL de água destilada em uma pipeta volumétrica de 5mL e transfira para uma proveta
de 10mL limpa e seca. Meça 5mL de água destilada em uma pipeta graduada de 5mL e
transfira para uma outra proveta de 10mL limpa e seca. Compare os volume. Anote a sua
observação na tabela de resultados.
18
Transformações Químicas
Material Volumétrico
7. Resultados
Tabela 3.1: Resultados das comparações de medida de volume
Procedimento
Observações
1
2
3
4
5
7
8. Exercícios Pós-Laboratório
1. Diferencie pipeta graduada de volumétrica. Dê a sua função e diga baseando-se no resultado
do procedimento 7, qual é a mais precisa.
2. Cite os erros mais comuns na leitura de volume.
3. Defina menisco e tensão superficial.
4. Qual a vidraria de medida de volume que apresentou maior precisão? Cite três vidrarias de
medidas precisas de volume.
5. Qual a vidraria que apresentou maior erro de volume. Cite três vidrarias de medidas
aproximadas de volume.
6. Se for necessário encher uma pipeta com um líquido corrosivo ou tóxico, como deve-se
proceder?
7. Se você tivesse que medir 50mL de água destilada com precisão, qual dos equipamentos a
seguir você usaria? Justifique.
-
proveta de 50mL; pipeta volumétrica de 50mL; balão volumétrico de 50mL; béquer de
50mL.
19
Transformações Químicas
Material Volumétrico
9. Referências
E. O. Albuquerque. Aulas Prática de Química. Editora Moderna, São Paulo, 1994.
10. Anotações
20
Transformações Químicas
4
Propriedades Físicas das Substâncias
Propriedades Físicas e Mudança de Estado das Substâncias
1. Introdução
A matéria encontra-se em permanente transformação. Sob a ação de agentes físicos ou
químicos, as substâncias podem sofrer alterações de estado, de decomposição ou mesmo de cor.
Certas transformações conduzem a variações drásticas na composição química das espécies por
meio de ruptura e formação de ligações, quase sempre acompanhas de trocas energéticas para o
ambiente. Essas transformações são descritas através de equações químicas e recebem o nome de
reação. As mudanças de estado, representadas por exemplo pela fusão, ebulição, sublimação,
condensação e solidificação, também envolvem ruptura e formação de ligações, porém não
alteram a composição química das espécies.
Ao realizar um experimento é importante saber identificar e reconhecer os diferentes
materiais que participam de uma transformação. Esses materiais podem apresentar um aspecto
uniforme em toda sua extensão e propriedades constantes ou não.
Uma substância pode ser identificada por um conjunto de propriedades classificadas como:
extensivas e intensivas. As propriedades extensivas são aquelas que dependem da quantidade de
matéria presente na amostra. As propriedades intensivas são aquelas que independe da
quantidade de matéria e sim da natureza da substância. Por isso são muitas vezes chamadas de
propriedades características de uma substância, utilizadas freqüentemente na determinação do
grau de pureza. Algumas dessas propriedades estão listadas a seguir:
Ponto de fusão: é a temperatura na qual uma substância sólida, em condições de
equilíbrio, passa para o estado líquido. No caso de uma “substância pura” o intervalo de
temperatura do momento inicial da fusão (aparência de uma fase líquida) a sua completa fusão
não deve exceder 0,5C. Substâncias contendo impurezas, não possuem um ponto de fusão
definido; elas possuem um intervalo com vários graus de temperatura.
Ponto de ebulição: é a temperatura na qual a pressão de vapor de um líquido torna-se
igual a pressão atmosférica (isto é, 760 mm Hg).
Densidade: a densidade pode ser classificada de duas maneiras, densidade absoluta e
relativa. A densidade absoluta também chamada de massa específica é a razão entre a massa de
um corpo e seu volume. A densidade relativa é a razão entre duas massas específicas em que o
denominador é a massa específica de uma substância tomada como padrão ou referência. Ela é
expressa geralmente em g/cm3. A densidade de líquidos pode ser determinada pela medida da
massa de líquido ocupando um volume conhecido (picnômetro) e pelo método do densímetro,
baseado no princípio de Arquimedes.
2. Objetivos
Estudar as propriedades físicas das substâncias, bem como as transformações de estado
físico. Aprender as técnicas de caracterização de substâncias químicas.
21
Transformações Químicas
Propriedades Físicas das Substâncias
3. Materiais
Tubo capilar
Termômetro de mercúrio
Chapa elétrica
Suporte universal com garras
Cápsula de porcelana
Funil simples
Béquer de 250mL
Balança analítica
Densímetros (alcoômetros)
Proveta de 250mL
4. Reagentes e Amostras
Naftaleno em pó
Vinho tinto, branco, pinga, álcool comercial
Álcool e Iodo P.A.
Metais: cobre, chumbo, alumínio
5. Procedimento Experimental
5.1. Fusão
Encha cerca de ¼ de um tubo capilar, fechado
numa das extremidades, com naftaleno em pó e
amarre-o junto ao bulbo de um termômetro, como
mostrado na figura 4.1. Mergulhe o bulbo do
termômetro num béquer contendo água e aqueça
lentamente. Inicie o aquecimento, anotando a
temperatura de minuto em minuto. Quando aparecer a
primeira fração líquida, em contato com o sólido, a
substância começa a fundir. Observe e anote as
temperaturas na tabela 4.1.
Termômetro
com Capilar
Figura 4.1: Aparelho para determinação do ponto de fusão
5.2. Sublimação
Na capela, coloque alguns cristais de iodo numa cápsula de porcelana e cubra com um funil
invertido. Aqueça fracamente e observe o desprendimento de vapores do iodo. Retire o funil
somente quando o sistema estiver completamente frio.
5.3. Densidade de Sólidos
Pese um pedaço de metal numa balança analítica e anote a sua massa. Coloque 40mL de água
destilada numa proveta de 250mL. Mergulhe o metal na proveta e anote o volume final (V) na
tabela 4.2. Calcule a densidade do metal pela fórmula: d Massa
V 40
5.5. Determinação da densidade: método do densímetro
Adicione 200mL da amostra numa proveta de 250mL. Meça a temperatura da amostra. Adicione
um densímetro apropriado e meça diretamente o valor da densidade. Anote na tabela 4.3.
22
Transformações Químicas
Propriedades Físicas das Substâncias
6. Resultados
Tabela 4.1: Resultados da determinação do ponto de fusão do naftaleno
t(min)
T(C)
t(min)
T(C)
t(min)
T(C)
t(min)
T(C)
t(min)
0
4
8
12
16
1
5
9
13
17
2
6
10
14
18
3
7
11
15
19
T(C)
Tabela 4.2: Resultados da determinação da densidade de sólidos
Amostra
Massa (g)
Volume deslocado (mL)
Densidade (g/mL)
Tabela 4.3: Resultados da determinação da densidade de líquidos
Amostra
Densidade (g/mL)
Amostra
Densidade (g/mL)
6. Exercícios Pós-Laboratório
1. Consultar na literatura, o ponto de fusão do naftaleno e comparar com o ponto de fusão obtido
experimentalmente.
2. Utilizando os dados experimentais, traçar uma curva de aquecimento em função do tempo.
Marcar cada porção da curva, mostrando as fases presentes. Explique em termos de energia, o
que ocorre em cada etapa da curva de aquecimento.
3. Defina ponto de ebulição e fusão.
4. Quando é que uma substância se sublima?
5. Pesquise a densidade das amostras sólidas estudadas.
23
Transformações Químicas
Propriedades Físicas das Substâncias
6. Coloque em ordem crescente a densidade das amostras líquidas que contêm álcool, e
correlacione com o teor alcoólico fornecido pelo fabricante.
7. Referência
D. F. Trindade et al. Química básica experimental. 2ª edição. São Paulo:Ícone, 1998.
8. Anotações
24
Transformações Químicas
5
Métodos de Separação de Misturas Heterogêneas
Métodos de Separação de Misturas Heterogêneas
1. Introdução
A natureza é extremamente rica e nos fornece tudo aquilo de que necessitamos. Apesar de
retirarmos dela o que precisamos para sobreviver, muitas vezes o que ela nos oferece não pode
ser utilizado da maneira como se encontra.
Sabemos que a água do mar é salgada. Apesar disto, não compramos água do mar para
cozinhar, mas sim sal marinho para ser utilizado no nosso dia a dia. Para obtermos este sal, a
água do mar é bombeada para tanques, nos quais é deixada evaporando até que só reste o sal, que
é então recolhido, industrializado, empacotado e vendido.
Existem substâncias que são encontradas na natureza na sua forma mais pura e assim são
por nós utilizadas. Por exemplo, o ouro, a prata, o oxigênio, a água, etc.
Como se pode observar, existe a necessidade de beneficiar as substâncias que temos na
natureza para podermos utilizá-las. A forma mais simples de beneficiamento é a separação
baseada nas diferenças de propriedade das substâncias, isto é, na forma, cor, densidade,
solubilidade, ponto de fusão, ebulição, etc.
As misturas podem ser homogêneas ou heterogêneas em função do número de fases que
apresentam. Misturas homogêneas são aquelas de aspecto uniforme, por exemplo água e álcool.
Misturas heterogêneas são aquelas que não apresentam aspecto uniforme, isto é, apresentam
mais de uma fase, por exemplo os minerais.
Separar os componentes de uma mistura é um dos problemas que normalmente a química
encontra. A escolha do método de separação deverá ser feita em função do tipo de mistura a ser
separada (homogênea e heterogênea) e do estado físico de seus componentes.
Os métodos de separação dos componentes de misturas heterogêneas utilizam processos
que envolvem operações mecânicas, tais como:
Decantação: utilizada para separar misturas cujos componentes se separam
espontaneamente pela ação da gravidade. Nos laboratórios utiliza-se o funil de decantação, na
separação de misturas formadas por dois líquidos imiscíveis.
Centrifugação: método que acelera a decantação através de um forte movimento giratório,
forçando a parte sólida a se depositar no fundo do recipiente.
Filtração: método utilizado para separar sólidos de líquidos. Nos laboratórios realiza-se
com freqüência a filtração através de papel de filtro, convenientemente dobrado e adaptado num
funil (Figura 5.1). A filtração é possível quando o tamanho das partículas sólidas é maior que os
poros do papel de filtro. Quando se deseja apressar a filtração ou quando o sólido a ser filtrado
tem aspecto gelatinoso costuma-se realizar a filtração a vácuo (Figura 5.2).
2. Objetivos
Esta aula tem como objetivos ensinar os principais métodos de separação dos
componentes de uma mistura heterogênea, baseando-se nas propriedades físicas das substâncias.
25
Transformações Químicas
Métodos de Separação de Misturas Heterogêneas
Figura 5.1: Sistema de filtração simples.
Vácuo
Figura 5.2: Sistema de filtração à vácuo.
3. Materiais
Béquer de 250mL (2)
Funil simples de haste longa
Proveta de 100mL
Béquer de 100mL (2)
Bastão de vidro
Suporte universal com argola
Estante com três tubos de ensaio graduados
Papel de filtro qualitativo
Centrífuga
Sistema de filtração à vácuo
Funil de decantação
Vidro de relógio
4. Reagentes e Amostras
Água destilada
Óleo vegetal
Solução de sulfato de sódio 0,1mol/L
Solução de cloreto de ferro(III)
Solução de hidróxido de sódio 3,0mol/L
Solução saturada de hidróxido de bário
Tetracloreto de carbono
Acetato de etila
26
Transformações Químicas
Métodos de Separação de Misturas Heterogêneas
5. Procedimento Experimental
1. Num béquer de 100mL, coloque 10mL de uma solução saturada de hidróxido de bário (água de barita).
Sobre essa solução, adicione, lentamente, 10mL de sulfato de sódio 0,1mol/L. Após essa adição agite a
mistura e deixe repousar por 5 minutos e observe. Filtre a mistura em papel de filtro devidamente
adaptado em um funil de vidro e observe o resultado.
2. Num béquer de 100mL, adicione 10mL de solução de cloreto de ferro(III) e em seguida adicione 10mL
de uma solução de hidróxido de sódio 3,0mol/L, deixe em repouso por 5 minutos e filtre à vácuo.
Anote suas observações.
3. Enumere três tubos de ensaio com uma caneta para vidro e adicione observando o que
acontece.
Tubo 1: 2mL de óleo vegetal e 2mL de água destilada.
Tubo 2: 2mL de água destilada e 2mL de tetracloreto de carbono
Tubo 3: 2mL de tetracloreto de carbono e 2mL de óleo vegetal.
Agite vigorosamente cada tubo, centrifugue, deixe em repouso por alguns minutos e anote suas
observações. Discuta com seu grupo um método de separação das substâncias contidas nos tubo 1 e 2.
4. Num funil de decantação com a torneira fechada, adicione um pouco de água destilada e de
acetato de etila. Tampe o funil e agite. Espere alguns minutos e observe. Retire a tampa e abra
lentamente a torneira do funil, deixando escoar uma das fases da mistura num béquer de
250mL.
7. Resultados
Tabela 5.1: Observações dos ensaios de misturas heterogêneas
Procedimento
Observações
1
2
3
4
7. Exercícios Pós-Laboratório
1. Deseja-se separar os componentes da pólvora negra, que é constituída de nitrato de sódio,
carvão e enxofre. Sabe-se que o nitrato de sódio é solúvel em água, o enxofre é solúvel em
dissulfeto de carbono, enquanto o carvão é insolúvel nestes dois solventes. Proponha um
procedimento para realizar esta separação.
8. Referência
A. M. P. Felicíssimo et al. Experiência de Química: técnicas e conceitos básicos. PEQ-Projeto
de Ensino de Química/Coordenador Ernesto Giesbrecht, São Paulo: Editora Moderna, 1979.
27
Transformações Químicas
6
Métodos de Separação de Misturas Homogêneas
Métodos de Separação de Misturas Homogêneas
1. Introdução
As misturas homogêneas são caracterizadas por apresentarem aspecto uniforme, isto é,
uma única fase, independente do número de substâncias constituintes. Os métodos de separação
dos componentes dessas misturas normalmente envolvem processos físicos, por exemplo, a
destilação.
A destilação objetiva-se separar um líquido volátil, de uma substância não volátil, ou a
separação de dois ou mais líquidos de diferentes pontos de ebulição. É um processo físico que
consiste basicamente na vaporização de um líquido por aquecimento, seguida da condensação do
vapor formado.
Os principais tipos de destilação são: simples, fracionada, a pressão reduzida e com arraste
de vapor. Estes tipos diferenciam-se nas aparelhagens utilizadas e em função das características
dos componentes individuais das misturas a serem separadas.
Destilação Simples só se aplica para separar um líquido de suas impurezas não voláteis,
um solvente usado numa extração ou para separar líquidos de pontos de ebulição muito
afastados.
Destilação Fracionada destina-se separar líquidos miscíveis entre si, mesmo aqueles de
ponto de ebulição próximos. Nesta destilação adapta-se uma coluna de fracionamento entre o
condensador e o balão de destilação. A função dessa coluna é proporcionar em uma única
destilação uma série de micro-destilações sucessivas, de tal modo que, pela extremidade
conectada ao condensador saem somente vapores do líquido volátil, regressando ao balão por
refluxo, a mistura dos vapores contendo o componente menos volátil.
Destilação a pressão reduzida é utilizada para destilar líquidos de pontos de ebulição
elevados ou que se decompõem a temperaturas próximas de seu ponto de ebulição.
2. Objetivos
Esta aula tem como objetivos demonstrar os vários tipos de destilações e observar as
propriedades das substâncias puras, a partir de misturas homogêneas.
3. Materiais
3.1. Materiais para Destilação Simples
Balão de fundo chato
Mangueiras (2)
Manta aquecedora e reostato
Béquer de 250mL
Suporte universal com garra
Bastão de vidro
Termômetro
Condensador tipo tubo
Cronômetro
Rolhas e junta
Água destilada
Refresco em pó
Pedras de ebulição
28
Transformações Químicas
Métodos de Separação de Misturas Homogêneas
3.2. Materiais para Destilação Fracionada
Balão de fundo chato
Mangueiras (2)
Manta aquecedora e reostato
Béquer de 250mL (2)
Suporte universal com garra
Bastão de vidro
Termômetro
Condensador tipo bolas ou espiral
Cronômetro
Rolhas e junta
Coluna de Vigreaux
Água destilada
Pedras de ebulição
Álcool etílico
Observações:
1- Toda a aparelhagem para destilação a pressão normal deve estar aberta para a atmosfera, a
fim de evitar aumento da pressão do sistema com o aquecimento.
2- Deve-se encher o balão até o máximo de 2/3 de sua capacidade. Se o balão estiver muito
cheio, pode ocorrer arraste mecânico do líquido a se destilar, impurificando assim o
destilado. Se o balão estiver muito vazio, isto é, menos da metade de sua capacidade,
ocorrerão perdas desnecessárias devido ao grande volume que o vapor deve ocupar para
encher o balão.
3- Não aquecer o balão até a secura se estiver usando bico de Bunsen, para não haver risco de
quebra.
4- A água no condensador deve fluir no sentido contrário à corrente dos vapores para evitar
choque térmico.
5- O superaquecimento do líquido poderá resultar em uma ebulição tumultuosa, que pode ser
evitada, adicionando-se a mistura, algumas pedras porosas. Neste caso, bolhas de ar contidas
nas pedras porosas são eliminadas pelo aquecimento, as quais, devido a um aumento da
pressão interna, vencem a pressão da coluna do líquido, sendo assim expelidas e rompem a
tensão superficial.
6- Deve-se controlar o aquecimento de modo que o líquido destile a uma velocidade constante,
ou seja, aproximadamente 1gota por segundo.
4. Procedimento Experimental
4.1. Destilação Simples
Adicione no balão de fundo chato a amostra a ser destilada, de modo que a mesma ocupe 2/3 da
capacidade do balão. Monte o sistema de destilação simples, conforme Figura 6.1. Caso tenha
dúvidas pergunte ao professor. Verifique a temperatura inicial da amostra e anote na tabela 6.1
dos resultados. Aqueça o sistema lentamente, aumentando a temperatura através do reostato.
Observe. Anote a variação de temperatura a cada intervalo de dois minutos. Destile por cerca de
30 minutos. No final da destilação, desligue a água de circulação e o aquecimento.
29
Transformações Químicas
Métodos de Separação de Misturas Homogêneas
Figura 6.1: Montagem do sistema de destilação simples.
4.2. Destilação Fracionada
Adicione no balão de fundo chato a amostra a ser destilada, de modo que a mesma ocupe 2/3 da
capacidade do balão. Monte o sistema de destilação fracionada, conforme figura 2. Caso tenha
dúvidas pergunte ao professor. Verifique a temperatura inicial da amostra e anote na tabela 2 dos
resultados. Aqueça o sistema lentamente, aumentando a temperatura através do reostato.
Observe. Anote a variação de temperatura a cada intervalo de dois minutos. Destile a amostra, e
substitua o béquer para separar as diferentes substâncias. Destile por cerca de 30 minutos. No
final da destilação, desligue a água de circulação e o aquecimento.
Figura 6.2: Montagem do sistema de destilação fracionada.
30
Transformações Químicas
Métodos de Separação de Misturas Homogêneas
5. Resultados
Tabela 6.1: Destilação simples(suco)
Tempo (min)
0
2
4
6
8
10
12
14
16
18
20
22
24
26
28
30
T (C)
Tabela 6.2: Destilação fracionada
Tempo (min)
0
2
4
6
8
10
12
14
16
18
20
22
24
26
28
30
T (C)-Pinga
T (C)-Vinho
6. Exercícios Pós-Laboratório
1. Como se comporta o ponto de ebulição com a redução da pressão externa? Justifique.
2. Porque a destilação simples não é usada na separação de líquidos de pontos de ebulição
relativamente próximos?
3. Se você tivesse as seguintes misturas, como faria para obtê-las separadamente? Dê o
procedimento e as vidrarias necessárias.
a) sal, areia, água
b) tetracloreto de carbono, água, etanol
c) sal, óleo, água
4. Traçar os gráficos obtidos na aula experimental, em papel milimetrado (tamanho A4) e
interpretá-los.
7. Referência
A. J. L. O.Pombeiro. Técnicas e operações unitárias em química laboratorial. 1ª edição. São
Paulo: Fundação Calouste Gulbenkian, 1983.
8. Anotações
31
Transformações Químicas
7
Condutividade Elétrica das Soluções
Condutividade Elétrica das Soluções
1. Introdução
Eletrólitos são substâncias que num meio de elevada constante dielétrica, tais como a água,
dissociam-se em íons (cátions e ânions) que se movem na solução, simultaneamente e em
direções opostas, estabelecendo a corrente elétrica.
O íon positivo (cátion) é atraído pelo pólo negativo (catodo) e o íon negativo (ânion) é
atraído pelo pólo positivo (anodo). A dissociação iônica pode ser total (eletrólitos fortes) como
acontece na maioria dos sais e em alguns ácidos e algumas bases, ou parcial (eletrólitos fracos),
como ocorre com a maioria dos ácidos e bases. Deve-se registrar que uma substância que se
comporta como um eletrólito em água, por exemplo, cloreto de sódio, pode não formar uma
solução condutora em outro solvente, como o éter ou hexano. No estado de fusão, a maioria dos
eletrólitos conduzirá a eletricidade.
Os não-eletrólitos são as substâncias que dissolvidas em água, não conduzem a corrente
elétrica e permanecem sem modificações. Por exemplo, sacarose, manose, glicose, etanol e uréia.
Nesta aula serão realizadas experiências para comparar a condutividade elétrica de
diferentes eletrólitos, verificar que a condutividade está relacionada com a mobilidade dos íons
na solução, verificar que a concentração iônica está diretamente relacionada com a carga que
atravessa a solução, verificar que quando se mistura uma substância iônica com uma substância
molecular, há uma interação entre as substâncias, modificando a estrutura das mesmas, e
podemos ainda verificar o efeito da natureza do solvente e do soluto e da concentração deste
último sobre a condutividade do meio.
2. Objetivos
Esta aula tem como objetivos verificar a diferença de propriedades das substâncias iônicas
e moleculares, como também verificar a condutividade elétrica de suas soluções.
3. Materiais
Béquer de 250 mL (3)
Sistema de condução eletrolítica
Pisseta com água destilada
Espátulas
Pipetas graduadas de 5mL
Papel toalha ou absorvente
Bureta de 25mL
Bastão de vidro
Agitador e barras magnéticas
32
Transformações Químicas
Condutividade Elétrica das Soluções
4. Reagentes
Cloreto de sódio
Açúcar
Solução de ácido acético 0,5 mol/L
Ácido sulfúrico 1,0mol/L
Solução de hidróxido de amônio 0,5 mol/L
Álcool etílico P.A.
Solução de hidróxido de bário saturada
Solução alcóolica de fenolftaleína 1%
5. Procedimento Experimental
5.1. Verificação da natureza elétrica de espécies puras e em solução
1. Transfira cerca de 150mL de água destilada e deionizada para um béquer de 250mL. Mergulhe
os eletrodos de cobre, previamente limpos, lavados e secos, e conecte a fonte de corrente
alternada, como mostrado na figura 8.1. Verifique a condutividade elétrica da água. Anote as
suas observações.
Figura 8.1: Arranjo a ser utilizado nas medidas de condutividade das soluções.
2. Adicione ao béquer contendo água, uma pequena quantidade de sacarose, agite até haver
dissolução completa do sólido e meça a condutividade da solução. Anote as suas observações.
3. No mesmo béquer, adicione uma pequena quantidade de cloreto de sódio, agite até haver
dissolução completa do sólido e meça a condutividade da solução. Anote as suas observações.
4. Em outro béquer de 250mL, transfira cerca de 50mL de solução de ácido acético 0,5mol/L e
meça a condutividade da mesma. Dilua com água destilada até 80mL e meça novamente a
condutividade. Anote suas observações. Reserve a solução.
5. Em outro béquer de 250mL, repita o procedimento acima utilizando uma solução de hidróxido
de amônio 0,5 mol/L. Dilua com água destilada até 80mL e meça novamente a condutividade.
Anote as suas observações. Reserve a solução.
6. Misture as soluções utilizadas nos itens 4 e 5 e verifique a condutividade. Compare com os
resultados obtidos acima. Anote as suas observações.
7. Lave o béquer e adicione 50mL de álcool etílico. Meça a condutividade. Em seguida adicione
uma pequena quantidade de cloreto de sódio. Agite e meça a condutividade da solução. Anote
as suas observações.
5.2. Determinação do ponto de equivalência de uma titulação utilizando medida de
condutividade
1. Transfira para um béquer de 250mL, 50mL de solução saturada de hidróxido de bário (água de
barita) e cerca de cinco gotas de fenolftaleína 1% (indicador ácido-base) e agite. Mergulhe os
33
Transformações Químicas
Condutividade Elétrica das Soluções
eletrodos na solução. Faça as conexões como indicadas na Figura 8.2 e verifique a
condutividade da solução.
2. Adicione na bureta de25mL, a solução de ácido sulfúrico 1,0 mol/L e titule lentamente,
adicionando gota a gota esta solução. Homogeneize a mistura após cada adição 0,5mL e
verifique a condutividade.
3. Titule lentamente até o ponto de viragem (rosa para incolor) do indicador.
4. Adicione algumas gotas da solução de ácido sulfúrico 1,0 mol/L e anote as suas observações.
Figura 8.2: Aparelho para titulação.
6. Resultados
Tabela 7.1: Resultados da verificação da natureza elétrica de substâncias em solução
Ensaio
Observação
Conclusão
1
2
3
4
5
6
7
34
Transformações Químicas
Condutividade Elétrica das Soluções
Tabela 8.2: Resultados da determinação do ponto de equivalência de uma titulação utilizando
medida de condutividade
Etapa
Observações
Conclusão
Hidróxido de bário com fenolftaleína
Algumas gotas de H2SO4
Ponto de equivalência
Excesso de H2SO4
7. Exercícios Pós-Laboratório
1. Defina eletrólito. Como se distingue entre um eletrólito forte e fraco. Dê exemplo de cada
tipo.
2.
Quais as substãncias que não conduziram corrente elétrica? Justifique.
3.
Explique o que aconteceu nos ensaios 4 a 6. Escreva a reação.
4. Coloque em ordem crescente de potência dissipada (luminosidade recebida) as substâncias
dos testadas. Justifique sua resposta.
5. O sal de Epsom, MgSO4.7H2O, é vendido em farmácias e usado, em solução aquosa, em
diversas medicações. O metanol, CH3OH, dissolve-se na gasolina, no inverno de climas muito
frios, para impedir a formação de gelo nos tubos de combustível dos automóveis. Qual destes
dois compostos é um eletrólito e qual não o é? Justifique sua resposta.
6. Escreva a reação química que ocorre na titulação e explique o que acontece na condução
eletrolítica nas seguintes etapas:
a) Somente com Ba(OH)2 (item 1)
c) No ponto de neutralização (item 3)
b) Com algumas gotas de H2SO4 (item 2)
d) Com excesso de H2SO4 (item 4).
8. Referência
KOTZ, J.C., TREICHEL Jr, P. Química e Reações Químicas. Vol 1. 3 ed. Rio de Janeiro:
Editora Livros Técnicos e Científicos, 1998.
9. Anotações
35
Transformações Químicas
8
Preparação de Soluções e Cálculos de Concentração
Preparação de Soluções e Cálculos de Concentração
1. Introdução
A solubilidade de uma substância num determinado solvente é controlada principalmente
pela natureza do próprio solvente e do soluto, mas também pela temperatura e pressão. Uma
solução é formada quando uma mistura homogênea de duas ou mais substâncias formam uma
única fase. O componente presente em maior quantidade é chamado solvente e os outros
componentes são denominados solutos.
Quando se pensa em soluções, as primeiras idéias que ocorrem envolvem a água como
solvente: refrigerantes, bebidas, detergentes, remédios em solução oral, etc. Porém muitos
produtos de consumo, tais como os óleos lubrificantes e a gasolina são soluções que envolvem
outros líquidos. Além disso, deve-se estar atento que soluções não dizem respeito somente aos
solventes líquidos. O ar é uma solução de N2, O2, CO2 vapor d’água e outros gases. O vidro,
sólido amorfo, é uma solução de óxidos metálicos (Na2O e CaO, entre outros) em SiO2. A solda
usada para fazer as conexões elétricas nos circuitos das calculadoras e dos computadores é
também uma solução sólida de Sn, Pb e outros metais.
Em química, a quantidade de soluto dissolvido numa unidade de volume ou de massa de
solvente se denomina concentração. A concentração é expressa, comumente, em mol do soluto
por litro da solução; esta concentração é a molaridade da solução.
As soluções podem ser classificadas como:
1- Soluções de reagentes com concentração aproximada;
2- Soluções padrões com a concentração conhecida de uma certa substância;
3- Soluções padrões de referência, com concentração conhecida de uma substância padrão
primária;
4- Soluções padrões de titrimetria com concentração conhecida (seja por pesagem ou por
padronização) de uma substância que não é padrão primária.
A comissão de Nomenclatura da IUPAC refere-se às soluções 3 e 4 como soluções padrões
primárias e soluções padrões secundárias, respectivamente.
Soluções de reagentes são preparadas, geralmente, pela pesagem num béquer de uma
quantidade da substância numa balança semi-analítica e depois adiciona-se um pouco do
solvente, para dissolver a substância e em seguida transferi-se para um balão volumétrico de
capacidade conhecida e completa-se o volume desejado da solução.
Soluções padrões são preparadas pesando-se a quantidade de substância apropriada numa
balança analítica, dissolve-se um pouco com o solvente apropriado e transfere-se com o auxílio
de um funil, à solução para um balão volumétrico de capacidade adequada, tendo o cuidado de
não perder a solução. O funil deve ser lavado algumas vezes com um jato do solvente e
transferindo-se para o balão. Agita-se a mistura e completa-se o volume até o traço de referência
e finalmente homogeneiza-se.
Quando a substância não for facilmente solúvel em água, é aconselhável aquecer o béquer
com a substância e um pouco do solvente, ligeiramente e com agitação, até que a substância se
dissolva completamente. Em seguida, deixa-se a solução resfriar e depois se transferi com o
auxílio do funil para o balão volumétrico. Lava-se o béquer algumas vezes com o solvente,
transferindo para o balão. Em nenhuma circunstância o balão pode ser aquecido.
36
Transformações Químicas
Preparação de Soluções e Cálculos de Concentração
Em alguns casos pode ser preferível preparar a solução padrão a partir de soluções
concentradas, por diluição apropriada.
As soluções que são relativamente estáveis e não são afetadas pela exposição ao ar podem
ser estocadas em frascos de um litro. Nos trabalhos de grande exatidão, os frascos devem ser de
pyrex, ou de outro vidro resistente com tampas esmerilhadas. Para soluções alcalinas os frascos
de vidro são substituídos por frascos de polietileno, pois estas reagem com os silicatos presentes
no vidro. Deve-se observar que os frascos de vidro são obrigatórios para algumas soluções, por
exemplo, iodo e nitrato de prata. Nestes dois casos o vidro deve ser escuro (castanho), pois estas
substâncias degradam-se com a luz.
Os frascos de estocagem devem estar limpos e secos. Para isto, ele deve ser lavado com um
pouco da solução, esgotando-se o líquido e enchendo-se os frascos com o restante da solução,
fechando-os imediatamente. Se o frasco estiver limpo, porém, molhado, deve-se lavá-lo
sucessivamente com pequenos volumes da solução, esgotando-se completamente o líquido
depois de cada lavagem. Depois se enche com a solução e se rotula com o nome da solução,
concentração, data de preparação e nome do analista. Antes de usá-lo para qualquer análise devese homogeneizar a solução.
2. Objetivos
Esta aula tem como objetivos preparar soluções aquosas de diferentes substâncias.
3. Materiais
Béquer de 100mL (3)
Balão volumétrico de 100mL (2)
Espátulas
Béquer contendo 300mL de água recém-fervida
Pisseta com água destilada
Bastão de vidro
Balança semi-analítica
Proveta de 50mL
Frasco de vidro
Frasco de polietileno
4. Reagentes
NaOH (P.A.)
HCl (P.A.)
5. Procedimento experimental
5.1. Preparação da solução NaOH 0,1mol/L
Calcule a quantidade de hidróxido de sódio necessária para se preparar 100mL de solução
0,1mol/L (massa molecular = 40,0 g/mol). Com o auxílio de um béquer de 100mL, pese numa
balança semi-analítica a quantidade de hidróxido calculada. Dissolva com 50mL de água
destilada recém fervida e transfira quantitativamente para um balão volumétrico de 100mL. Lave
o béquer com pequenos volumes de água destilada, transfira para o balão e finalmente complete
o volume com água destilada recém fervida, homogeneize, armazene esta solução em frasco de
polietileno e rotule-a.
Observações:
NaOH é higroscópico e corrosivo. As pastilhas contêm Na 2CO3 como impureza. Deve-se utilizar
água destilada fervida para minimizar a quantidade de CO2 dissolvida. A massa e o volume são
aproximados porque esta solução não é padrão primária e desta forma deve ser padronizada
37
Transformações Químicas
Preparação de Soluções e Cálculos de Concentração
(próxima aula). O armazenamento de solução de NaOH deve ser em frasco plástico porque
NaOH ataca o vidro (NaOH reage com os silicatos que constituem o vidro).
5.2. Preparação de solução 1,0mol/L de HCl
Cuidado: ácido clorídrico concentrado é altamente tóxico e corrosivo
Utilizando os dados do rótulo (36,5-38% HCl, M.M. 36,46, e densidade 1,19g/mL), calcule o
volume do ácido concentrado necessário para preparar 100mL de solução 1,0mol/L. Utilizando
uma pipeta graduada, meça o volume calculado e transfira para um balão volumétrico de 100mL
contendo cerca de 50mL de água destilada. Lave algumas vezes a pipeta com um pouco de água
destilada transferindo sempre para o balão. Agite cuidadosamente o balão e adicione água até
completar 100mL. Feche bem o balão e vire-o de ponta-cabeça baixo, várias vezes, para
homogeneizar a solução. Transfira esta solução para um frasco de vidro e rotule-o.
6. Resultados
Tabela 8.1: Resultados dos cálculos para preparação de soluções
Massa de NaOH (g)
0,1mol/L
Volume de HCl (mL)
1,0mol/L
7. Exercícios Pós-Laboratório
1. Qual a importância de se preparar soluções aquosas?
2. Quais os cuidados que um analista deve observar ao preparar uma solução aquosa de NaOH e
HCl?
3. Calcule a massa necessária para preparar 250mL de solução 0,1mol/L de NaOH.
4. Diferencie solução reagente de solução padrão.
5. Explique como deve ser feita a transferência quantitativa de uma substância para o balão
volumétrico.
6. Utilizando os dados do rótulo (37% HCl, M.M. 36,46g/mol, e densidade 1,19 g/mL), calcule o
volume do ácido concentrado necessário para preparar 250mL de solução 1,0mol/L.
8. Referência
N. Baccan; J. C. de Andrade; O. E. S. Godinho e J. S. Barone. Química Analítica Quantitativa
Elementar, 2a edição, Editora da UNICAMP, Campinas, 1995.
9. Anotações
38
Transformações Químicas
9
Reações Químicas em Solução Aquosa
Padronização de Solução e Estequiometria de Reação
1. Introdução
Em análise química é necessário preparar soluções de concentração exatamente conhecida,
isto é soluções padrões. Essas soluções requerem, muitas vezes, que se faça uma análise
titulométrica para se determinar à quantidade exata do soluto presente no volume da solução.
Este procedimento chama-se padronização da solução.
A solução a ser padronizada é usualmente adicionada por uma bureta. O processo de
adição da solução até que a reação se complete é chamado de titulação e a substância a ser
determinada de titulada. O ponto final da titulação chama-se ponto de equivalência. Este ponto
deve ser identificado por alguma mudança, produzida pela própria solução, como no caso das
soluções de permanganato de potássio (KMnO 4) ou pela adição de um reagente auxiliar
conhecido como indicador. Após a finalização da reação entre a substância padrão e a solução a
ser padronizada, o indicador deverá produzir uma mudança de coloração no sistema. Este ponto
é chamado de ponto final da titulação.
No entanto, nem todas as reações químicas podem ser utilizadas em uma titulação. Uma
reação é adequada quando ela satisfaz as seguintes condições: a) deve ocorrer uma reação
simples que possa ser expressa por uma equação química; b) a substância padrão deverá reagir
completamente com a solução a ser padronizada em proporções estequiométricas; c) a reação
deve ser rápida (em alguns casos, deve-se adicionar um catalisador para acelerar a reação); d)
deve haver uma mudança de energia livre marcante conduzindo a alteração de alguma
propriedade física ou química do soluto no ponto de equivalência; e) deve haver um indicador
específico que defina nitidamente o ponto final da reação.
Para preparar soluções padrões alcalinas, o reagente mais usado é o hidróxido de sódio. No
entanto, este reagente não é padrão primário, porque é higroscópio e sempre contém uma
quantidade indeterminada de água e carbonato de sódio adsorvida no sólido. O carbonato de
sódio pode ser completamente removido quando se prepara uma solução saturada de NaOH, a
qual é deixada em repouso por 24horas. O carbonato de sódio precipita por ser pouco solúvel na
solução. Isto significa que as soluções de NaOH devem ser padronizadas com um reagente
padrão primário, por exemplo o biftalato de potássio, para poder determinar a concentração real
da solução.
As soluções de hidróxido de sódio atacam o vidro e dissolvem a sílica com formação de
silicatos solúveis. A presença de silicatos solúveis causa erros e as soluções de hidróxidos devem
ser conservadas em frascos de polietileno.
2. Objetivos
Esta aula tem como objetivos treinar a técnica de pesagem em balança analítica, ilustrar a
técnica de padronização de solução aquosa de hidróxido de sódio 0,1 mol/L e estudar
estequiometria de reação.
3. Considerações sobre padrão primário
Padrão primário é uma substância que apresenta as seguintes características:
39
Transformações Químicas
Reações Químicas em Solução Aquosa
1- Fácil obtenção, purificação e secagem;
2- Deve existir teste qualitativo simples para identificação de contaminantes, que se presentes
devem estar em pequena porcentagem;
3- Deve possuir massa molecular elevada (para diminuir o erro de pesagem);
4- Solúvel nas condições experimentais;
5- Deve reagir com a espécie de interesse de modo estequiométrico e instantâneo;
6- Deve manter-se inalterada ao ar durante a pesagem. Não pode ser higroscópica, oxidada ou
afetada pelo CO2.
4. Materiais
Espátula de porcelana
Balança analítica
Béquer de 100 mL
Erlenmeyer de 250mL (2 por grupo)
Pisseta com água destilada
Béquer de 300mL com água destilada recém fervida
Bastão de Vidro
Proveta de 50mL
5. Reagentes
Água destilada recém fervida
Fenolftaleína 1%
Biftalato de potássio seco a 105ºC
Solução de NaOH 0,1 mol/L
6. Procedimento experimental
6.1. Solução NaOH 0,1mol/L
Utilize a solução de hidróxido de sódio preparada pelo grupo na aula anterior.
6.2. Padronização da solução de NaOH 0,1mol/L com Biftalato de potássio - KHC8H4O4 (1
mol = 204,23 g)
Pese em duplicata com o auxílio de um papel manteiga, aproximadamente 0,5105g de biftalato
de potássio seco em estufa a 110C por 1-2 horas (anote o valor da massa até a quarta casa
decimal). Transfira quantitativamente para um erlenmeyer de 250mL (esta massa de biftalato de
potássio é a quantidade necessária para reagir completamente com 25mL da solução de NaOH
0,1mol/L). Adicione cerca de 50mL de água destilada fria e recém fervida. Homogeneíze até
dissolução completa. Adicione duas gotas de fenolftaleína 1% e homogeize.
Lave a bureta de 50mL com pequena quantidade da solução de NaOH 0,1mol/L. Fixe a bureta no
suporte universal. Feche a torneira de controle de escoamento. Coloque um béquer de 100mL em
baixo da bureta. Com auxílio de um béquer de 50mL, encha a bureta com solução de NaOH
0,1mol/L e observe se há vazamento. Verifique se há bolha entre a torneira e a extremidade
inferior da bureta. Caso tenha, abra a torneira rapidamente até removê-la. Em seguida, encha a
bureta com NaOH 0,1mol/L e acerte o menisco com o traço de aferição (zero), que fica na parte
superior.
Coloque um papel branco em baixo do erlenmeyer para facilitar a visualização da viragem do
indicador. Titule com a solução de NaOH aproximadamente 0,1mol/L, lentamente e sob
agitação. Se ficar solução de NaOH nas paredes do erlenmeyer, lave com pequena quantidade de
40
Transformações Químicas
Reações Químicas em Solução Aquosa
ÁGUA DESTILADA e continue a adição de NaOH até mudança de coloração do indicador
(incolor para rosa), que persista por mais de 30 segundos. Anote o volume da solução de NaOH
consumido. Esse volume será usado no cálculo da concentração.
Observação:
indicador que o recomendado.
7. Cálculos
7.1. Fator de correção
Calcule o fator de correção, utilizando a seguinte fórmula: Fc
m
0,2042.Vg .M
m = massa do biftalato de potássio pesada (g); Vg = volume gasto da solução de NaOH (mL)
M= molaridade da solução (0,1 mol/L); 0,2042 = mmol do biftalato de potássio
7.2. Molaridade real da solução de hidróxido de sódio
Calcule a média dos fatores de correção da turma. Em seguida, calcule a concentração real da
solução de NaOH 0,1mol/L e escreva no rótulo. Mreal = Fc x 0,1.
8. Resultados
Tabela 9.1: Resultados da padronização da solução de NaOH 0,1 mol/L
Massa de HKC6H4(COO)2 (g) Volume gasto de NaOH (mL)
Média do fator de correção=
Fator de Correção
Molaridade real (mol/L) =
9. Questões Pós-Laboratório
1- Qual a importância em se fazer análise em duplicata?
2- Quais as características necessárias para que uma substância seja considerada padrão
primário?
3- Justifique por que se deve utilizar água destilada recém fervida nesta análise.
4- Por que não se deve armazenar solução alcalina em frascos de vidro?
10. Referências bibliográficas
Ohlweiler, O.A., Química analítica quantitativa. 3a ed., volume 2, Livros Técnicos e Científicos,
Rio de Janeiro, 1981.
41
Transformações Químicas
10
Reações Químicas em Solução Aquosa
Reações Químicas em Solução Aquosa
1. Introdução
Os ensaios de reações por via úmida são realizados com as substâncias em solução aquosa,
ou seja, o reagente e substância problema (amostra) estão no estado líquido. No caso de amostras
sólidas, a primeira etapa é dissolvê-las. O solvente usual é a água, ou um ácido se a amostra for
insolúvel em água.
Para os ensaios de análise qualitativa, somente, empregamos as reações que se processam
acompanhadas de variações nas suas propriedades físicas ou químicas facilmente detectáveis.
Por exemplo, na mistura de soluções, para identificação de um dado íon deve ocorrer: formação
de uma substância sólida (formação de precipitado), desprendimento de gás (formação de gases
identificáveis através da cor, cheiro etc.), ou mudança de coloração (formação de complexos
coloridos). Quando não existem observações visuais ou olfativas para uma reação, a sua
ocorrência pode ser constatada através de um teste auxiliar tal como, um indicador, células
elétricas que respondam a variação de concentração de H+, medidas de condutividade elétrica e
outras propriedades.
Em geral, as reações de análise qualitativa inorgânica empregam soluções aquosas de sais,
ácidos e bases. Estas substâncias são eletrólitos fortes ou fracos, dependendo do grau de
ionização ou dissociação. Por exemplo:
Sal: BaCl2 Ba2+ + 2 Cl- (eletrólito forte)
Ácido: CH3COOH H+ + CH3COO- (eletrólito fraco)
Base: NH4OH NH4+ + OH- (eletrólito fraco)
Ácido: HCl H+ + Cl- (eletrólito forte)
Base: NaOH Na+ + OH- (eletrólito forte)
A equação química que descreve uma transformação durante uma reação é chamada de
equação molecular. Por exemplo:
NaCl (aq) + AgNO3 (aq) AgCl (s) + NaNO3 (aq)
Uma representação mais precisa da reação, como realmente ocorre em solução, é dada pela
equação iônica. Assim:
Na+ (aq) + Cl- (aq) + Ag+ (aq) + NO3- (aq) AgCl (s) + Na+ (aq) + NO3- (aq)
Nesta equação, todas as substâncias iônicas são solúveis e encontram-se dissociadas na
solução. A fórmula do cloreto de prata (AgCl) é escrita na forma molecular porque os seus íons
não estão separados. Como nas reações analíticas por via úmida não detectamos o sal, mas sim
o(s) íon (s) deste sal, representamos estas de uma forma simplificada denominada equação
iônica representativa, isto é, à equação que resume as mudanças que ocorrem:
Cl- (aq) + Ag+ (aq) AgCl (s)
2. Objetivos
42
Transformações Químicas
Reações Químicas em Solução Aquosa
Esta aula tem como objetivos estudar os métodos e os princípios da análise qualitativa,
utilizando-se reações químicas que envolvam os íons ou elementos mais comuns e
representativos.
3. Materiais
Estante com dez tubos de ensaio
4. Reagentes
Solução de cloreto de sódio 0,1mol/L
Solução de nitrato de prata 0,1mol/L
Solução de sulfato de sódio 0,1mol/L
Solução de cloreto de bário 0,1mol/L
Solução hidróxido de sódio de 0,1mol/L;
Solução de sulfato de cobre 0,1 mol/L
Solução saturada de carbonato de sódio
Solução de ácido clorídrico 3,0 mol/L
Solução tiocionato de potássio 0,1mol/L
Solução de nitrato férrico 0,1mol/L
Prego
Papel alumínio picado
5. Procedimento Experimental
Tubo 1
Adicione num tubo de ensaio 10 gotas de solução de cloreto de sódio 0,1mol/L. Em seguida
adicione 10 gotas de nitrato de prata 0,1mol/L. Observe a reação. Escreva a equação química.
Guarde este tubo e examine-o após 30 minutos.
Tubo 2
Adicione num tubo de ensaio 10 gotas de cloreto de bário 0,1mol/L. Em seguida, adicione 10
gotas de solução de sulfato de sódio 0,1mol/L. Observe a reação química. Escreva a equação
química e a característica do precipitado formado.
Tubo 3
Adicione num tubo de ensaio 5 gotas de solução de sulfato de cobre 0,1mol/L. Em seguida,
adicione 10 gotas de hidróxido de sódio 0,1mol/L. Observe a reação química. Escreva a equação
química e a característica do precipitado formado. Guarde este tubo e examine-o após 30
minutos.
Tubo 4
Adicione em um tubo de ensaio 1,0mL de solução saturada de carbonato de sódio. Em seguida,
adicione lentamente pelas paredes do tubo de ensaio, gotas de solução de ácido clorídrico
3,0mol/L. Observe a reação química. Escreva a equação química e anote as suas observações.
Tubo 5
Adicione em um tubo de ensaio 10 gotas de solução de nitrato férrico 0,1mol/L. Em seguida,
adicione 5 gotas de solução de tiocianato de potássio 0,1mol/L. Observe a reação química.
Escreva a equação e a característica do produto formado. Neste mesmo tubo, adicione
lentamente pelas paredes do tubo de ensaio, gotas de solução de ácido clorídrico 3,0mol/L.
Observe a reação química. Escreva a equação química e anote as suas observações.
Tubo 6
43
Transformações Químicas
Reações Químicas em Solução Aquosa
Adicione em um tubo de ensaio 20 gotas de solução de sulfato de cobre 0,1 mol/L. Em seguida
coloque um prego limpo e observe. Anote as suas observações.
Tubo 7
Adicione em um tubo de ensaio alguns pedaços de papel alumínio. Em seguida adicione
lentamente pelas paredes do tubo de ensaio, gotas de solução de ácido clorídrico 3,0mol/L.
Observe a reação química. Escreva a equação química e anote as suas observações.
6. Resultados
Tabela 1: Resultados das reações em solução aquosa
Tubo
Observações
1
2
3
4
5
6
7
7. Exercícios Pós-Laboratório
1. Escreva as reações moleculares, iônica e iônica representativa para todos os ensaios.
2. Classifique as reações químicas realizadas.
8. Referência
A. Vogel. Quíçmica analítica qualitativa. 5ª. edição. São Paulo: Editora Mestre Jou, 1981.
44
Transformações Químicas
Reações Químicas em Solução Aquosa
9. Anotações
45
Transformações Químicas
11
Reações de Óxido-Redução
Reações de óxido-redução
1. Introdução
As reações que ocorrem com transferência de elétrons são chamadas de óxido-redução. As
substâncias que perdem elétrons são chamadas de agentes redutores ou simplesmente redutores e
as que recebem elétrons, chamam-se agentes oxidantes.
O termo oxidação refere-se a qualquer transformação química onde haja um aumento do
número de oxidação (nox). Por exemplo, quando o gás hidrogênio reage para formar água, o nox
dos átomos de hidrogênio passa de zero (0) para mais um (+1), diz-se então que o hidrogênio
sofreu uma oxidação. Emprega-se o termo redução sempre que ocorre diminuição do nox. Por
exemplo, quando o oxigênio reage para formar água, seu nox passa de zero (0) para menos dois
(-2), como houve um decréscimo do nox, diz-se que o oxigênio foi reduzido.
Nos processos de óxido-redução, o aumento ou diminuição de nox é proveniente de uma
transferência de elétrons de um átomo a outro. O agente oxidante provoca a oxidação de uma
substância, sofrendo redução, enquanto que o agente redutor provoca a redução da outra
substância, reduzindo-se.
2. Objetivos
Esta aula tem como objetivo verificar experimentalmente, a tendência que apresentam as
substâncias químicas à oxidação e à redução, bem como os produtos de uma reação de óxidoredução.
3. Materiais
Estante com 10ubos de ensaios graduados
4. Reagentes
Solução de KMnO4 0,1mol/L
Metal: Al, Zn, Cu, Fe, Mg
Solução de H2SO4 3,0mol/L
Solução de HCl 1,0mol/L
Água oxigenada P.A.
Solução de NaOH 1,0mol/L
Solução de FeSO4 0,5mol/L
Sódio metálico
Solução de NH4SCN 0,5mol/L
Fenolftaleína
5. Procedimento experimental
5.1. Reações de óxido-redução em meio ácido
Tubo 1: Em um tubo de ensaio coloque 2mL de solução de KMnO 4 0,1mol/L e em seguida
adicione 1 mL de solução de H2SO4 3,0mol/L e 2mL de H2O2. Agite e observe a reação.
Complete a tabela de resultados.
46
Transformações Químicas
Reações de Óxido-Redução
Tubo 2: Em um tubo de ensaio coloque 2mL de solução de FeSO 4 0,5mol/L e em seguida
adicione 1mL de solução de H2SO4 3,0mol/L e 2mL de H2O2. Agite e observe a reação. Adicione
nesse mesmo tubo algumas gotas de solução de NH4SCN. Observe e anote na tabela de
resultados.
5.2. Reações de metais com ácidos
Nos tubos 3 a 7, que contém um pedaço de metal (Al, Zn, Cu, Fe, Mg), coloque 2mL de solução
de HCl 1,0 mol/L. Anote o tempo que leva para ocorrer cada reação (aproximadamente). Ordene
os metais em ordem crescente de reatividade de acordo com o tempo gasto na reação. Preencha a
tabela de resultados.
5.3. Reações de metais com bases
Nos tubos 8 a 10 que contém um pedaço de metal (Al, Cu, Fe), coloque 3mL de NaOH 1,0
mol/L. Anote o tempo que leva para ocorrer cada reação (se ocorrer). Ordene os metais em
ordem crescente de reatividade de acordo com o tempo gasto na reação. Preencha a tabela de
resultados.
5.4. Experiência Demonstrativa
Num béquer de 1L contendo 800mL de água, colocar 5 gotas de fenolftaleína. Em seguida, na
capela, retirar com uma pinça metálica, um pedaço pequeno de sódio metálico que está guardado
no querosene.
Cuidado, pois o sódio ocasiona graves queimaduras em contato com a pele.
Com a pinça metálica colocar o sódio na água e observar. O que indica a mudança de coloração?
Escrever a equação da reação entre o sódio e a água.
6. Resultados
Tabela 11.1: Resultados das reações de precipitação e complexação
Ensaio
1
2
Ensaio
3
4
Reações de óxido-redução em meio ácido
KMnO4 + H2SO4 + H2O2
Agente oxidante:
Agente Redutor:
Observações:
FeSO4 + H2SO4 + H2O2
Agente oxidante:
Agente redutor
Fe3+ + NH4SCN [Fé(SCN)6]3- + NH4+ (balancear a reação)
Observações:
Reações de metais com ácidos
Al + HCl
Agente oxidante:
Agente Redutor:
Observações:
Zn + HCl
Agente oxidante:
Agente Redutor:
Observações:
47
Transformações Químicas
Cu + HCl
Agente oxidante:
Agente Redutor:
Observações:
5
Fe + HCl
Agente oxidante:
Agente Redutor:
Observações:
6
Mg + HCl
Agente oxidante:
Agente Redutor:
Observações:
7
Ensaio
8
Reações de Óxido-Redução
Reações de metais com bases
Al + NaOH
Observações:
9
Cu + NaOH
Observações:
10
Fe + NaOH
Observações:
Experiência Demonstrativa
7. Exercícios Pós-Laboratório
1. Pesquise e escreva todas as reações dos tubos de ensaios.
8. Referências
A. Vogel. Química analítica qualitativa. 5a. edição. São Paulo: Editora Mestre Jou, 1981.
D. F. Trindade et al. Química básica experimental. 2ª edição. São Paulo:Ícone, 1998.
9. Anotações
48
Transformações Químicas
12
Reatividade Química dos Metais
Reatividade Química dos Metais
1. Introdução
As reações que ocorrem com mudança do estado de oxidação são denominadas reações de
oxidação-redução (redox).
A oxidação é um processo que resulta na perda de um ou mais elétrons pelos átomos de um
elemento. Quando um elemento está sendo oxidado, seu estado de oxidação altera-se para
valores positivos (cátion). O agente oxidante é aquele que aceita elétrons e é reduzido durante o
processo. Por exemplo.
M M x xe
A redução é, por sua vez, um processo que resulta em ganho de um ou mais elétrons pelos
átomos de um elemento. Quando um elemento está sendo reduzido, seu estado de oxidação
altera-se para valores negativos ou menos positivos. O agente de redução é consequentemente
aquele que perde elétrons e que se oxida no processo.
Para que um determinado elemento sofra uma oxidação ou uma redução, entra em jogo um
tipo de energia denominada potencial de oxidação ou potencial de redução, conforme o caso.
Por exemplo:
0
Cu 2 2e Cu Ered
0,337V
0
Ag e Ag Ered
0,799V
Uma reação é teoricamente possível quando a diferença dos potenciais normais de redução
resulta em um número positivo.
Cu 2 Ag Cu 2 2Ag E 0 0,462V
Onde:
Eo = Eo
reduzida
- Eo
oxidada
Eo = 0,799-0,337 = 0,462V
Logo, a reação é possível.
2. Objetivos
Esta aula tem como objetivo verificar a ocorrência espontânea de algumas reações de
oxidação-redução.
3. Materiais
Uma estante com dez tubos de ensaio
Cobre metálico
Zinco metálico
Magnésio metálico
49
Transformações Químicas
Reatividade Química dos Metais
4. Reagentes
Solução de ZnSO4 0,1mol/L
Solução de CuSO4 0,1mol/L
Solução de Fe(NO3)3 0,1mol/L
Solução de AgNO3 0,1mol/L
5. Procedimento Experimental
Dada a tabela dos potenciais normais de oxidação, verifique a probabilidade de ocorrerem as
reações da tabela 12.2, calculando o valor de E. Faça na prática estas reações para comprovar
as suas conclusões. Para isso, coloque um pedaço de metal num tubo de ensaio. Adicione
cuidadosamente a solução reagente sem agitar. Observe e anote o resultado.
Tabela 12.1.: Potenciais de redução de algumas espécies químicas
Reações de Redução
NO3 + 4H+ + 3 e- NO + 2H2O
NO3- + 3H+ + 2 e- HNO2 + H2O
Ag+ + e- Ag
Cu2+ + 2 e- Cu
SO42- + 4H+ 2 e- SO2 + 2H2O
SO42- + 4H+ 2 e- H2SO3 + H2O
2H+ + 2 e- H2
Fe2+ + 2 e-Fe
Zn2+ + 2e- Zn
Mg2+ + 2 e- Mg
-
E (V)
+ 0,96
+0,94
+ 0,80
+ 0,34
0,20V
0,71
0,00
- 0,44
- 0,76
- 2,37
6. Resultados
Tabela 12.2: Resultados das reações de óxido-redução
Tubo
Reação
1
Cu (s) + ZnSO4 (aq)
2
Cu (s) + AgNO3 (aq)
3
Cu (s) + Fe(NO3)3 (aq)
4
Cu (s) + Mg(NO3)2 (aq)
5
Zn (s) + CuSO4 (aq)
6
Zn (s) + AgNO3 (aq)
7
Zn (s) + Fe(NO3)3 (aq)
8
Zn (s) + Mg(NO3)2 (aq)
9
Mg (s) + CuSO4 (aq)
10
Mg (s) + AgNO3 (aq)
11
Mg (s)+ Fe(NO3)3 (aq)
12
Mg (s) + ZnSO4 (aq)
E (V)
Espontaneidade
50
Transformações Químicas
Reatividade Química dos Metais
7. Exercícios Pós-laboratório
1. O que é potencial padrão de redução? Como ele é calculado?
2. Justifique os valores encontrados nesta aula.
3. Coloque em ordem crescente de reatividade as reações estudadas.
4. Em relação ao íon Ag+, qual foi o metal que sofreu maior oxidação?
8. Referência
V. Gentil. Corrosão. 3ª. edição. Rio de Janeiro: Livros Técnicos e Científicos, 1996.
J. B. Russell. Química Geral. 2ª edição, vol. 1. Tradução e revisão técnica: Márcia Guekezian. São Paulo:
Makron Books, 1994.
9. Anotações
51
Tabela 1. Classificação periódica dos elementos
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
H
He
1,008
3
4
5
6
7
8
9
4,003
10
Li
Be
B
C
N
O
F
Ne
6,939
11
9,012
12
10,811
13
12,011
14
14,01
15
16,00
16
18,998
17
20,183
18
Na
Mg
Al
Si
P
S
Cl
Ar
22,99
19
24,312
20
26,982
31
28,086
32
30,974
33
32,064
34
35,453
35
39,948
36
21
22
23
24
25
26
27
28
29
30
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
39,102
37
40,08
38
44,956
39
47,90
40
50,942
41
51,936
42
54,938
43
55,847
44
58,933
45
58,71
46
63,54
47
65,37
48
69,72
49
72,59
50
74,922
51
78,96
52
79,91
53
83,80
54
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
85,47
55
87,62
56
88,905
57-71
91,22
72
92,906
73
95,94
74
(99)
75
101,07
76
102,91
77
106,4
78
107,87
79
112,40
80
114,82
81
118,69
82
121,75
83
127,60
84
126,90
85
131,30
86
La-Lu Hf
Cs
Ba
132,91
87
137,34
88
89-103
Fr
Ra
Ac-Lr
(223)
(226)
178,49
104
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn
180,95
183,85
186,2
190,2
192,2
195,09
196,97
200,59
204,37
207,19
208,98
(210)
(210)
(222)
Ku
(260)
Série dos lantanídios
Número
Atômico
Símbolo
Massa
Atômica
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
La
Ce
Pr
Nd
Pm
Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
138,9
140,1
140,9
144,2
(147)
150,4
152,0
157,3
158,9
162,5
164,9
167,3
168,9
173,0
175,0
Série dos actinídios
89
90
91
92
93
94
95
96
97
98
99
100
101
102
103
Ac
Th
Pa
U
Np
Pu
Am
Cm
Bk
Cf
Es
Fm
Md
No
Lr
(227)
232,0
(231)
238,0
(237)
(242)
(243)
(247)
(247)
(251)
(254)
(253)
(256)
(253
(257)