1
UNIVERSIDADE ESTÁCIO DE SÁ
CURSO DE CIÊNCIAS BIOLÓGICAS
BIOQUÍMICA
Prof. William Volino
I – Funções químicas orgânicas
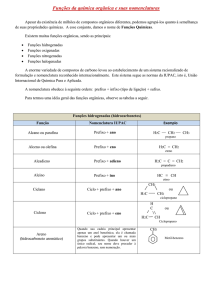
Função química é cada conjunto de substâncias com mesmas propriedades químicas.
As orgânicas são formadas basicamente por átomos de carbono e hidrogênio.
O carbono é tretravalente, ou seja, é capaz de fazer quatro ligações covalentes com outros átomos.
1- Como dar nomes aos compostos orgânicos
Os nomes dos compostos orgânicos são dados seguindo-se as regras da IUPAC1. Para os
compostos de cadeia normal, o nome é constituído de três partes, a saber:
PREFIXO + INFIXO + SUFIXO
prefixo: indica o número de átomos de carbono na cadeia.
Para os dez primeiros, temos:
1C
2C
3C
4C
5C
-
MET
ET
PROP
BUT
PENT
6C
7C
8C
9C
10 C
-
HEX
HEPT
OCT
NON
DEC
infixo: indica o tipo de saturação da cadeia (ligação simples, dupla ou tripla).
AN : para cadeia com ligações simples somente.
EN : para cadeia com pelo menos uma ligação dupla.
IN : para cadeia com pelo menos uma ligação tripla.
Sufixo: é a terminação característica da função química.
2- Nomes de alguns compostos de cadeia normal
2.1- Hidrocarbonetos
Compostos constituídos apenas por átomos de carbono e hidrogênio.
ALCANOS – apresentam cadeia saturada. Fórmula-geral: CnH2n+2.
Exemplos:
o
N de carbonos
1
2
3
4
1
fórmula
CH4
C2H6
C3H8
C4H10
International Union of Pure and Aplied Chemistry.
prefixo
met
et
prop
but
infixo
an
an
an
an
sufixo
o
o
o
o
nome
metano
etano
propano
butano
2
ALCENOS – cadeia insaturada com uma ligação dupla. Fórmula-geral: CnH2n.
Exemplos:
o
N de carbonos
2
3
4
5
fórmula
C2H4
C3H6
C4H8
C5H10
prefixo
et
prop
but
pent
infixo
en
en
en
en
sufixo
o
o
o
o
nome
eteno
propeno
buteno
penteno
ALCINOS – cadeia insaturada com uma ligação tripla. Fórmula-geral: CnH2n2.
Exemplos:
o
N de carbonos
2
3
4
fórmula
C2H2
C3H4
C4H6
prefixo
et
prop
but
infixo
in
in
In
sufixo
o
o
o
nome
etino
propino
butino
ALCADIENOS – cadeia com duas ligações duplas. Fórmula-geral: CnH2n2.
Exemplo: H2C = CH – CH = CH2
1,3-butadieno
CICLO ALCANOS – cadeia saturada (alcano) fechada. Fórmula-geral: CnH2n.
Exemplos:
ciclopropano;
ciclopentano
CICLO ALCENOS – cadeia fechada com ligação dupla. Fórmula-geral: CnH2n2.
Exemplos:
ciclobuteno;
ciclohexeno
AROMÁTICOS
São derivados do benzeno. Todo composto aromático possui o anel ou núcleo
benzênico:
H
8
C
H
C
C
H
C
C H
8
2
6
3
5
4
ou
ou
H
1
7
C
H
naftaleno
9
3
1
7
2
6
3
5
1
0
benzeno
4
4
2
5
1
6
antraceno
7
8
9
1
0
fenantreno
2.2- Derivados halogenados (haletos de alquila)
Derivam de hidrocarbonetos pela substituição de um ou mais átomos de H por átomos de
halogênios ( F, Cl, Br e I). Para dar o nome IUPAC, escreve-se o nome do halogênio seguido do
hidrocarboneto correspondente.
Exemplos: CH3Cl – clorometano;
C2H5Br – bromoetano.
3
2.3- Compostos oxigenados
Álcoois: são compostos que possuem o grupo –OH ligado a um carbono saturado. A
fórmula estrutural dos álcoois é conseguida substituindo-se um ou mais hidrogênios de
um hidrocarboneto pela hidroxila.
Exemplos:
fórmula
CH3OH
C2H5OH
C3H5OH
prefixo
met
et
prop
infixo
an
an
en
sufixo
ol
ol
ol
nome
metanol
etanol
propenol
Faça as fórmulas estruturais dos álcoois acima.
Enóis: são compostos que possuem o grupo –OH ligado a carbono sp2, isto é, com
dupla ligação.
Exemplo: H2C = CHOH etenol
Fenóis: são compostos que apresentam o grupo –OH ligado diretamente ao anel
benzênico.
Exemplo:
OH
hidróxibenzeno (fenol comum)
Éteres: são compostos que apresentam o grupo funcional – O – . O oxigênio aparece
na cadeia como heteroátomo. Na nomenclatura oficial usa-se o sufixo oxi.
Exemplo: CH3 – O – C2H5 metoxi-etano
Aldeídos: são compostos que apresentam o grupo funcional chamado carbonila ( C =
O ) na extremidade da cadeia.
O
Exemplos:
fórmula
HCHO
CH3CHO
H2C=CHCHO
prefixo
met
et
prop
infixo
an
an
en
sufixo
al
al
al
nome
metanal
etanal
propenal
C
H
carbonila no
aldeído
Cetonas: são compostos que apresentam o grupo funcional carbonila no meio da
cadeia.
Exemplos:
fórmula
H3CCOCH3
H3CCH2COCH3
HCCCOCH3
O
prefixo
prop
but
but
Ácidos carboxílicos:
carboxila (-COOH).
infixo
an
an
in
sufixo
ona
ona
ona
nome
propanona
butanona
butinona
C
C
C
carbonila na
cetona
são compostos que apresentam o grupo funcional chamado
Exemplos:
fórmula
HCOOH
H3CCOOH
H2C=CHCOOH
O
prefixo
met
et
prop
infixo
an
an
en
sufixo
óico
óico
óico
nome
ác. metanóico
ác. etanóico
ác. propenóico
C
OH
grupo carboxila
4
Anidridos: os anidridos derivam dos ácidos carboxílicos pela desidratação de duas
moléculas destes. Para dar o nome de um anidrido substitui-se apenas a palavra ácido
por anidrido.
O
Exemplo: 2 H3C-COOH
ácido etanóico
H3C-C
anidrido etanóico
O
H3C-C
O
Sais de ácidos carboxílicos: derivam destes pela substituição do H da carboxila por
um cátion metálico. Para dar o nome, substitui-se o sufixo óico por OATO e a seguir o
nome do cátion.
Exemplos: HCOO Na+ metanoato de sódio;
CH3COO K+ etanoato de potássio
Ésteres: diferem estruturalmente dos ácidos carboxílicos pela substituição do H da
carboxila por uma cadeia carbônica. Utiliza-se o sufixo OATO no lugar de óico.
Exemplo:
HCOOCH3 – metanoato de metila (deriva do ácido metanóico).
2.4- Cloretos de acila
São compostos que derivam dos ácidos carboxílicos com um átomo de cloro no lugar da
hidroxila. Para dar o nome, escreve-se: cloreto + de + nome do ácido com o sufixo OILA no lugar
de óico.
Exemplo: H3C-COCl
cloreto de etanoíla;
H3C-CH2-COCl cloreto de propanoíla
2.5- Funções nitrogenadas
Amidas: Estruturalmente, diferem dos ácidos pela substituição do –OH da carboxila
pelo grupo NH2.
Exemplos:
fórmula
HCONH2
H3CCONH2
H2C=CHCONH2
prefixo
met
et
prop
infixo
an
an
en
sufixo
amida
amida
amida
nome
metanamida
etanamida
propenamida
Aminas: São compostos nitrogenados que possuem o grupo funcional -NH2 (amino).
As aminas diferem das amidas pois não possuem oxigênio na estrutura. Derivam da
amônia (NH3) pela substituição de um, dois ou três hidrogênios (aminas primárias,
secundárias e terciárias, respectivamente).
Exemplos:
fórmula
H3CNH2
H3CCH2NH2
prefixo
met
et
infixo
il
il
sufixo
amina
amina
nome
metilamina
etilamina
5
Nitrilas: são compostos que apresentam o grupo funcional -CN (cianeto).
Exemplo: H3C-CN
etanonitrila
Isonitrilas: apresentam o grupo funcional –N
C (isocianeto).
Para dar o nome: prefixo + il + carbilamina
Exemplo: H3C-N
C metilcarbilamina
Nitrocompostos: apresentam o grupo funcional –NO2 (nitro). Para dar o nome
IUPAC escreve-se a palavra nitro seguida do nome do hidrocarboneto
O
correspondente.
grupo nitro
N
Exemplos: H3C-NO2 nitrometano;
NO 2 nitrobenzeno
O
3- Nomenclatura de compostos de cadeia ramificada
Para dar os nomes dos compostos de cadeia ramificada, primeiramente identifica-se a cadeia
principal. As demais cadeias da estrutura são consideradas como ramificações e recebem nomes
característicos (chamados grupos orgânicos ou radicais4).
Características da cadeia principal (na ordem de prioridade):
1o) Possui o grupo funcional;
2o) Possui o maior número de insaturações;
3o) Possui o maior número de átomos de carbono;
4o) Possui o maior número de grupos orgânicos substituintes.
Normas IUPAC para a nomenclatura de compostos com cadeia ramificada:
1- O nome da cadeia principal é dado da mesma maneira que a cadeia normal;
2- Numeram-se os carbonos da cadeia principal, a partir da extremidade mais próxima do grupo funcional, das
insaturações ou dos grupos orgânicos, nesta ordem;
3- A soma dos números que localizam grupo funcional, insaturações ou grupos orgânicos deve ser a menor
possível;
4- Os números são escritos, de preferência, antes dos nomes dos grupos, separados destes por hífen, e separados
entre si por vírgulas;
5- Grupos iguais repetidos no mesmo composto recebem os prefixos di, tri, tetra, etc;
6- Os grupos são escritos em ordem de complexidade ou em ordem alfabética (recomendado pela IUPAC);
Grupos orgânicos
Grupos orgânicos derivados de alcanos, alcenos e alcinos
Os mais utilizados são, sem dúvida, os grupos derivados dos alcanos pela saída de um átomo de
hidrogênio (monovalentes), chamados de alquil, alquila ou alcoíla.
Atualmente o expressão “grupo orgânico“ vem sendo mais utilizada do que o termo “radical” para definir os grupos
substituintes na cadeia principal.
4
6
O nome IUPAC para as alquilas é: PREFIXO + IL (ou ILA).
o
N de C
1
2
prefixo
met
et
sufixo
nome
IL
IL
METIL(A)
ETIL(A)
Fórmula
H3C
CH3CH2
Os grupos alquil com mais de dois átomos de carbono são:
derivados do propano:
derivados do butano:
CH3 – CH2 – CH2
CH3 – CH – CH3
propil (n-propila)
iso-propila (s-propila)
CH3 – CH2 – CH2 – CH2
CH3 – CH2 – CH – CH3
butila (n-butila)
sec-butila (s-butila)
CH3 - CH - CH2
CH3 - C - CH3
CH3
CH3
terc-butila (t-butila)
isobutila
derivados do pentano:
CH3-CH2-CH2-CH2-CH2
CH3-CH-CH2-CH2
pentila (n-pentila)
CH3
isopentila
CH3
CH3 - C - CH2
CH3
neopentila
Iso e neo são escritos juntos com o nome, enquanto n, s (sec) e t (terc), são separados por
hífen.
Os grupos alquenil(a) são os derivados dos alcenos e que possuem somente uma valência livre.
O nome IUPAC dos alquenilas é: PREFIXO + EN + IL(A). Os mais importantes são:
H2C = CH
H2C = CH -CH2
etenil(a) ou vinil(a)
alil(a)
Os grupos alquinil(a) são os derivados dos alcinos e que possuem uma única valência livre.
O nome IUPAC dos alquinilas é: PREFIXO + IN + IL(A). Destacam-se:
HC C
HC C-CH
etinil
propargil
Grupos orgânicos derivados de hidrocarbonetos aromáticos
Os radicais monovalentes derivados de hidrocarbonetos aromáticos mais importantes são:
CH2
fenil
benzil
CH3
orto-toluil
(o-toluil)
CH3
meta-toluil
(m-toluil)
CH3
para-toluil
(p-toluil)
7
-naftil
EXERCÍCIOS
1. Qual o nome IUPAC para os compostos abaixo?
4
OH
2
5
ramificação
metil (1 C)
cadeia principal
com 5 C
4
2
b.
função álcool
1
3
a.
1
6
5
3
h.c. com uma ligação
dupla (alceno)
6
c.
carbonila cetônica
O
5
3
2
4
1
d.
OH
Br
e.
Br
carbonila aldeídica
f.
CH2 -CH2 -C = O
H
função éster
g.
O
O
h.
O
NH2
i.
grupo amida
O
OH
grupo carboxila
-naftil
8
6
j.
1
5
4
3
2
N
l.
O
m.
NH
Trata-se de uma amida
N-monosubstituída.
O
n.
N
Trata-se de uma amida
N-dissubstituída.
6
o.
H3C
1
5
4
CH 3
2 3
CH 3
Regra dos menores números
CH 3
7
6
p.
H3C
8
1 2
5
4 3
No naftaleno a numeração dos
carbonos é feita desta maneira.
3
2
q.
1
O
A sequência menor recebe
o prefixo + oxi.
A sequência maior recebe o
nome do hidrocarboneto.
Deriva do ácido metilpropanóico
O
r.
O
O
Deriva do ácido etanóico
9
II – Soluções
- São misturas uniformes de átomos, íons ou moléculas de duas ou mais substâncias.
- Geralmente uma das substâncias é líquida
- Possui dois componentes principais:
Soluto: substância dissolvida, em menor quantidade
Solvente: substância que dissolve, em maior quantidade
- O solvente mais comum é a água
Possui 2 átomos de hidrogênio ligados covalentemente a um átomo de oxigênio.
A molécula é polar e se ligas a outras moléculas por pontes de hidrogênio
É capaz de dissolver os solutos polares
É capaz de dissociar os solutos
Obs. Dissociação: consiste na separação dos íons que formam um soluto pelas moléculas da água.
1 – Solubilidade de uma solução
- É a massa do soluto que pode ser dissolvida numa certa quantidade de solvente numa determinada
temperatura.
- Expressa em gramas de soluto por 100 mL ou 100g de solvente numa dada temperatura
Ex.:
Sacarose: 204g por 100g de água a 20°C
308g por 100g de água a 100°C.
- As soluções podem ser:
Saturadas – já possui a quantidade máxima de soluto para chegar ao equilíbrio
Não saturadas – possui menos soluto do que o necessário para chegar ao equilíbrio
Supersaturadas – possui mais soluto do que o necessário
2 – Concentração de uma solução
- Especifica a quantidade de soluto presente numa dada quantidade de solvente ou solução.
- Possui vários tipos, de acordo com as unidades utilizadas
a) Concentração comum ou Densidade
- Informa a massa do soluto em gramas contida em 1 litro de solução (g/L)
C = m/V
Ex. Solução aquosa de cloreto de sódio a 200g/L
Existem 200g de NaCl em 1L
10
b) Porcentagem em massa
- Indica a massa do soluto existente em 100 gramas de solução.
P = gramas de soluto/gramas de solução x 100%
Ex. Solução aquosa de cloreto de sódio a 20%
Existem 20g de NaCl em 100g de solução
c) Porcentagem em massa por volume
- Indica a massa do soluto (em g) num determinado volume (100mL) de solução.
P = m/V x 100%
Ex. Solução aquosa de cloreto de sódio a 20%
Existem 20g de NaCl em 100mL de solução
d) Concentração Molar ou Molaridade (M)
- Indica o número de mols do soluto dissolvido em cada um litro de solução
Obs. 1 mol = 6,02 x 1023 unidades do soluto
M = nº mols/ L da solução
Ex. Solução aquosa de cloreto de sódio a M = 5
Existem 5 mols de NaCl em 1L de solução
e) Concentração Molal ou Molalidade (m)
- Indica a número de mols do soluto dissolvido em um kg de solvente
m = nº mols/ Kg solvente
Ex. Solução aquosa de cloreto de sódio a m = 5
Existem 5 mols de NaCl em 1kg de solvente
f) Concentração Normal ou Normalidade (N)
- Indica o número de equivalentes-grama do soluto dissolvido em um litro de solução.
Obs: equivalente-grama é a massa de uma substância que numa reação química movimenta 1
mol de cargas positivas ou negativas
N = e/V
Ex. Solução aquosa de cloreto de sódio a N = 5
Existem 5 eq-g de NaCl em 1L de solução
11
3 – Diluição de soluções
- Consiste no preparo de soluções a partir da diluição de soluções de concentração conhecida.
- Faz-se a adição de mais solvente a solução. Qual quantidade???
Utiliza-se a fórmula:
C1V1 = C2V2
Onde:
C1 = concentração inicial da solução
V1 = quantidade da solução original que deverá ser utilizada
C2 = concentração final que desejo obter
V2 = o volume final que desejo obter desta solução
Portanto, a incógnita e o V1.
Ex.
De uma solução de NaCl 10M desejo obter 100 ml de uma solução 5M
Logo:
10M . V1 = 5M . 100ml
V1 = 500/10 = 50 ml
12
III – Ácidos e Bases
- Exemplo da água
Existe em forma de moléculas de H2O
Se ioniza ligeiramente formando íons H+ e OHA concentração destes íons é muito baixa na água pura
A reação é reversível
O H+ se liga nas moléculas de H2O e forma o íon hidrônico H3O+
- Os ácidos e as bases alteram a quantidade destes íons nas soluções
a) Ácidos
- Moléculas que liberam íons H+ quando os átomos se dissociam, aumentando sua quantidade na
solução.
Ácidos fortes – reagem fortemente com a água de forma que quase todas as moléculas
liberam próton H+
Ex. HCl
Ácidos fracos – somente uma porção das moléculas liberam H+
Ex. HC2H3O2
b) Bases
- Moléculas que liberam íons OH- quando os átomos se dissociam, aumentando sua quantidade na
solução.
Bases fracas
Ex. NH3 – NH4+ e OH
Bases fortes
Ex. NaOH e KOH
c) Medida de pH
Indica a concentração de íons H3O+ numa solução, indicando acidez ou alcalinidade
Quanto mais íons mais ácida é a solução e menor é o pH
pH 0 a 6,9 – ácido
pH 7,0 – neutro
pH 7,1 a 14 - alcalino