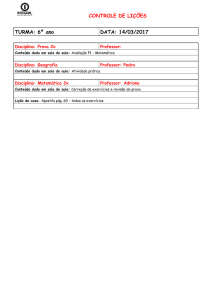
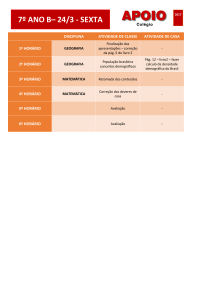
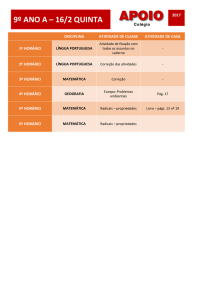
PROVA DISCURSIVA DE QUÍMICA
CURSO DE GRADUAÇÃO EM MEDICINA
INSTRUÇÕES:
1. Só abra a prova quando autorizado.
2. Veja se este caderno contém 5 (cinco) questões discursivas.
Caso contrário chame o fiscal.
3. No caderno das questões escreva o seu número de inscrição no
espaço reservado no canto superior esquerdo de cada página.
4.
Em nenhuma hipótese escreva o seu nome em qualquer das
folhas do caderno das questões da prova. Esse procedimento
resultará na anulação da sua prova.
5. ATENÇÃO: Os itens das questões que exigem espaço próprio
deverão ser resolvidos nos locais reservados. Somente a
resposta final deverá ser apresentada na FOLHA DE
RESPOSTAS.
Apenas as respostas constantes da folha de respostas serão
consideradas.
6. As respostas devem ser feitas com caneta esferográfica azul ou
preta. Somente a resolução de problemas poderá ser feita
usando lápis.
7. Caso necessário, consulte tabelas ao final desta prova.
Polegar
Impressão Digital do
Candidato
DURAÇÃO DA PROVA: 03 HORAS
PROCESSO SELETIVO 2017/1 - CPS
Processo Seletivo 2017/1 Medicina - Pág. 1
Inscrição nº
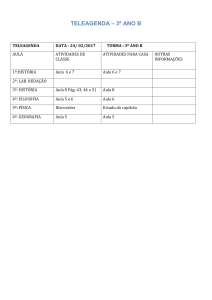
FOLHA DE RESPOSTAS
A solução de cada questão (e seus itens) deverá ser apresentada no espaço
reservado ao longo da prova e, somente as respostas finais, transferidas para esta
folha de resposta.
QUESTÃO ÍTEM
RESPOSTA
A)
Adotou-se como critério o acerto de todos os compostos. (A, B, C e D).
B)
01
C)
D)
E)
NOTA
(reservado)
Processo Seletivo 2017/1 Medicina - Pág. 2
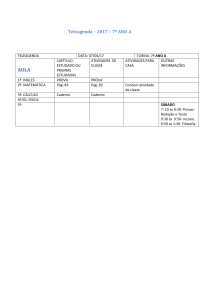
Inscrição nº
QUESTÃO ÍTEM
RESPOSTA
A)
B)
02
C)
Considerando que dois reagentes formam um único produto, então,
está ocorrendo uma organização do sistema. Desta forma, a reação
é entropicamente desfavorecida;
D)
O HCl como catalisador apenas diminui a energia de ativação do
sistema e por conseguinte não afeta o equilíbrio da reação;
E)
Considerando que a reação direta é exotérmica e a reação inversa
é endotérmica, o aumento da temperatura deslocará o equilíbrio da
reação no sentido inverso.
NOTA
(reservado)
Processo Seletivo 2017/1 Medicina - Pág. 3
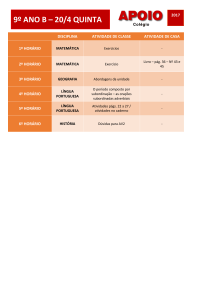
Inscrição nº
QUESTÃO
ÍTEM
RESPOSTA
A)
De um modo geral, os pontos de ebulição de uma série de
compostos semelhantes contendo elementos do mesmo grupo
aumentam com o aumento da massa molar. Isso deve-se ao
aumento das forças de dispersão nas moléculas que possuem
mais elétrons.
B)
Estes compostos possuem pontos de ebulição maiores porque
são capazes de efetuarem ligações de H intermoleculares.
C)
A água possui um ponto de ebulição maior do que o HF porque
é capaz de fazer um número de ligações de H maior (quatro) se
comparado ao HF (duas);
HF > HCl > HBr > HI
03
D)
Ponto atribuído a todos os candidatos, uma vez que a questão
ficou comprometida pela expressão “ponto de ebulição”.
O NF3 apresentará o menor valor de momento dipolar.
E)
NOTA
RESERVADO
Processo Seletivo 2017/1 Medicina - Pág. 4
Inscrição nº
QUESTÃO
ÍTEM
NOTA
RESERVADO
RESPOSTA
C6H12O6 + 6O2 6H2O + 6CO2
ou
A)
C6H12O6 + 6O2 + 6H2O 6CO2 + 12H2O
ou
C6H12O6 + 6O2 + 6H2O + 32ADP + 32Pi
6CO2 + 12H2O + 32ATP
ΔH = -628,3 kJ/mol
B)
Corrigido para ΔrHo = -2.801,3 kJ/mol
04
C)
Exotérmico, ΔH < 0
ΔS = -7,56 kJ.mol-1.K-1
ou
D)
ΔS = -7,56 x 103 J.mol-1.K-1
Corrigido para é ΔrSo = 0,271 kJ/K.mol = 271 J/K.mol
E)
ΔG < 0
Energia livre negativa, processo espontâneo.
Processo Seletivo 2017/1 Medicina - Pág. 5
Inscrição nº
QUESTÃO
ÍTEM
RESPOSTA
A)
% Xetanol = 42%
B)
Xetanol = 0,22
C)
ϻ = 15,74 mol/Kg
D)
M = 8,50 mol/L
05
E)
Etanol e água são de estrutura molecular polar e a interação nesse caso por
ligação de hidrogênio, onde o hidrogênio (carga positiva) atrai o oxigênio (carga
negativa)
NOTA
RESERVADO
Processo Seletivo 2017/1 Medicina - Pág. 6
Inscrição nº
PROVA DE QUÍMICA
ATENÇÃO: Os itens das questões que exigem espaço próprio deverão ser resolvidos nos
locais reservados. Apenas a resposta final deverá ser apresentada na FOLHA DE
RESPOSTAS.
Somente as respostas constantes da folha de respostas serão consideradas.
QUESTÃO 01
A sequência reacional mostrada abaixo refere-se à síntese da molécula alvo denominada aqui
como produto D, que possui, dentre outras funções químicas, a função éster em sua estrutura. Em
relação a essa síntese, pede-se:
A) Forneça as estruturas químicas dos compostos A, B, C e D.
Respostas:
A)
B)
C)
D)
B) Escreva o mecanismo da reação em que o produto C forma a molécula-alvo D.
Resposta:
Resposta:
Inscrição nº
Processo Seletivo 2017/1 Medicina - Pág. 7
C) Segundo a lei cinética de uma reação, qual é a equação de velocidade para o processo descrito
na formação do produto D?
Resposta:
D) Identifique no material de partida os substituintes ativantes e desativantes, se houverem.
Resposta:
E) Considerando que a reação de preparação do produto A ocorreu com 78% de rendimento e
que foram utilizados 2,00 g do material de partida, qual a massa, em gramas, obtida do produto
A.
Cálculos:
Resposta:
Inscrição nº
Processo Seletivo 2017/1 Medicina - Pág. 8
QUESTÃO 02
A seguir é mostrada a reação de hidratação do acetaldeído. Sabendo-se que as energias de ativação
para as reações de formação do hidrato, reação direta () e de decomposição deste, reação inversa
(), são 25,0 e 30,0 kJ/mol, respectivamente. Pede-se:
A) Represente em um gráfico (entalpia no eixo da ordenada e caminho da reação no eixo da
abcissa) os níveis das entalpias dos reagentes, complexo ativado e produtos.
Resposta:
B) Qual a variação de energia (entalpia) para a reação global?
Cálculos:
Resposta:
C) Em termos entrópicos a reação direta é favorecida ou desfavorecida?
Resposta:
Inscrição nº
Processo Seletivo 2017/1 Medicina - Pág. 9
D) Se na reação direta mostrada no enunciado fosse adicionada uma quantidade catalítica de HCl,
este afetaria o equilíbrio químico? Explique sua resposta.
Resposta:
E) Se a reação direta mostrada no enunciado fosse submetida a um aquecimento, o que se pode
afirmar acerca do deslocamento do equilíbrio químico?
Resposta:
Inscrição nº
Processo Seletivo 2017/1 Medicina - Pág.10
QUESTÃO 03
O gráfico abaixo fornece os pontos de ebulição dos compostos de hidrogênio com elementos dos
grupos 14 (4A), 15(5A), 16(6A) e 17(7A) da tabela periódica. Em relação a ele, pede-se:
A) Analisando os compostos constituídos por hidrogênio e os elementos do grupo 14, porque o
CH4 possui o menor ponto de ebulição?
Resposta:
B) Os compostos constituídos por hidrogênio e os elementos dos grupos 15, 16 e 17 apresentam
no NH3, HF e H2O um comportamento anômalo quando comparado aos demais hidretos dos
seus respectivos grupos. Por que o NH3, HF e H2O apresentam ponto de ebulição maiores?
Resposta:
Inscrição nº
Processo Seletivo 2017/1 Medicina - Pág.11
C) Porque a água possui maior ponto de ebulição do que o ácido fluorídrico?
Resposta:
D) Considerando apenas os hidretos do grupo 17 e as suas respectivas forças de ligação, coloqueos em ordem decrescente dos pontos de ebulição.
Resposta:
E) Considerando as substâncias NH3 e NF3, qual delas apresentará o menor momento dipolar (µ)?
Justifique sua resposta apresentando representações vetoriais para as duas moléculas:
Resposta:
Inscrição nº
Processo Seletivo 2017/1 Medicina - Pág.12
QUESTÃO 04
O metabolismo é uma “quebra” gradativa do alimento que ingerimos com a finalidade de prover
a energia para crescimento e funções. Uma das equações química para esse processo é
representada pela degradação da glicose (C6H12O6) a dióxido de carbono (CO2) e água (H2O).
Com base nesse enunciado:
A) Escreva e balanceie a equação química do processo de degradação da glicose.
Resposta :
B) Calcule a entalpia padrão de reação (ΔrHo) em kJ/mol a 298oC.
Dados: ΔfHo (CO2, g) = -393,5 kJ/mol
ΔfHo (H2O, l) = -285,8 kJ/mol
ΔfHo (C6H12O6, S) = -1274,5 kJ/mol
Cálculo:
Resposta:
Inscrição nº
Processo Seletivo 2017/1 Medicina - Pág.13
C) O processo de degradação da glicose é endotérmico ou exotérmico?
Resposta:
D) Se ΔrGo (C6H12O6), que é a energia livre da reação da degradação da glicose
foi -2882,0 kJ/mol, calcule a entropia a 298 oK.
Cálculo:
Resposta:
E) A degradação da glicose é um processo espontâneo? Responda SIM ou NÃO e
justifique.
Resposta:
Inscrição nº
Processo Seletivo 2017/1 Medicina - Pág.14
QUESTÃO 05
Em geral quando se prepara uma solução, os componentes da mesma seguem a regra
“semelhante dissolve semelhante”. Assim, se uma quantidade de etanol (C2H5OH) de 54,6 g
foi misturado com 75,4 g de água, formando uma solução tendo uma densidade de
0,931 g/mL:
A) Calcule a percentagem em massa do etanol e da água na solução.
Cálculo:
Resposta:
B) Calcule a fração molar do etanol na solução.
Cálculo:
Resposta:
Inscrição nº
Processo Seletivo 2017/1 Medicina - Pág.15
C) Calcule a molalidade do etanol na solução.
Cálculo:
Resposta:
D) Calcule a molaridade do etanol na solução
Cálculo:
Resposta:
E) Se nesse caso “semelhante dissolve semelhante”, explique porque isso ocorre para o etanol
em água.
Resposta:
Inscrição nº
Processo Seletivo 2017/1 Medicina - Pág.16
Inscrição nº
Processo Seletivo 2017/1 Medicina - Pág.17