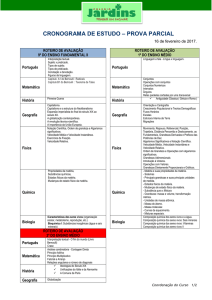
LOQ - 4007 Físico-Química
Capítulo 2: A Primeira Lei:
Conceitos
TERMOQUÍMICA
Atkins & de Paula (sétima edição)
Profa. Dra. Rita de Cássia L.B. Rodrigues
Departamento de Biotecnologia – LOT
E-mail: [email protected] ou [email protected]
Fone: 3159-5027
Cap 2– Termoquímica
1. Os Conceitos
Fundamentais
» (a) Trabalho, calor e energia
» (b) A primeira lei
» 2. Trabalho e Calor
(a) Trabalho de expansão
(b) Trocas térmica
(c) Entalpia
(d) Transformações
adiabáticas
»
3. Termoquímica
(a) Variações de
entalpia padrão
(b) Entalpias padrões
de formação
(c) Dependência das
entalpias de reação
com a temperatura
(d) Transformações
adiabáticas
LISTA DE EXERCÍCIOS
capítulo 2 – Atkins
(sétima edição)
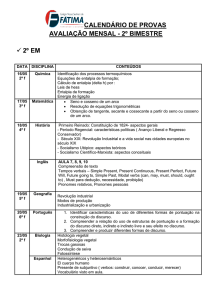
Cap. 2 - A Primeira Lei
Conceitos importantes: abordagem
Sistema (aberto, fechado e isolado)
Vizinhanças
Energia de um sistema
Calor
Processo exotérmico
Processo endotérmico
Movimento térmico
Energia interna
Função de estado
Primeira lei da Termodinâmica
Trabalho de expansão
Trabalho extra ou trabalho adicional
(trabalho elétrico)
Expansão livre
Diagrama indicador
Transformação reversível
Equilíbrio
calorímetro
Bomba calorimétrica
adiabática
Constante do calorímetro
Capacidade calorífica a
volume constante
Capacidade calorífica
molar a volume constante
Capacidade calorífica
específica
Cap. 2 - A Primeira Lei
Conceitos importantes: abordagem
Entalpia
Equação termodinâmica
Calorímetro isobárico
Entalpia padrão de reação
Calorímetro de chama adiabático
Entalpia padrão de combustão
Calorímetro diferencial de varredura Lei de Hess
Capacidade calorífica a pressão
Entalpia padrão de formação
constante
Estado de referência
Capacidade calorífica molar a pressão Entalpias médias
constante
Grupos termoquímicos
Razão entre capacidades caloríficas Lei de Kirchhoff
Termoquímica
Entalpia padrão de transição
Entalpia padrão de vaporização
Entalpia de fusão
Conceito mais importante do capítulo: ENTALPIA
ȃ
uma propriedade muito útil
para contabilizar o balanço
térmico de processos físicos e
de reações químicas que
ocorram a pressão constante
Entalpia
Definição
A variação da energia não é igual ao calor
recebido pelo sistema quando o volume não é
contante.
Nesta circunstâncias parte da energia fornecida
como calor retorna ás vizinhanças na forma de
trabalho de expansão e então dU é menor do que
dq.
Neste caso, o calor fornecido a pressão constante
é igual á variação de outra propriedade termodinâmica
do sistema, a ENTALPIA.
Entalpia
Definição
Se o trabalho PV pode ser realizado pelo sistema, a
pressão constante, V varia
» Parte da energia interna perde-se através do
trabalho
» U=q-pV ou q = U+ pV
»
dU < dq, se o trabalho é realizado; dU=dq, se
não há trabalho
Entalpia
Definição
Definir uma nova variável, H, tal que H= U +
pV
» H é chamado entalpia
Como U, H é uma função de estado
» A pressão constante p, dH = dU +pdV
Esta é uma função importante porque a
maioria dos experimentos são realizados
a pressão constante, ex. Pressão
dH dU d ( pV )
atomosférica
dH dU pdV Vdp( produto)
Entapia é o calor fornecido a pressão
@const. p,dP 0assim
contante
dH dU pdV
ouparaumalateraçãofi nita )
Se pdV=0, dH=dq ou DH=qP
Assim como Cv, Cp é definido como DH DU pDV
dqp/dt = (dH/dT)p
Capitulo 2
1. TERMOQUÍMICA
Termoquímica
Termoquímica é o estudo do calor produzido ou
consumido nas reações químicas.
É um ramo da termodinâmica (vaso da reação e seu
conteúdo constituem um sistema e as reações químicas
provocam troca de energia entre o sistema e as vizinhanças).
Podemos usar a calorimetria para medir o calor produzido
ou absorvido numa reação e identificar à variação de
energia interna (se a reação ocorrer a volume constante) ou à
variação de entalpia (se a reação ocorrer a pressão
constante).
Inversamente, se ΔU e ΔH forem conhecidas para uma certa
reação, é possível calcular a quantidade de calor que a reação
pode produzir.
Termoquímica
Em termoquímica, reações químicas são divididas em duas
categorias:
reação exotérmica
q<0; calor é produzido pelo sistema de reação (ou seja, a
temperatura do sistema aumenta com o início da reação; calor
deve ser transferido do sistema para o ambiente, a fim de retornar
o sistema à sua temperatura inicial)
reação endotérmica
q > 0; calor é absorvido pelo sistema de reação (ou seja, a
temperatura do sistema diminui após o inicio da reação; calor
deve ser transferido do ambiente para o sistema, a fim de retornar
o sistema à sua temperatura inicial)
Estas reações também podem ser
descritas em termos de entalpia, ΔH
Termoquímica
As reações endotérmica e exotérmicas também
podem ser descritas em termos de entalpia, ΔH
ΔH < 0: para um processo exotérmico a pressão
constante = liberação de calor corresponde à
diminuição da entalpia de um sistema ( a
pressão constante).
ΔH > 0:para um processo endotérmico a pressão
constante = Absorção de calor provoca a
elevação de entalpia (a pressão constante).
Variações de Entalpia Padrão
Variações de entalpia = são registradas para processos que
ocorrem em condições admitidas como padrões
Variação de entalpia padrão =
= variação de entalpia
num processo em que as substâncias, nos estados inicial e
final, estão nos respectivos estados padrões:
ΔHθ
O estado padrão de uma substância, numa certa temperatura, é
o da substância na sua forma pura sob pressão de 1 bar.
Exemplo = estado padrão do etanol a 298K = é o etanol líquido
puro, a 298 K, sob pressão de 1 bar.
Estado padrão do ferro sólido, a 500K = é o ferro puro, a 500 K, sob
pressão de 1 bar.
Variações de Entalpia Padrão
Variação de entalpia padrão numa reação ou
processo físico = é a diferença entre as
entalpias dos produtos nos respectivos
estados padrões e a entalpia dos reagentes,
também nos respectivos estados padrões,
todos numa certa temperatura.
Variações de Entalpia Padrão
Exemplos:
A entalpia padrão de vaporização, ΔvapHθ , é a variação de
entalpia por mol quando um líquido puro, a 1 bar, se vaporiza em
gás, também a 1 bar, como na seguinte transformação:
A entalpia padrão de fusão, ΔfusHθ , é variação de entalpia
padrão na conversão de um sólido em líquido
A entalpias padrões podem se referir a
qualquer temperatura.
Entretanto, a temperatura para registro de dados
termodinâmicos é de 298 K (25,00 ºC).
a) Entalpia de Transformações Físicas
Entalpia padrão de transição, ΔtrsHθ = é aquela que
acompanha uma mudança de estado físico.
(A) Entalpia é uma função de estado, a variação de entalpia é
independente do processo que leva de um estado a outro. Esta
propriedade tem muita importância na termoquímica, pois diz
que o valor de ΔHθ será sempre o mesmo, qualquer que tenha
sido o processo de transformação, desde que não se altere os
estados inicial e final!
Conclusão imediata desta igualdade = a entalpia de sublimação de
uma substância é maior do que a entalpia de vaporização da mesma
substância, pois as entalpias de fusão são sempre positivas (todas
as entalpias são consideradas numa mesma temperatura).
a) Entalpia de Transformações Físicas
(B) Outra conseqüência de H ser uma função de
estado é a de as variações de entalpia padrão
dos processos direto e inverso só diferem pelo
sinal.
Exemplos a 298K
Representação Gráfica de Entalpias de
Transformações Físicas
A) Mesmo H, independente do caminho B) Processos
encaminhados e revertidos H difere somente no sinal
Entalpias de Fusão e Vaporização
Entalpias padrões de fusão e vaporização na temperatura de transição
(Ver Tabela 2.3 Atkins 7 Ed. e outros valores podem ser vistos na
Seção de dados no final deste livro)
Entalpias de Transição
Há muitos tipos diferentes de transições, cada
qual com uma mudança na entalpia associada
c) Entalpias de Transformações Químicas
Variações de entalpia que acompanham as reações
químicas. Existem duas maneiras de se registrar este
tipo de entalpia :
1) Escrever a equação termoquímica: combinação de uma
equação química com a correspondente variação de
entalpia padrão:
Reagentes isolados, puros,
nos respectivos estados
padrões
Produtos isolados, puros, nos
respectivos estados padrões
Ex. mudança de entalpia para a equação termoquímica acima = 1 mol
de CH4 (g), na forma de metano gasoso puro, a 1 bar, reage
completamente com 2 moles de O2 (g) na forma de oxigênio gasoso
puro , também a 1 bar, para dar 1 mol de CO2 como dióxido de carbono
puro a 1 bar e 2 moles de H2O (l ) como líquida pura a 1 bar, o valor
numérico é para a reação a 298K.
b) Entalpias de Transformações Químicas
As variações de entalpia que acompanham a mistura (entalpia de
mistura) e a separação (entalpia de separação) são
insignificantes em comparação com as variações de entalpia
de reação em si (entalpia de reação).
b) Entalpias de Transformações Químicas
Uma outra forma de se registrar a variação de entalpia que
acompanha uma reação química consiste em
2) Escrever a equação química e então registrar a entalpia
padrão de reação, ΔtHθ.
Assim, para a reação de combustão, escrevemos:
Continuação a seguir...
Entalpias molares Padrão
Considere a reação:
Entalpia padrão de reação é calculada a partir de:
onde são coeficientes estequiométricos. Assim,
Hm, onde o (J) é a entalpia molar padrão de espécies J.
Simbolicamente, escrevemos 0 = 3C + D - 2A - B, ou
Aqui J denota substâncias e J os números estequiométricos,
Assim, a entalpia padrão de reação:
c) Lei de Hess
É possível combinarem-se as entalpias padrões de
várias reações para se ter a entalpia de outra reação.
Esta é uma aplicação imediata da primeira lei da termodinâmica e é
conhecida como LEI
DE HESS:
A entalpia padrão de uma reação é igual à soma
das entalpias padrões das reações parciais
em que a reação possa ser dividida.
c) Lei de Hess
Observações:
Reações parciais não são realizáveis na prática.
Para cálculo, elas podem ser reações hipotéticas: a única exigência
que se faz é a de as equações estarem equilibradas.
A base termodinâmica da lei de Hess é a independência de ΔrHθ
em relação ao processo.
A importância da lei de Hess está na possibilidade de se ter
uma informação sobre certa reação, que pode ser difícil de
conseguir diretamente, através de informações obtidas em outras
reações.
c) Lei de Hess
Entalpia de reação padrão para hidrogenação de propeno: -124 kJ mol-1
Entalpia padrão de reação para a combustão de propano: -2220 kJ mol-1
Calcule a entalpia padrão de combustão de propeno:
Entalpias Padrões de Formação
A entalpia padrão de formação, ΔfHθ, de uma substância é a
entalpia padrão da reação de formação do composto a partir dos
respectivos elementos, cada qual no seu estado de referência.
Estado de referência de um elemento: é o estado mais
estável de um elemento, numa certa temperatura, sob pressão de 1
bar.
a) Entalpia de Reação em termos de
formação
Conceitualmente: Decompor os reagentes em seus
elementos e depois combinar estes elementos nos
produtos correspondentes.
O valor de Valor de ΔfHθ da reação global é igual à soma das
entalpias de decomposição e de formação.
Como a decomposição é a reação inversa da formação, a
entalpia de cada decomposição é o negativo da entalpia de
formação correspondente.
Logo, com as entalpias de formação das substâncias temos
informação suficiente para calcular a entalpia de qualquer reação
usando:
onde cada entalpia de formação aparece multiplicada pelo
coeficiente estequiométrico correspondente.
a) Entalpia de Reação em termos de
formação
b) Contribuição de Grupo
Vimos que as entalpias das reações podiam ser calculadas pela
combinação das entalpias padrões de formação.
Agora seria possível se saber se é possível chegar às entalpias
padrões de formação a partir da constituição química das
espécies?
Resumidamente, não há nenhum procedimento
termodinamicamente exato de expressar as entalpias de
formação em termos de contribuições de átomos e ligações
isoladas.
No passado, os procedimentos baseavam-se nas entalpias médias
de ligação (variações de entalpia associadas ao rompimento de
certas ligações)
Este procedimento é pouco confiável. O procedimento também não
distingue entre isômeros geométricos, que tem os mesmos átomos e as
mesmas ligações, mas cujas entalpias de formação podem ser
significantemente diferentes.
b) Contribuição de Grupo
Uma abordagem confiável: é imaginar a
molécula constituída por GRUPOS
TERMOQUÍMICOS, um átomo ou um grupo
de átomos que se ligam a pelo menos dois
outros grupos átomos.
Nesta forma, a entalpia de formação está
associada a soma das contribuições
associadas com todos os grupos
termoquímicos em que a molécula pode
ser dividida - algumas vezes chamados de
grupos termoquímicos de Benson.
Contribuições do Grupo Benson
Exemplo: Estimativa de entalpia padrão de formação de hexano (g l) a 298 K:
Decomposição: dois C (H)3(C) e quatro grupos C(H)2 (C)2
Contribuições do Grupo Benson
Exemplo: Estimativa de entalpia padrão de formação de hexano (g l) a 298 K:
Decomposição: dois C (H)3(C) e quatro grupos C(H)2 (C)2
Decomposição da molécula em grupos
2 x C(H)3(C)
2 x (-42,2) kJ/mol
4 x C(H)2 (C)2
4 x (-20,7) kJ/mol
C6H14 (g)
-167,2 kJ/mol
DHof a 298 K do hexano na fase gasosa
Dependência das Entalpias de Reação
com a Temperatura
As entalpias padrões podem ser medidas em
diferentes temperaturas (figura ao lado). Na ausência
de informações diretas, é possível estimar as entalpias
padrões de reação em diferentes temperaturas a partir
das capacidades caloríficas
Aqui, aquecemos de T1 para T2, e admitimos que não há
transição de fase no intervalo de temperatura
considerado. Lei
de Kirchoff é escrita como:
onde ΔrCpθ é a diferençaa entre as capacidades
caloríficas molares dos produtos e as capacidades
caloríficas molares dos reagentes, nas condições
padrões, cada qual ponderada pelo coeficiente
estequiométrico correspondente na equação química :
Dependência de temperatura de entalpias de reação
Ilustração da lei de Kirchhoff
Quando a temperatura se eleva, as entalpias dos produtos e dos
reagentes também aumentam, mas numa extensão diferente.
Em cada caso, a variação de entalpia depende das capacidades
caloríficas das substâncias.
A variação da entalpia da reação reflete as diferenças das variações de
entalpia.