OBJETIVOS
Medir as velocidades de transformação
CINÉTICA ENZIMÁTICA
Avaliar a influência de condições de reação (conc. de
reagentes, enzimas, temperatura, pH, etc..) nas
velocidades de reação
Correlacionar através de modelos matemáticos (empíricos)
as velocidades das transformações com fatores que as
afetam
Caso particular da Cinética Química
Otimização; controle e projeto de reatores
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
1
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
2
Classificação
ENZIMAS
São catalisadores orgânicos protéicos, relativamente
específicos, produzidos por organismos vivos.
Disponibilidade
comercial
Natureza da
reação catalisada
São proteínas com atividade catalítica. Praticamente
todas as reações que caracterizam o metabolismo
celular são catalisadas por enzimas.
Industriais
(Ex: amilases)
Oxiredutases
Analíticas
(Ex: glicose oxidase)
Hidrolases
Médicas
(Ex: asparaginase)
Isomerases
Como catalisadores celulares, as enzimas aceleram
a velocidade de uma reação, sem no entanto
participar dela como reagente ou produto.
Nomenclatura:
substrato
sufixo
ASE
adicionado
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
a
seu
3
Transferases
Liases
Ligases
http://www.chem.qmul.ac.uk/iubmb/enzyme/
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
4
IMPORTÂNCIA INDUSTRIAL
Classificação Internacional das Enzimas
Amiloglicosidase
glicose
(A.
niger)
-------
Produção
de
Proteases (B. subtilis) ---------- Detergentes
Glicose isomerase (L.brevis) ----------Frutose
Invertase (S. cerevisiae) ------- Alimentos (previne a
cristalização do açúcar)
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
5
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
6
1
IMPORTÂNCIA INDUSTRIAL
CINÉTICA ENZIMÁTICA
É a parte da enzimologia que estuda a velocidade
das reações enzimáticas, e os fatores que
influenciam nesta velocidade.
A cinética de uma enzima é estudada avaliando-se
a quantidade de produto formado ou a quantidade
de substrato consumido por unidade de tempo de
reação.
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
7
Medida da Velocidade
8
Fatores que Afetam a Atividade Enzimática
E
S → P
catalase
H
2
O
2
→
H
2
O + 1
2
O
Temperatura
pH
A velocidade de reação
aumenta aumento da
energia cinética
Depende dos grupos
ionizáveis presente no sítio
ativos das enzimas.
2
A velocidade de consumo de [S] ou formação de [P] varia com o tempo
Mesmo mantendo constantes a temperatura e pH, a [E] pode diminuir devido a sua
labilidade (produtos inibidores de sua ação catalítica)
A velocidade da reação deve ser calculada, sempre que possível no instante inicial t = 0
(instante em que as condições experimentais são conhecidas)
Há porém casos, em que a v0 não pode ser medida (falta de técnicas experimentais,
equação química não totalmente conhecida). Nestes casos, a velocidade da reação pode
ser representada por uma velocidade média de substancias escolhidas, ou ainda pela
variação de uma propriedade do sistema (viscosidade)
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
Fatores que Afetam a Atividade Enzimática
Concentração da enzima
A velocidade de reação
aumenta com o aumento da
[E]
Cinética de 1a ordem
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
9
10
Hipóteses
Concentração do substrato
O substrato e a enzima reagem reversivelmente entre
si formando um complexo intermediário chamado de
complexo enzima-substrato
A formação do complexo se dá na proporção de 1 mol
de [S] para cada mol de [E], produzindo 1 mol do
complexo
A velocidade da reação
aumenta com aumento da
[S] até um limite (saturação).
O complexo formado se decompõe regenerando a
enzima e formando produtos
Modelo cinético para explicar a influência das concentrações iniciais de [E]
e [S] na velocidade da reação.
Michaelis-Menten
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
11
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
12
2
d [ES ]
=0
dt
Aplicando estado estacionário, na eq.2, ou seja
E+S
k1
→
←
v
ES → E + P
k2
k3
Sendo:
K1 = constante de velocidade de formação do complexo
K2 = constante de velocidade de dissociação do complexo
K3 = constante de velocidade de decomposição do complexo formando o produto
ν = velocidade de formação do produto
d [ES ]
= k1 [E ][S ] − k 2 [ES ] − k 3[ES ]
dt
(2)
[ES ] = k1[E ][S ]
(4)
k 2 + k3
Substituindo a eq.(3) na eq.(4), teremos:
Balanço de massa
Produto [P]:
(1)
Complexo [ES]
d [ES ]
= k1 [E ][S ] − k 2 [ES ] − k 3[ES ]
dt
(2)
E = E0 − [ES ]
(3)
Enzima [E]:
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
v = Vmáx
k 2 + k3
[ES ] = k
Resolvendo a eq.(5), teremos:
d [P ]
v=
= k3 [ES ]
dt
[ES ] = k1 (E0 − [ES ])[S ]
2
E0 [S ]
+ k3
+ [S ]
k1
(5)
(6)
Substituindo a eq.(6) na eq.(1), teremos:
v=
d [P]
E0 [S ]
= k3
k2 + k3
dt
+ [S ]
k1
v =V
(7)
[s ]
km + [S ]
(8)
Equação de Michaelis-Menten
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
13
14
Por que na região
de elevada [S] a
velocidade é
máxima e
constante?
[s]
km + [S ]
Equação de Michaelis-Menten
v = Vmáx
Sendo:
[ s]
km + [ S ]
Quanto menor o
valor de Km
maior será a
afinidade da E
pelo S
ν= velocidade da reação
V= velocidade máxima da reação
S=Km
Km = constante de Michaelis.
Km = É a concentração de substrato a qual
corresponde a uma velocidade igual a metade
da máxima
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
15
16
Determinação das Constantes Cinéticas (km e Vmáx)
Determinação das Constantes Cinéticas (km e Vmáx)
O método mais utilizado foi a linearização proposta por
Lineweaver-Burk (duplo recíproco) e consiste em inverter
ambos os lados da equação de Michaelis
O método proposto por Hanes, consiste simplesmente em
multiplicar por [S]ambos os lados da equação de Michaelis
1
1
k 1
=
+ m
v Vmáx Vmáx S
S
1
k
=
S+ m
v Vmáx
Vmáx
Y = b + aX
Y = aX + b
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
17
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
18
3
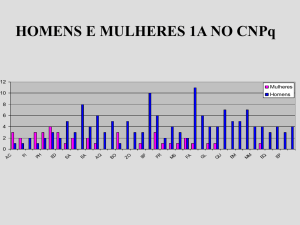
A título de exemplo, consideremos os valores da Tabela 1 que nos
fornece os dados experimentais de uma reação enzimática.
Influência da Presença de um Inibidor
Os inibidores são substâncias que podem diminuir a velocidade
da reação.
Tabela 1: Velocidade inicial de formação do produto em função da
concentração inicial do substrato.
S (g/L)
ν (g/l.h)
0,25
0,78
0,51
1,25
1,03
1,66
2,52
2,19
4,33
2,35
7,25
2,57
Inibição
Reversível
Determinar os valores das constantes cinéticas da reação aplicando
O método de Lineweaver-Burk e de Hanes.
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
19
Irreversível
Competitiva
Não-Competitiva
O inibidor se liga no mesmo
sítio de ligação do substrato
O efeito é revertido
aumentando-se a concentração
de substrato
O inibidor liga-se
reversivelmente à enzima em
um sítio próprio de ligação
Depende apenas da
concentração do inibidor.
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
20
Modelos de Ligação Enzima-Substrato
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
21
Mecanismo para inibição COMPETITIVA
E
+
I
b
EI
+
k1
S
→
←
k 2
v
ES
→
k
E
+
v = Vmáx
P
3
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
Mecanismo para inibição NÃO-COMPETITIVA
[s ]
I
k m 1 + + [ S ]
kI
v=
α
k m ,app
Vmáx
[s]
I km + [ S ]
1 + k
I
Vmax,app =
I
= k m 1 +
kI
α=1 Não ocorre inibição
Efeito do [I] é aumentar km pelo
fator α
Contornado pelo aumento de [S]
Vmax
I
1 + k
I
O inibidor se liga em ambos (E ou ES)
em um sítio distinto do sítio ativo
O efeito do [I] é diminuir a Vmáx
pelo fator α
Nenhuma mudança no km
Não modifica a Vmáx
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
22
23
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
24
4
Influência da Presença de um Inibidor nas Constantes
Cinéticas (Km e Vmáx)
Tipo de Inibidor
Sem Inibidor
Ligação no Sitio Ativo
Nenhum
Efeito Cinético
Não altera as constantes
Competitivo
Compete com o S pelo mesmo Aumentar Km sem alterar a
sítio ativo (reversível pelo S)
velocidade
Não-Competitivo
O inibidor ocupa outro sítio Não altera o Km e a
regulador da enzima (não velocidade decresce com
reversível pelo S)
proporcionalmente a [I]
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
25
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
26
Na tabela estão mostrados os dados experimentais obtidos após a reação de hidrólise do
amido com a enzima α-amilase na ausência e na presença de maltose. Pede-se:
a) Representação gráfica da influência do substrato sobre a velocidade de hidrólise do
amido, na presença e na ausência de maltose;
b) Representação gráfica de Lineweaver-Burk e determinação da constante de Michaelis
(KM) e a velocidade máxima (VM), para ambas condições
Ausência de Maltose
Substrato
Velocidade de hidrólise
(g/L)
(g/min)
12.56
101
11.24
98.2
9
92.4
8.12
90
6.33
82.7
5.61
79.1
4.28
70.9
3.56
65
2.34
51.7
1
28.8
Presença de Maltose
Velocidade de hidrólise
Substrato
(g/min)
10
77
7.7
71.4
5.26
62.5
4.55
58.9
3.33
51.4
2.04
38.9
1.89
37
1.67
34.2
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
27
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
28
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
29
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
30
5
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
31
Resolução
32
Resolução - Comportamento
Hidrólise do amido
Hidrólise do amido
120
120
100
100
80
80
V 60
V 60
40
40
20
20
0
Vmáx
Vmáx
0
0
5
10
15
0
KM
5
Ausência de Maltose
Ausência de Maltose
Presença de Maltose
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
15
34
Resolução - Linearização
Presença de Maltose
1/S
1/V
1/S
1/V
0.080
0.089
0.111
0.123
0.158
0.178
0.234
0.281
0.427
1
0.0099
0.0102
0.0108
0.0111
0.0121
0.0126
0.0141
0.0154
0.0193
0.034722
0.100
0.130
0.190
0.220
0.300
0.490
0.529
0.599
0.013
0.014
0.016
0.017
0.019
0.026
0.027
0.029
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
Presença de Maltose
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
33
Linearização
Ausência de Maltose
10
[S]
[S]
Hidrólise do amido
0.0400
1/V 0.0350
0.0300
y = 0.0325x + 0.0098
0.0250
y = 0.0269x + 0.0078
0.0200
0.0150
0.0100
0.0050
0.0000
0.000
35
0.200
0.400
0.600
[S]
0.800
1.000
1.200
Ausência de Maltose
Presença de Maltose
Linear (Ausência de Maltose)
Linear (Presença de Maltose)
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
36
6
Ausência de Maltose
1/S
-0.289
0.080
0.089
0.111
0.123
0.158
0.178
0.234
0.281
0.427
1
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
37
1/V
0.0000
0.0099
0.0102
0.0108
0.0111
0.0121
0.0126
0.0141
0.0154
0.0193
0.034722
Presença de Maltose
1/S
-0.300
0.100
0.130
0.190
0.220
0.300
0.490
0.529
0.599
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
1/V
0.000
0.013
0.014
0.016
0.017
0.019
0.026
0.027
0.029
38
KM semelhante
Velocidades máximas diferentes
Hidrólise do amido
0.0300
y = 0.0326x + 0.0098
0.0250
0.0200
0.0150
1/V
y = 0.027x + 0.0078
0.0100
0.0050
-0.400
-0.200
0.0000
0.000
-0.0050
0.200
0.400
0.600
1/[S]
Ausência de Maltose
Presença de Maltose
Linear (Ausência de Maltose)
Linear (Presença de Maltose)
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
39
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
40
CINÉTICA ENZIMÁTICA
Aula 4 – Eng. Bioquimica Profa.
Inês Roberto - 2015
41
7