Os compostos orgânicos estão presentes em
nossa vida diária:
UNIVERSIDADE FEDERAL DE CAMPINA GRANDE
CENTRO DE TECNOLOGIA AGROALIMENTAR
CURSO DE GRADUAÇÃO EM AGRONOMIA
DISCIPLINA: BIOQUÍMICA GERAL
PROFESSOR: Adriana Silva Lima
REVISÃO
QUÍMICA ORGÂNICA
1
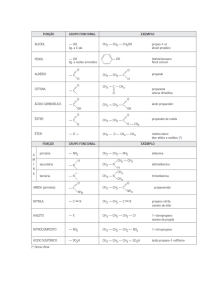
Álcool Comum
Vinagre
C2H6O
C2H4O2
Ainda na pré-história, tais substâncias
eram utilizadas pelo homem para a produção
de calor, para realização de pinturas nos
corpos, em cerâmicas e em desenhos nas
cavernas.
Petróleo e seus derivados.
Desde os alquimistas do
século XVI, as técnicas para
extração de substâncias foram
sendo aperfeiçoadas.
Em 1777, Bergman (Torben Olof
Bergman), introduziu a expressão:
COMPOSTOS ORGÂNICOS
•Do limão extraiu-se o ácido cítrico (C6H8O7);
De acordo com Bergman, tínhamos:
•Das gorduras animais, extraiu-se a glicerina
(C3H8O3).
• COMPOSTOS ORGÂNICOS:
extraídas dos organismos vivos;
Substâncias
• COMPOSTOS INORGÂNICOS: Substâncias
do reino mineral.
1
Juntamente com a distinção
proposta por Bergman em 1777,
desenvolveu-se a concepção de que
um simples composto orgânico não
poderia jamais ser sintetizado pelo
homem, haja visto que para a
produção desses compostos seria
necessário a existência de "uma força
vital" que somente existiria nos
organismos vivos.
Em 1828, as
pesquisas em
Química
orgânica foram
ampliadas,
principalmente
após a
descoberta de
Woller.
Essa idéia, proposta por Jöns
Jacob von Berzelius no ano de 1807,
deu origem à Teoria da Força Vital ou
simplesmente
vitalismo.
Berzelius
CONCEITO ATUAL:
Química orgânica
•
É um ramo da Química que estuda os
compostos do elemento carbono,
denominados compostos orgânicos.
Cianato de amônio
+
aquecimento =
Uréia
IMPORTANTE:
PROPRIEDADES GERAIS:
Existe um pequeno grupo de compostos que
contém carbono, mas são estudados na química
inorgânica
por
não
apresentarem
certas
Tipo de ligação: os compostos orgânicos são
moleculares (ligações covalentes), sem carga
(íons). Por isso os compostos orgânicos não são
bons condutores de eletrólitos (eletricidade).
características comuns aos compostos orgânicos.
São os chamados compostos de transição.
Como exemplos:
NH4CNO – Cianato de amônio;
CO2 – Gás carbônico;
HCN – ácido cianídrico.
2
PF, PE e Estabilidade térmica: Apresentam
baixos PF e PE (por serem moleculares) com
atração entre suas moléculas reduzida,
devido a ausência de cargas elétricas.
•
O açúcar é orgânico e o sal é inorgânico
e apresenta maior estabilidade térmica, uma
vez que o açúcar derrete facilmente.
A velocidade de reação dos compostos orgânicos é lenta,
e geralmente necessitam de catalisadores.
Como exemplo: a hidrogenação de óleos, que melhora a
estabilidade do óleo e modifica a sua textura.
Uma hidrogenação completa modifica a textura do
óleo endurecendo-o para produzir a margarina.
Elementos
constituintes:
são
os
organógenos (C, H, O, N) e em ordem
de frequência: S, P, Cl.
Solubilidade: A maioria dos compostos orgânicos é
pouco solúvel ou insolúvel em água.
As mãos sujas de
graxa devem ser
lavadas em solvente
orgânico: Gasolina
Fibras sintéticas, alimentos, cosméticos,
medicamentos e combustíveis são alguns dos
produtos
que
envolvem
milhões
de
substâncias em que o principal componente é
o
mais
extraordinário
dos
químicos, o:
Carbono
elementos
FRIEDRICH AUGUST
KEKULÉ VON
STRADONITZ
FOI UM QUÍMICO
ALEMÃO.
EM 1857,DETERMINOU
AS CARACTERÍSTICAS
FUNDAMENTAIS DO
ÁTOMO DE CARBONO
NOS COMPOSTOS.
3
O CARBONO É TETRAVALENTE
Trata-se do primeiro
postulado de Kekulé, que
atribui ao carbono a
possibilidade de quatro
ligações.
CH3Cl
A estrutura ao lado
representa o composto:
CH4
As quatro valências são iguais entre si
QUÍMICA ORGÂNICA
CLASSIFICAÇÃO DO CARBONO
Carbono primário
Ligado diretamente, no máximo, a um outro carbono
Cafeína
Vinagre
Glicose
Carbono secundário
Ligado diretamente a dois outros carbonos
(É o ramo da Química que estuda os compostos do CARBONO)
21
22
CADEIAS CARBÔNICAS
Carbono terciário
Ligado diretamente a três outros carbonos
Alifática (aberta)
Normal
Carbono quaternário
Ligado diretamente a quatro outros carbonos
Ramificada
23
24
4
CADEIAS CARBÔNICAS
CADEIAS CARBÔNICAS
Saturada
Cíclica (fechada)
Alicíclica
Aromática
Insaturada
25
CADEIAS CARBÔNICAS
26
HIDROCARBONETOS
Homogênea
Alcano (CnH2n+2)
Cadeia alifática e saturada
CH3 – CH2 – CH2 – CH3
Alceno (CnH2n)
Cadeia alifática e insaturada por uma ligação dupla
CH3 – CH = CH – CH3
Heterogênea
Alcino (CnH2n-2)
Cadeia alifática e insaturada por uma tripa ligação
HC ≡ C – CH3
27
HIDROCARBONETOS
28
HIDROCARBONETOS
Aromático
Alcadieno (CnH2n-2)
Cadeia alifática e insaturada por 2 duplas ligações
H2C = C = CH – CH3
Cicloalcano (CnH2n)
Cadeia cíclica e saturada
Cicloalqueno
Cadeia cíclica e insaturada por dupla ligação
29
30
5
NOMENCLATURA
NOMENCLATURA
PREFIXO
NOME
INTERMEDIÁRIO
SUFIXO
(nº de carbonos)
(saturação na cadeia)
(função)
1C: MET
2C: ET
3C: PROP
4C: BUT
5C: PENT
6C: HEX
7C: HEPT
8C: OCT
9C: NON
10C: DEC
11C UNDEC
Saturadas: NA
Insaturadas:
1= EN
2= DIEN
3= TRIEN
...........................
1≡ IN
2≡ DIIN
3≡ TRIIN
...........................
1= e 1≡ ENIN
HIDROCARBONETOS
CH3 - CH2 – CH3
H2C = C = CH – CH2 – CH3
propano
1,2-pentadieno
H2C = CH – C ≡ CH
butenino
CH3 – CH = CH – CH3
Hidrocarboneto:
O
2-buteno
H2C = CH – CH = CH2
1,3-butadieno
H2C = CH – CH2 – CH3
HC ≡ C – CH3
ciclobuteno
propino
1-buteno
31
32
GRUPOS OU AGRUPAMENTOS
GRUPOS OU AGRUPAMENTOS
H3C –
metil
H3C – CH2 –
H3C – CH2 – CH2 –
etil
propil
CH3 – CH –
isopropil
CH3 – CH – CH2 –
isobutil
CH3
CH2 = CH –
vinil
H
CH3
CH3 – CH2 – CH2 – CH2 –
CH3 – CH2 – CH – CH3
butil
CH3 – C – CH3
terc-butil
sec-butil
CH3
H
H
H
CH2 –
H
H
H
H
H
H
fenil
benzil
33
FUNÇÕES ORGÂNICAS
34
FUNÇÕES ORGÂNICAS
Álcool
Fenol
Álcool primário (grupo hidroxila ligado a um carbono
Grupo hidroxila ligado diretamente ao anel aromático
primário)
Álcool secundário (grupo hidroxila ligado a um carbono
Aldeído
secundário)
Presença do grupamento H –C = O (formila)
Álcool terciário (grupo hidroxila ligado a um carbono
terciário)
Éter
presença de um átomo de oxigênio entre dois carbonos
35
R — O — R'
36
6
FUNÇÕES ORGÂNICAS
OUTRAS FUNÇÕES
Cetona
Amida
Presença do grupamento – C = O (carbonilo)
Ácido carboxílico
Amina
presença do grupo – COOH (carboxila)
Nitrila
Éster
R—C≡N
R—C—X
Haleto
constituem o grupo funcional R – COO – R´
(X = F, Cl, Br, I)
37
NOMENCLATURA
NOMENCLATURA
NOME
INTERMEDIÁRIO
PREFIXO
(nº de carbonos)
1C: MET
2C: ET
3C: PROP
4C: BUT
5C: PENT
6C: HEX
7C: HEPT
8C: OCT
9C: NON
10C: DEC
11C UNDEC
38
Ácido carboxílico
SUFIXO
(saturação na cadeia)
Saturadas: NA
Insaturadas:
1= EN
2= DIEN
3= TRIEN
...........................
1≡ IN
2≡ DIIN
3≡ TRIIN
...........................
1= e 1≡ ENIN
ÁCIDO + NOME DO RADICAL + ÓICO
(função)
O
Hidrocarboneto:
O
Álcool:
OL
Aldeído:
AL
Cetona:
ONA
Ác. Carboxílico:
ÓICO
H 3C – C
OH
ácido etanóico
Éter
MENOR RADICAL + OXI + MAIOR RADICAL
CH3 – CH2 – O – CH3
metóxietano
39
40
NOMENCLATURA
NOMENCLATURA
Éster
Éster
RADICAL + AMIDA
RADICAL + ATO DE + RADICAL
O
H 3C – C
O
NH2
H 3C – C
etanoamida
O – CH2 – CH2 – CH3
Nitrilo
etanoato de propila
Amina
RADICAL + NITRILO
N ≡ C – CH2 – CH2 – CH3
RADICAL + AMINA
butanonitrilo
Haleto orgânico
CH2 – CH3
HALETO + RADICAL
H 3C – N
CH2 – CH2 – CH3
metiletilpropilamina
41
Cl – CH2 – CH2 – CH3
1- cloro propano
42
7
ISOMERIA
ISOMERIA
(COMPOSTOS DIFERENTES COM A MESMA FÓRMULA MOLECULAR)
Isomeria plana
(COMPOSTOS DIFERENTES COM A MESMA FÓRMULA MOLECULAR)
Isomeria plana
Isomeria de cadeia (mesma função e cadeias
Isomeria de função (diferente função química)
carbônicas diferentes)
H3C – H2C – OH
CH2
H3C – CH = CH2
H 2C
H3C – O – CH3
CH2
Isomeria de compensação (diferente posição do
Isomeria de posição (mesma função, mesma cadeia
heteroátomo da cadeia)
carbônica, diferentes posições dos átomos ou radicais a
ela ligados)
H3C – O – CH2 – CH2 – CH3
H3C – CH2 – O – CH2 – CH3
CH3
CH3
H2C – CH2 – CH – CH3
H2C – CH – CH2 – CH3
43
44
(COMPOSTOS DIFERENTES COM A MESMA FÓRMULA MOLECULAR)
(COMPOSTOS DIFERENTES COM A MESMA FÓRMULA MOLECULAR)
ISOMERIA
ISOMERIA
Isomeria plana
Isomeria espacial
Tautomeria (isômeros em equilíbrio químico)
Isomeria geométrica (CIS – TRANS)
aldeído ↔ enol
cetona ↔ enol
Alifáticos (C = C)
A
OH
B
A
O
B
H2C = CH ↔ H3C – C
H
OH
A
O
B
B
CIS
H2C = C – CH3 ↔ H3C – C
A
TRANS
CH3
45
46
(COMPOSTOS DIFERENTES COM A MESMA FÓRMULA MOLECULAR)
(COMPOSTOS DIFERENTES COM A MESMA FÓRMULA MOLECULAR)
ISOMERIA
ISOMERIA
Isomeria espacial
Isomeria espacial
Isomeria geométrica (CIS – TRANS)
Isomeria geométrica (CIS – TRANS)
Alifáticos (C = C)
Cíclicos
CIS
47
TRANS
48
8
ISOMERIA
ISOMERIA
(COMPOSTOS DIFERENTES COM A MESMA FÓRMULA MOLECULAR)
Isomeria espacial
(COMPOSTOS DIFERENTES COM A MESMA FÓRMULA MOLECULAR)
Isomeria espacial
Isomeria óptica (presença de pelo menos um carbono
Isomeria óptica (presença de pelo menos um carbono
assimétrico/quiral)
assimétrico/quiral)
Carbono assimétrico é um átomo de carbono saturado (hibridação
sp3), que apresenta quatro radicais diferentes ligados a ele
R´
R – C* – R´´
R´´´
49
50
(COMPOSTOS DIFERENTES COM A MESMA FÓRMULA MOLECULAR)
(COMPOSTOS DIFERENTES COM A MESMA FÓRMULA MOLECULAR)
ISOMERIA
ISOMERIA
Isomeria espacial
Isomeria espacial
Isomeria óptica (presença de pelo menos um carbono
Isomeria óptica (presença de pelo menos um carbono
assimétrico/quiral)
assimétrico/quiral)
Isômero opticamente ativo (IOA)
IOA = 2 n
Isômero opticamente inativo (IOI)
IOI = 2 n −1
dextrógero
levógero
51
52
9