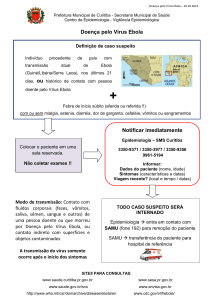
Febre hemorrágica viral
Filoviridae
Marburg e Ebola
Doença do vírus Ebola, 2014
África
Conflitos, Diásporas e Pobreza!
Campos de refugiados, aglomerações
E muitas doenças!
Malária, Febre de Lassa, Cólera, HIV e
Tuberculose!
Ebola
Pobreza, Muita Pobreza!
Malária
Febre Hemorrágica Viral - FHV
Doença humana ou animal causada por cinco
distintas famílias de vírus RNA
Arenaviridae, Bunyaviridae, Flaviviridae,
Filoviridae, Rhabdoviridae.
Febre e desordens hemorrágicas evolui para
Febre alta, choque e morte. Ex. Ebolavirus
Amena. Nefropatia epidêmica escandinava
(hantavírus)
Febres Hemorrágicas
Arenaviridae :
Febre de Lassa (endêmica, Libéria, Serra Leoa, Congo e
Nigéria),
Febre do vírus Lujo (Lusaka, Zâmbia e em Johanesburgo,
África do sul).
Febres hemorrágicas: Argentina, Boliviana, Brasileira e
Venezuelana.
Bunyaviridae - gêneros:
Hantavirus: febre hemorrágica com síndrome renal .
Nairovirus : febre hemorrágica da Criméia – Congo
Orthobunyavirus: vírus Garissa e vírus Ilesha
Phlebovirus : vírus da Febre do Vale Rift (RVF)
Febres Hemorrágicas
Flaviviridae: Dengue, Febre amarela, Encefalite
transmitida pelo carrapato - dois virus:
vírus da febre hemorrágica de Omsk e vírus da
doença da floresta de Kyasanur.
Rhabdoviridae: quatro casos (dois fatais) de
febre hemorrágica do distrito Bas-Congo na
República Democrática do Congo.
Filoviridae - Filovirus
Vírus de Marburg
Febre hemorrágica de Marburg
Ebola Zaire
Febre hemorrágica Ebola
Ebola Sudão
Febre hemorrágica Ebola
Ebola Reston
Não Patogênico para humanos
Ebola Costa do Marfim
Febre hemorrágica Ebola
Ebola Bundibugyo
Febre hemorrágica Ebola
Árvore filogenética: Comparação
entre os Marburgvirus e Ebolavirus.
Marburgvirus
Sobre a febre hemorrágica de Marburg
Marburg
História e epidemiologia: vírus de Marburg
Em 1967, na acolhedora
cidade de Marburg
Alemanha.
Laboratório de produção
de vacina de Pólio
Macaco verde africano
Cercopithecus aethiops
Cultivo de células
contaminada enviada a
outros laboratórios
Marburg: primeira epidemia, 1967
Alemanha: Marburg e Frankfurt – 21 pessoas
Antiga Yugoslávia (Sérvia) - Belgrado.
Primeiro isolamento e identificação de filovírus
37 pessoas infectadas
6 casos de infecção secundária
7 casos fatais
Epidemias: 1975, 1980, 1987, 1998, 2004 e 2005...
Quênia, Zimbábue, Congo, Angola, Uganda.
Ocorrência de Febres hemorrágicas
associadas vírus de Marburg: caverna Kitum
Zimbábue
1975, em Johanesburgo, África do Sul
Jovem australiano de 20 anos em regresso de longa viaje a Zimbábue
– morto quatro dias após.
Quênia – Janeiro, 1980.
Charles Monet, um francês de 56 anos faleceu em 7 dias.
Visitou a caverna Kitum, o Monte Elgon.
Jovem de 19 anos - companheira de viagem. Sobreviveu.
uma enfermeira de 20 anos. Sobreviveu.
Médico também morreu.
Quênia – 13 de agosto de 1987,
Jovem 15 anos Morreu após 10 dias. Caverna Kitum.
Monte Elgon – caverna Kitum
Monte Elgon – caverna Kitum
Caverna Kitum- Celebração
em Masai
Epidemias associadas ao vírus de
Marburg: RDC e Angola
Entre 1998 e 2000 - República Democrática do Congo.
154 doentes – morte de 128 (mortalidade 83%).
Mineiros - mina de ouro de Durba, aldeia de Watsa
Entre 2004-2005 - Angola
maior surto de febre hemorrágica de Marburg da
historia.
província de Uíge, outubro de 2004.
Morte de Maria Bonino
374 casos (mortalidade 88%)
Revolta popular
Febre hemorrágica associada ao vírus de
Marburg: Uganda
Entre Junho e agosto de 2007 - Uganda
três casos entre mineiros de Kamwenge.
Dois se infectaram ao atender o companheiro doente
Um morreu
Holanda - Julho de 2008, holandesa após férias
Uganda.
Havia visitado varias cavernas habitadas por morcegos
Morcegos? Outros animais silvestres?
Morcegos
Ebola
Sobre a febre hemorrágica Ebola
Vírus Ebola: Sudão e Zaire (RDC) 1976
O primeiro surto de Ebola em Nzara, Sudão (subtipo:
Sudão)
O segundo surto em Yambuku, Zaire, Ebola-Zaire
(subtipo: EBOZ).
mais de 284 pessoas
taxa de mortalidade de 53%.
EBOZ infectou 318 pessoas
alta taxa de mortalidade (88%).
O reservatório natural do vírus não foi identificado.
Perto do rio Ebola que deu nome a doença.
Rio Ebola- Zaire -RDC
O rio Ebola é localizado na região norte da RDC.
Ebola Reston e Costa do Marfim
Surto de Ebola em Reston, Virginia, USA
(subtipo EBOR), 1989.
Macacos oriundos de Mindanao, Filipinas.
As pessoas infectadas com o EBOR - não
adoeceram - soro converteram
não desenvolveram a febre hemorrágica Ebola.
Surto de Ebola na Costa do Marfim - necropsia
chimpanzé da floresta Tai – 1994/1995
sub tipo EBO-IC - Ebola da floresta Tai - TAFV
Ebolavirus 2014
Guine, Serra Leoa, Libéria
Mais de 5000 mortes
Ebola vírus: casos e mortes
de abril a julho de 2014
Ebola surtos até 19 de julho de 2014
Ebola Costa Ocidental:
agosto-novembro
Atualização dos casos de Ebola
15 de Dezembro de 2014. CDC/USA
Atualização dos casos de Ebola
15 de Dezembro de 2014. CDC/USA
CDC 2014 Ebola Outbreak in West Africa Outbreak Distribution Map
Epidemiologia molecular Guiné 2014
Seqüenciamento genômico EBV:
Instituto Broad e da Universidade de Harvard, com
Ministério da Saúde de Serra Leoa e pesquisadores de
diversos institutos e continentes.
Mais de 99 genomas do vírus Ebola oriundos de 78
pacientes diagnosticados em Serra Leone
Mais de 300 alterações genéticas - mutações
Distinto dos surtos anteriores
Variações nas seqüências indicam uma única introdução
do vírus entre os humanos
O EBV se dispersou pessoa a pessoa por muitos meses
Variações genéticas
Região do genoma do vírus que codifica as proteínas.
Algumas das variações genéticas afetavam os Primers
(pontos para a síntese de DNA de partida) utilizados no
diagnóstico por PCR,
Enfatizando a importância e a necessidade da vigilância
genômica.
Técnica: Deep sequence (seqüenciamento é repetido
várias vezes até chegar a um resultado de alta confiança)
2014 Zaire Ebolavirus (EBOV )
Para acelerar os esforços de resposta, as seqüências de tamanho completo foram
divulgadas no Centro Nacional de Informações Biotecnológicas do banco do NCBI)
2014 -Zaire Ebolavirus (EBOV) e o 1976-Zaire Ebolavirus: ancestral comum
Transmissão
Humano para humano
Animal para humano
Mecanismo de transmissão
Contato Direto com as secreções de indivíduos
primatas e não primatas com sintomas de
infecção.
Morcegos – infectados não sintomáticos ?
Transmissão aérea ?
Em alguns primatas não humanos oral ou conjuntiva
Nota do CDC
Humano – humano: contato direto
Lesões/micro lesões na pele ou na mucosa:
Cerimônias fúnebres – embalsamento:
contato com sangue, secreções, fluidos corporais
ou de órgão de pessoa ou animais infectados.
contado direto com o cadáver.
Sexual: o sêmen até sete semanas após a
recuperação.
Em laboratório
Em laboratório: o vírus não é transmitido por
via aérea de forma natural.
Transmissão transmitida através de gotículas
inaláveis produzidas em laboratório.
Vírus puro, concentrado.
Os Ebolavirus são classificados como armas
biológicas de categoria A.
Contato indireto
Meio ambiente e equipamentos contaminados
Instrumentos médicos
As transmissões em meio hospitalar na África
associadas a reutilização de agulhas
inexistência de medidas de precaução universais.
OMS: Os profissionais de saúde que não usem
vestuário de proteção apropriado apresentam
um risco acrescido de contrair a doença.
Ebola Serra Leoa/Libéria
Serviço médico no Zaire, 1976.
Ebola Uganda 2000
Transmissão de animais – humana
Contaminação direta ou indireta com sangue,
secreções, fluidos corporais e órgãos de
animais infectados.
A manipulação de chimpanzés, gorilas, morcego
frutívoro, macacos, antílopes e porcos-espinhos
encontrados doentes ou mortos.
Células oriundas de animais infectados
Vírus Ebola em animais
Primatas não humanos - fonte de infecção ?
Não são reservatórios – infecção acidental
1994 – surtos de Ebola em chimpanzés e
gorilas
Costa do Marfim, Floresta Tai.
Tai Forest Ebolavirus – TAFV
5000 gorilas mortos
Surto de Ebola em gorilas, 1994
Costa do marfim
Filipinas: surtos em macacos
Ebola subtipo Reston
1989- surtos de Ebola nos macacos (Macaca
fascicularis) Filipinas
importados pelo EUA (1989, 1990 e 1996)
importados pela Itália em 1992.
Desde 2008, surtos de doença mortal em suínos
na República popular da China e nas Filipinas.
Infecção assintomática em suínos natural e
experimental – subtipo Reston
Macaca fascicularis
Outros animais
Rastreamento do vírus de 1976 a 1998:
30.000 mamíferos, aves, répteis, anfíbios e artrópodes
recolhidas nas regiões dos surtos,
não foi detectado Ébola vírus
Alguns vestígios genéticos em seis roedores na
República Centro-Africana: Mus setulosus e Praomys e um
musaranho (Sylvisorex ollula)
Os morcegos de fruta: reservatório
são também uma fonte alimentar em algumas regiões da
África ocidental, onde são defumados, grelhados ou usados
na preparação de sopa.
Consumo de carne selvagem
Morcegos
morcegos das frutas da família
Pteropodidae
Ciclo enzoótico
Hospedeiros naturais – ciclo enzoótico
África e Filipinas
morcego de frutas
Família: Pteropodidae
Espécies:
Hypsignathus monstrosus,
Epomops franqueti
Myonycteris torquata
Hospedeiros naturais – ciclo enzoótico
África e Filipinas
morcego de frutas
Família: Pteropodidae
Espécies:
Hypsignathus monstrosus,
Epomops franqueti
Myonycteris torquata
Ciclos: enzoótico e epizótico
Mecanismo de transmissão: Hipótese
Os morcegos descartam fruta parcialmente ingerida.
Mamíferos terrestres ingerem a fruta contaminada.
Considerado um possível meio de transmissão indireta
entre o hospedeiro natural e as populações animais.
Surtos ocasionais:
a produção de fruta
comportamento animal
o local e a época
Febre Hemorrágica e florestas
Vírus de Marburg (MARV)
Vírus do Ebola
Filoviridae
Características dos Filovirus
Vírus de Marburg
Vírus Ebola
Classificação
Ordem: Mononegavirales
Vírus com genoma RNA, não segmentado,
senso negativo
Famílias: Paramyxoviridae, Rhabdoviridae,
Filoviridae
Família Filoviridae:
Gêneros: Marburgovirus e Ebolavirus
Ebola (EBOV) e Marburg (MARV)
Cortesia do CDC Microscopia eletrônica de transmissão (MET). Efeito
citopático e presença de virions em tecidos infectados com EBOV.
Filovirus – Patógeno animal
Vírus de Marburg
Vírus Ebola
Ebola Zaire ou ZEBOV,
Ebola Sudão ou SEBOV,
Ebola Costa do Marfim ou TAFV
Ebola Bundibugyo – Uganda 2008
Ebola Reston – USA e Filipinas – assintomático para humanos e
infecções em macacos
BDBV, EBOZ e o SUDV: grandes surtos na África.
Ebola sub tipo Reston - Suínos – infecções assintomáticas
Todos os subtipos doença experimental: macacos, cobaias,
hamsters e camundongos
Taxonomia e características
Ordem: Mononegavirales
Família: Filoviridae
Gênero: Filovirus
Formato: pleomórficos, longo
filamento em forma de U, 6 ou
circular.
Tubular ou filiforme
Diâmetro: 80nm
Comprimento médio:
Vírus Ebola: 974 to 1,086 nm
Vírus de Marburg : 795–828 nm
Partículas de 14,000 nm foram
observadas em cultivo celular.
Estrutura e Composição
Envelope lipídico
Grandes Peplômeros: 7-10 nm
Rígido nucleocapsídeo: 50nm
Simetria helicoidal
Massa molecular: >500x106
Densidade em tartarato de
potássio: 1,14g/cm3
Nucleocapsídeo
Consiste genoma RNA fita
simples helicoidal
Envolto pelas proteínas NP,
VP35, VP30 e L.
Envelope externo derivado
da membrana celular com
projeções, de glicoproteínas
de 10 nm (GP) espículas.
Entre o Capsídeo e o
envelope estão as proteínas
VP40 e VP24
Genoma
Ácido Ribonucléico- RNA. Molécula linear. Fita única. Sentido
negativo. Tamanho: 19.1 kb. Complementaridade inversa:
términos 3' e 5‘. Não possuem 5' Cap nem são poliadenilados.
Genes: codificam sete proteínas estruturais e uma não estrutural.
As regiões leader e trailer não são transcritas: sinais de controle
da transcrição, replicação e empacotamento.
3'-UTR-NP-VP35-VP40-GP-VP30-VP24-L-5'-UTR
Replicação de Filovírus
Genoma
Marburg
Ebola
Gene 4: glicoproteína
O gene 4 - É transcrito em
duas frentes abertas de leitura
(ORF)
O produto gênico primário é
uma pequena glicoproteína
(sGP).
A Glicoproteína total (GP)
expressa por dois
mecanismos diferentes:
Edição do RNA ou
Frameshift - alterações no
quadro de leitura da
transcrição
Duas glicoproteínas: sGP e GP1-GP2
Glicoproteína solúvel ou secretada (sGP)
Menor, não estrutural,
Dimérica, solúvel
Transcrita diretamente do RNAm viral.
Função- desconhecida (?)
Não é encontrada na partícula viral
Secretada da célula infectada para o sangue.
Duas glicoproteínas: sGP e GP1-GP2
Glicoproteína tipo I
Transmembrana. Trimérica. Projeções no envelope.
Transcrição editada.
Os trímeros-heterodímeros : GP1-GP2 ligados pontes
de dissulfideo.
Clivagem da GP precursora pela convertase Furina .
Função: ligação (GP1) e fusão (GP2).
Alvo dos anticorpos neutralizantes.
Proteínas virais e funções
Ribonucleoproteína: NP, VP30, VP35, e L.
Marburgvirus é capaz replicar na ausência VP30.
A VP35 bloqueia a indução de Interferon
tanto nos vírus de Marburg como nos vírus
Ebola
Seqüência da VP35 – no genoma do morcego
VP40 eVP24 formam a membrana interna viral
(matriz)
Ciclo de replicação viral
Sinais e sintomas
Febre Hemorrágica
Alerta!
Febre hemorrágica de Marburg
Febre, dores de cabeça e mialgia
Incubação: 5 a 10 dias.
Inflamação maculopapular, vômitos, dores do peito e
abdominais e diarréia.
Agravamento: icterícia, delírios, problemas hepáticos e
hemorragias extensas.
Recuperação: inflamação dos testículos, hepatite
recorrente, inflamações da medula espinal, olhos e da
glândula parótida.
Dependendo dos serviços de saúde e apoio hospitalar:
mortalidade entre 25% até 92%
Febre hemorrágica Ebola:
Incubação: 8 a 10 dias, pode ocorrer entre 2 e 21
dias.
Alerta: diferencial
Os primeiros sintomas do Ebola: febre
semelhantes a malária, dengue, Lassa ou outras
doenças tropicais, antes da doença progredir
para a fase hemorrágica.
Estágio inicial:
Forma súbita semelhante à gripe
Fadiga, febre, dor de cabeça e dores nas articulações,
musculares e abdominais.
Anorexia, vômitos e diarréia – insuficiência renal e
hepática
Menos comum: a inflamação da garganta, dores no
peito, soluços, falta de ar e dificuldade em engolir.
Em 50% casos - apresentam exantema maculopapular.
Começam os problemas hemorrágicos
Agravamento: hemorragias
Fase hemorrágica
Comprometimento do sistema circulatório:
coagulopatia.
Primeiras hemorragias internas ou subcutâneas : olhos
avermelhados ou presença de sangue no vômito, na
tosse e nas fezes
40-50% dos casos - hemorragias nas dobras da pele e
das mucosas: sistema digestivo, nariz, vagina e gengivas.
Hemorragias intensas são raras
Sintomas hemorrágicos - agravamento do prognóstico
Perda de sangue - morte.
Fisiopatologia
Tropismo viral: células endoteliais, os fagócitos
mononucleares e os hepatócitos.
Síntese da GP viral:
Glicoproteína segregada (sGP) sobrepõe a síntese protéica
celular.
GP dimérica - interfere na sinalização dos neutrófilos
bloqueia sistema imune.
GP viral trimérica - células endoteliais da superfície
interior dos vasos sanguíneos
Disseminação do vírus
Gânglios linfáticos, fígado, pulmões e baço.
Patogenia
Replicação viral – produção de citocinas
sinalização para a febre e inflamação.
Lesões células endoteliais provoca a perda da
integridade vascular.
Replicação viral - síntese de GP.
Reduz a produção das integrinas específicas
responsáveis pela coesão celular - intercelular
Infecção e necrose nos hepatócitos - lesões no
fígado – coagulopatia.
Patogênese
Anticorpos x infecção
Citocinas e Ebola
Quem mata o homem?
Vírus ou o sistema imune?
“CYTOKINE STORM”
Sistema Imune: Citocinas
Função: defender o organismo.
Função exacerbada: fora de controle e provoca
danos ao hospedeiro.
Influenza aviária, SARS, vírus da doença do Ebola é
o mais eficiente.
Estágio final da infecção com Ebolavirus :
tempestade de citocinas
Tempestade de citocinas
Sinal para o sistema imune
Ativar
seu arsenal de armas de uma só vez.
Gera vários danos colaterais.
O mais extremo ataque do sistema imune
Vazamentos nos vasos sanguíneos, nenhuma pressão
arterial, queda temperatura corporal, choque
Excessiva liberação de citocinas inflamatórias
– fator de necrose tumoral
Tempestade de Citocinas:
vasos sanguíneos
Aumenta a permeabilidade vascular: artérias, veias e
capilares começam a vazar sangue e plasma.
Grande liberação de óxido nítrico
afina os vasos sanguíneos
Todos esses fatores combinados:
redução da pressão arterial.
Morte pela perda de sangue semelhante ao choque
séptico grave.
Como é que Ebola consegue lançar
a tempestade de citocinas?
Mecanismos Patogênicos
Em 1993, o CDC ainda propunha que o
aumento de permeabilidade dos vasos
sanguíneos era devido a replicação viral em
células do endotélio.
Em poucos anos foi demonstrado o aumento de
permeabilidade era conseqüência da indução
TNF pelos monócitos e macrófagos.
Mecanismos Patogênicos
2 mecanismos patogênicos importantes:
Resposta imune inata - macrófagos.
Imunossupressão
Provocam a libertação de grandes quantidades de
citocinas pró-inflamatórias, tais como TNFα,
Bloqueia a síntese de Interferon - Reduz a
imunidade anti-viral
Intensa replicação
Inibição das células dendríticas
Resposta imune específica
Inibição da maturação das DCs em células
apresentadoras de antígenos funcionais
Juntamente com o decréscimo do IFN gama
Bloqueia a ativação da células T e B
Evita o desenvolvimento da resposta imune
específica
Disseminação para células hepáticas
Ebola ataca as células do fígado e provoca insuficiência
hepática.
Depleção de fatores de coagulação
Aumento a permeabilidade vascular - Perdas de fluidos:
choque.
Induz a produção de Fator Tecidual (TF), distúrbio na
coagulação do sangue normal e contribui para a hemorragia
Diagnóstico
laboratorial
Diferencial
Vários métodos
Preliminares
Histórico médico e viagens
Diagnóstico é confirmado
Isolamento do vírus em cultura celular: mais eficaz
durante a fase inicial e após a morte
RNA pelo PCR ou proteínas virais (ELISA) –
realizável em hospitais de campanha
Anticorpos contra do vírus: mais eficaz em estágios
avançados e nas pessoas em recuperação.
Outros achados: baixas contagem de leucócitos e
plaquetas e altas taxas de enzimas hepáticas.
Diagnóstico Laboratorial
ELISA de Captura: Detecção de antígeno virais
Soro neutralização
PCR - Padrão OMS – Primers fornecidos pela
OMS
Fundação Oswaldo Cruz - Fiocruz/Lacen,RJ
Instituto Evandro chagas, Belém
Microscopia eletrônica
Isolamento do vírus em cultura celular
PCR: análise de campo
Diagnóstico: exclusão de doenças
Diagnóstico diferencial
Malária,
Febre tifóide, Shigeloses, Cólera, Leptospiroses,
Rickettsioses, Meningites, Hepatites
Febre Lassa
Outras febres hemorrágicas.
Ainda não existe vacinas!
Vacinas de DNA – prevenção equipe de saúde
Vacinas Recombinantes
2003. Adenovirus: proteção 28 dias pi
2005. Vírus da Estomatite Vesicular: inserção de
glicoproteína de Ébola ou do vírus de Marburg:
proteção primatas não humanos.
Filovírus: cepas próximas das epidemias
A imunização induzida em seis meses
impede o seu uso como medida de controle de
surtos.
Vacinas
Em 2009. Experimental
vírus da estomatite vesicular recombinante em
modelos de primatas não humanos
2014. Ensaios clínicos de uma vacina
experimental recombinante em Adenovirus
modificado de chimpanzé
NIAID/GSK – prometem 10 milhões de doses
Tratamento
Ala de quarentena em Uganda durante surto de 2000
Medicina de suporte: intensivo
Desidratação: re-hidratação oral ou intravenosa
soluções contendo eletrólitos
Dor, enjôo febre e ansiedade,
Derivados do sangue, hemácias, plaquetas ou plasma
Reguladores da coagulação como a heparina – impedir
a coagulação intravascular disseminada
Fatores de coagulação – diminuir a hemorragia.
Medicamentos para a malária e infecções bacterianas,
Anticorpo policlonal – proteção de Rhesus.
Tratamentos experimentais
Ética e Desespero
Maior disponibilidade de tratamentos experimentais em
África por razões humanitárias.
Ética – utilização fármacos experimentais sem eficácia
demonstrada!
Em 12 de agosto de 2014, a OMS divulgou uma nota:
o uso de tratamentos cuja eficácia ainda não está
demonstrada é ético em determinadas situações...
Medicamentos experimentais
ZMapp: três anticorpos monoclonais.
Demonstrou
ter elevada eficácia em ensaios
clínicos com macacos Rhesus.
Pouca disponibilidade.
Algumas destas pessoas tenham recuperado,
os resultados não são considerados
significativos em termos estatísticos.
RNA interferente - tecnologia anti-senso
Alvo-Ebola Zaire
Exercito Americano
Oligômeros de Morfolino (PMO)
Análogo de ácido nucléico – imunização de símios
Anti-senso – 25 pares de base
Empresa canadense: TKM – Ebola
Combinação de pequenos RNA interferentes.
Três das sete proteínas do Ebola Zaire: L, VP24 e VP35,
formulado com cm tecnologia de nanopartículas lipídica.
Outros medicamentos
Favipiravir, um antiviral japonês Japão
Receptores de estrogênio
prevenção para pandemias de gripe
aparenta ter alguma eficácia em modelos de ratos de Ébola.
inibem a progressão do vírus de Ébola em ratos infetados.
90% dos ratos tratados com clomifeno e 50% dos ratos
tratados com toremifeno sobreviveram aos ensaios.
Amiodarona, um bloqueador dos canais de íons usado
no tratamento de arritmias cardíacas.
bloqueia “in vitro” a entrada do vírus de Ébola nas células.
Soro imune
O soro de sobreviventes da infecção - possibilidade de
tratamento eficaz (?)
A favor: sete de oito pessoas infetadas com Ébola
sobreviveram no surto de 1999 na República Democrática do
Congo.
Contra: tratamento só foi iniciado numa fase avançada da
doença- indivíduos. Recuperação natural por si próprios,
tratamento de maior qualidade
Imunoglobulina por via intravenosa
parece (?) proteger primatas não humanos.
Prevenção e Controle
Comportamental, equipamento de proteção individual e
desinfecção.
Evitar o contacto com sangue ou secreções corporais infetadas,
de humanos e animais doentes ou suspeitos ou mortos
Detectar e diagnosticar a doença durante a fase inicial e usar
medidas de precaução universais para todos os pacientes.
Uso de vestuário de proteção adequado, como máscaras, luvas,
batas, óculos,
Esterilização do equipamento.
A lavagem das mãos é igualmente importante, mas pode ser
difícil em regiões onde a disponibilidade de água é escassa.
Quarentena
A quarentena é geralmente eficaz na diminuição
da velocidade de propagação.
Rastreamento:
Áreas ou regiões onde a doença ocorre
Pessoas – contato- infetados.
Controle de estradas ou meios de transporte
tentativa de diminuir a velocidade de
propagação do vírus em África.
Ebola Reston – Granjas de suínos
Granjas de Suínos – Amplificação – presença de
morcegos de frutas
Medidas de biosegurança apropriadas:
Educação pública, redução de risco:
Redução de contato: porco – humano
criação
Abate
sangue, leite e carne crua
Trabalhadores de laboratório
Bissegurança
Patógeno do grupo de risco 4
Requer – Biosegurança contenção - nível 4
Instituto Nacional de Saúde/ Instituto Nacional de
alergia e doenças infecciosas – categoria A –
patógeno prioritário
Centros de controle de doenças e prevenção de
bioterrorismo nível A
Controle de agente biológico para exportação
Bibliografia citada
http://www.who.int/csr/disease/marburg/en/index.html
http://www.who.int/csr/disease/ebola/en/index.html
Dye, J.M., Herbert, A.S., Kuehne, A.I., Barth, J.F., Muhammad, M.A., Zak,
S.E., Ortiz, R.A., Prugar, L.I., and Pratt, W.D. (2012). Postexposure antibody
prophylaxis protects nonhuman primates from filovirus disease. Proc Natl
Acad Sci U S A 109, 5034-5039.
Takada et al. 2003. Journal of Virology, 77 (13): 7539-7544
Vários. Journal of Infections disease.
Tânia R. P. Freitas
Freitas, T. R. P., PhD. Pesquisadora em Ciências Exatas e da Natureza
Virologia Animal – Pesquisa e Projetos Científicos
LANAGRO - Minas Gerais
Dezembro, 2014