
Cimerman, et al • Enterobíase
ARTÍCULO DE REVISIÓN/ARTIGO DE REVISÃO
Enterobíase
Enterobiasis
Sérgio Cimerman1
Benjamin Cimerman2
Médico Assistente da 3ª Unidade de
Internação do Instituto de Infectologia
Emílio Ribas. São Paulo, Brasil.
2
Professor Titular de Parasitologia da
Faculdade de Enfermagem do Hospital
Israelita Albert Einstein. São Paulo,
Brasil.
1
Rev Panam Infectol 2005;7(3):27-30
Recibido en 18/8/2005.
Aceptado para publicación em 16/9/2005.
Resumo
Os autores fazem uma revisão da enterobíase com uma visão
clínica, com maior ênfase no diagnóstico e apresentação de novas
opções terapêuticas desta parasitose intestinal.
Palavras-chave: Enterobius vermicularis, Enterobíase, Revisão.
Abstract
The authors present an overview of enterobiasis with a clinical approach and main emphasis in diagnosis and new treatment
options.
Key words: Enterobius vermicularis, Enterobiasis, Review.
Introdução
A enterobíase ou oxiuríase é uma infecção parasitária intestinal
causada pelo nematódeo Enterobius vermicularis ou Oxyurus vermicularis. A evolução nos mostra que esta verminose foi originária
no continente africano, dispersando-se com as migrações ocorridas
no passado para outros continentes. Um dos ramos de estudo da
Parasitologia, a Paleoparasitologia, tem contribuído em muito para
os dados históricos da patologia, reconstruindo rotas da dispersão,
com especial atenção nos achados em material arqueológico(1).
O encontro do nematódeo data de período antes da Era Cristianiana, em especial no Estado do Colorado, nos Estados Unidos,
através de coprólitos(1).
Na América do Sul, o primeiro achado de ovos de E. vermicularis em coprólitos humanos foi feito por Patruco e colaboradores
em 1983, no Peru, seguido de Ferreira et al. (1984) e Araújo et
al., em 1985, no Chile, com datas pré-colombianas (4.000 anos
a 800 a.D.)(2).
O parasito (agente etiológico)
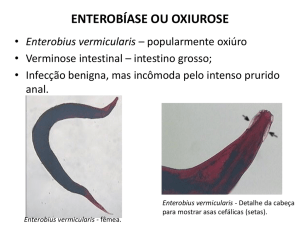
O Enterobius vermicularis ou Oxyurus vermicularis é um verme
cilíndrico, de cor branca, com aspecto de fio de linha, medindo o
macho 2 a 5 mm de comprimento e a fêmea, 8 a 13 mm. Apresenta na extremidade anterior uma dilatação da cutícula formando
duas expansões, denominadas asas cervicais. Internamente, o
27
Rev Panam Infectol 2005;7(3):27-30
esôfago termina em uma estrutura muscular arredondada e proeminente, chamada bulbo esofagiano. A
extremidade posterior da fêmea termina em ponta fina
e alongada, enquanto a do macho mostra um enrodilhamento ventral e a presença de um espículo(3).
Os ovos são brancos, transparentes, com dupla
membrana, um lado plano e o outro convexo, similar à
letra D do alfabeto. Medem aproximadamente 50 a 60
micras de largura por 20 a 30 micras de comprimento,
são resistentes aos desinfetantes comerciais e podem
sobreviver em ambientes domiciliares por duas a três
semanas(4).
Ovo de E. vermicularis – “anal swab”
E. vermicularis é o parasito de maior poder de
infecção, pois seus ovos necessitam de apenas seis
horas para se tornar infectantes.
Ao serem ingeridos, os ovos sofrem a ação do
suco gástrico e duodenal, libertando as larvas que
se dirigem ao ceco, onde se fixam e evoluem até o
estágio adulto. A duração do ciclo é em média de 30
a 50 dias.
Epidemiologia
É uma doença de distribuição mundial (cosmopolita), mais freqüentemente encontrada em crianças
de 5 a 14 anos de idade(6). Sua transmissão é direta
de pessoa a pessoa, sem a intervenção do solo, não
requerendo condições especiais de ambiente, clima
e nível social(4).
Elevada prevalência tem sido relatada nos Estados
Unidos (20%)(5), Índia (12,8%)(7) e Brasil (5,9%)(8),
embora sua mensuração seja difícil, pois a maioria dos
inquéritos epidemiológica não utiliza a metodologia
adequada para o diagnóstico dessa parasitose.
Em pacientes com Aids, nos parece até o momento
não existir qualquer importância da doença durante
o curso natural da patologia, conforme estudos realizados por nosso grupo em 1999(9) e em publicação
mais recente; nem ao menos obtivemos o encontro do
nematódeo, com justificativa de não termos também
procedido à metodologia ouro para o diagnóstico(10).
Raramente a infecção é fatal, sendo que a sua
morbidade é correlacionada com as infecções
secundárias(5).
Patogenia
Ao nível do intestino atua sobre a mucosa intestinal, ocasionando um processo inflamatório com
exsudato catarral. Devemos lembrar que não ocorre
lesão anatômica, pois a mucosa não é penetrada. A
migração dos parasitos adultos pela pele a diferentes
locais pode desencadear uma reação inflamatória local, agravando-se por lesões traumáticas e infecções
secundárias(3-5).
Ovo de E. vermicularis - fezes
Ciclo de vida(5)
Os vermes adultos vivem no intestino grosso e após
a cópula o macho é eliminado. As fêmeas fecundadas
não fazem oviposição no intestino e têm seu útero
abarrotado com aproximadamente 11.000 ovos. Em
um determinado momento o parasito se desprende do
ceco e é arrastado para a região anal e perianal, onde
se fixa e libera grande quantidade de ovos.
28
Manifestações clínicas
O sintoma característico da enterobíase é o prurido
anal, que se exacerba no período noturno devido à
movimentação do parasito pelo calor do leito, produzindo um quadro de irritabilidade e insônia(3-6).
Em relação às manifestações digestivas, a maioria dos pacientes apresenta náuseas, vômitos, dores
abdominais em cólica, tenesmo e, mais raramente,
evacuações sanguinolentas(3-6).
Nas mulheres, o verme pode migrar da região anal
para a genital, ocasionando prurido vulvar, corrimento
vaginal, eventualmente infecção do trato urinário,
Cimerman, et al • Enterobíase
e até excitação sexual. Apesar da sintomatologia,
não se verifica eosinofilia periférica e os níveis de
IgE em patamares dentro da normalidade, com exceção de estudo de infecção massiva promovendo
uma alta elevação de IgE sangüínea e contagem de
eosinófilos(11).
Existem relatos de localização ectópica da patologia
levando a quadros de apendicites, salpingites, granulomas peritoneais e perianais, doença inflamatória
pélvica(12).
Diagnóstico
O método de escolha utilizado para o diagnóstico da
enterobíase difere em relação às outras verminoses em
geral. As técnicas habituais de demonstração de ovos
de helmintos não apresentam positividade superior
a 5% dos casos, uma vez que as fêmeas não fazem
oviposição no intestino.
Como eleição emprega-se a técnica dos “swabs
anais”, também denominada de método da fita de
celofane adesiva e transparente, ou da fita gomada,
reportada por Graham(3-6). A outra técnica não habitual
descrita na literatura é chamada de vaselina-parafina
(VASPAR). Adota-se como padrão da colheita do
material o horário no período matutino, antes de o
paciente defecar ou tomar um banho(5). Caso não seja
possível tal procedimento, poderia se optar pela coleta
após o paciente ter se deitado. Com estas técnicas,
aumenta-se sensivelmente a positividade do achado
dos ovos de E. vermicularis e, se realizado em dias
consecutivos, com no mínimo três coletas, segundo
consenso de expertos da Federação Latino-Americana
de Parasitologia (FLAP)(13).
Prevenção e controle
Inicialmente, para se realizar uma excelente profilaxia, deve-se estender o tratamento da parasitose a
todos os indivíduos que residem na mesma residência,
além de troca de roupa de cama, interior e cobertor no
dia da realização do tratamento proposto(3,4,6).
A atenção das autoridades públicas na questão
da educação sanitária deve ser um dos quesitos
primordiais, principalmente objetivando a população
pediátrica. Nesta faixa etária temos que orientar para
que as unhas sejam cortadas bem rentes e sobre o uso
de macacão para dormir.
A limpeza ambiental é outro fator que deve ser
verificado devido à transmissão da doença ocorrer
pela inalação de pó, pela ingestão nasal dos ovos do
parasito. Com esta afirmação existe a necessidade de
não varrer a poeira nas casas, e sim proceder com uso
de aspirador.
O controle de cura desta helmintose, segundo o
último consenso da FLAP, sugere efetuar pela técnica
de Graham um exame diário por sete dias a partir de
uma semana depois de finalizada a terapia(13).
Tratamento
A enterobíase, por ser uma parasitose de fácil
disseminação, deve ser tratada para todos aqueles
com exposição. Várias drogas estão disponíveis no
mercado internacional, com índices de cura clínica e
parasitológica bastante satisfatórios.
O tratamento de escolha é o pamoato de pirantel na
dose de 10 mg/kg em dose única, não ultrapassando
1 g, por via oral, preferencialmente em jejum. Apresenta uma eficácia em torno de 80 a 100% de cura, com
poucos efeitos adversos, tais como: cefaléia, tonturas
e distúrbios gastrointestinais leves. Não deve ser administrado a gestantes e, como lembrança, o paciente
deve ser comunicado que o fármaco poderá produzir
cor vermelha na urina e fezes. Sugere-se na maioria
dos casos a repetição do tratamento, aumentando assim a taxa de cura deste nematódeo intestinal(14).
Como terapia alternativa à participação dos benzimidazólicos de uso em humanos, mebendazol e
albendazol apresentam também o mesmo esquema
preconizado em dose única e repetição em 2 semanas. A maior vantagem da utilização destas drogas
reside nas populações poliparasitadas, como ocorre na
maioria dos países da América Latina. O mebendazol
é administrado por via oral, 100 mg, independente
da idade do paciente, apresentando eficácia de 90
a 100% de cura, com raros efeitos colaterais(15,16). O
albendazol é receitado na dose de 400 mg, também
independente da idade, e proporcionando taxa de cura
também perto dos 100%. Náuseas, vômitos, diarréia,
secura na boca e prurido cutâneo podem surgir após a
ingesta, porém é raro o seu acometimento(3,4).
Com o advento de novas buscas para o tratamento
antiparasitário, novas medicações têm sido propostas
e que merecem citação, dentre elas: ivermectina e a
nitazoxanida.
A ivermectina é membro das avermectinas, sendo
um análogo sintético da avermectina B1a (abamectina),
resultante da fermentação do actinomiceto do solo
Streptomyces avermitilis. Recentemente liberado
para uso em humanos, no tratamento da enterobíase,
utiliza-se na dose de 200 μg/kg, alcançando índices
de cura de cerca de 85%, embora não seja esta a sua
principal indicação(3-5,14).
A nitazoxanida, um 5-nitotriazol, de amplo espectro
antiparasitário, cuja maioria dos trabalhos desenvolvidos foi em relação aos patógenos oportunistas em
pacientes com Aids e em casos de giardíase, amebíase,
fasciolíase, teníase em indivíduos imunocompetentes.
Sua veiculação em enterobíase ocorreu em estudo
clínico de pacientes no Egito, com índices de cura de
29
Rev Panam Infectol 2005;7(3):27-30
95% nos pacientes, com leve ou quase ausência de
eventos adversos, como: cefaléia, náuseas, vômitos,
dor abdominal, diarréia e dor gástrica. A dose recomendada é aproximadamente 7,5 mg/kg, por via oral,
por período de três dias consecutivos, ingeridos depois
de comida. Como dado adicional, existe comprimido
e suspensão líquida que atende o grupo etário infantil
no gosto morango(17,18).
Referências
1. Ferreira LF, Reinhard KL, Araújo A, Camillo-Coura L.
Paleoparasitology of oxyuriasis. Anais da Academia
Nacional de Medicina 1997;157(1):20-24.
2. Araújo A & Ferreira LF. Oxiuríase e migrações préhistóricas. História, Ciências, Saúde. Manguinhos
1985;2(1):99-109.
3. Botero D & Restrepo M. Parasitosis intestinales por nematodos. En: Parasitosis Humanas. 3ª ed. Corporación
para Investigaciones Biológicas. Medellín, Colombia:
1998. p. 125-134.
4. Bina JC. Enterobíase. Em: Medicina Tropical - Seus Fundamentos e Bases Gerais. Cimerman Sérgio & Cimerman
Benjamin. 1ª ed. Editora Atheneu; 2003 (no prelo).
5. Bocka J. Pinworms. Last Updated July 12, 2001. Disponível em: www.emedicine.com/infectiousdiseases.
6. Cimerman B & Cimerman S. Enterobíase. Em: Parasitologia Humana e seus Fundamentos Gerais. 2ª ed. Rio de
Janeiro, Brasil: Editora Atheneu; 2001. p. 304-306.
7. Kang G, Mathew MS, Rajan DP, Daniel JD, Mathan MM,
Mathan VI et al. Prevalence of intestinal parasites in
rural Southern Indians. Tropical Medicine and Health
1998;3(1):7-75.
8. Prado MS, Barreto ML, Strina A, Faria JAS, Nobre AA,
Jesus SR. Prevalência e intensidade da infecção por
parasitas intestinais em crianças na idade escolar na
cidade de Salvador (Bahia, Brasil). Revista da Sociedade
Brasileira de Medicina Tropical 2001;34(1):99-101.
9. Cimerman S, Cimerman B, Lewi DS. Prevalence of
intestinal parasitic infections in patients with acquired
immunodeficiency syndrome in Brazil. International
Journal Infectious Diseases 1999;3:203-206.
30
10. Cimerman S, Castañeda CG, Iuliano WA, Palacios R.
Perfil das enteroparasitoses de pacientes com infecção
pelo vírus HIV/Aids na era da terapia anti-retroviral potente em um centro de referência em São Paulo, Brasil.
Parasitología Latinoamericana 2002;57:111-119.
11. Villarreal O, Villarreal JJ, Domingo JA. Progressive
eosinophilia and elevated IgE in enterobiasis. Allergy
1999;54(6):646-648.
12. Tandan T, Pollard AJ, Money DM, Scheifele DW. Pelvic
inflammatory disease associated with Enterobius vermicularis. Archives Diseases of Children 2002;86:439440.
13. FLAP. Informe técnico de un comité de expertos Normas para evaluar medicamentos en parasitosis del
tubo digestivo y anexos del hombre. Parasitología al día
2000;24:3-4.
14. Anonymous. Drugs for parasitic infections. The Medical
Letter on Drugs and Therapeutics. April, 2002.
15. Cimerman B, Fernandes MFP, Hernandes N, Campos
Neto JM. Mebendazol: esquemas terapêuticos na prática
clínica. Folha Médica 1980;80:101-103.
16. Chaia G, Cimerman B, Bichued L. Reavaliação terapêutica do mebendazol na enterobíase. Folha Médica
1986;92:71-73.
17. Abaza H, El-Zayadi A, Kabil SM, and Rizk H. Nitazoxanide in the treatment of patients with intestinal
protozoan and helminthic infections: a report on 546
patients in Egypt. Current Therapeutic Research
1998;59:116-121.
18. Romero Cabello R, Robert Guerrero L, Munoz Garcia
MR, and Geyne Cruz A. Nitazoxanide for the treatment
of intestinal protozoan and helminthic infections in
Mexico. Transactions of The Royal Society of Tropical
Medicine and Hygiene 1997;91:701-703.
Correspondência:
Dr. Sérgio Cimerman
R. Zacarias de Góis, 966, apto 41,
CEP 04610-002, São Paulo, SP, Brasil
e-mail: [email protected]



![Ppt0000079 [Somente leitura]](http://s1.studylibpt.com/store/data/003752968_1-1257c89e89e4e7c354469b531a0c1e3a-300x300.png)







