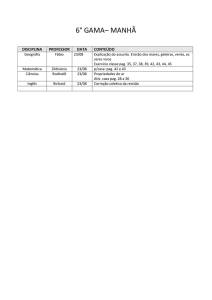
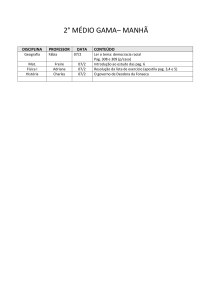
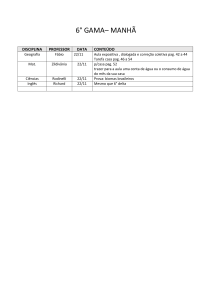
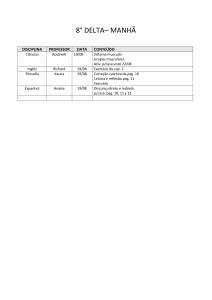
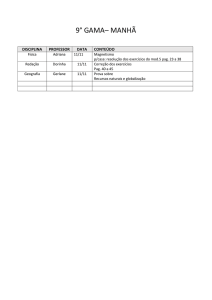
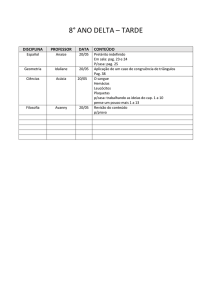
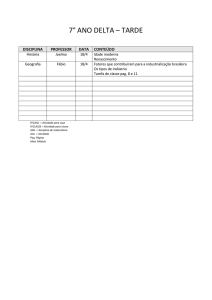
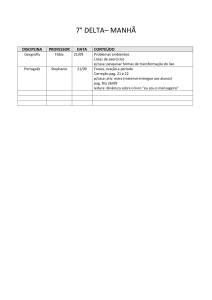
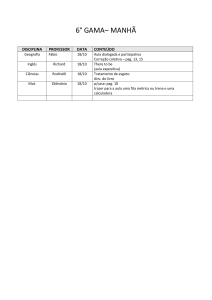
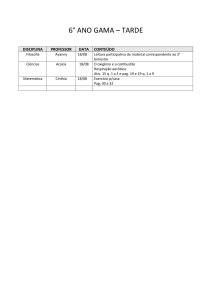
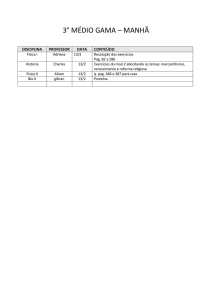
PAG Química – Equilíbrio Químico
1. Para o equilíbrio gasoso entre NO e O2 formando NO2 (2 NO (g) + O2 (g)
2 NO2 (g)), a constante de equilíbrio é Kc = 6,45 x 105.
a) em que concentração de O2 as concentrações de NO2 e de NO são iguais?
b) em que concentração de O2 a concentração de NO2 é 100 vezes maior do que a
concentração de NO?
PAG Química – Equilíbrio Químico
2. Considere o seguinte equilíbrio: A (aq)
B (aq), cujo Kc é 0,1. Se em
um litro de solução adicionarmos 0,1 mol de A a 0,1 mol de B, quais vão ser
as concentrações de A e B no equilíbrio?
mol/L
mol/L
PAG Química – Equilíbrio Químico
3. A constante de equilíbrio Kp para a reação:
PCl3 (g) + Cl2 (g)
PCl5 (g) é 0,0131 a 250º C.
São colocados 1,50 mol de PCl5, 3,00 mols de PCl3 e 0,50 mols de Cl2 num
balão de 0,5 L a 250ºC.
a) calcule Kc.
b) o sistema está ou não está em equilíbrio? Justifique.
c) caso não esteja, em que sentido está ocorrendo a reação? Justifique sua
resposta.
d) calcule a concentração das espécies quando o equilíbrio se estabelece.
0,0131 = Kc x (0,082x523)-1
Kc
não, Qc < Kc
PAG Química – Equilíbrio Químico
x´ = 8,704
x´´ = 0,076
3,076 mol/L
0,9242 mol/L
5,9242 mol/L
PAG Química – Equilíbrio Químico
4. Mistura-se um mol de álcool etílico puro (C2H5OH) com um mol de ácido
acético (CH3CO2H) em 1 L de um solvente adequado. Após atingido o
equilíbrio, a mistura contém 2/3 de mol de éster (CH3CO2C2H5) além das outras
substâncias.
a) qual o valor da constante de equilíbrio Kc para a reação
C2H5OH + CH3CO2H
CH3CO2C2H5 + H2O
b) quantos mols de éster são formados no equilíbrio quando 3 mols de álcool
são misturados com 1 mol de ácido em 1 L do mesmo solvente?
c) o que acontece com uma mistura em equilíbrio se forem adicionados mais 3
L de solvente?
PAG Química – Equilíbrio Químico
PAG Química – Equilíbrio Químico
5. A certa temperatura, uma mistura em equilíbrio NO 2 + SO 2
NO + SO3 foi analisada e encontrou-se seus componentes nas
seguintes concentrações (mol/L): [NO2] = 0,10, [SO2] = 0,30, [NO] = 2,00, [SO3]
= 0,60. Se 0,50 mols de SO2 são introduzidos, na mesma temperatura, quais
serão as concentrações de reagentes e produtos quando o novo equilíbrio for
estabelecido? O volume do recipiente é de 1 L.
0,055
PAG Química – Equilíbrio Químico
0,045
0,655
0,745
2,055
PAG Química – Equilíbrio Químico
6. NH4HS sólido a 25o C é colocado em um recipiente evacuado, onde se
decompõe de acordo com a reação NH4HS (s)
NH3 (g) + H2S (g)
A pressão total dos gases, quando o equilíbrio é atingido, é de 0,658 atm.
Qual a pressão parcial de cada espécie quando um novo equilíbrio é
reestabelecido, após a adição de 0,300 atm de NH3 ?
PAG Química – Equilíbrio Químico
PAG Química – Equilíbrio Químico
7. É dada a reação
H+ (aq) + CN- (aq)
HCN (aq)
cuja constante de equilíbrio é Kc = 4,76 x 108.
a) calcule ΔGo para esta reação a 298 K
b) calcule ΔG para esta reação a 298 K quando a concentração de H+ for 1,5 x 10-8,
a de CN- for 5,4 x 10-5 mol/L e a de HCN for 3,2 x 10-3
c) nas condições da alínea b, em que sentido a reação está se deslocando?
d) calcule ΔG para esta reação a 298 K quando todas as concentrações forem
unitárias
e) nas condições da alínea d, em que sentido a reação está se deslocando?
f) qual deve ser a relação entre a concentração de H+ e a de CN- para que ΔG da
reação seja 18 kJ a 298 K, sabendo que a concentração de HCN é unitária?
PAG Química – Equilíbrio Químico
8. A síntese de 2 mols de HBr (g) a partir de hidrogênio gasoso e bromo líquido
tem uma constante de equilíbrio Kp = 4,5 x 1015 a 25° C. Sabendo que a
pressão de vapor de bromo líquido (pressão do vapor de bromo em equilíbrio
com o líquido) é 0,28 atm, encontre o valor de Kp e ΔGo para a reação de
síntese de 1 mol de HBr em fase gasosa na mesma temperatura
PAG Química – Equilíbrio Químico
9. As energias livres padrão de formação do cis e trans 2-buteno são,
respectivamente, - 67,15 e - 64,10 kJ/mol. Calcule as constantes de equilíbrio
Kp e Kc para a reação de conversão cis 2-buteno
trans 2-buteno
PAG Química – Equilíbrio Químico
10. A 817o C, Kp para a reação entre CO2 puro e excesso de grafite quente
para formar CO é 10, de acordo com a reação CO2 (g) + C (s)
2 CO
(g)
a) qual é a pressão parcial dos gases no equilíbrio, na temperatura de 817o C
e pressão total de 4 atm?
b) se 1 atm de CO for injetada no sistema em equilíbrio, qual o deslocamento
observado? Qual será a pressão parcial de cada gás no novo equilíbrio?
c) após um aumento do volume do vaso de reação, a análise da mistura
gasosa em equilíbrio mostra 6 % de CO2 em percentagem volumétrica. Qual a
pressão total do sistema nesse equilíbrio?
PAG Química – Equilíbrio Químico
% CO2 = (1,22 x 100)/4,72 = 25,8%
PAG Química – Equilíbrio Químico
11. A 25o C, Kc = 0,145 para a seguinte reação 2 BrCl (g)
Br2 (g) +
Cl2 (g)
a) se a concentração inicial de cada substância é 0,040 mol/L, quais serão
suas concentrações de equilíbrio?
b) qual o percentual de dissociação do BrCl no equilíbrio?
PAG Química – Equilíbrio Químico
Br2 (g) + Cl2 (g) à 2 BrCl (g)
i
f
0,026 0,026
0
0
0,068
0,068 + 2 x 0,026
quanto dissociou
quanto teria de BrCl no início
para que se chegasse
àquela posição de equilíbrio
PAG Química – Equilíbrio Químico
12. Uma mistura reacional que consiste de 0,9 mol de H2, 1,35 mol de I2 e 0,45
mol de HI, foi preparada em um frasco de 3 L e aquecida a 500 K. Dado: Kc =
0,0181, para a reação 2 HI (g)
H2 (g) + I2 (g)
a) qual a concentração de cada componente ao ser atingido o equilíbrio?
b) qual a quantidade de HI que deve ser adicionada ao equilíbrio anterior para
que o frasco contenha 0,3 mol de H2 ao ser restabelecido o equilíbrio.
c) qual o grau de dissociação do HI na alínea a)?
PAG Química – Equilíbrio Químico
PAG Química – Equilíbrio Químico
PAG Química – Equilíbrio Químico
13. A 600º C, a constante de equilíbrio, Kc, é 7,0 x 10-2 para a reação a
seguir: PH3BCl3 (s)
PH3 (g) + BCl3 (g)
a) um frasco de 2,5 L foi carregado com 8,66 g de PH3BCl3, 0,100 mol de
PH3, 0,100 mol de BCl3 e levado à temperatura de 600º C. Quais as
concentrações no equilíbrio?
b) em seguida, o equilíbrio anterior foi perturbado através da adição de mais
0,50 mol de PH3. Quais as concentrações quando o novo equilíbrio é
restabelecido?
c) qual o valor de Kp para a reação acima representada?
PAG Química – Equilíbrio Químico
Problema irreal: o equilíbrio precisa se deslocar 0,225 mol/L. Em 2,5 L, precisa se
deslocar 0,5625 mol, consumindo 0,5625 mol de PH3BCl3, ou seja, 85,22 g. Mas
só tem 8,66 g!! E essa massa era inútil…
PAG Química – Equilíbrio Químico
PAG Química – Equilíbrio Químico
PAG Química – Equilíbrio Químico
14. A 673 K, a constante de equilíbrio, Kc, é 0,215 para a reação a seguir:
NH4I (s)
NH3 (g) + HI (g)
Um frasco de 2,5 L foi carregado com 607 g de NH4I, 1,50 mol de NH3, 1,50
mol de HI e levado à temperatura de 673 K.
a) o sistema está ou não está em equilíbrio? Caso não esteja, em que
sentido está ocorrendo a reação? Justifique sua resposta.
b) calcule a concentração das espécies quando o equilíbrio se estabelece.
c) calcule o grau de dissociação do NH4I no equilíbrio quando 607 g de NH4I
forem colocados no frasco evacuado de 2,5 L, a 673 K.
PAG Química – Equilíbrio Químico
PAG Química – Equilíbrio Químico
15. Escolha entre as soluções aquosas a seguir, NaOH, HCl ou FeCl3, a que
você usaria para melhor dissolver um precipitado de Fe(OH)3. Explique a sua
escolha.
PAG Química – Equilíbrio Químico
16. a) Considere o seguinte sistema em equilíbrio, a uma dada temperatura:
H2O (l)
H2O (g) Explique, justificando, o que acontece com o sistema,
se for adicionada a ele uma certa quantidade de água líquida em que o átomo de
hidrogênio foi substituído por seu isótopo deutério.
b) O hidróxido de zinco é um composto que não é muito solúvel em água. Ao se
solubilizar, libera íons Zn2+ e OH- em solução. Em que composto esse hidróxido
deve ser mais solúvel: ácido nítrico ou hidróxido de amônio? Justifique.
PAG Química – Equilíbrio Químico
17. A reação de fotossíntese é 6 CO2 (g) + 6 H2O (l)
C6H12O6 (s) + 6 O2
(g) e ΔHº = + 2802 kJ/mol. Supondo que a reação esteja em equilíbrio, diga,
justificando, qual será o efeito de cada uma das seguintes perturbações no
sentido do equilíbrio:
a) a pressão parcial de O2 é aumentada.
b) o sistema é comprimido
c) a temperatura é diminuída
d) um pouco de C6H12O6 é removida
PAG Química – Equilíbrio Químico
18. Considere a reação: SnO2(s) + 2 H2 (g)
Sn(s) + 2 H2O(g), cujo ΔH é +
97,1 kJ. Admita que o sistema está em equilíbrio. O que ocorrerá à
concentração de H2 no recipiente se:
a) for adicionado H2O
b) for adicionado SnO2
c) for adicionado He
d) for aumentado o volume do recipiente
e) a temperatura for elevada
PAG Química – Equilíbrio Químico
19. Usando o Princípio de Le Châtelier, faça uma previsão da consequência que
a mudança dada na 1a. coluna da tabela a seguir tem sobre a quantidade na 2a.
coluna, para o seguinte sistema em equilíbrio:
2 HCl (g) + I2 (s)
2 HI (g) + Cl2 (g)
ΔHo = + 120 kJ/mol Resposta
a) diminuição de volume
Kc
=
b) aumento de volume
quantidade de Cl2
+
c) aumento de temperatura
Kc
+
d) adição de HI
quantidade de Cl2
-
e) adição de I2
quantidade de HI
=
f) remoção de Cl2
quantidade de HI
+
g) compressão
quantidade de HCl
+
h) redução da temperatura
quantidade de HI
-
i) adição de Cl2
quantidade de I2
+
j) adição de Cl2
quantidade de Cl2
+
l) adição de N2 a volume constante
quantidade de Cl2
=
m) adição de catalisador
quantidade de HCl
=
PAG Química – Equilíbrio Químico
20. Use o princípio de Le Châtelier para prever a consequência que a
mudança dada na primeira coluna da tabela a seguir tem sobre a quantidade
na segunda coluna para o seguinte sistema em equilíbrio:
2 Pb(NO3)2 (s)
2 PbO (s) + 4 NO2 (g) + O2 (g) ΔH = - 266,1 kJ.mol-1
Cada mudança é aplicada separadamente ao sistema. Expresse a
consequência como +, - ou =. Mudança
a) diminuição do volume
b) aumento de volume
c) aumento da temperatura
d) adição de O2
e) adição de PbO
f) remoção de NO2
g) diminuição da temperatura
h) adição de Pb(NO3)2
i) adição de gás inerte, a P e T constantes
j) adição de um catalisador
Quantidade
Consequência
Kp
=
quantidade de NO2
+
Kc
quantidade de NO2
quantidade de O2
=
quantidade de PbO
+
quantidade de Pb(NO3)2
quantidade de O2
=
quantidade de NO2
+
Kp
=
PAG Química – Equilíbrio Químico
21. Para o sistema em equiíbrio:
C2H5OH (l) + 3 O2 (g)
2 CO2 (g) + 3 H2O (g) ΔHo = -1233,71 kJ/mol
a) escreva a expressão da constante de equilíbrio.
b) use o Princípio de Le Châtelier para prever a consequência que a
mudança dada na 1a. coluna da Tabela a seguir tem sobre a quantidade na
2a. coluna (cada mudança é aplicada separadamente ao sistema). Mudança
Quantidade
Resposta
a) diminuição de volume
Kp
=
b) aumento de volume
quantidade de O2
-
c) aumento de temperatura
Kp
-
d) adição de H2O
quantidade de C2H5OH
+
e) adição de C2H5OH
quantidade de CO2
=
f) remoção de O2
quantidade de C2H5OH
+
g) compressão
quantidade de O2
+
h) redução da temperatura
quantidade de CO2
+
i) adição de CO2
quantidade de O2
+
j) adição de H2O
quantidade de H2O
+
k) adição de N2 à P e T ctes
quantidade de O2
-
l) adição de catalisador
quantidade de CO2
=
PAG Química – Equilíbrio Químico
22. Explique porque cada uma das seguintes afirmações é falsa:
a) um processo não espontâneo endotérmico com ΔS positivo pode se tornar
espontâneo em baixas temperaturas.
b) o trabalho de compressão de um gás consumido em uma reação química é
uma função de estado.
c) quando uma reação química reversível atinge o equilíbrio, as concentrações de
todos os reagentes e produtos são iguais entre si.
d) uma reação exotérmica que produz mais mols de gás do que os que são
consumidos, possui energia livre padrão de reação positiva.
e) um sistema reacional reversível entra em equilíbrio químico quando sua
velocidade atinge um mínimo e sua energia livre um máximo
PAG Química – Equilíbrio Químico
23. Abaixo são feitas algumas afirmações. Atribua às mesmas o conceito
verdadeiro (V) ou falso (F). No caso da afirmação ser falsa, reescreva-a
corretamente.
a) como ΔU é o calor trocado a pressão constante, um processo realizado com
variação de pressão não tem ΔU associado a ele.
b) a diferença entre Cp e Cv é de 0,082 atmL/molK, portanto é desprezível.
c) um sistema atinge o equilíbrio químico quando tanto a reação direta quanto
a reação inversa têm velocidade nula.
d) a adição de um reagente a um sistema em equilíbrio leva a um novo estado
de equilíbrio onde a concentração desse reagente é menor que a sua
concentração no equilíbrio inicial.
e) para um gás, sendo a pressão proporcional à temperatura, o aumento da
pressão em uma reação exotérmica desloca o equilíbrio no sentido da
formação de reagentes.
PAG Química – Equilíbrio Químico
PAG Química – Equilíbrio Químico
f) a evaporação da água aumenta a entropia do sistema.
g) a 1ª lei da termodinâmica diz que, o que quer que aconteça em um sistema, a
respectiva energia interna (ΔU) não varia.
h) na reação N2 (g) + 3 H2 (g)
2 NH3 (g) realizada a pressão constante, o
exterior executa trabalho sobre o sistema.
i) um sistema em equilíbrio é caracterizado por uma única relação de
concentrações que conduz ao valor de sua constante de equilíbrio.
f)
g)
h)
i)
PAG Química – Equilíbrio Químico
j) como Energia Interna é função de estado e ΔU = q + w, então trabalho (w) e
calor (q) também são funções de estado.
k) um processo nem sempre será espontâneo quando a transformação for
acompanhada por um aumento de entropia do sistema.
l) quando se fornece 1000 J a um sistema, o aumento da desordem é maior se
o sistema está a 150o C do que quando o mesmo está a 50o C.
m) costuma-se dizer que uma reação praticamente não ocorre quando ΔGo
>>> 0 e, consequentemente Keq <<< 1. Nessas condições, a mistura em
equilíbrio é composta quase somente por reagentes.
n) no equilíbrio químico os reagentes não são mais transformados em
produtos.