UNIVERSIDADE FEDERAL DE GOIÁS
ESCOLA DE VETERINÁRIA E ZOOTECNIA
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL
Disciplina: SEMINÁRIOS APLICADOS
USO DE FÁRMACOS AGONISTAS DOS RECEPTORES α-2
ADRENÉRGICOS EM MEDICINA VETERINÁRIA
Sandro de Melo Braga
Orientador: Juan Carlos Duque Moreno
GOIÂNIA
2012
ii
SANDRO DE MELO BRAGA
USO DE FÁRMACOS AGONISTAS DOS RECEPTORES α-2
ADRENÉRGICOS EM MEDICINA VETERINÁRIA
Seminário apresentado junto à
disciplina de Seminários Aplicados do
Curso de Pós-graduação em Ciência
Animal da Escola de Veterinária da
Universidade Federal de Goiás.
Nível: Mestrado
Área de Concentração:
Patologia, Clínica e Cirurgia Animal
Linha de Pesquisa
Técnicas cirúrgicas e anestésicas,
patologia clínica cirúrgica e cirurgia
experimental.
Orientador:
Prof. Dr. Juan Carlo Duque Moreno-EVZ/UFG
Comitê de Orientação
Prof. Dr. Ricardo Miyasaka de Almeida - FAV/UnB
Prof. Dr. Luiz Antônio Franco da Silva - EVZ/UFG
GOIÂNIA
2012
iii
SUMÁRIO
1 INTRODUÇÃO .................................................................................................... 1
2 REVISÃO DE LITERATURA ............................................................................... 3
2.1 Sistema nervoso autônomo e receptores adrenérgicos do tipo alfa ................. 3
2.2 Efeitos dos agonistas de receptores alfa-2 adrenégicos .................................. 7
2.1.1 Sedação ........................................................................................................ 7
2.2.2 Analgesia....................................................................................................... 7
2.2.3 Efeitos no sistema cardiovascular ................................................................. 8
2.2.4 Efeitos no sistema respiratório ...................................................................... 9
2.2.5 Efeitos no sistema urinário ............................................................................ 9
2.2.6 Efeitos no sistema reprodutor...................................................................... 10
2.2.7 Efeitos no sistema digestório....................................................................... 10
2.2.8 Efeitos na glicemia ...................................................................................... 11
2.2.10 Efeitos no sistema imunológico ................................................................. 11
2.3 Fármacos agonistas de receptores α-2 .......................................................... 11
2.3.1 Xilazina ........................................................................................................ 11
2.3.2 Detomidina .................................................................................................. 13
2.3.3 Medetomidina .............................................................................................. 14
2.3.4 Dexmedetomidina ....................................................................................... 15
2.3.5 Clonidina ..................................................................................................... 16
2.3.6 Romifidina ................................................................................................... 17
2.4 Uso clínico e vias de administração nas espécies ......................................... 18
2.5 Antagonistas dos receptores α-2 .................................................................... 19
2.5.1 Ioimbina ....................................................................................................... 19
2.5.2 Atipamezole ................................................................................................. 20
2.5.3 Tolazolina .................................................................................................... 20
3 CONSIDERAÇÕES FINAIS .............................................................................. 21
4 REFERÊNCIAS ................................................................................................. 22
1
1 INTRODUÇÃO
Os
fármacos
agonistas
de
receptores
α-2
adrenérgicos
são
amplamente utilizados em medicina veterinária na medicação pré-anestésica,
como coadjuvantes no tratamento da dor e, eventualmente, na anestesia epidural,
para fornecer sedação, miorrelaxamento e analgesia para procedimentos médicos
e cirúrgicos.
Os
fármacos
pertencentes
a
este
grupo
apresentam
efeitos
analgésicos induzidos por sua ação em estruturas presentes na medula espinhal
e no tronco cerebral. A sedação é outra importante característica dos agonistas α2 adrenérgicos e é produzida por sua ação em receptores adrenérgicos centrais,
impedindo a liberação de noradrenalina na fenda sináptica.
O conhecimento sobre a segurança e a eficiência farmacológica é
importante para o médico veterinário escolher o protocolo mais adequado para o
paciente e, assim como com a maioria dos fármacos, algumas alterações
sistêmicas são observadas com o uso dos agonistas de receptores α-2
adrenérgicos. No sistema cardiovascular observa-se bradicardia, bloqueio
atrioventricular e hipertensão seguida de hipotensão. Também é possível
observar depressão respiratória, alterações da motilidade intestinal, aumento na
diurese e hiperglicemia transitória.
São do grupo dos agonistas de receptores α-2 adrenérgicos fármacos
como
xilazina,
detomidina,
medetomidina,
dexmedetomidina,
clonidina
e
romifidina, sendo os dois primeiros os mais utilizados na rotina da medicina
veterinária no Brasil. No entanto, a busca por novos fármacos mais seletivos,
mais seguros e com melhor relação custo-benefício é constante.
As vias de administração para os agonistas de receptores α-2
adrenérgicos são variadas e estes fármacos são passíveis de uso em quase
todas as espécies domésticas e selvagens, o que os torna muito úteis e versáteis.
A presença de antagonistas farmacológicos como a ioimbina,
atipamezole e telazolina proporciona um diferencial dos agonistas α-2
adrenérgicos em relação aos outros fármacos analgésicos e sedativos. A
possibilidade de reversão das alterações que possam levar a complicações
2
anestésicas é essencial, proporcionando ao grupo uma vantagem sobre outros
sedativos e tranquilizantes.
Nesta revisão foram abordados os principais aspectos sobre os efeitos
sedativos, analgésicos, miorrelaxantes e cardiorrespiratórios dos agonistas de
receptores α-2 adrenérgicos, abordando as principais diferenças entre espécies e
apresentando as particularidades dos fármacos do grupo disponíveis para uso no
Brasil.
3
2 REVISÃO DE LITERATURA
2.1 Sistema nervoso autônomo e receptores adrenérgicos do tipo alfa
O sistema nervoso divide-se em central e periférico e este último, por
sua vez, divide-se em sistema nervoso somático e sistema nervoso autônomo
(FANTONI & CORTOPASSI, 2002). O sistema nervoso somático é responsável
pela inervação da musculatura esquelética, enquanto as funções involuntárias e
viscerais são controladas pelo sistema nervoso autônomo (SANTOS et al., 2012).
O sistema nervoso autônomo apresenta gânglios, plexos nervosos e
redes de fibras aferentes e eferentes que são responsáveis pelo controle das
funções dos sistemas respiratório, circulatório, termorregulador, digestório e
metabólico. Este sistema apresenta duas subdivisões, sistema simpático e
sistema parassimpático, que exercem efeitos opostos e complementares sobre as
funções que regulam (ROLIN et al. 2010).
No sistema nervoso autônomo parassimpático as fibras nervosas
eferentes emergem do tronco cerebral e dos segmentos S2, S3 e S4 na medula
sacral, recebendo o nome de fibras pré-ganglionares. Essas fibras préganglionares fazem sinapse como outras fibras chamadas pós-ganglionares, cujo
corpo se localiza nos gânglios autônomos presentes em locais próximos aos
órgãos ou estruturas viscerais ou até mesmo dentro deles (Figura 1). Neste
sistema a acetilcolina é o neurotransmissor responsável pela transmissão do
impulso nervoso tanto entre as fibras pré e pós ganglionares, como entre as fibras
pós-ganglionares e o órgão efetor (PIMENTEL et al., 2009; ROLIN et al., 2010).
No sistema nervoso autônomo simpático as fibras nervosas préganglionares emergem da medula espinhal, a partir dos segmentos T-2 a L1, e
fazem sinapse com as fibras pós-ganglionares em gânglios localizados longe dos
órgãos e estruturas efetoras, mas próximos do neuroeixo (Figura 1). No sistema
nervoso autônomo simpático o neurotransmissor entre as fibras pré e pósganglionar é a acetilcolina, enquanto que a neurotransmissão entre as fibras
nervosas pós-ganglionares e os órgãos efetores é adrenérgica (Figura 2). Isso
significa que esse processo é mediado por neurotransmissores endógenos
4
originados da tirosina, como adrenalina, dopamina ou noradrenalina, conhecidos
também como catecolaminas (GILSBACH et al., 2011).
FIGURA 1 - Representação das fibras pré e pós ganglionar do sistema nervoso
autônomo simpático e parassimpático. Fonte: http://www.mypersonaltrainer.it/fisiologia/sistema-simpatico.html
Os
receptores
adrenérgicos
são
glicoproteínas
localizadas
na
superfície das células efetoras, possuem estruturas moleculares específicas e são
responsáveis pela atividade adrenérgica do sistema nervoso autônomo simpático,
sendo divididos em três grupos principais: receptores α, receptores e receptores
dopaminérgicos (BOSCO, 2001).
5
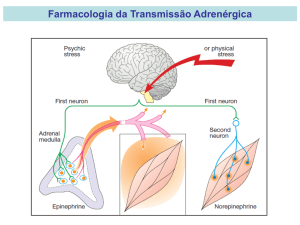
FIGURA
2
- Receptores
noradrenérgicos
nos
neurônios pré e pós-sináptico do
sistema
nervoso
autônomo
simpático.
Fonte: GILSBACH, et. al, (2011)
Os receptores α-adrenérgicos são classificados em dois grupos, α-1 e
α-2 de acordo com a posição anatômica e função fisiológica. Os receptores α-1
são pós-sinápticos, estão no músculo liso vascular e promovem vasoconstrição e
efeitos simpatomiméticos. Já os receptores α-2 são inibitórios, estão localizados
na membrana pré-sináptica de neurônios nos centros superiores e quando
ativados induzem efeitos ansiolíticos, sedativos, simpatolíticos e anti-hipertensivos
(SCHMITZ & HOLZGRADE, 2011). Em humanos foi demonstrada a existência de
quatro subtipos de receptores α-adrenérgicos, denominados α2A, α2b, α2c e α2D,
porém os efeitos de cada subtipo ainda não foram bem elucidados (SOUZA,
6
2006). O quadro 1 apresenta a localização dos receptores α e a função
desempenhada de acordo com a estrutura em que se encontram.
QUADRO 1 - Ações fisiológicas decorrentes da estimulação adrenérgica em
receptores alfa.
Receptor
Localização
Ações primárias
Receptor α-2
Neurônio pré-sináptico
Inibição da liberação de noradrenalina
Receptor α-2
Neurônio pós-sináptico
Vasoconstrição
Receptor α-1 e α-2
Vasos sanguíneos
Vasoconstrição
Receptor α-1
Pulmão
Inibição da secreção
Receptor α-1 e α-2
Estômago
Reduz motilidade e tônus muscular
Receptor α-1 e α-2
Intestino
Reduz motilidade e tônus muscular
Receptor α-1
Rim – Secreção de renina
Diminuição da liberação
Receptor α-1
Bexiga
Contração
Receptor α-1
Útero
Contração
Receptor α-1
Olho – Musculatura da íris
Contração – midríase
Receptor α-1
Glândulas lacrimais
Aumento da secreção
Receptor α-1
SNC
Atividade simpática
Receptor α-2
SNC
Sedação, analgesia
Fonte: Adaptado de FANTONI & CORTOPASSI, 2002; SCHMITZ &HOLZGRADE, 2011
Os receptores β-adrenérgicos são associados a efeitos inibitórios,
como vasodilatação, relaxamento da musculatura uterina e dos brônquios. São
divididos em receptores β1, encontrados em maior densidade no miocárdio e nó
sinoatrial e receptores β2 localizados em maior número no músculo liso dos
brônquios, vasos, útero, bexiga e intestino, sendo responsáveis por vasodilatação,
broncodilatação e relaxamento da bexiga( BOSCO, 2001)
A estimulação por fármacos agonistas de receptores α-2 adrenérgicos
promoverá a inibição e liberação de noradrenalina na fenda sináptica, modulando
7
a
atividade
do
sistema
nervoso
autônomo
simpático,
proporcionando
características como miorrelaxamento, sedação e analgesia, características
inerentes ao grupo farmacológico (MURRELL & HELLEBREKERS, 2005).
2.2 Efeitos dos agonistas de receptores alfa-2 adrenégicos
2.1.1 Sedação
A ativação do receptor α-2 pré-sináptico inibe a liberação de
noradrenalina na fenda sináptica, modulando assim a atividade das células
efetoras do sistema nervoso autônomo simpático. O tronco cerebral é a região
com maior presença de células noradrenérgicas, localizadas bilateralmente em
um pequeno núcleo neural conhecido como Locus coeruleus. Esta estrutura é um
importante modulador do estado de alerta, sendo o principal local de ação dos
agonistas adrenérgicos α-2 (MURRELL & HELLEBREKERS, 2005; ELFENBEIN
et al., 2009). Como resultado da interação desses fármacos com os receptores
adrenérgicos α-2 observam-se analgesia, sedação e alterações cardiovasculares,
todos dependentes da dose (SOUZA et al., 2011).
2.2.2 Analgesia
Os fármacos agonistas dos receptores α-2 adrenérgicos produzem
analgesia pela ação em estruturas espinhais e supra-espinhais. As terminações
aferentes centrais estão presentes no corno dorsal da medula espinhal e no
tronco cerebral. A administração de doses reduzidas de agonistas α-2 em
qualquer um destes locais induz analgesia com mínimos efeitos adversos
(GUIRRO et. al., 2009; VALVERDE, 2010).
Em cães submetidos a cirurgias ortopédicas a dexmedetomidina
administrada em bolus, na dose de 5μg/kg com posterior infusão contínua na
dose de 15μg/kg/h, proporciona terapia analgésica complementar, reduzindo o
8
consumo de anestésico geral e favorecendo a qualidade da recuperação da
anestesia (UILENREEF et al., 2008). Outro estudo em cães demonstrou que a
utilização de dexmedetomidina na dose de 5μg/kg proporcionou analgesia
eficiente para avaliação da pressão intraocular em cães (ARTIGAS et al., 2012).
Segundo ELFENBEIN et al., (2009), equinos tratados com detomidina
na dose de 10 a 20μg/kg pela via intravenosa apresentam analgesia visceral
dose-dependente, no entanto, por meio da utilização do teste de limiar térmico,
não apresentam analgesia somática eficiente.
2.2.3 Efeitos no sistema cardiovascular
As alterações cardiovasculares decorrem da inibição do tônus
simpático ocasionada pela redução da liberação pré-sináptica de noradrenalina, o
que favorece a atividade do sistema nervoso parassimpático, via acetilcolina. As
alterações observadas incluem diminuição na frequência cardíaca, bloqueios
atrioventriculares de primeiro e segundo grau e redução no débito cardíaco
(MURRELL & HELLEBREKERS, 2005).
A bradicardia observada em pacientes após administração do fármaco
agonista α-2 ocorre pelo aumento do tônus vagal e resposta reflexa de
barorreceptores à vasoconstrição periférica. Esta resposta ocorre a partir da
hipertensão transitória observada por estimulação inicial de receptores α-1
adrenérgicos (VALADÃO et. al., 2000; MURRELL & HELLEBREKERS, 2005).
Segundo CULLEM (1999) cães e gatos tratados com xilazina e
medetomidina apresentam bradicardia, com redução na frequência cardíaca em
até 60%, iniciando 10 minutos após administração e podendo durar até 60
minutos. ILBACK et al. (2003) se referem à diminuição da frequência cardíaca por
até quatro horas, quando comparada com a observada antes da administração de
xilazina em cães. Em equinos a xilazina apresentou menor redução na frequência
cardíaca, quando comparada com detomidina e romifidina em doses equipotentes
(ENGLAND & CLARKE, 1996).
A pressão arterial aumenta após administração de xilazina em cães,
com pico de cinco a 10 minutos, em seguida diminui até valores menores que os
9
observados no basal e se normaliza 50 minutos após administração (ILBACK et.
al., 2003). Entretanto, a duração da fase hipertensiva está relacionada com a
dose do fármaco agonista α-2, enquanto a duração da fase hipotensiva não
apresenta a mesma relação, sendo que, mesmo com a utilização de pequenas
doses observa-se hipotensão (ENGLAND & CLARKE, 1996).
2.2.4 Efeitos no sistema respiratório
Os agonistas de receptores α-2 adrenérgicos promovem depressão
respiratória de forma variável entre as espécies, modificando sua função de
acordo com a dose e o fármaco empregado. A ocorrência de depressão
respiratória
é
principalmente
observada
pela
redução
dos
movimentos
respiratórios, diminuição na pressão parcial arterial de oxigênio e aumento das
pressões de gás carbônico sanguíneo, induzidas pela ação do fármaco nos
centros respiratórios superiores (JONES & YOUNG, 1991; KASTNER et al.,
2001).
Em equinos NYNAM et al. (2009) demonstraram redução na frequência
respiratória com a utilização de detomidina, enquanto com doses equipotentes de
xilazina os animais apresentaram um padrão respiratório lento e profundo,
caracterizado por alterações nos gases sanguíneos. Nessa avaliação, verificou-se
redução na pressão de oxigênio no sangue arterial e aumento do dióxido de
carbono, sendo que os valores de oxigênio no sangue arterial retornaram ao
normal após 30 minutos de administração da xilazina (ENGLAND & CLARKE,
1996).
2.2.5 Efeitos no sistema urinário
No sistema urinário ocorrem alterações de ph, osmolaridade e
concentração na urina, assim como alterações nas concentrações de cloro e
fósforo. A diurese observada ocorre pela inibição da liberação de arginina-
10
vasopressina no sangue, ocasionada pela ação do fármaco em receptores
adrenérgicos (TALUKDER & HIKASA, 2009).
TALUKDER et al. (2009) observaram que a xilazina proporcionou um
maior efeito diurético em cães quando comparado a medetomidina. Este efeito foi
descrito até quatro horas após administração do fármaco, demonstrando relação
dose dependentes. No mesmo estudo, ambos os fármacos aumentaram a
osmolaridade, concentração de sódio, potássio e cloreto na urina.
2.2.6 Efeitos no sistema reprodutor
No sistema reprodutor de fêmeas observa-se elevação na pressão
intrauterina 30 minutos após a administração do fármaco, aumento nas
contrações da musculatura uterina e aumento da atividade elétrica de células
miométricas (VALVERDE, 2010). De acordo com ENGLAND & CLARKE (1996),
as concentrações uterinas são similares com xilazina, detomidina e romifidina em
equinos.
2.2.7 Efeitos no sistema digestório
No sistema digestório os mecanismos analgésicos são centrais e
periféricos, envolvendo vias neurais compostas pelo sistema nervoso entérico,
responsável pela motilidade intestinal através de uma via complexa de interação
com o sistema nervoso autônomo (KOENING & COTE, 2006). A redução da
motilidade é observada devido à ativação de fibras pré-sinápticas assim como a
diminuição no fluxo sanguíneo arterial via artéria cecal, devido à redução no
débito cardíaco sistêmico (KOENING & COTE, 2006; VALVERDE, 2010).
ELFENBEIN et. al (2009) observaram que equinos tratados com
detomidina, na dose de 20μg/kg, analgesia visceral de 165 minutos, sendo que a
redução na motilidade intestinal e a distensão abdominal observadas sugeriram
dose-dependência. Em ovinos a administração de xilazina reduziu a motilidade
11
ruminal, podendo apresentar quadros de timpanismo após aplicação pela via
intravenosa (KASTER, 2006).
2.2.8 Efeitos na glicemia
Os
agonistas
de
receptores
α-2
adrenérgicos
estimulam
adrenorreceptores pancreáticos responsáveis pela inibição da liberação de
insulina, reduzindo assim sua concentração no plasma sanguíneo e provocando
aumento transitório da glicemia (SAHA, et. al, 2005).
KANDA & HIKASA (2008) descrevem relação dose-resposta no
aumento da glicemia em gatos sedados com xilazina ou medetomidina, porém
este aumento não é observado com medetomidina nas primeiras três horas após
a administração.
2.2.10 Efeitos no sistema imunológico
No sistema imunológico os agonistas de receptores α-2 foram
associados com mecanismos apoptóticos e, dependendo da dose e do fármaco
empregado, pode haver estímulo ou depressão de timócitos, os quais são as
células precursoras de linfócitos T (COPIC et al., 2003).
2.3 Fármacos agonistas de receptores α-2
2.3.1 Xilazina
A xilazina, C12H16N2S foi sintetizada em 1962 pela Bayer, sendo
primeiramente usada como droga anti-hipertensiva em humanos, porém devido
ao grande poder sedativo, sua utilização foi reduzida. O fármaco apresenta
relação de seletividade entre receptores α-2/α-1 de 160 e é comercializada na
12
forma de cloridrato, em solução estéril e concentrações de 20 ou 100mg/mL
(GUIRRO et al., 2009).
Ao ser administrada pela via intravenosa em equinos induz efeitos
sedativos e analgésicos após quatro a oito minutos e, pela via intramuscular, os
efeitos iniciomam-se em 10-15 minutos. Depois de sua absorção, o fármaco é
biotransformado pela via hepática e eliminado via renal em processo
relativamente rápido (SPYRIDAKI et al., 2004). Em felinos, MORAIS et al. (2005)
ao associarem a xilazina na dose de 1,0 mg/kg, cetamina na dose de 10mg/kg e
atropina 0,044 mg/kg, observaram anestesia de 20 minutos e analgesia de 44
minutos. Entretanto, os animais permaneceram 134 minutos em decúbito lateral
em média, contra 78 minutos de decúbito registrados no grupo em que o
midazolam foi usado como relaxante muscular ao invés da xilazina.
Em pequenos animais as doses recomendadas para sedação,
miorrelaxamento e analgesia são de 0,1–1,0 mg/kg, administradas pela via
intravenosa, intramuscular ou subcutânea. Em equinos, a dose de xilazina
recomendada é de 0,5-1,0 mg/kg administrada via intramuscular ou intravenosa
(FANTONI & CORTOPASSI, 2002). No entanto, DORIA et al. (2008) utilizaram
0,2 mg/kg de xilazina pela via epidural e observaram analgesia de 120 minutos
com mínimas alterações cardiorrespiratórias.
Em ruminantes a xilazina apresenta potencia 10 a 20 vezes maior do
que em outras espécies, sendo que em ovinos, a dose de 0,05 à 0,1 mg/kg induz
a sedação, analgesia e decúbito de 55 minutos. Em bovinos, as doses de xilazina
recomendadas são de 0,05 a 0,1 mg/kg pela via intravenosa ou intramuscular
(FANTONI & CORTOPASSI, 2002). RIZC et al. (2012) demonstraram em seus
trabalhos redução no estresse e efeitos analgésicos em animais que receberam
0,05mg/kg de xilazina pela via intramuscular e foram submetidos a decúbito
lateral. Nestes animais, as concentrações de cortisol foram menores que as dos
animais que não receberam o fármaco.
DÓRIA et al. (2009) refere-se em seus estudos à infusão contínua de
xilazina na dose de 0,35mg/kg/hr como terapia complementar à anestesia geral
por isoflurano. Neste estudo se observou redução no requerimento do anestésico
geral e auxílio na sedação de equinos submetidos a anestesia geral. No entanto,
13
também houve depressão cardiovascular, respiratória e térmica, porém sem
grande interferência na segurança da anestesia geral com isoflurano em equinos.
2.3.2 Detomidina
A detomidina {4-[(2,3-dimethylphenyl) methyl]-1H-imidazole} é um
derivado imidazólico alcaloide disponível sobre a fórmula de cloridrato, com
relação seletividade entre receptor α-2/α-1 de 260. O fármaco apresenta
características lipofílicas, responsáveis pela rápida absorção, ampla distribuição e
alta afinidade pelo sistema nervoso.
A detomidina é um agonista de receptores α-2 adrenérgico utilizado
comumente em equinos para promover sedação, analgesia e relaxamento
muscular, porém pode induzir o desenvolvimento de alterações cardiovasculares
(GUEDES & NATALINI, 2002; FISCHER et al., 2009). A detomidina apresenta
ação similar à xilazina, entretanto com potencia dez vezes maior e efeitos mais
prolongados devendo, desta maneira, ser utilizada com cautela em pacientes
debilitados (HODGSON & DUNLOP, 1990; GUEDES & NATALINI, 2002).
A inibição de neurotransmissores excitatórios observada com a
administração da detomidina promove relaxamento muscular profundo, ataxia,
diminuição da altura de cabeça, da motilidade intestinal e redução dos
movimentos respiratórios. Os modelos analgésicos citados por ELFENBEIN et al.
(2009) e OWENS et al. (1996) demonstraram sua eficiência para o tratamento de
dor em laminites crônicas e lesões crônicas de tendão em equinos. Outro modelo
demonstrou que o fármaco é uma boa opção para o tratamento da dor no
abdômen agudo em equinos, quadro bastante comum para espécie (ELFENBEIN
et al., 2009).
FEITOSA et. al (1990) descreveram a utilização de detomidina em
equinos para procedimentos em posição quadrupedal, apresentado sedação e
relaxamento muscular eficiente. A detomidina, quando comparada à xilazina,
apresenta efeitos analgésicos, sedativos e hipnóticos mais pronunciados e com
maior
durabilidade,
tornando-se
segura
diagnósticos e terapêuticos na espécie equina.
para
procedimentos
cirúrgicos,
14
2.3.3 Medetomidina
A medetomidina é uma mistura racêmica de dois enantiômeros, a
dexmedetomidina e a levomedetomidina, sendo esta última geralmente
considerada farmacologicamente inativa, enquanto a primeira é a forma ativa
(SAVOLA et al., 1991). O fármaco apresenta relação de seletividade entre α2/α1
1620, é dez vezes mais potente que a xilazina e, de acordo com MOENS et.al.
(2003), é o fármaco agonista de receptores α-2 adrenérgicos que apresenta as
melhores característica e eficácia do grupo, seguida pela romifidina, detomidina,
clonidina e xilazina.
O fármaco apresenta ação em receptores α-2 adrenérgicos no sistema
nervoso central e inibe a liberação de norepinefrina dentro das vesículas présinápticas, produzindo sedação e analgesia dose-dependente. O relaxamento
muscular promovido decorre da inibição da transmissão interneuronal na medula
espinhal (MOENS et al., 2003).
MURRELL & HELLEBREKERS (2005) descrevem em seus estudos os
efeitos da medetomidina em cães nas doses de 10-40μg/kg administradas pelas
vias intramuscular, intravenosa ou subcutânea, sendo um excelente sedativo
utilizado na medicação pré-anestésica para induções com tiopental, propofol,
cetamina, halotano e isoflurano. A aplicação intravenosa de medetomidina na
dose de 7μg/kg em pôneis induziu sedação entre dois e sete minutos,
permanecendo os efeitos durante 20 a 30 minutos, sendo observado BAV de
primeiro e segundo grau (BETTSCHART-WOLFENSBERGER et al., 1999).
Segundo JONES (2001), a administração de medetomidina na dose de
15μg/kg pela via epidural confere analgesia em cães e gatos durante quatro a oito
horas, reduzindo os efeitos adversos observados na administração sistêmica
(OTERO, 2005).
Alterações relativas à eletrocardiografia obtidas em cães submetidos à
medetomidina via epidural foram investigadas por VESAL et al. (1996). Esses
autores demonstraram haver retardo na transmissão do impulso elétrico no nodo
atrioventricular, associada com arritmia sinusal por breve período de 20 minutos
após a administração, como relatado para outros fármacos do grupo (LIMA et al.,
2011).
15
2.3.4 Dexmedetomidina
A dexmedetomidina é o enantiômero dextrógiro da medetomidina,
apresenta relação de seletividade entre receptor α2/α1 de 1600, sendo um
fármaco
agonista
de
receptores
α-2
adrenérgicos
super
seletivo.
A
dexmedetomidina promove analgesia, relaxamento muscular e sedação com
menos sinais de depressão respiratória que os outros fármacos representantes do
grupo. A meia-vida de eliminação é de duas horas, sendo biotransformada pelo
fígado e eliminada principalmente pela urina (95%) e o restante pelas fezes
(VILELA & NASCIMENTO, 2003; BACCHIEGA & SIMAS, 2008).
Em humanos, o fármaco foi liberado para uso nos Estados Unidos em
1999, indicado na medicação pré-anestésica, durante a anestesia ou para
bloqueios loco-regionais como a epidural (VILELA & NASCIMENTO, 2003).
Os efeitos sedativos da dexmedetomidina são mediados centralmente
no lócus coeruleus onde concentra-se grande quantidade de receptores do tipo α2 adrenérgicos. A sedação proporcionada pela dexmedetomidina raramente utiliza
medicação complementar para sua manutenção (HALL, 2000). Segundo BHANA
(2000) pacientes tratados com dexmedetomidina apresentaram redução de 50%
na dose da morfina para produzir analgesia, comparada com pacientes que
utilizam apenas o opioide.
Em cães a doses recomendada é de 1-10μg/kg de dexmedetomidina,
administrada pela via intravenosa, observa-se redução no ritmo cardíaco com
duração de duas horas. BARBOSA et al. (2007) observaram os efeitos da
dexmedetomidina sobre o ritmo cardíaco em cães anestesiados com sevoflurano
e submetidos à infusão contínua de adrenalina e concluíram que o fármaco
agonista α-2 interfere na condução do impulso atrioventricular e reduz o número
de complexos ventriculares prematuros provocados pela adrenalina na dose de
3μg/kg.
Em felinos tratados com 4μg/kg de dexmedetomidina, pela via
intramuscular, foi observada redução na frequência cardíaca, pressão arterial
sistólica, frequência respiratória e êmese em 38% dos pacientes tratados. A
êmese observada nos animais ocorre em decorrência da ativação de receptores
α-2 e consequente relaxamento do esfíncter gastresofágico. Além disso, a
16
dexmedetomidina mostrou potencializar a depressão do reflexo laringotraqueal e
aumentou o relaxamento muscular da mandíbula de gatos (SOUZA, 2006).
2.3.5 Clonidina
A clonidina é um composto imidazólico, lipossolúvel, pertencente ao
grupo dos agonistas de receptores α-2 adrenérgicos. Apresenta relação de
seletividade entre receptores α2/α1 de 220, proporcionando características como
sedação e analgesia por atuar em sítios espinhais, com menores efeitos
indesejáveis como vômito e depressão respiratória (EISENACH et al., 1993;
BRANDONI et al., 2004).
Em procedimentos anestésicos a clonidina é indicada para reduzir a
resposta ao estresse cirúrgico, auxiliar na intubação endotraqueal, promover
estabilidade hemodinâmica, reduzir o consumo de analgésicos e halogenados e
fornecer efeitos ansiolítico e antissialogogo (BRANDONI et al., 2004).
Após a administração de clonidina pela via intravenosa em ovinos se
observa
rápida
absorção,
distribuição
e
meia-vida
de
95
minutos.
A
biotransformação do fármaco não produz metabólitos tóxicos e apresenta baixa
incidência de efeitos indesejáveis (CALLEGARI, et al. 2009).
Com a aplicação de clonidina na dose de 6μg/kg em ovinos se
observou analgesia de 95 minutos. A administração de clonidina pela via epidural
em cães submetidos a cirurgia da articulação coxofemoral induz analgesia de
aproximadamente quatro horas, tempo similar ao observado em humanos que é
de três a cinco horas (BRANDANI et al., 2004). Entretanto, CASSU et al. (2010)
ao utilizar a associação de lidocaína e clonidina pela via epidural em cães, não
observaram aumento na duração do bloqueio e sim uma dispersão mais cranial
do bloqueio, quando comparado à técnica com utilização de anestésico local.
Em equinos GUIRRO et. al (2011) observaram analgesia de 360
minutos com a utilização de clonidina pela via epidural, avaliada por meio de
modelo incisional e dos filamentos de Von Frey.
17
2.3.6 Romifidina
A romifidina (2-[(2-bromo-6-fluorofenil) imino] monoidrocloridrato de
imidazolidina) é um agonista de receptores α-2 adrenérgicos potente desenvolvida
a partir da clonidina e apresenta seletividade para receptores α2/α1 de 200
(MUIR, 2000). A romifidina tem sido estudada para uso em pequenos animais,
pelas vias intravenosa e intramuscular (PYPENDOP & VERSTEGEN , 2001).
ENGLAND et al., 1996 observaram em seus estudos os efeitos
proporcionados pela administração de romifidina nas doses de 20, 40, 80 e 120
µg/kg, pela via intramuscular em cães da raça Beagle. Após administração,
verificou-se ataxia, relaxamento muscular e sedação, porém com o incremento da
dose observou redução na frequência cardíaca dos animais.
Segundo FIGUEREDO et al. (2005) a romifidina em equinos apresenta
características similares à administração em outras espécies, observando
relaxamento muscular, sedação, analgesia, relutância em mover-se, pouca
resposta ao ambiente e a estímulos externos. Entretanto, no sistema
cardiorrespiratório verifica-se bradicardia, redução no débito cardíaco e
diminuição dos movimentos respiratórios.
Em muares, ALVES et. al, 1999 se referem à utilização de romifidina
pela via intramuscular e intravenosa para sedação dos animais para
procedimentos de orquiectomia. Segundo os autores, a administração do fármaco
pela via intravenosa induz melhor sedação. Entretanto, pela dificuldade de manejo
e temperamento dos animais, a dose de 0,12mg/kg pela via intramuscular
produziu melhores resultados.
A romifidina, assim como a clonidina, apresenta propriedades
analgésicas com aproximadamente quatro horas de duração, quando empregada
pela via epidural, mas induzindo bradicardia nos primeiros 15 minutos após
administração (BRONDANI et al., 2004).
18
2.4 Uso clínico e vias de administração nas espécies
Os agonistas de receptores α-2 adrenérgicos são fármacos sedativos
utilizados na rotina anestésica da medicina veterinária. Em equinos e bovinos,
estes fármacos fazem parte da maioria dos protocolos anestésicos da rotina
médico veterinária em trabalhos a campo, tendo uma enorme participação nas
indústrias de produtos de origem veterinária.
Estes fármacos são usados na medicina veterinária para diversos
procedimentos na rotina anestésica, sendo sedação, terapia complementar no
tratamento da dor, bloqueios analgésicos loco-regionais, contenção física, dentre
outros (ALMEIDA et al., 2004; MURRELL et al., 2005; CRUZ et al., 2011; SOUZA
et al., 2011; LIMA et al., 2011).
Dentre as vias de administração do fármaco destaca-se a via
intramuscular, bastante utilizada para sedação em pequenos animais (MORAIS
et. al, 2005; ALMEIDA et al., 2004). Já a via intravenosa, por meio de bolus ou
infusão contínua, é utilizada para terapia analgésica complementar em
procedimentos de anestesia geral (SCHAUVLIEGE et al., 2011, SOUZA et al.,
2011).
GRANT & UPTON, 2004 observaram que a dose de 2,5 miligramas de
xilazina pela via intravenosa em ovinos apresentou 20 minutos de analgesia,
enquanto pelas vias intramuscular e subcutânea o período analgésico foi superior
a 40 minutos.
Outra via importante é a epidural, utilizada em terapias analgésicas
complementares em cães, equinos e bovinos (DORIA et al., 2008; FISCHER et
al., 2011; SOUZA et al., 2011). Neste caso, são utilizadas pequenas doses do
fármaco para produzir um excelente efeito analgésico com mínimos efeitos
sistêmicos. CONDINO et. al (2010) compararam o efeito da administração de
lidocaína e xilazina pela via epidural e raquidiana em vacas e observaram
excelente analgesia com poucas alterações sistêmicas, porém os efeitos
analgésicos foram superiores com a aplicação pela via raquidiana.
A utilização de agonistas de receptores α-2 adrenérgicos pela via
epidural foi descrita por VESAL et al. (1998), sendo que, quando comparados aos
anestésicos locais, os agonistas α-2 provocam menor ataxia e induzem analgesia
19
mais potente e duradoura (ALMEIDA et al., 2004). Em cães, CARDOSO et al.
(2008) descreveram excelente analgesia com a utilização de xilazina pela via
epidural lombossacra para procedimentos cirúrgicos pré-retroumbilicais.
2.5 Antagonistas dos receptores α-2
2.5.1 Ioimbina
A ioimbina (17a-hidroxiioimban-16a- acido carboxílico metilester) é um
antagonista adrenérgico de receptores α-2, encontrada na casca da árvore
Pausinystalia. Este fármaco atua como antagonista competitivo, irreversível,
apresentando dissociação lenta do receptor α-2 (HOFFMAN et al., 1996).
Na medicina veterinária a ioimbina tem sido utilizada como antagonista
competitivo dos agonistas α-2 adrenérgicos em cães, gatos, bovinos, ovelhas,
animais silvestres e pequenos roedores. Nesses animais, a ioimbina tem sido
utilizada em intoxicações causadas por xilazina, detomidina, romifidina e amitraz,
revertendo de forma parcial ou total a ação desses fármacos, antagonizando seus
efeitos sedativos e outros efeitos indesejáveis (ANDRADE, 2004).
O antagonismo nos receptores α-2 adrenérgicos aumenta a liberação
de noradrenalina nas terminações nervosas do sistema nervoso autônomo
simpático, proporcionando o incremento na atividade deste sistema. Portanto, as
ações da ioimbina otimizam o sistema cardiovascular devido à estimulação dos
receptores α no coração e nos vasos periféricos, com consequente aumento da
frequência cardíaca e da pressão arterial (ADAMS, 1992; ANDRADE, 2004).
A dose de ioimbina indicada para cães é 0,4mg/kg, apresentando
período médio de ação de 163 minutos. Em equinos a dose é de 0,075-0,15mg/kg
e tempo médio de ação de 106 minutos. Em bovinos a dose de 0,25mg/kg e
tempo médio de ação de 86 minutos. As alterações observadas com a utilização
deste fármaco incluem midríase, taquicardia, agitação, tremores musculares,
aumento da ansiedade e salivação (VOLMER et al., 1994).
20
2.5.2 Atipamezole
O
atipamezole,
[4-(2-etil-2,3-diidro-1H-inden-2-yl)-1H-imidazole
hidroclorídrico] é um potente e seletivo antagonista α-2 adrenérgico usado para
reverter os efeitos sedativos e simpatolíticos dos agonistas de receptores α-2
adrenérgicos (ANDRADE, 2004).
O atipamezole é considerado uma nova geração de antagonistas de
receptores α-2 adrenérgicos, devido à maior seletividade e por não apresentar
interação importante em outros tipos de receptores. Em modelo farmacológico,
demonstrou ser mais potente e seletivo antagonista α-2 adrenérgico do que a
ioimbina (VIRTANEN et al.,1989).
2.5.3 Tolazolina
A tolazolina é um antagonista não competitivo dos agonistas de
receptores α-2 adrenérgicos utilizado na reversão dos efeitos indesejáveis destes
fármacos. Em cães, HSU et al. (1989) descreveram a utilização de 5mg/kg de
tolazolina, pela via intravenosa, para reversão da hipotensão provocada pela
administração de 1,0 mg/kg de xilazina. Os autores tiveram sucesso e não
observaram aumento da frequência cardíaca.
BALSAN et al. (1990) descreveram a importância da tolazolina no
sistema vascular pulmonar, promovendo vasodilatação arterial e venosa,
reduzindo a vasoconstrição pulmonar hipóxica e diminuindo a pressão da artéria
pulmonar.
Em aves GUIMARÃES & ANDRADE (2000) utilizaram, com sucesso,
15 mg/kg de tolazolina para a reversão dos efeitos sedativos da xilazina. No
entanto, recomenda-se acompanhar 60 minutos após administração de tolazolina,
período este que os animais ainda continuam sedados.
21
3 CONSIDERAÇÕES FINAIS
Os fármacos agonistas de receptores α-2 adrenérgicos apresentam
muitos benefícios na utilização da rotina anestésica em medicina veterinária em
procedimentos que incluem sedação, anestesia, diagnóstico e terapêutica. Estes
fármacos atuam em receptores encontrados no sistema nervoso periférico
autônomo
simpático,
promovendo
diversos
efeitos.
As
características
farmacológicas colocam o grupo em destaque devido à importância alcançada na
veterinária.
Os
efeitos
cardiovascular,
adversos
respiratório,
encontrados
digestório,
principalmente
endócrino,
dentre
no
sistema
outros,
são
contrabalanceados com a utilização de doses corretas e a existência de fármacos
antagonistas proporciona maior segurança na utilização dos agonistas de
receptores α-2 adrenérgicos.
Estudos sobre estes fármacos aparecem continuamente, sendo a
criação de novas medicações do grupo ou novas vias e associações, uma forma
de se obter benefícios antes não descritos na anestesiologia. A diferença entre
espécies
é
muito
importante
para
ampliação
demonstrando novas perspectivas de trabalho.
do
mercado
veterinário,
22
4 REFERÊNCIAS
1. ADAMS, H. R. Drogas adrenérgicas e antiadrenérgicas. In: BOOTH, N. H.;
MCDONALD, L. E. Farmacologia e terapêutica em veterinária. 6 ed. Rio de
Janeiro: Guanabara Koogan, 1992. p. 71 – 92.
2. ALMEIDA, R. M.; VALADÃO, C. A. A.; MORENO, J. C. D.; FARIAS, A. SOUZA,
A. H. Efeitos da administração epidural de amitraz, xilazina e dimetil sulfóxido em
vacas. Arquivo Brasileiro de Medicina Veterinária e Zotecnia. São Paulo, v.56,
n.6, p.723-732, 2004.
3. ANDRADE, S. F. Estudo clínico e laboratorial da intoxicação experimental
por amitraz em gatos e comparação entre ioimbina e atipamezole como
tratamento. 2004. 175f. Tese (Doutorado em Medicina Veterinária) – Faculdade
de Medicina e Zootecnia Veterinária, Universidade Estadual Paulista, São Paulo,
2004.
4. BACCHIEGA, T. S.; SIMAS, R. C. Dexmedetomidina um novo medicamento na
anestesiologia
veterinária.
Revista
Científica
Eletrônica
de
Medicina
Veterinária. Garça, v.1, n.10, 2008.
5. BARBOSA, V. F.; NUNES, N.; CONCEIÇÃO, E. D. V.; NISHIMORI, C. T.;
PAULA, T. B.; FERRO, P. C.; CARARETO, R. Efeitos da dexmedetomidina sobre
a arritmia cardíaca induzida pela adrenalina em cães anestesiados pelo
sevoflurano. Arquivo Brasileiro de Medicina Veterinária e Zootecnia. Belo
Horizonte, v.59, n.6, p.1439-1444, 2007.
6. BHANA, N.; GOA, K.; MCCLELLAN, K. J. Dexmedetomidine. Drugs, Sydney,
v.59, n.2, p.263-268, 2000.
7. BRANDONI, J. C.; NATALINI, C. C.; RAISER, A. G.; MAZZANTI, A.; PRATI, L.
Analgesia epidural com clonidina ou romifidina em cães submetidos a cirurgia
coxofemural. Arquivo Brasileiro de Medicina Veterinária e Zootecnia. Santa
Maria, v.56, n.2, p.175-182, 2004.
8. CONDINO, M. P.; SUZIKI, K.; TAGUCHI, K. Antinociceptive, sedative and
cardiopulmonarry effects of subrachnoid and epidural xylazine-lidocaine in
xylazine-sedated calves. Veterinary Anaesthesia and Analgesia. Davis, v.37,
p.70-78, 2010.
23
9. CULLEM, L. K. Xylazine and medetomidina in small animals: these drugs
should be used carefully. Australian Veterinary Journal. Victoria, v.77, n.11,
p.722-723, 1999.
10. CUPIC, V.; COLIC, M.; JANDRIC, D.; MILOJKOVIC, B.; VARAGIC, V. M.
Xilazine, an alpha 2-adrennergic agonist, induces apoptosis of rat thymocytes and
a thymocytes hybridoma line in vitre. Methods & Findings in Experimental &
Clinical Pharmacology. Belgrade, v.25, n.1 p.5-10, 2003.
11. CRUZ, F. S.; CARREGARO, A. B.; MACHADO, M.; ANTONOW, R. R.
Sedative and cardiopulmonary effects of buprenorphine and xylazine in horses.
Canadian Journal of Veterinary Researsh, Ottawa, v. 75, n. 1, p. 35-41, 2011.
12. DÓRIA, R. G. S.; VALADÃO, C. A. A.; CANOLA, P. A.; GUIRRO, E. C. B. P.;
MENDES, M. P.; ESCOBAR, A. RIBEIRO, G.; NATALINI, C. C. Anestesia por
isoflurano em equinos submetidos à infusão contínua de medetomidina ou
xilazina. Ciência Rural. Santa Maria, v.39, n.2, p.447-452, 2009.
13. DÓRIA, R. G.; VALADÃO, C. A.; DUQUE, J. C.; FARIAS, A.; ALMEIDA, R. M.;
NETTO, A. C. Comparative study of epidural xylazine or clonidine in horses.
Veterinary Anaesthesia and Analgesia, Davis, v. 35, n. 2, p. 166-172, 2008.
14. ELFENBEIN, J. R.; SANCHEZ, L. C.; ROBERTSON, S. A.; COLE, C. A.;
SAMS, R. Effect of detomidine on visceral and somatic nociception and duodenal
motility in conscious adult horses. Veterinary Anaesthesia and Analgesia,
Davis, v. 36, n. 2, p. 162-172, 2009.
15. ENGLAND, G.C.W.; FLACK, T.E.; HOWIGWORTH, E.; HAMMOND, R.
Sedative effects of romifidine in the dog. Journal of Small Animal Practice, v.37,
n.1, p.19-24, 1996.
16. FISCHER, B. L.; LUDDERS, J. W.; ASAKAWA, M.; FORTIER, L. A.; FUBINI,
S. L.; NIXON, A. J.; RADCLIFFE, R. M.; ERB, H. N. A comparison of epidural
buprenorphine plus detomidine with morphine plus detomidine in horses
undergoing bilateral stifle arthroscopy. Veterinary Anaesthesia and Analgesia,
Davis, v. 36, n. 1, p. 67-76, 2009.
17. GILSBACH, R.; PREIBIL, S.; HEIN, L. α-2 Adrenozeptoren: Drei Subtypen fur
ein breites Wirkspektrum. Pharmazie Unserer Zeit. Weinheim, v.6, n.1, p.462468, 2011.
24
18. GUEDES, A. G. P.; NATALINE, C. C. Anestesia em equinos com síndrome
cólica- Análise de 48 casos - Revisão de Literatura. Ciência Rural, Santa Maria,
v. 32, n. 3, p. 545-542, 2002.
19. GUIRRO, E. C. B. P.; SOBRINHO, G. R.; FERREIRA, I. M. M.; VALADÃO, C.
A. A. Injeção epidural de xilazina e amitraz, em equinos: Efeitos antinociceptivos.
Ciência Rural, Santa Maria, v.39, n.1, p.104-109, 2009.
20. HUBBELL, J. A.; AARNES, T. K.; LERCHE, P.; BEDNARSKI, R. M. Evaluation
of a midazolam-ketamine-xylazine infusion for total intravenous anesthesia in
horses. American journal of Veterinary Research, Columbus, v. 73, n. 4, p. 470475, 2012.
21. JONES, R. S. Epidural analgesia in the dog and cat. Veterinary Journal.
London, v.161, p.123-131, 2001.
22. ILBACK, N. G.; STALHANDSKE, T. Cardiovascular effects of xilazina recorded
with telemetry in the dog. Journal of Veterinary Medicine. Berlim, v.50, p.279483, 2003.
23. KASTER, S. B. R. A2-agonists in sheep: a review. Veterinary Anaesthesia
and Analgesia. Davis, v.33, p.79-96, 2006.
24.
KOENIG,
J.;
COTE,
N.
Equine
gastrointestinal
motility--ileus
and
pharmacological modification. The Canadian Veterinary Journal, Ottawa, v. 47,
n. 6, p. 551-559, 2006.
25. LIMA, A. D. S. D.; SOUZA, A. P.; SANTANA, V. L.; ARAUJO, A. L.; MENDES,
R, S.; NOBREGA, P. I. N. Anestesia epidural com medetomidina e lidocaína, em
gatos pré-medicados com acepromazina e midazolam. Arquivo Brasileiro de
Medicina Veterinária e Zotecnia. Belo Horizonte, v.63, n.2, p.308-316, 2011.
26. MOENS , Y.; LANZ, F.; DOHERR M. G.; SCHATZMANN, U. A comparison of
the antinociceptive effects of xylazine, detomidine and romifidine on experimental
pain in horses. Veterinary Anaesthesia Analgesia. Davis, v.30, p.183-190, 2003.
27. MORAIS, C. B.; PAULA, V. V.; ALVES JUNIOR, R. B. Avaliações das
associações
anestésicas:
atropina/cetamina/xilazina
e
acepromazina/cetamina/midazolam em felinos domésticos. Brazilian journal of
Veterinary Research and Animal Science. São Paulo, v.42, n.2, p.98-104, 2005.
25
28. MUIR, W. W.; MASON, D. Cardiovascular system. In: THURMON, J. C.;
TRANQUILLI, W. J.; BENSON, G. J. Lumb & Jones’ veterinary anesthesia. 3.
ed. Lea & Feabiger: Philadelphia, 1996. cap. 5, p. 62-114.
29.
MURRELL,
J.
C.;
HELLEBREKERS,
L.
J.
Medetomidine
and
dexmedetomidine: a review of cardiovascular effects and antinociceptive
properties in the dog. Veterinary Anaesthesia and Analgesia, Davis, v. 32, n. 3,
p. 117-127, 2005.
30. OGILVIE, G. K. Chemotherapy. In: WITHROW, S. J.; MAcEWEN, E. G. Small
animal clinical oncology. 2. ed. Philadelphia: W. B. Saunders, 1996. p. 75.
31. OSTINI, F. M.; ANTONIAZZI, P.; PAZIN, A. F.; BESTETTI, R.; CARDOSO, M.
C. M.; BASILE, A. F. Uso de drogas vasoativas em terapia intensiva. Medicina
Intensiva. Ribeirão Preto, v.31, p.400-411, 1998.
32. OTERO, P. Dor: avaliação e tratamento em pequenos animais. São Paulo:
Interbook, 2005. Cap.14, p.192-211.
33. OWENS, J. G.; KAMERLING, S. G.; STANTON, S. R.; Evaluation of
detomidine-induced analgesia in horses with chronic hoof pain. Journal
Pharmacology and Experimental Therapeutic. Baton Rouge, v.278, n.1, p.179–
184, 1996.
34. PIMENTEL, L. A.; OLIVEIRA, D. M.; GALIZA, G. J. N.; REGO, E. O.;
DANTAS, A. F. M.; CORREA, F. R. Doenças do sistema nervoso central de
equinos no semi-árido. Pesquisa Veterinária Oliveira. Rio de janeiro, v.27, n.7,
p.589-597, 2009.
35. ROLIM, V. P.; VANDERLEI, S. R. S.; SILVA, L. T. R.; AMORIM, M. J. A. A. L.;
MONTES, G. M. S.; PESSOA, R. S. M.; CIDRAL, A. H.; OLIVEIRA, J. M. R. P. B.;
COSTA, E. F.; LIMA, J. Y. B. Estudo Neuroanatômico sobre o sistema nervoso
autônomo referente a inervação cervical autônoma em equinos. In: X JORNADA
DE
ENSINO
PESQUISA
E
EXTENSÃO
–
JEPEX,
2010,
Recife.
Resumo.../0001/R1077-1, Recife, 2010.
36. SAHA, J. K.; XIA, J.; GRONDIM, J. M.; ENGLE, S. K.; JAKUBOWSKI, J. A.
Acute Hyperglycemia Induced by Ketamine/Xylazine Anesthesia in Rats:
Mechanisms and Implications for Preclinical Models. Experimental Biology and
Medicine. Indianapolis, v.230, p.777-784, 2005.
26
37. SANTOS, R. P.; FIGHERA, R. A.; BRUM, J. S.; RIPPLINGER, A.;
BRAUNHERDT, R.; MAZZANTI, A. Neoplasma envolvendo o sistema nervoso
central de cães: 26 casos (2003-2011). Pesquisa Veterinária Brasileira. Santa
Maria, v.32, n.2, p.153-158, 2012.
38. SAVOLA, J. M.; VIRTANEN, R. Central alpha2-adrenoceptors are highly
stereoselective for dexmedetomidine, the dextro enantiomer of medetomidine.
European Journal Pharmacology, v.2, n.1, p.193-199, 1991.
39. SKARDA, R.T.; St. JEAN, G.; MUIR III, W.W. Influence of tolazoline on caudal
epidural administration of xylazine in cattle. American Journal of Veterinary
Research, Columbus, v.51, p.556-560, 1990
40. SOUZA, J. F. F.; MONTEIRO, E. R.; CAMPAGNOL, D.; RAMOS, R. C.;
FRASSON, A. M. F. Evaluation of nociception, sedation, and cardiorespiratory
effects of a constant rate infusion of xylazine alone or in combination with lidocaine
in horses. Journal of Equine Veterinary Science. v.1, p.1-7, 2011.
41. SOUZA, S. S. Efeitos da dexmedetomidina, por via epidural ou infusão
contínua intravenosa, em gatas anestesiadas com propofol e isoflurano e
submetidas a ovariossalpingohisterectomia. 2006. 141f. Tese (Mestrado em
Medicina Veterinária) – Faculdade de Medicina Veterinária e Zootecnia da
Universidade de São Paulo, São Paulo, 2006.
42. SPYRIDAKI, M. H.; LYRIS, E.; GEORGOULAKIS, I.; KOURETAS, D.;
KONSTANTINIDOU, M.; GEORGAKOPOULOS, C. G. Determination of xylazine
and its metabolites by GC-MS in equine urine for doping analysis. Journal
Pharmaceutical Biomedical Analysis, Kifissia, v. 35, n. 1, p. 107-116, 2004.
43. SWEENEY, C. L.; CONSTATINESCU, G. M. Vascular surgery. In: AUER, J. A.
Equine surgery. 2 ed. Phidadelphia, WB Saunders Co, 1991, p.517-519.
44. TALUKDER, H.; HIKASA, Y. Diuretic effects of medetomidine compared which
xilazina in healthy dogs. The Canadian Journal of Veterinary Research. Ottawa,
v.73, p.224-236, 2009.
45. UILENREEF, J. J.; MURRELL, J. C.; MCKUSICK, B. C.; HELLEBREKERS, L.
J. Dexmedetomidine continuous rate infusion during isoflurane anaesthesia in
canine surgical patients. Veterinary Anaesthesia and Analgesia. Davis, v.35,
p.1-12, 2008.
27
46. VALADÃO, C.A.A.; TEIXEIRA NETO, F.J.; MARQUES, J.A. Evaluation of the
effect of hyoscine-n-butyl-bromide on the cardiovascular actions of detomidine, in
the horse. Brazilian Journal of Veterinary Research and Animal Science , São
Paulo, v. 37, p. 405-409, 2000.
47. VALVERDE, A. Alpha-2 agonists as pain therapy in horses. Veterinary clinics
of North America. Equine practice, Guelph, v. 26, n. 3, p. 515-532, 2010.
48. VALVERDE, A. DYSON, D. H.; COCKSHUTT, J R.; McDONELL, W. N.;
VALLIANT, A. E. Comparison of the hemodynamic effects of halothane alone and
halothane combined with epidurally administered morphine for anesthesia in
ventilated dogs. American Journal of Veterinary Research, Schaumburg, v. 52,
n. 3, p. 505-509, 1991.
49. VILELA, N. R.; NASCIMENTO, P. J. uso de dexmedetomidina em anestesia.
Revista brasileira de anestesiologia. Rio de Janeiro, v.51, n.1, p.97-113, 2003.
50. VILELA, N. R.; NASCIMENTO, P. J.; CARVALHO, L. R. Efeitos
cardiovasculares de duas doses de dexmedetomidina. Estudo experimental em
cães. Revista Brasileira de Anestesiologia. Rio de janeiro, v.53, n.6, p.784-796,
2003.
51. VOLMER, P. A.; TRANQUILLI, W. J.; FLEMING, J. R.; BUCK, W. B. Acute
oral yohimbine toxicosis in a dog. Canine Practice., v. 19, p. 18 – 9, 1994.