N.o:
Nome:
Turma:
Data:
4.º teste de avaliação
Grupo 1
Leia com atenção o texto seguinte.
A AMEAÇA ÁCIDA
O CO2 AUMENTA. É O FIM DOS ANIMAIS COM CONCHA?
A vida das criaturas minúsculas perto da base da cadeia alimentar marinha é, na melhor das hipóteses,
perigosa, e o risco é agravado por uma nova ameaça provocada pelo Homem. Desta vez, não se trata do
aquecimento global, embora a raiz do problema seja a mesma. A subida do nível de dióxido de carbono
atmosférico (CO2) está a aquecer o Mundo e, ao mesmo tempo, a dissolver-se nas águas oceânicas, tornando-as mais ácidas. Para os animais com concha, isso pode significar um ambiente corrosivo.
Os oceanos são um sumidouro natural de CO2 e absorvem mais de um quarto do que é libertado na
atmosfera. Actualmente, estamos a emitir enormes quantidades, e os oceanos captam 25 milhões de
toneladas diárias de CO2 em excesso: o impacto começa a notar-se. Os cientistas já mediram um aumento
da acidez de cerca de 30% nas águas superficiais e prevêem um aumento de 100 a 140% até 2010.
Ainda não foram documentados efeitos nocivos no mar aberto, mas a ameaça é evidente. Absorvido pela água do mar, o CO2 reage e forma ácido carbónico que, por sua vez, torna a água, normalmente alcalina, mais ácida. Durante o processo, a quantidade de iões carbonato dissolvidos, diminui.
Muitos organismos marinhos dependem do carbonato da água do mar para construir as suas conchas e outras componentes duras. Por fim, espécies fundamentais perderão a capacidade de construir ou manter as suas conchas e esqueletos.
Os utilizadores do mineral aragonite são particularmente vulneráveis. Entre estes, incluem-se
minúsculos caracóis que ajudam a alimentar peixes essenciais do ponto de vista comercial, como o
salmão. Modelos computorizados prevêem que as águas polares se tornarão hostis para estes caracóis nos próximos cinquenta anos.
Em 2100, o habitat de muitas espécies com
concha poderá diminuir drasticamente e as repercussões sentir-se-ão na cadeia alimentar. Se a
acidificação atingir os trópicos, «será um cenário
apocalíptico para os recifes de coral», diz o oceanógrafo Ken Caldeira, que prevê que, se as tendências actuais se mantiverem, os recifes só sobreviverão em refúgios murados, com acidez controlada.
J. HOLLAND, «A ameaça ácida», in National Geographic,
Novembro de 2007, vol. 7, n.o 80, pp. 66-67 (adaptado)
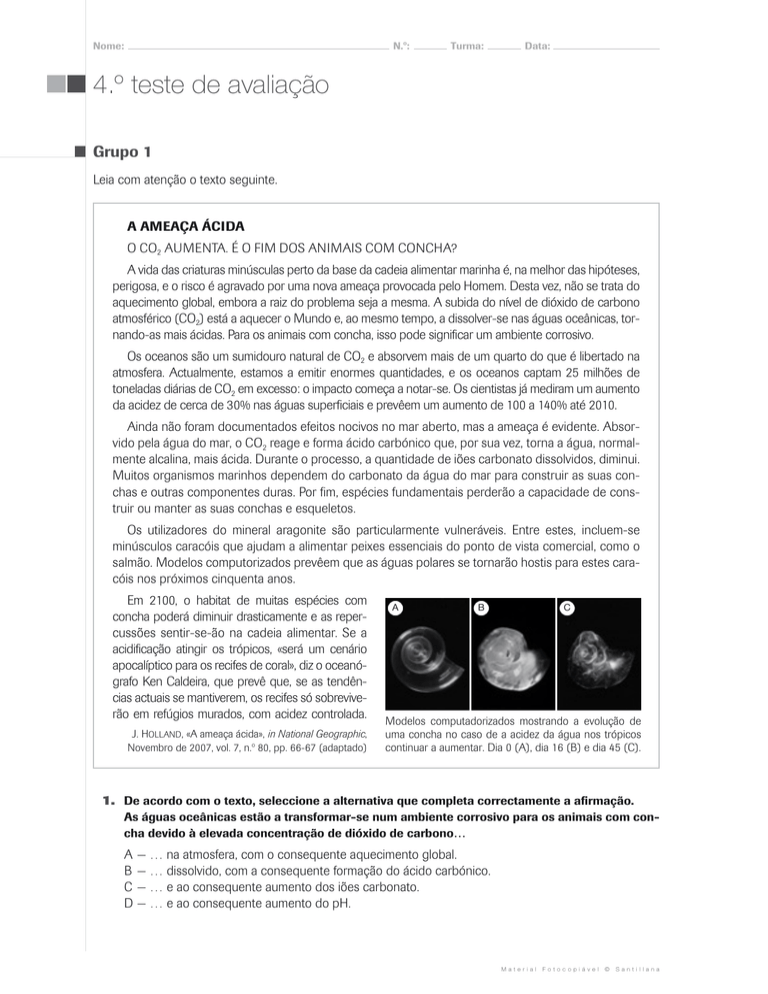
A
B
C
Modelos computadorizados mostrando a evolução de
uma concha no caso de a acidez da água nos trópicos
continuar a aumentar. Dia 0 (A), dia 16 (B) e dia 45 (C).
1. De acordo com o texto, seleccione a alternativa que completa correctamente a afirmação.
As águas oceânicas estão a transformar-se num ambiente corrosivo para os animais com concha devido à elevada concentração de dióxido de carbono…
A — … na atmosfera, com o consequente aquecimento global.
B — … dissolvido, com a consequente formação do ácido carbónico.
C — … e ao consequente aumento dos iões carbonato.
D — … e ao consequente aumento do pH.
Material
Fotocopiável
©
Santillana
2. De acordo com o texto, seleccione a opção correcta.
A — As águas oceânicas apresentam um valor de pH cada vez mais alto.
B — O pH das águas oceânicas é menor do que 7.
C — A concentração de ião hidróxido tem vindo a diminuir nas águas oceânicas.
D — A concentração de ião oxónio nas águas oceânicas tem vindo a diminuir.
3. De acordo com o texto, seleccione a opção correcta.
A — De acordo com as medições efectuadas pelos cientistas, prevê-se um aumento de acidez em
30% nas águas superficiais até 2010.
B — Modelos computorizados prevêem que, em 2100, os caracóis com conchas de aragonite estejam extintos.
C — De acordo com Ken Caldeira, a acidificação das águas ameaça chegar aos recifes de corais em 2100.
D — De acordo com a tendência actual, Ken Caldeira prevê que os recifes de corais terão de ser protegidos em refúgios murados para não desaparecerem.
4. De acordo com texto, responda às questões seguintes.
4.1
Traduza a dissolução do dióxido de carbono nas águas oceânicas por uma equação química.
4.2
Identifique os pares conjugados ácido-base.
4.3
Explique por que razão o elevado nível de dióxido de carbono presente na atmosfera é responsável pela acidez das águas oceânicas.
4.4
Para efectuar medições do pH nas águas oceânicas, os cientistas recolheram uma amostra de
500 mL de água do oceano. Na medição efectuada registaram um valor de pH ⫽ 8,1. Calcule a
concentração de ião oxónio na solução.
5. Considere que no fundo do oceano se encontra um navio naufragado. O seu casco é feito de
ferro e, devido à acidez local das águas, sofre uma deterioração rápida com a corrosão da
estrutura metálica. Responda às questões seguintes.
5.1
Escreva a equação química que traduz a reacção que ocorre entre o ferro e a água ácida naquele
local do oceano.
5.2
Refira, justificando, se a equação anterior traduz uma reacção de oxidação-redução.
Material
Fotocopiável
©
Santillana
5.3
Normalmente, protegem-se os cascos dos navios utilizando metais de sacrifício, como o zinco,
para diminuir a corrosão do ferro. O que se pode concluir relativamente ao poder redutor destes dois metais?
6. Nas águas oceânicas encontram-se diversos iões dissolvidos, como o ião cloreto ou o ião sulfato.
Esses iões originam compostos sólidos a que chamamos sais. Responda às questões seguintes.
6.1
Classifique como verdadeira (V) ou falsa (F) cada uma das afirmações seguintes.
A — Os sais são compostos iónicos, constituídos por átomos que estabelecem ligações iónicas
entre si.
B — O ião cloreto pode estabelecer ligação com o ião sódio e formar cloreto de sódio.
C — O carbonato de sódio resulta da ligação iónica entre o carbono e o sódio.
D — O sal de fórmula química NaCH3COO chama-se acetato de sódio.
E — A fórmula química do hidróxido de potássio é K2OH.
F — O ião sulfato só pode estabelecer ligações com iões negativos para formar sais.
G — O sal de fórmula química NaCñO resulta da ligação entre os iões Na⫹ e CñO⫺.
H — O óxido de magnésio tem a fórmula química Mg2O.
6.2
Quando se retira uma amostra de água do mar e se adiciona ião prata, verifica-se a formação de
um precipitado de cloreto de prata em água pura, cujo Ks é 1,6 ⫻ 10⫺10 a 25 ºC. Escreva a
equação química que traduz a reacção e calcule a solubilidade do cloreto de prata à temperatura
referida.
Grupo 2
A questão da crescente acidez das águas oceânicas, provocada pela subida do nível de dióxido
de carbono atmosférico, tem preocupado a comunidade científica. Por isso, o conhecimento químico
assume uma importância fundamental na resolução destes problemas. Para recriar o que acontece
na Natureza, um grupo de alunos fez uma actividade prática na sala de aula.
1. Começaram por determinar o pH da água do mar, na ausência de excesso de dióxido de carbono.
Nessas condições, a água do mar apresenta um pH ligeiramente básico devido aos iões carbonato, de acordo com a equação química:
➝
➝
CO32⫺(aq) ⫹ H2O(ñ)
HCO3⫺(aq) ⫹ OH⫺(aq)
A presença de iões hidróxido e iões cálcio permite a formação do hidróxido de cálcio em solução. Por
isso, prepararam 250 mL, a 25 °C, de uma solução aquosa saturada de hidróxido de cálcio por dissolução de 0,23 g de soluto. Responda às questões.
1.1
De entre o material seguinte, seleccione aquele de que os alunos necessitam para preparar a solução.
A — Tubos de ensaio
B — Vareta
C — Bureta
D — Balão volumétrico
E — Balão Erlenmeyer/matraz
F — Suporte universal
G — Pinça metálica
H — Balança
I — Papel de filtro
J — Gobelé
L — Vidro de relógio
M — Espátula
Material
Fotocopiável
©
Santillana
1.2
Ordene as afirmações que se seguem de modo a traduzir correctamente a descrição do procedimento da preparação da solução saturada de hidróxido de cálcio.
A — Transferir a solução para o balão volumétrico de 250 mL.
B — Pesar 0,23 g de soluto.
C — Agitar a solução.
D — Perfazer o volume com água destilada.
E — Dissolver o soluto num pouco de água destilada.
1.3
Tendo em conta que o produto de solubilidade deste hidróxido, a 25 °C, é 7,9 ⫻ 10⫺6, calcule o
valor de pH medido pelos alunos após a preparação da solução saturada.
1.4
Comente o valor de pH obtido pelos alunos, tendo em conta o pH das águas oceânicas na
ausência de excesso de dióxido de carbono.
2. A aragonite é uma forma mineral de formação rochosa de carbonato de cálcio CaCO3 e encontra-se em conchas de um elevado número de moluscos e corais. As espécies utilizadoras da
aragonite, de acordo com o texto, são as mais vulneráveis à acidez das águas oceânicas; por
isso os alunos precipitaram carbonato de cálcio e simularam o que ocorre na Natureza. Responda às questões seguintes.
2.1
Para prepararem o precipitado de carbonato de cálcio, os alunos misturaram 200 mL de uma
solução aquosa de CaCñ2 0,010 mol dm⫺3 com 300 mL de uma solução aquosa de Na2CO3
0,015 mol dm⫺3. Verifique se houve formação de precipitado de carbonato de cálcio sabendo
que o produto de solubilidade é 4,5 ⫻ 10⫺9.
2.2
Escreva a equação química que traduz a reacção do dióxido de carbono com a aragonite (carbonato de cálcio) na água dos oceanos, que destrói a aragonite e conduz à formação de iões
cálcio e hidrogenocarbonato.
Material
Fotocopiável
©
Santillana