Capítulo 1. Química Orgânica: os compostos do carbono
Objetivos: Revisão sobre estruturas e reatividades de compostos orgânicos.
Hidrocarbonetos: compostos contendo apenas C e H.
Classes de hidrocarbonetos: alcanos, alcenos, alcinos e aromáticos.
Compostos com composições idênticas cujas moléculas têm diferentes
estruturas: a existência de isômeros.
Princípio organizacional da química orgânica: grupo funcional.
Moléculas bioquimicamente importantes: proteínas, carboidratos e ácidos
nucléicos.
1.
O surgimento da expressão química orgânica:
Torben Olof Bergman, químico sueco (1777), introduziu na literatura química pela primeira
vez a expressão Química Orgânica.
Compostos Orgânicos: substâncias dos organismos vivos.
Compostos Inorgânicos: substâncias do reino mineral.
O elemento carbono forma um vasto número de compostos. Mais de 16 milhões de
compostos contendo carbono são conhecidos; aproximadamente 90% dos novos compostos
sintetizados a cada ano contêm carbono. O estudo dos compostos de carbono constitui um
ramo separado da química, conhecido como Química Orgânica. Esse termo originou-se
das crenças do século XVII de que os compostos orgânicos poderiam ser formados apenas
pelos seres vivos. Essa idéia foi desmentida em 1828 pelo químico alemão Friedrich
Wohler quando sintetizou a uréia (H2NCONH2), uma substância orgânica encontrada na
urina dos mamíferos, por meio do aquecimento de cianato de amônio (NH4OCN),
substância inorgânica.
Síntese de Wohler : NH4OCN
Cianato
de
anônio
NH2
O=C
NH2
Uréia
Cronologia de algumas preparações e acontecimentos ocorridos após a síntese de Wohler:
1828: Hennel prepara o álcool etílico.
1846: Dr. John C. Warren realiza, no Hospital Geral de Massachusetts (EUA), a primeira
intervanção cirúrgica de grande porte com o emprego de um anestésico: o éter. Este fato
fato assinala uma nova era na Medicina: a era dos anestésicos.
1847: Dr. James Simpson, cirurgião de Edimburgo, usa pela primeira vez o clorofórmio
como anestésico.
1848: Frankland e Kolbe preparam o ácido acético.
1854: Berthelot prepara o gás metano.
1935: Químicos do Instituto Pasteur descobrem a sulfanilamida: substância de ação
bactericida. A seguir são descobertas outras sulfas.
1945: A partir da descoberta da penicilina, em 1929, por Alexandre Fleming, químicos e
físicos da Inglaterra e dos Estados Unidos descobrem que existem várias penicilinas e
conseguem sintetizar a Penicilina G. (As penicilinas são agentes bactericidas mais eficazes
que as sulfas).
2.
Algumas características gerais das moléculas orgânicas:
O que o carbono apresenta que leva à enorme diversidade em seus compostos e permite
que tenham papéis cruciais na biologia e na indústria? Os compostos orgânicos
diferenciam-se dos inorgânicos por uma série de características:
a) Elementos constituintes: constituídos fundamentalmente por 4 elementos: C, H, O e N,
denominados elementos organógenos.
b) Combustão: como todos os compostos orgânicos contêm C e a imensa maioria possui
H, a queima completa dessas substâncias produz CO2 e H2O. A combustão incompleta
produz CO, enquanto a parcial, apenas C (fuligem). Portanto, para um composto
orgânico que contém C e H ou C, H e O, pode-se escrever:
Composto orgânico + O2 combustão completa
CO2 + H2O
OBS: A combustão incompleta dos combustíveis produz CO, que, ao ser inalado, se une a
hemoglobina, impedindo que ela exerça o papel fundamental de transportar oxigênio no
sangue. Produz também carvão, que caracteriza fuligem, liberada principalmente pelos
caminhões desregulados.
c) Ligações e forças intermoleculares: grande parte dos compostos orgânicos exibe apenas
ligações covalentes. Dessa forma, as forças de atração intermoleculares predominantes são
as forças de Van der Waals; posteriormente aparecem as forças de atração entre dipolos
permanentes, o que inclui as pontes de hidrogênio. As substâncias orgânicas que exibem
ligação iônica apresentam, na maioria das vezes, pequeno grau de dissociação ao serem
dissolvidas num solvente, em geral, a água.
d) Estabilidade: os compostos orgânicos apresentam, geralmente, pequena estabilidade
diante de agentes enérgicos, como temperatura, pressão, ácidos concentrados, entre outros.
Como vimos, a maioria dos compostos orgânicos ao ser aquecidos sofre combustão
completa, produzindo CO2, incompleta, formando CO, ou carbonização, que origina
carbono.
e) Ponto de fusão e de ebulição: os compostos orgânicos sendo, de modo geral,
moleculares apresentam pontos de fusão e ebulição baixos.Isso justifica a predominância na
Química Orgânica de compostos gasosos e líquidos: os sólidos existentes são, em grande
parte, facilmente fusíveis.
f) Solubilidade: os compostos orgânicos, em geral, são solúveis em solventes apolares e
insolúveis em solventes polares, como a água.
g) Velocidade das reações: as reações orgânicas envolvendo, geralmente, substâncias
moleculares e de grande massa molar são, na maioria dos casos, lentas, requerendo o uso de
catalisadores. O aquecimento para aumentar a velocidade deve ser feito com cuidado,
devido à instabilidade dos compostos orgânicos em elevadas temperaturas.
h) Isomeria: fenômeno verificado quando duas ou mais substâncias diferentes apresentam a
mesma fórmula molecular. Por ex., com a fórmula C2H6O existem duas substâncias: etanol
(álccol comum) e metoximetano (éter dimetílico).
H3C – CH2 – OH
Etanol
H3C – O – CH3
Metoximetano
(líquido)
3.
(vapor)
Características do átomo de carbono:
Em 1852, o químico inglês Edward Frankland publicou um trabalho em que parecia a
expessão valência, relacionada com a capacidade de ligação que teriam os átomos. Poucos
anos depois, o químico alemão August Kekulé lançava hipóteses extraordinárias, que
causariam um grande avanço no estudo das substâncias orgânicas:
O carbono teria quatro valências.
C
Os átomos de C poderiam formar cadeias.
C–C–C–C
Os átomos de C poderiam unir-se entre si, utilizando uma ou mais valências.
C–C
Lig. Simples
C=C
Lig. Dupla
CC
Lig. Tripla
Os átomos de C têm enorme capacidade de ligar-se a outros átomos de C ou de diferentes
elementos, formando seqüências estáveis.
Cadeia é o nome dado à seqüência de átomos ligados entre si.
Em todas as cadeias carbônicas, observamos que o número de ligações covalentes de um
átomo de C é igual a quatro. Entretanto, dois átomos de C podem ligar-se entre si por
ligações simples, dupla ou tripla.
Tipo de
ligação
entre C
4 lig. simples
1 lig. dupla
1 lig. tripla
2 lig. duplas
Ligações
estabelecidas
Hibridação
Geometria do
carbono
4
3e1
2e2
2e2
sp3
sp2
sp
sp
tetraedro
triangular
linear
linear
Ângulo
entre as
ligações
109º28’
120º
180º
180º
Exemplo
CH4
H2C = O
H–CN
O=C=O
4.
Classificação do carbono na cadeia carbônica:
Observando modelos de várias cadeias carbônicas, os cientistas notaram que determinado
átomo de carbono podia estar unido a um, dois, três ou quatro átomos de carbono. Em
função dessas observações, os carbonos foram classificados da seguinte maneira:
Classificação
C primário
C secundário
C terciário
C quaternário
Conceito
Ligado a apenas outro átomo
de carbono
Ligado a dois átomos de
carbono
Ligado a três átomos de
carbono
Ligado a quatro átomos de
carbono (o número máximo
de ligações que o carbono
admite).
Exemplo
C–C
C–C–C
C–C–C
C
C
C–C–C
C
Exemplo:
C1
C1 – C2 – C3 – C4 – C1
C1 C1
1 carbonos primários
2 carbono secundário
3 carbono terciário
4 carbono quaternário
Um átomo de carbono é nulário (n) quando não se liga a nenhum outro átomo de carbono.
O número de compostos que exibem apenas carbonos nulários é muito pequeno; não
chamaremos a atenção para os átomos nulários.
5.
As cadeias carbônicas:
Atualmente são conhecidos aproximadamente 7 milhões de compostos orgânicos e apenas
cerca de 200 mil substâncias inorgânicas. Esse enorme número de compostos orgânicos,
formado na maioria por 4 elementos químicos ( C, H, O e N ), é explicável por uma
propriedade muito especial do elemento carbono: a formação de cadeias.
O quadro abaixo mostra as diversas apresentações de duas estruturas típicas, uma cadeia
aberta outra fechada.
Butano C4H10
Ciclo-propano C3H6
C
Fórmula estrutural plana
C
C
C
C
C
C
CH2
Fórmula estrutural
simplificada
H3C – CH2 – CH2 – CH3
H2C CH2
Representação tipo bond
line
OBS: A representação da cadeia carbônica por meio de segmentos de reta (bond line
formula) ainda não tem nome oficial em português . Essa representação obedece ao
seguinte código:
A cadeia será representada como um ziguezague.
As pontas corresponderão ao grupo CH3.
A junção de dois traços corresponderá a um grupo CH2.
A junção de três traços indicará um grupo CH.
A junção de quatro traços corresponderá a um carbono quaternário.
Exemplos:
H3C – CH = CH – CH3
H3C – N – CH2 – CH3
N
CH3
6.
Classificação das cadeias carbônicas:
Uma cadeia carbônica pode ser classificada de acordo com vários critérios:
a) Quanto ao sentido do percurso
Aberta ou acíclica: quando percorrida num sentido qualquer, sempre se chega a uma
extremidade.
Fechada ou cíclica: percorrida num determinado sentido, nunca se chega a uma
extremidade.
b) Quanto à disposição
Normal ou linear: quando contém apenas átomos de carbono primários e/ou
secundários.
Ramificada ou arborescente: quando contém átomos de carbono terciários e/ou
quaternários.
c) Quanto à saturação
Saturada: quando entre átomos de carbono existem apenas ligações simples.
Insaturada: quando entre átomos de carbono existem ligações duplas e/ou triplas.
d) Quanto à natureza
Homogênea: quando entre átomos de carbono existem apenas átomos de carbono.
Heterogênea: quando entre átomos de carbono existe átomo diferente de carbono
(heteroátomo).
É hábito denominar as cadeias cíclicas ramificadas de mistas. Portanto, uma cadeia
mista é uma cadeia carbônica que tem uma parte cíclica e outra acíclica.
Halogênios nunca podem ser heteroátomos. Eles pertencem à família 7A e por esse
motivo, fazem apenas uma ligação covalente e nunca poderão estar intercalados entre
dois carbonos.
Veja a cadeia da molécula do cloro-etano, por ex., que é um gás usado como anestésico:
H3C – CH2 – CH2 – Cl
Não é heteroátomo
Átomos como oxigênio (O), nitrogênio (N), fósforo (P) e enxofre (S), que formam várias
ligações covalentes, podem ser heteroátomos ou não, dependendo da maneira como se
colocam na estrutura da molécula. Veja os ex. abaixo:
Heteroátomo
Não é heteroátomo
H3C – O – CH3
H3C – CH2 – O – H
H3C – N – CH3
H3C – CH2 – N – H
CH3
O heteroátomo
precisa estar ligado
a pelo menos dois
átomos de carbono.
H
OBS: Núcleo benzênico é uma cadeia homogênea e cíclica constituída de seis átomos de
carbono no anel, ligados alternadamente por ligações simples e duplas. Ele pode ser
representado de várias maneiras.
OBS: Cadeia aromática é uma cadeia homocíclica (homogênea e cíclica) que apresenta
núcleo benzênico.
Cadeia alicíclica é uma cadeia homocíclica que não apresenta núcleo benzênico.
As ligações dupla ne tripla denominam-se ligações insaturadas ou insaturações.
O grupo mais característico das cadeias aromáticas denomina-se núcleo (ou anel)
benzênico, ou apenas grupo aromático. O composto aromático mais simples é o benzeno.
Classificação dos compostos orgânicos:
7.
De acordo com a cadeia carbônica os compostos orgânicos classificam-se em
heterocíclicos, aromáticos e alifáticos.
8.
Heterocíclicos: apresentam cadeia carbônica heterocíclica (heterogênea e cíclica),
com ou sem ramificação.
Aromáticos: apresentam cadeia carbônica aromática, com ou sem ramificação.
Alifáticos (são os demais): apresentam cadeia carbônica acíclica ou alicíclica, com
ou sem ramificação.
Classificação geral das cadeias carbônicas:
Normal
quanto às ramificações
Ramificada
Aberta
(acíclica
ou
alifática)
tipo de ligação
Saturada
Insaturada
tipo de átomo
Cadeias
carbônicas
Homogênea
Heterogênea
Aromática
Fechada
(cíclica)
Homogênea (homocíclica)
Heterogênea (heterocíclica)
Não-aromática (alicíclica)
Saturada
Insaturada
9.
Função orgânica:
Função química é uma série de compostos que tem propriedades químicas em comum.
Esses compostos apresentam um radical (ou grupo) funcional, grupamento atômico comum
a todos os constituintes da função, responsável pelas suas propriedades químicas.
Nomenclatura oficial:
O nome oficial das substâncias orgânicas é constituído de acordo com normas estabelecidas
pela União Internacional de Química Pura e Aplicada (Iupac). As normas da Iupac
permitem que seja estabelecido um nome característico para cada composto, não
importando a maneira como a cadeia carbônica é escrita. Esse sistema de regras foi criado
em 1892, mas tem sido constantemente aprimorado por meio de várias revisões. A
nomenclatura oficial visa uniformizar os critérios para se nomear um composto orgânico.
Desse modo geral, podemos dizer que o nome oficial de uma substância orgânica apresenta
3 partes principais:
Nome oficial = prefixo + parte intermediária + sufixo
Prefixo: Indica a quantidade de átomos de carbono na cadeia. Os quatro primeiros
receberam nomes consagrados pelo uso (met, et, prop e but) ; de 5 átomos em diante
são usados os prefixos gregos (pent, hex, ...).
Número de átomos de carbono
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Prefixo
Met
Et
Prop
But
Pent
Hex
Hept
Oct
Non
Dec
Undec
Dodec
Tridec
Tetradec
Pentadec
Parte intermediária: Indica a presença ou não de insaturações. Observe a tabela:
Tipo de ligação entre átomos de C
Apenas ligação simples – C – C –
Uma ligação dupla – C = C –
Duas ligações duplas – C = C = C –
Uma ligação tripla – C C –
Duas ligações triplas – C C – C C –
Parte intermediária
an
en
dien
in
diin
Sufixo: Indica a função orgânica. Depende da função a que pertence a substância.
As principais funções orgânicas
Função
Grupo funcional
Exemplo
Regras básicas
de nomenclatura
Hidrocarboneto
Álcool
Fenol
Aldeído
Cetona
Ácido carboxílico
Éster
Éter
Derivado halogenado
Haleto de ácido
Amina
Amida
Nitrocomposto
Composto de Grignard
Tioálcool
OBS: Há muitos compostos de função mista, ou seja, que apresentam diferentes grupos
funcionais em suas estruturas.
Exemplo 1: H3C – CH2 – CH2 – CH3
Prefixo: 4 átomos de carbono - but
Parte intermediária: só ligações simples entre átomos de C – na
Sufixo: possui apenas C e H (hidrocarbonetos) – o
Nome: butano
Exemplo 2: H3C – CH2 – OH
Prefixo:
P. intermediária:
Sufixo:
Nome:
Exemplo 3: H2C – CH2
HC = CH
Quando a cadeia carbônica é cíclica, antes do prefixo numérico se coloca a palavra ciclo.
Cadeia carbônica cíclica: ciclo
Prefixo:
Infixo:
Sufixo:
Nome:
Exemplo 4: H – C – CH2 – C – H
||
||
O
O
Quando na cadeia carbônica existem repetições de radicais funcionais ou de insaturações,
usam-se os prefixos di, tri, ..., que indicam o número de repetições. Os prefixos são escritos
antes das palavras que identificam os radicais funcionais ou as insaturações.
Prefixo:
Infixo:
Sufixo:
Repetição: dois radicais funcionais:
Nome:
Entre duas consoantes coloca-se uma vogal, a ou o, dependendo da melhor fonia.
Exemplo 5: H3C – CH2 – CH – CH3
|
OH
Quando é necessário posicionar um radical funcional ou uma insaturação, numera-se a
cadeia a partir da extremidade mais próxima do radical funcional (no caso de
hidrocarboneto, da insaturação). O número é colocado antes do que se deseja posicionar:
quando só há um radical funcional ou uma insaturação a ser posicionada, admite-se
escrever o número em outr4os locais da nomenclatura.
Prefixo:
Infixo:
Sufixo:
Posição do radical funcional:
Nome:
O hífen separa o número da palavra.
Exemplo 6: H2C = CH – CH = CH2
Prefixo:
Infixo:
Sufixo:
Posição das insaturações:
Nome:
Exemplo 7: H3C – C – CH2 – CH3
||
O
Prefixo:
Infixo:
Sufixo:
Nome:
Observe que é desnecessário especificar, mas não errado, escrever butan-2-ona ou 2butanona ou butanona-2, uma vez que para ser cetona o radical funcional não pode estar em
C primário, ou seja, na extremidade da cadeia, mas apenas em C secundário. Não existe 1butanona: na verdade, o composto seria o butanal.
Também é desnecessário especificar a numeração nos exemplos 2 – etanol só pode ser 1etanol - , 3 – ciclobuteno só pode ser 1-ciclobuteno – e 4 – propanodial só pode ser 1,3propanodial.
Exemplo 8: H2C = CH – CH – CH3
|
OH
Prefixo:
Infixo:
Posição da dupla ligação:
Sufixo:
Posição do radical funcional:
Nome:
Obeserve que, na numeração da cadeia carbônica, o radical funcional tem preferência sobre
a insaturação.
Cadeia carbônica ramificada:
Para dar o nome o nome oficial de uma substância que apresenta cadeia carbônica
ramificada, devemos inicialmente escolher e numerar a cadeia principal e posteriormente
identificar as ramificações ligadas a ela.
Escolha da cadeia principal
Para se escolher a cadeia principal existem algumas regras que devem ser usadas na
ordem em que são apresentadas.
1. quando a cadeia carbônica é cíclica, os átomos de carbono do ciclo constituem a
cadeia principal.
2. quando a cadeia carbônica é acíclica, a cadeia principal deve ser a maior seqüência
que contenha o radical funcional ou, no caso de hidrocarbonetos, os carbonos da
insaturação, se essa existir.
3. existindo duas ou mais possibilidades de cadeia principal deve-se optar pela mais
ramificada.
Ramificações
As principais ramificações são radicais derivados de hidrocarboneto pela retirada de um
átomo de hidrogênio. Se o hidrocarboneto for alifático, o radical é chamado de alcoíla
ou alquila, sendo representado por R – . Se o hidrocarboneto for aromático e a valência
livre se apresentar em carbono de núcleo aromático, o radical denomina-se arila, sendo
representado por Ar – ; se estiver fora do núcleo aromático, é denominado alcoíla. Na
nomenclatura desses radicais o sufixo é il ou ila.
Veja alguns exemplos de radicais alquila.
Hidrocarboneto
Radical alcoíla ou alquila
OBS: Cadeia principal de uma estrutura é a maior seqüência possível de átomos de C
que engloba a função orgânica mais importante da substância. As ramificações devem
ser citadas em ordem alfabética, sem levar em conta eventuais prefixos de quantidades
(di, tri, etc.) Exemplo:
trietil--------------------- dimetil
Ordem alfabética: etil--------------------metil
Antes da adoção da nomenclatura oficial, utilizava-se na Química Orgânica a
nomenclatura comercial. Veja alguns nomes oficiais e usuais que os antigos estudantes
necessitavam saber:
Etino = acetileno
metanol = espírito da madeira
Etanol = espírito do vinho
pentanol = álcool amílico
1,2,3-propanotriol = glicerina
ácido etanodióico = ácido oxálico
2-butenal = aldeído crotônico
propenal = acroleína
ácido metanóico = ácido fórmico
propanona = acetona
ácido hexanóico = ácido capróico ácido etanóico = ácido acético
ácido octanóico – ácido caprílico
ácido heptanóico = ácido enântico
ácido decanóico = ácido cáprico
ácido nanóico + ácido pelargônico
ácido hexanodióico = ácido adípico
ácido decanodióico = ácido sebássico
ácido propenóico = ácido acrílico ácido 2-metilbut-2-enóico = ácido angélico
Para numerar a cadeia principal existem algumas regras que devem ser usadas na ordem
em que estão apresentadas.
A cadeia principal é cíclica
A cadeia principal é acíclica
1. A cadeia principal é numerada a partir do C
que contém o radical funcional ou, no caso de
hidrocarboneto, a partir da insaturação se
existir.
2. Se a regra anterior não decidir, a cadeia
principal é numerada a partir do C que contém
um radical.
3. Se a regra anterior não decidir, a cadeia
principal é numerada a partir do carbono que
posicione os radicais nos carbonos de menores
números (regra dos menores números).
1. A cadeia principal é numerada a partir da
extremidade mais próxima do radical funcional
ou, no caso de hidrocarboneto, dos C da
insaturação se existirem.
2. Se a regra anterior não decidir, a cadeia
principal é numerada a partir da extremidade
mais próxima do primeiro radical.
3. Se a regra anterior não decidir, a cadeia
principal é numerada a partir da extremidade
que posiciona os radicais nos carbonos de
menores números (regra dos menores
números).
4. Se a regra anterior não decidir, a cadeia 4. Se a regra anterior não decidir, a cadeia
principal é numerada de acordo com a ordem principal é numerada a partir da extremidade
alfabética dos radicais.
mais próxima do radical de acordo com a sua
ordem alfabética.
Regra geral:
Número do carbono
ramificado
-
Nome da
ramificação
-
Nome do hidrocarboneto que
possui a cadeia principal
OBS: se houver várias seqüências com o mesmo número de átomos de carbono, a cadeia
principal será a seqüência mais ramificada.
Capítulo 2. Função Hidrocarboneto
1. Hidrocarbonetos:
São compostos binários formados exclusivamente por C e H, sendo a classe de compostos
orgânicos mais simples. Na nomenclatura oficial apresentam terminação o. São numerosos,
e por isso é conveniente organiza-los em famílias que exibem similaridades estruturais. O
aspecto chave estrutural dos hidrocarbonetos (e de muitas outras substâncias orgânicas) é a
presença de ligações carbono-carbono estáveis. O carbono é o único elemento capaz de
formar cadeias estendidas e estáveis de átomos unidos por ligações simples, duplas e
triplas.
Os hidrocarbonetos podem ser divididos em 4 tipos gerais, dependendo dos tipos de
ligações carbono-carbono em suas moléculas:
Alcanos
Alcenos
Alcinos
Hidrocarbonetos aromáticos
Nesses hidrocarbonetos, bem como em outros compostos orgânicos, cada átomo de carbono
invariavelmente tem 4 ligações (4 ligações simples, 2simples e 1 dupla, ou 1 ligação
simples e outra tripla ).
2. Alcanos:
São hidrocarbonetos alifático, acíclicos e saturados, sendo também chamados
hidrocarbonetos parafínicos (apresentam baixa reatividade química) ou metânicos (derivam
teoricamente do metano ).
Os alcanos são hidrocarbonetos que contém apenas ligações simples, como no etano
(C2H6). Uma vez que os alcanos contém um maior numero possível de átomos de
hidrogênio por átomo de carbono, são chamados hidrocarbonetos saturados. A tabela
abaixo relaciona vários dos mais simples alcanos. O metano é o principal componente do
gás natural, utilizado em fogões a gás. O propano é o principal componente do gás
engarrafado (GLP) usado para aquecimento domestico e na cozinha o butano é usado em
isqueiros descartáveis. Os alcanos de 5 a 12 átomos de carbono por molécula são
encontrados na gasolina.
Fórmula
molecular
CH4
C2H6
C3H8
C4H10
C5H12
C6H14
C7H16
C8H18
C9H20
C10H22
Primeiros membros da serie de alcanos de cadeia linear
Fórmula estrutural condensada
Nome
CH4
Metano
Etano
CH3CH3
Propano
CH3CH2CH3
Butano
CH3CH2CH2CH3
Pentano
CH3CH2CH2CH2CH3
Hexano
CH3CH2CH2CH2CH2CH3
Heptano
CH3CH2CH2CH2CH2CH2CH3
Octano
CH3CH2CH2CH2CH2CH2CH2CH3
Nonano
CH3CH2CH2CH2CH2CH2CH2CH2CH3
CH3CH2CH2CH2CH2CH2CH2CH2CH2CH3 Decano
Ponto de
ebulição
-161
-89
-44
-0,5
36
68
98
125
151
174
Propriedades físicas dos alcanos:
Os alcanos são substâncias apolares, o que justifica sua baixa solubilidade em água.
Considerando estruturas não-ramificadas, os alcanos de 1 a 4 carbonos são gases; com 5
a 17 carbonos são líquidos e com 18 carbonos em diante são sólidos.
O petróleo é uma enorme mistura de hidrocarbonetos e você sabe que esse liquido
flutua no mar. Isso ocorre porque a densidade dos hidrocarbonetos líquidos é menos que
a da água.
Propriedades químicas dos alcanos:
A principal reação química dos alcanos é a combustão , que pode ser completa ou não,
dependendo das quantidades relativas de combustível e gás oxigênio.
Combustão completa: CH4 + 2 O2 CO2 + 2 H2O
Combustão incompleta: CH4 + O2 C + 2 H2O
(fuligem)
Propriedades bioquímicas dos alcanos:
As propriedades fisiológicas dos alcanos variam de acordo com o tamanho da cadeia. O
metano parece ser fisiologicamente inerte. Em um aposento com alta concentração
dessa substância, há riscos que não derivam de uma ação biológica desse gás. Uma
amostra de ar contendo 15% de metano, por ex. torna-se explosiva sob a ação de uma
simples faísca. Um outro ex. pode ser a respiração humana em uma atmosfera carregada
de metano. Nesse ambiente a respiração pode ser prejudicada não pela ação do metano
em si, mas pela proporção de gás oxigênio na mistura, que pode provocar asfixia.
Alcanos gasosos não possuem cheiro. Para que se possa detectar vazamentos em
botijões domiciliares, costuma-se acrescentar ao gás de botijão outro gás de cheiro
forte, como as mercaptanas. Alcanos com cadeias maiores, como os componentes
líquidos da gasolina, podem provocar náuseas e vômitos, quando ingeridos
ocasionalmente, ou problemas de pele (dermatites), quando manuseados. Mas, por outro
lado, alcanos obtidos com grande massa molecular, são usados como creme amaciante.
A vaselina, por ex., é um dos componentes empregados na fabricação de cremes
cosméticos.
Estruturas dos alcanos:
As fórmulas para os alcanos dadas na tabela estão escritas em uma notação chamadas
fórmulas estruturais condensadas. Essa notação revela a maneira pela qual os átomos
estão ligados uns aos outros, mas não exige o desenho de todas as ligações.
H
H H H
H3C – CH2 – CH2 – CH3
H–C–C–C–C–H
H
H H H
ou
CH3CH2CH2CH3
Por ex., a estrutura de Lewis e as fórmulas estruturais para o butano (C4H10) são
apresentadas acima.
Usaremos freqüentemente as estruturas de Lewis ou as fórmulas estruturais condensadas
para representar os compostos orgânicos. Observe que cada átomo de C em um alcano tem
4 ligações simples, enquanto cada átomo de H forma uma ligação simples. Observe,
também, que cada composto seguinte na série relacionada na tabela acima tem unidade CH2
adicional.
Os alcanos relacionados na tabela são chamados hidrocabonetos de cadeia linear porque
todos os átomos de C estão unidos em uma cadeia contínua. Os alcanos consistindo em 4
ou mais átomos de C podem também formar hidrocarbonetos de cadeias ramificadas. Os
compostos com a mesma fórmula molecular, mas com diferentes arranjos de ligação (e,
conseqüentemente, diferentes estruturas) são chamados isômeros estruturais. Os isômeros
estruturais de determinado alcano diferem ligeiramente um do outro nas propriedades
físicas. Observe os pontos de fusão e ebulição dos isômeros do butano e pentano abaixo.
H
H H H
H–C–C–C–C–H
H
H H H
Butano: p.f. = -135ºC
p.e. = -0,5ºC
H
H H
H–C–C–C–H
H
H
C
H
H
H
Isobutano (2-metilpropano):
p.f. = -145ºC
p.e. = -10ºC
H
H H H H
H
H–C–C–C–C–C–H
H
H H H
H–C–C–C–C–H
H H H H
Pentano: p.f. = -130ºC
p.e. = +36ºC
H
H
C
H H
H
H
Isopentano (2-metilbutano):
p.f. = -160ºC
p.e. = +28ºC
O número possível de isômeros estruturais aumenta rapidamente com o número de átomos
de C no alcano. Existem 18 isômeros possíveis tendo a mesma fórmula molecular C8H18,
por ex., e 75 isômeros possíveis com a fórmula molecular C10H22.
Nomenclatura dos alcanos:
Os primeiros nomes dados para os isômeros estruturais acima são chamados nomes
comuns. O isômero no qual, um grupo CH3 está ramificada da cadeia principal é chamado
isômero isso- (por ex., isobutano). À medida que o numero de isômeros cresce, torna-se
impossível encontrar um prefixo apropriado para denominar o isomero. Os químicos de
todo o mundo, independentemente de suas nacionalidades ou afiliações políticas,
concordam com um sistema comum para dar nomes aos compostos. Os nomes da Iupac
para os isômeros do butano e pentano são aqueles dados entre parênteses para cada
composto. Esses nomes, bem como aqueles de outros compostos orgânicos, têm 3 partes:
Prefixo base
sufixo
Quantos carbonos?
Quais substituintes?
Qual família?
As seguintes etapas resumem os procedimentos usados para chegar aos nomes dos alcanos,
todos com nomes finalizados com o sufixo –ano.
1. Encontre a cadeia mais longa de átomos de C e use o nome dessa cadeia com o
nome base do composto. A cadeia mais longa nem sempre está escrita em uma linha
reta, como visto no seguinte exemplo:
CH3 – CHCH3
CH2 – CH2 – CH2 – CH3
2-metilhexano
Uma vez que esse composto tem cadeia de seis átomos de C, recebe o nome como um
hexano substituído. Os grupos ligados à cadeia principal são chamados substituintes
porque substituem um H ligado a um carbono da cadeia principal.
2. Numere os átomos de cada C na cadeia mais longa, começando com o lado da
cadeia mais próximo de um substituinte. A cadeia é numerada a partir do lado que
fornece o menor número para a posição do substituinte.
3. Dê o nome e forneça a localização de cada grupo substituinte. Um grupo
substituinte formado pela remoção de um átomo de H do alcano é chamado grupo
alquil ou alquila. Os grupos alquila são nomeados pela substituição da terminação
–ano do nome do alcano por –il. O grupo metil (CH3), pó ex., é derivado do metano
(CH4). Analogamente, o grupo etil (C2H5) é derivado do etano (C2H6).
4. Quando dois substituintes estão presentes, relacione-os em ordem alfabética.
Quando existem dois ou mais do mesmo substituinte, o número de substituintes
daquele tipo é indicado por um prefixo: di (2), tri (3), tetra (4), penta (5), e assim
por diante. Observe o seguinte ex.:
CH3
CH3 – CH – CH2
CH – CH – CH2 – CH3
CH3 CH – CH3
CH3
3-etil-2,4,5-trimetileptano
Cicloalcanos:
Os alcanos podem formar não apenas cadeias ramificadas, mas também anéis ou ciclos. Os
alcanos com essa forma de estrutura são chamados cicloalcanos. As estruturas dos
cicloalcanos algumas vezes são desenhadas como polígonos simples nos quais cada vértice
do polígono representa um grupo CH2. Esse método de representação é similar ao usado
para os anéis de benzeno. No caso das estruturas aromáticas, cada vértice representa um
grupo CH. Os anéis de carbono contendo menos de 5 átomos de C são tensionados porque
o ângulo de ligação C – C nos anéis menores deve ser menor que o ângulo tetraédrico de
109,5º. A tensão é aumentada à medida que os anéis ficam menores. No ciclopropano, o
ângulo é de apenas é de apenas 60º; essa molécula é, conseqüentemente, muito mais reativa
que o propano, seu semelhante na cadeia linear. Os cicloalcanos, particularmente os
compostos de anéis pequeno, algumas vezes comportam-se quimicamente como os
hidrocarbonetos insaturados.
Cicloehano
ciclopentano
ciclobutano
ciclopropano
Reações dos alcanos:
Uma vez que contenham apenas ligações C – C e C – H, muitos alcanos são
relativamente não-reativos. À temperatura ambiente, por ex., não reagem com ácidos,
bases ou agente oxidantes fortes, não sendo sequer atacados por ácido nítrico fervente.
A baixa reatividade química dos alcanos deve-se basicamente à falta de polaridade das
ligações C – C e C – H.
Entretanto, os alcanos não são completamente inertes. Uma das suas reações mais
importantes comercialmente é a combustão ao ar, a base de seu uso como combustível.
Por ex., a combustão completa do etano prossegue como segue:
2 C2H6(g) + 7 O2(g) 4 CO2(g) + 6 H2O(l)
∆H = - 2.855 Kj
3. Alcenos:
São hidrocarbonetos alifáticos, acíclicos e insaturados com uma dupla ligação, sendo
também chamados alquenos , hidrocarbonetos olefínicos (originam líquidos oleosos em
presença de halogêneos) ou etilênicos (derivam teoricamente do eteno, também conhecido
como etileno). Os alcenos são hidrocarbonetos insaturados que contém uma ligação C = C .
O alceno mais simples é o CH2 = CH2, chamado eteno (Iupac) ou etileno. O etileno é um
hormônio vegetal. Ele tem papel importante na germinação das sementes e no
amadurecimento das frutas. O próximo membro da série é CH3 – CH = CH2, chamado
propeno ou propileno. Para os alcanos com 4 ou mais átomos de C existem vários isômeros
para cada fórmula molecular. O nome dos alcenos são baseados na cadeia contínua mais
longa de átomos de C que conte a ligação dupla. O nome dado a cadeia é obtido a partir do
nome do alcano correspondente trocando a terminação de –ano para –eno. A localização da
ligação dupla ao longo da cadeia do alceno é indicada por um prefixo numérico que designa
o número do átomo de C que é parte da ligação dupla e que está mais próximo de um lado
da cadeia. A cadeia é sempre numerada do lado que leva a ligação dupla mais rapidamente
e, portanto, fornece o menor prefixo numérico. No propeno a única posição possível para a
ligação dupla é entre o primeiro e o segundo C; assim um prefixo que indique sua
localização torna-se desnecessário. Para o buteno existem duas posições possíveis para a
ligação dupla: depois do primeiro carbono (1-buteno) ou depois do segundo carbono (2buteno).
Metilpropeno
p.e. = -7ºC
1-buteno
p.e. = -6ºC
cis-2-buteno
p.e. = +4ºC
trans-2-buteno
p.e. = +1ºC
Se uma substância contém duas ou mais ligações duplas, cada uma é localizada por um
prefixo numérico. A terminação do nome é alterada para identificar o número de ligações
duplas: dieno (duas), trieno (três) etc, por ex., CH2 = CH – CH2 – CH = CH2 é 1,4pentadieno. Os dois isômeros (cis-2-buteno e trans-2-buteno) diferem nas localizações
relativas de seus grupos metil terminais. Esses dois compostos são isômeros geométricos,
compostos que tem a mesma fórmula molecular e os mesmos grupos ligados entre si, mas
diferem no arranjo espacial dos grupos. No isômero cis os dois grupos metil estão no
mesmo lado da ligação dupla, enquanto no isômero trans eles estão em lados opostos. Os
isômeros geométricos possuem propriedades físicas distintas e, geralmente, diferem
significativamente no comportamento químico. O isomerismo geométrico em alcenos
origina-se porque, diferentemente da ligação C – C, a ligação C = C resiste a rotação.
Recorde-se que a ligação dupla entre dois átomos de C consiste em uma outra ligação e
uma .
Os principais grupos derivados dos alcenos são chamados vinil e alil, nomes usuais aceitos
pela Iupac.
H2C = C – H
H2C = C –
H
eteno
H
grupo vinil (vinila)
H2C = CH – CH2 –
grupo alil (alila)
H2C = CH – CH3
Propeno
– CH = CH – CH3
grupo 1-propen-1-il (nome usual: propenil (a))
H2C = C – CH3
grupo 1-propen-2-il (nome usual: isopropenil(a))
Propriedades físicas dos alcenos
Alcenos até quatro carbonos são gases pouco solúveis em água, porém um pouco mais
solúveis que os alcanos correspondentes. Todos os alcenos são menos densos que a
água, e suas temperaturas de ebulição e fusão aumentam à medida que cresce a cadeia.
Propriedades físicas de alguns alcenos
Nome
Fórmula
Ponto de fusão
(ºC)
eteno
CH2 = CH2
-169
propeno
CH3 – CH = CH2
-185
1-buteno
H2C = CH – CH2 – CH3
-185
1-penteno CH3 – CH2 – CH2 – CH = CH2
-106
Ponto de ebulição
(ºC)
-104
-47
-6
+30
Propriedades químicas dos alcenos:
A principal reação química dos alcenos consiste na quebra parcial da ligação dupla, em
um processo genericamente denominado reação de adição.
adição
–C=C–
A–B
+
–C – C–
A
B
Pelo fato de existirem muitas possibilidades de reações de adição, os alcenos são fontes
para a produção de várias substâncias, constituindo-se assim, em matérias-primas muito
importantes para as indústrias. O eteno por ex., está em quarto lugar na lista das
substâncias mais produzidas no mundo, enquanto o propeno ocupa um considerável
nono lugar.
etanol
Solvente, produtos farmacêuticos
polietileno
Plásticos
Eteno
Óxido de etileno
Cloreto de etila
Detergentes, anticongelantes, fibras sintéticas
Anestésicos, polímeros, solvente, sínteses orgânicas
polipropileno
Plásticos
Outros usos
Solventes, resinas, produtos farmacêuticos
Propeno
Propriedades bioquímicas dos alcenos:
As propriedades fisiológicas dos alcenos são semelhantes ás dos alcanos. Assim como
ocorre com os alcanos gasosos, o etileno pode causar desmaios (e até a morte) por
asfixia. Os alcenos de cadeia longa, porém, fazem parte do metabolismo de alguns seres
vivos. O 1-octeno, por ex., é encontrado no limão e o octadeceno (C18H36) faz parte do
metabolismo no fígado de peixes. Além disso, o etileno é produto do metabolismo de
frutas, sendo utilizado para acelerar seu amadurecimento.
4. Alcinos:
São hidrocarbonetos alifáticos, acíclicos e insaturados com uma tripla ligação, sendo
também chamados alquinos e hidrocarbonetos acetilênicos (derivam teoricamente do
etino, conhecido como acetileno). Os alcinos são hidrocarbonetos insaturados que
contém uma ou mais ligações C C . Os alcinos que apresentam tripla ligação na
extremidade da cadeia são denominados verdadeiros; os que apresentam insaturação
entre os demais átomos de C são chamados falsos. Os alcinos, em geral, são moléculas
altamente reativas. Por causa de sua alta reatividade, não estão bastante distribuídos na
natureza como os alcenos; entretanto, os alcinos são intermediários importantes em
muitos processos industriais. Os alcinos, em geral, são poucos solúveis em água, mas
dissolvem-se em solventes orgânicos, como o benzeno e o clorofórmio. Ao contrário
dos alcanos, os alcinos possuem odor característico, mas também têm ação asfixiante.
Eles são nomeados com a identificação da cadeia contínua mais longa na molécula
contendo a ligação tripla e com a modificação da terminação do nome, de –ano para –
ino.
Reações de adição de alcenos e alcinos:
A presença de ligações C – C duplas ou triplas, nos hidrocarbonetos aumenta
notavelmente a reatividade química deles. As rações mais características dos alcenos e
alcinos são as reações de adição, nas quais um reagente é adicionado aos dois átomos
que formam a ligação múltipla. Um ex. simples é a adição de um halogênio como Br2
ao etileno:
H2C = CH2 + Br2
H2C = CH2
Br
Br
O par de elétrons que forma a ligação no etileno não está acoplado e é usado para
formar duas novas ligações com átomos de bromo. A ligação entre os átomos de C é
mantida. A adição de H2 ao alceno o converte a um alcano:
Ni, 500ºC
CH3CH = CHCH3 + H2
CH3CH2CH2CH3
A reação entre um alceno e H2, chamada hidrogenação, não ocorre rapidamente sob
condições ordinárias de temperatura e pressão. Para promover a reação, é necessário
usar um catalisador que auxilie na ruptura da ligação H – H . Os catalisadores mais
usados são metais finamente divididos nos quais H2 é adsorvido.
Os haletos de hidrogênio e a água podem, também, ser adicionados à ligação dupla dos
alcenos, como ilustrados nas seguintes reações do etileno:
CH2 = CH2 + HBr CH3CH2Br
H2SO4
CH2 = CH2 + H2O
CH3CH2OH
A adição de água é catalisada por um ácido forte, como o H2SO4. As reações de adição
dos alcinos lembram as dos alcenos, como mostrado nos seguintes exemplos:
Cl
CH3C CCH3 + Cl2
CH3
C=C
CH3
2-butino
Cl
trans-2,3-dicloro-2-buteno
Cl Cl
CH3C CCH3 + 2Cl2
CH3 – C – C – CH3
2-butino
Cl Cl
2,2,3,3-tretraclorobutano
5. Alcadienos:
São hidrocarbonetos alifáticos, acíclicos e insaturados com duas duplas ligações.
Observe que um alcadieno é isômero de um Alcino de mesmo conteúdo carbônico: com
fórmula molecular C4H6, podemos ter quatro estruturas planas acíclicas.
H2C = C = CH2
1-butino
H2C = C = CH – CH3
1,2-butadieno
H3C – C C – CH3
2-butino
H2C = CH – CH = CH2
1,3-butadieno
Os alcadienos são classificados em função da posição das duas duplas ligações em:
Alcadienos de duplas acumuladas, quando elas são consecutivas:
H2C = C = CH2
Propadieno
Alcadienos de duplas conjugadas, quando elas estão separadas por uma ligação
simples:
H2C = CH – CH = CH2
1,3-butadieno
Alcadienos de duplas isoladas, quando elas estão separadas por mais de uma ligação
simples:
H2C = CH – CH2 – CH2 – CH = CH – CH3
1,5-heptadieno
5. Hidrocarbonetos aromáticos:
São hidrocarbonetos que apresentam um ou mais núcleos benzênicos. O membro mais
simples dessa série é o benzeno (C6H6). A estrutura plana a altamente simétrica do
benzeno, com seus ângulos de 120º, sugere alto grau de insaturação. O comportamento
químico do benzeno é diferente do dos alcenos e alcinos. O benzeno e outros
hidrocarbonetos aromáticos são muito mais estáveis que os alcenos e alcinos porque os
elétrons estão deslocalizados nos orbitais . A cada sistema de anel aromático é dado
um nome comum.
CH3
Benzeno
Naftaleno
Antraceno
Tolueno
Provavelmente por ter um odor característico, o benzeno e seus derivados mais simples
foram chamados de compostos aromáticos. Embora essa não seja uma propriedade
exclusiva dessa substância e alguns desses compostos tenham um odor muito desagradável,
esse nome histórico permanece até hoje e serve para designar qualquer substância que
possua núcleo benzênico. Os anéis aromáticos são representados por hexágonos com um
círculo inscrito para denotar o caráter aromático. Cada vértice representa um átomo de C.
Cada C está ligado a três outros átomos – três átomos de C ou dois átomos de C e um de H.
Os átomos de H não são mostrados. Apesar de hidrocarbonetos aromáticos serem
insaturados, eles não sofrem reações de adição rapidamente. O benzeno, por ex., não
adiciona Cl2 ou Br2 às ligações duplas sob condições ordinárias. Em contraste, os
hidrocarbonetos aromáticos sofrem reações de substituição de maneira relativamente fácil.
Em uma reação de substituição, um átomo de uma molécula é removido e substituído por
outro átomo ou grupo de átomos. Os radicais ligados ao núcleo aromático podem ser
saturados ou insaturados.
CH3
Benzeno
metilbenzeno (tolueno)
CH2 – CH3
etilbenzeno
CH = CH2
vinilbenzeno (estireno)
Mononucleares:
O benzeno é o primeiro dos hidrocarbonetos aromáticos mononucleares com
ramificação saturada, apresentando fórmula molecular C6H6. A fórmula estrutural foi
estabelecida em 1859 pelo químico alemão Friederich August Kekulé von Stradonitz,
que idealizava o benzeno como um (hexa)anel onde os átomos de C se uniriam
alternadamente por simples e por duplas ligações, mas já admitindo duas formas:
(I)
(II)
Hoje se diz que o benzeno não corresponde a nehuma das formas, e sim a um “híbrido de
ressonância” entre as formas I e II, representada por:
Isso implica um gasto de energia, que acaba por estabilizar o anel, dando a ele o caráter
“saturado”.
Posições de dois radicais no núcleo aromático:
Posição 1,2 = orto (o)
Posição 1,3 = meta (m)
Radicais de hidrocarbonetos aromáticos:
Radicais arilas
Benzeno ou feno
Radicais alcoíla
O principal radical derivado do
benzeno é o grupo fenil. É possível
que tal denominação seja
proveniente de feno, antigo nome do
benzeno.
fenil (a)
CH2
Grupo benzil, derivado do grupo metil
do tolueno.
CH3
Tolueno
Posição 1,4 = para (p)
benzil (a)
Polinucleares:
Existem diversos tipos em função da posição dos núcleos: conjugados, isolados e
condensados.
CH2
Difenil metano
Difenilo
Naftaleno
OBS:
À temperatura ambiente – em torno de 20ºC – são líquidos os hidrocarbonetos alifáticos
com conteúdo carbônico variando nos intervalos indicados.
Alcanos
Alcenos
Alcinos
Alcadienos
Ciclanos
de 5 a 17
de 5 a 15
de 5 a 15
de 5 a 15
de 5 a 12
Os hidrocarbonetos aromáticos mononucleares com atpe 4 átomos de C nas ramificações
são, em geral, líquidos.
Os hidrocarbonetos são insolúveis em solventes polares, como a água, e solúveis em
apolares. Os que se apresentam no estado líquido têm densidade menor que a da água e
considerando o mesmo conteúdo carbônico as densidades, em geral, crescem na
ordem:alcano, alceno, Alcino, alcadieno, ciclano e aromático.
O benzeno é conhecido no comércio por benzina. É utilizado como solvente e na obtenção
de inseticidas. É também, o ponto de partida na síntese de diversas substâncias, como fenol,
anilina, tolueno, ácido benzóico, estireno.
Tolueno é um dos ingredientes de certas colas que, ao serem “cheiradas”, produzem
excitação tipo alcoólica, falta de coordenação, fala desarticulada; é extremamente tóxico e
pode resultar em coma e morte.
A partir do metilbenzeno ou tolueno, produz-se um explosivo extremamente utilizado, para
fins pacíficos ou militares, o TNT ou trinitrotolueno.
O naftaleno sublima facilmente e é o principal componente da naftalina. Já o antraceno é
uma importante matéria-prima para a fabricação de corantes, e a estrutura do fenantreno,
por sua vez, é o esqueleto de uma importante classe de compostos naturais: os esteróides. O
principal exemplo dessas substâncias causadoras de câncer é o benzopireno, substância
formada a partir da queima do fumo. Substâncias cancerígenas dessa classe também foram
na fumaça do cigarro, em gases de escapamentos de carros e na queima de carvão de
churrasco.
Capítulo 3. Outras
funções orgânicas
A reatividade dos compostos orgânicos pode ser atribuída aos átomos em particular ou
grupos de átomos nas moléculas. Um sítio de reatividade em uma molécula orgânica é
chamado grupo funcional porque controla como a molécula se comporta ou funciona.
Assim, a química de uma molécula orgânica é largamente dominada pelos grupos
funcionais que ela contém. Podemos pensar nas moléculas orgânicas como sendo
compostas de grupos funcionais ligados a um ou mais grupos alquil. Os alcanos, Por
exemplo, que não contem grupos funcionais, são representados como R – H.Os álcoois,
contem O – H , ou grupo funcional álcool, são representados como R – OH.
Funções oxigenadas
A substituição de um átomo de H de um hidrocarboneto por um radical hidroxila pode
gerar três funções distintas: álcool, enol e fenol.
OH
– C – OH
–C=C
OH
álcool
fenol
enol
Álcoois ( R – OH)
Os álcoois são derivados de hidrocarbonetos dos quais um ou mais H de um
hidrocarboneto – pai foram substituídos por um grupo funcional hidroxila ou álcool,
OH. Se na molécula existe apenas um hidroxila o álcool é monoálcool ou monol e se
existem várias hidroxilas é polialcool (os diois são denominados glicois). Se no monol a
hidroxila se liga a um C primário, secundário, ou terciário, o álcool é, respectivamente,
primário, secundário, ou terciário. Na nomenclatura oficial, a terminação é –ol . os
álcoois mais simples são nomeados adicionando-se um –l ao nome do alcano
correspondente – por exemplo, etano torna-se etanol. Quando necessário, a localização
do grupo OH é designada por um prefixo numérico apropriado que indica o numero do
átomo de C que carrega o grupo OH; a cadeia deve ser numerada a partir da
extremidade mais próxima do grupo hidroxila, como mostrado nos exemplos abaixo.
CH3
CH3 – CH – CH3
OH
2-propanol
CH2 – CH2
OH
OH
1,2-etanodiol
CH2 – CH2 – CH2
OH
OH
OH
1,2,3-propanotriol
CH3 – C – CH3
OH
metil-2-propanol
A ligação O – H é polar, logo os álcoois são muitos mais solúveis que os
hidrocarbonetos em solventes polares como a água. O grupo funcional OH pode
participar também na ligação de hidrogênio. Como resultado, os pontos de ebulição dos
álcoois são muito mais que dos seus alcanos-pai. Os monoálcoois com até 12 átomos de
C são líquidos, solúveis em água e tem menor densidade que a dela.
O álcool mais simples, o metanol (álcool metilico), apresenta usos industriais
importantes e é produzido em larga escala.
CO(g) + 2H2(g)
200-300 atm
CH3OH(g)
400º C
O etanol (álcool etílico) é um produto da fermentação de carboidratos como o açúcar e
o amido. Na ausência de ar as células de levedo convertem os carboidratos em uma
mistura de etanol e CO2 , como mostrado na equação abaixo.
C6H12O6 (aq)
levedo
2C2H5OH(aq) + 2CO2(g)
Essa reação é realizada sob condições cuidadosamente controladas para produzir
cerveja, vinho e outras bebidas nas quais o etanol é o ingrediente ativo.
Muitos álcoois polidroxílicos (aqueles que contem mais de um grupo OH) são
conhecidos. O mais simples destes é o 1,2-etanodiol (etilenoglicol, HOCH2CH2OH).
Essa substancia é o principal ingrediente dos anticongelantes dos automotivos. Outro
álcool
polidroxílico
comum
é
o
1,2,3-propanotriol
(o
glicerol,
HOCH2CH(OH)CH2OH). Ele é um liquido viscoso que se dissolve rapidamente em
água e é muito usado como amaciante de pele em preparações cosméticas. É usado
também em alimentos doces, para mantê-los úmidos.
O fenol é o composto mais simples com um grupo OH ligado a um anel aromático. Um
dos muitos efeitos notáveis do grupo aromático é a acidez enorme do grupo OH. O
fenol é 1 milhão de vezes mais ácido em água que um álcool não aromático típico como
o etanol. O fenol é usado industrialmente para fazer vários tipos de plásticos e corantes.
Também é usado como anestésico tópico em muitos borrifadores para garganta
inflamada.
De acordo com as normas da Iupac, a nomenclatura dos álcoois deve ser construída da
seguinte maneira:
prefixo
+
parte intermediária
+
ol
sufixo
Enóis
São compostos derivados dos hidrocarbonetos pela substituição de átomo de H , de
carbono de dupla ligação, excetuando-se as do núcleo aromático, por igual número
de hidroxilas (- OH). Os enóis são compostos instáveis que só existem em solução,
em equilíbrio dinâmico com aldeído ou cetona. Na nomenclatura oficial, a
terminação é ol.
H2C = CH
H3C – C = CH2
OH
etenol
OH
prop-1-en-2-ol
H2C – CH = CH2
Tome cuidado:
OH
é alcool, e não enol
prop-2-en-1-ol
Fenóis
São compostos derivados dos hidrocarbonetos pela substituição de um ou mais
átomos de H, de carbono de núcleo aromático, por igual número de hidroxilas (OH). Se na molécula só existe uma hidroxila, eles são monofenóis e se existem
várias hidroxilas, são polifenóis. Na nomenclatura oficial, usa-se o prefixo hidroxi.
OH
OH
hidroxibenzeno
ácido fênico
OH
1,2-hidroxibenzeno
HO
CH3
1-hidroxi-4-metilbenzeno
p-hidroximetilbenzeno
Os fenóis são sólidos, em geral, com maior densidade que a água e pouco solúveis nela.
Éteres (C – O – C)
São compostos que apresentam o radical C – O – C. Os éteres podem ser obtidos
pela condensação de álcoois e/ou fenóis.
R1(Ar1) – O – H + H – O – R2(Ar2) R1(Ar1) – O – R2(Ar2) + H2O
O éter comum tem fórmula:
H3C – CH2 – O – CH2 – CH3 éter de farmácia
Usado como anestésico desde 1842, o éter comum foi obtido pela primeira vez no
século XVI, pela reação de álcool etílico com ácido sulfúrico. Por esse motivo,
ficou conhecido inicialmente como éter sulfúrico e, tempos depois como éter etílico.
H3C – CH2 – OH + HO – CH2 – CH3 H3C – CH2 – O – CH2 – CH3 + H2O
álcool etílico
éter etílico
Se os dois radicais ligados ao átomo de O são iguais, o éter é simétrico; se
diferentes, é assimétrico. Os éteres podem ser considerados como derivados da
água, por substituição dos hidrogênios por grupos de C.
R – O – H álcool
H–O–H
R ou R´= metil, etil, fenil, etc
R – O – R´ éter
A nomenclatura determinada pela Iupac para os éteres obedece ao seguinte
esquema:
+
Prefixo que indica o número
de C do menor grupo
oxi
+
Nome do hidrocarboneto
correspondente ao maior grupo
Ex:
H3C – O – CH2 – CH3 met + oxi + etano (metóxi-etano)
A nomenclatura usual, os grupos R são escritos em ordem alfabética e devem
terminar com a palavra éter.
Ex: H3C – O – CH2 – CH3
etil-metil-éter
Quando os grupos são iguais, devemos usar o prefixo di.
Ex: H3C – O – CH3
dimetil-éter
Também é usado como nomenclatura usual o seguinte esquema:
éter
Nome dos grupos em ordem alfabética
Ex: H3C – O – CH2 – CH3
H3C – O – CH3
+
ico
éter etil-metílico (éter assimétrico)
éter dimetílico
H3C – CH2 – O – CH2 – CH3
éter dietílico (éter simétrico)
OBS: Os principais usos do etoxietano (éter comum) são como anestésico, como
solvente e na extração de óleos, gorduras e essências. É um anestésico fácil de
administrar, mas que exige cuidados. É líquido, muito volátil e seus vapores são
muito inflamáveis. Esses vapores são mais densos que o ar e tendem a se acumular
perto do solo. Por esse motivo, não se utilizam roupas de nylon em salas cirúrgicas
em que o éter comum é usado como anestésico; caso contrário, o atrito do tecido
durante os movimentos produziria a eletricidade estática, podendo liberar faíscas
que inflamariam os vapores.
Aldeídos ( – C = O )
H
São compostos que apresentam o radical funcional ( – CHO), denominado aldoxila. Nos
aldeídos o grupo carbonílico tem no mínimo um átomo de H ligado.
Ex:
H–C=O
H3C – C = O
H
H
metanal
etanal
monoaldeídos
H–C–C–H
O O
etanodial
dialdeído
São classificados em monoaldeídos ou polialdeídos, dependendo do número de radicais
aldoxila na molécula. Na nomenclatura oficial, a terminação é al. Os dois primeiros
aldeídos são gasosos e apresentam cheiros desagradáveis. A partir do propanal, os aldeídos
são líquidos; apenas os de massas molares elevadas são sólidos.
Os aldeídos de baixas massas moleculares têm densidade menor que a da água e são nela
solúveis.
O metanal é usado como desinfetante, na conservação de peças anatômicas e de cadáveres,
além de ser utilizado na preparação de baquelita e medicamentos. O formol é uma solução
que contém 40% de metanal.
O propenal, também denominado acroleína, é um composto malcheiroso, que pode ser
sentido quando gordura é queimada. Neste caso, a desidratação da glicerina produz esse
aldeído.
A desidrogenação dos álcoois é uma das formas utilizadas para se obter aldeído, dando
origem ao nome dessa função: aldeído = álcool desidrogenado.
Cetonas ( – C = O)
São compostos que apresentam o radical funcional (– C = O), denominado carbonila. Nas
cetonas o grupo carbonílico ocorre no interior de uma cadeia de carbonos e está, em
conseqüência, ladeado por átomos de C:
H3C – C – CH3
O
propanona
monocetona
H3C – C – CH2 – CH3
H3C – C – CH2 – C – CH3
O
2-butanona
monocetona
O
O
2,4-pentanodiona
dicetona
São classificadas em monocetonas ou policetonas, dependendo do número de radicais
carbonila na molécula. Na nomenclatura oficial, a terminação é ona. As cetonas de menores
massas molares são líquidas; as de massas molares elevadas são sólidas. As cetonas de
baixas massas moleculares têm densidade menor que a da água e são nela solúveis.
Ácidos carboxílicos ( H – C – O – H )
O
São compostos que apresentam o radical funcional (– COOH), denominado
carboxila. São também chamados de carboxilácidos. Classificam-se em monoácidos
ou poliácidos, dependendo do número e radicais carboxila presentes na molécula.
Na nomenclatura oficial, a terminação é óico.
Ex:H – C – OH
H3C – C – OH
HO – C – C – OH
O
Ácido metanóico
monoácido
O
ácido etanóico
monoácido
O O
ácido etanodióico
diácido
Os dois primeiros ácidos têm densidades maiores que a da água e os restantes,
menores. Os monoácidos alifáticos saturados contendo ate 9 átomos de C são
líquidos e solúveis em água. Com 10 ou mais átomos de C são sólidos, insolúveis
em água e semelhantes a ceras e graxas (daí o nome de ácidos graxos).
Esses ácidos fracos são encontrados na natureza e são comumente usados em
produtos de consumo. São também importantes na fabricação de polímeros
utilizados para fazer fibras, filmes e tintas. Os nomes comuns de muitos ácidos
carboxílicos são baseados em suas origens históricas ou ao seu odor exalado por
quem os produz.
Nome oficial
Ácido metanóico
Ácido etanóico
Nome comercial
Ácido fórmico
Ácido acético
Ácido propanóico
Ácido butanóico
Ácido pentanóico
Ácido própiônico
Ácido butírico
Ácido valérico
Ácido hexanóico
Ácido capróico
Ácido octanóico
Ácido caprílico
Ácido decanóico
Ácido cáprico
Origem do nome
Existe nas formigas
Formado no azedamento
do vinho
gordura
Encontrado na manteiga
Encontrado na planta
valeriana
Produzidos por cabras e
bodes
Produzidos por cabras e
bodes
Produzidos por cabras e
bodes
OBS: O ácido metanóico (ácido fórmico) é usado como desinfetante e no tingimento de
tecidos; o ácido etanóico (ácido acético) é o principal constituinte do vinagre, sendo
utilizado na preparação de corantes , perfumes. O ácido benzóico é usado como antiséptico; por aumentar o fluxo urinário, é também usado como diurético. O ácido salicílico
(ácido 2-hidroxibenzóico) é usado como antipirético – reduz a febre – e como analgésico –
alivia a dor.
Essas substâncias, chamadas de ácidos carboxílicos, obedecem à seguinte nomenclatura
proposta:
ácido
prefixo
+
Parte intermediária
+
óico
sufixo
Mas porque o nome ácido???
Moléculas com grupo carboxílico sofrem ionização em água, produzindo cátions
hidroxônio (H3O+), e isso é característico dos ácidos de Arrhenius. Observe:
H3C – C = O
+
H2O
H3C – C = O
+ H3O+
Oânion acetato
OH
ácido acético
Ésteres
São compostos derivados dos carboxilácidos pela substituição do átomo de
hidrogênio da carboxila por radical alcoíla ou arila.
R – C – O – H R – C – O – R´
O
O
Os ésteres são compostos de forma que o átomo de H de um grupo carboxílico seja
substituído por um grupo hidrocarboneto. Podem ser obtidos, quando for o caso,
pela reação entre ácido carboxílico e álcool por um processo chamado esterificação.
ácido carboxílico + álcool éster + água
H3C – C – O – H
+ H3C – O – H
H3C – C – O – CH3 + H2O
O
O
etanoato de metila
Um éster pode sofrer hidrólise; quando isso acontece, há o estabelecimento do
equilíbrio entre essa reação e a esterificação.
éster + água ácido carboxílico + álcool
Os ésteres são nomeados usando-se inicialmente o grupo do qual o ácido é derivado e
depois o grupo do qual o álcool é derivado precedido da palavra “de”. Os ésteres de menor
conteúdo carbônico são líquidos e pouco solúveis em água, enquanto os de maiores massas
molares são sólidos e insolúveis. Ao contrário dos ácidos, dos quais são derivados, os
ésteres geralmente possuem odor muito agradável; eles são os principais responsáveis pelo
aroma das frutas e das flores. O acetato de pentila (CH3COOCH2CH2CH2CH2CH3), por
exemplo, é o responsável pelo cheiro de banana. Quando os ésteres são tratados com ácido
ou base em solução aquosa, são hidrolisados, isto é, a molécula é dividida em seus
componentes de álcool e ácido:
CH3CH2 – C – O – CH3 + NaOH CH3CH2 – C – O- + Na+ + CH3OH
Propionato de metila
propionato de sódio
metanol
Nesse exemplo a hidrólise é realizada em meio básico. Os produtos da reação são sal de
sódio do ácido carboxílico e álcool.
A hidrólise de um éster na presença de uma base é chamada saponificação, termo que vê,
da palavra latina para sabão (sapon). Os ésteres naturais incluem gorduras e óleos. No
processo da fabricação de sabão, gordura animal ou óleo vegetal estável é fervido com base
forte, geralmente NaOH. O sabão resultante consiste em uma mistura de sais de sódio de
ácidos carboxílicos de cadeia longa (chamados ácidos gordurosos), que se formam durante
a reação de saponificação.
OBS: as essências de flores e frutos são ésteres formados por um ácido e por um álcool,
ambos de baixo conteúdo carbônico: o metanoato e o etanoato de isobutila são os ésteres
determinantes do aroma da framboesa. Veja outros ex.: metanoato e heptanoato de etila =
uva; etanoato de pentila = banana; etanoato de isopentila = pêra; etanoato de octila =
laranja; etanoato de benzila = jasmim; propanato e butanoato de etila = maçã; butanoato de
metila = pinha; butanoato de etila = morango; butanoato de butila = damasco; hexanoato de
etila = abacaxi. Esses ésteres são usados para darem sabor e aroma artificiais em bebidas,
guloseimas em geral, produtos da indústria farmacêutica e de cosméticos.
Compostos halogenados
São compostos orgânicos que apresentam halogênios (F, Cl, Br e I). Esses
compostos têm sido usados como propelentes em aerossóis em sistemas de
refrigeração, e são genericamente chamados de CFCs (cloro-fluor-cabonos). Entre
os compostos halogenados mais importantes destacamos os haletos orgânicos e os
haletos de acila.
Haletos orgânicos
São compostos derivados dos hidrocarbonetos pela substituição de um ou mais
átomos de H por igual número de átomos de halogênio. Se na molécula houver
apenas um halogênio, o composto é classificado como monohaleto; se existirem
vários, polihaleto. Na nomenclatura oficial, cita-se o nome e a posição do halogênio
na molécula do hidrocarboneto; no caso de monohaletos, a nomenclatura usual
utiliza-se da palavra haleto mais o nome do radical alçoíla ou arila.
Ex: H3C – Cl
H3C – CH – CH3
clorometano
Br
2-bromopropano
H2C = CH
Cl
cloroeteno
Haletos de acila
São compostos derivados dos carboxilácidos pela substituição do grupo OH da
carboxila por átomo de halogênio. Os mais importantes haletos de acila são os
derivados do cloro. Na nomenclatura oficial utilizam-se a palavra haleto e o nome
do radical acila ligado ao halogênio.
H3C – C – Cl
H3C – CH2 – CH2 – C – Cl
O
cloreto de etanoíla
O
cloreto de butanoíla
C – Cl
O
cloreto de benzoíla
Tome cuidado para não errar na nomenclatura:
H3C – CH2
H3C – C = O
Cl
cloreto de etila
Cl
cloreto de etanoíla
Funções nitrogenadas
Aminas
São compostos derivados da amônia, NH3, pela substituição de um ou mais átomos de H
por igual número de radicais alcoíla ou arila. As aminas são bases orgânicas. Elas tem a
fórmula geral R3N, onde R pode ser H ou um grupo hidrocarboneto, como nos seguintes
exemplos:
CH3CH2NH2
etilamina
(CH3)3N
trimetilamina
NH2
fenilamina (anilina)
Uma amina é primária, secundária ou terciária conforme o número de radicais ligados ao
atomo de N. Na nomenclatura oficial, citam-se os nomes dos radicais e acrescenta-se a
palavra amina. No caso de amina primária, pode-se considerar o grupo amino ( – NH2)
como radical da cadeia do hidrocarboneto.
H3C – CH – CH3
NH2
Isopropilamina
H3C – NH – CH2 – CH3
metiletilamina
H3C – N – CH3
CH3
trimetilamina
As aminas mais simples são gasosas; com até 12 átomos de C, são líquidas e as demais,
sólidas. As aminas de menor conteúdo carbônico são solúveis em água. As aminas
apresentam cheiro que varia entre o da amônia e o de peixe podre. A fenilamina (anilina) é
um líquido incolor, usado na síntese de corantes e de medicamentos (sulfas).
A substância responsável pelo cheiro de peixe podre é a trimetilamina. Após mexer com
peixe, recomenda-se lavar as mãos com limão ou vinagre, que por conter ácidos, reagem
com a amina, que tem caráter básico.
Amidas
São compostos derivados da amônia, NH3, pela substituição de um ou mais átomos e H
por igual número de radicais acila. Podemos considerar o grupo funcional amida
derivado de um ácido carboxílico com um grupo NR2 substituindo OH do ácido, como
nesses exemplos:
O
H3C – C – OH
C – NH2
O
etanamida
fenilmetanamida
Uma amida é primária, secundária ou terciária conforme o número de radicais ligados
ao átomo de N. Na nomenclatura oficial, substitui-se a terminação óico do ácido por
amida.
H – C – NH2
H – C – NH – C – CH3
O
metanamida
O
O
metanoetanamida
C – NH2
benzamida
Apenas a metanamida é liquida, as demais são sólidas. As de menor conteúdo carbonico
são solúveis em água.
Nitrilas
São compostos resultantes da substituição do átomo de H do cianeto de hidrogênio, H –
C N, por radical alcoíla ou arila.
CN
H3C – CN
H3C – CH2
H2C = CH
CN
etanonitrila
propanonitrila
cianeto de metila cianeto de etila
CN
propenonitrila
cianeto de vinila
benzonitrila
cianeto de fenila
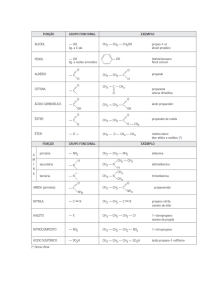
Compostos de função mista
São compostos orgânicos que apresentam mais de um radical funcional. É comum uma
substância exibir mais de um radical funcional. Vejamos alguns exemplos:
H2C – CH – CH – CH – CH – C – H
OH
OH OH
OH
O
Glicose
Funções: álcool e aldeído
Encontra-se na uva e em outras frutas.
O
Ácido acetilsalicílico
Funções: ácido e éster
Usado como antitérmico
O – C – CH3
C=O
OH
CH – CH2 – NH – CH3
HO
Adrenalina
Funções: álcool, amina e fenol
Produzida pelo organismo sob tensão
OH
H2C –CH – CH – CH – C – CH2
OH OH OH OH
O
Frutose
Funções: álcool e cetona
Encontra-se no mel e em diversas frutas
OH
HO – C – CH2 – C – CH2 – C – OH
O
C=O
OH
O
Ácido cítrico
Funções: ácido e álcool
Responsável pelo sabor azedo da laranja e do limão
Capítulo 4. Isomeria
Isomeria
É o fenômeno em que se verifica a existência de diferentes substâncias com a mesma
fórmula molecular, que se distinguem entre si por uma ou mais propriedades físicas,
químicas ou fisiológicas e que apresentam fórmulas estruturais, planas ou espacial
diferentes. É muito freqüente em compostos orgânicos apresentarem a mesma fórmula
molecular. Assim dois compostos são isômeros ou isoméricos quando possuem a
mesma fórmula molecular e diferentes fórmulas estruturais.
Para iniciar o estudo de isomeria, é necessário saber diferenciar a isomeria plana da
isomeria espacial:
A diferença entre os isômeros já é
observada nas fórmulas estruturais
planas.
plana
isomeria
Temos de usar fórmulas espaciais
para diferenciar os isômeros.
espacial
1. Exemplos de isomeria plana
1º caso: isomeria funcional ou de função
Os isômeros pertencem a funções orgânicas diferentes.
H3C – CH2 – CH2 – O 1-propanol
Ex: C3H8O
H3C – CH2 – O – CH3
etil-metil-éter
2º caso: isomeria de cadeia ou de núcleo
A única diferença estrutural está na organização da cadeia carbônica.
H3C – CH2 – CH2 – CH3
butano (cadeia normal)
Ex: C4H10
H3C – CH – CH3
CH3
2-metil-propano (cadeia ramificada)
3º caso: isomeria de posição
Pertencem à mesma função, apresentam a mesma cadeia carbônica principal e diferem
na posição do radical ou de insaturações.
H2C = CH – CH2 – CH3
1-buteno
C3H6
H3C – CH = CH – CH3
2-buteno
4º caso: isomeria com heteroátomo (metameria ou isomeria de compensação)
A diferença entre as estruturas está na posição de um heteroátomo.
H3C – O – CH2 – CH2 – CH3
metil-propil-éter
C4H10O
H3C – CH2 – O – CH2 – CH3
dietil-éter
OBS: se o O estiver na extremidade da cadeia não será um heteroátomo.
H3C – CH2 – CH2 – CH2 – O – H
álcool
Isomeria de função
H3C – CH2 – CH2 – O – CH3
éter
5º caso: tautomeria
É o caso em que dois isômeros estão em equilíbrio.
Ocorre principalmente entre um aldeído (ou cetona) e o enol correspondente.
O–H
H
R–C–C=O
H H
aldeído
R–C=C–H
H
enol
O–H
H
R–C–C=O
H R`
cetona
R – C = C – R`
H
enol
No primeiro ex., temos um equilíbrio Aldo-enólico; no segundo, um equilíbrio cetoenólico. O enol é uma estrutura com grupo OH ligado a carbono insaturado. Esses
compostos são muito instáveis. No equilíbrio predominam as formas carbonílicas
(aldeído ou cetona).
2. A isomeria espacial
Os químicos ficaram surpresos quando encontraram dois compostos diferentes com a
mesma fórmula estrutural plana. Veja o caso do 1,2-dibromo-eteno.
Composto A (p.e. = 108 ºC)
HC = CH
Br
Br
Composto B (p.e. = 112 ºC)
Isso mostrava claramente que a diferença entre as estruturas só poderia ser vista em
fórmulas espaciais.
Se você observar com atenção as fórmulas espaciais a seguir, poderá notar que há duas
possibilidades para a colocação dos átomos de bromo. Veja:
Br
Isômero cis: ambos os bromos
estão do mesmo lado do plano
da dupla ligação.
Br
C=C
H
H
cis-1,2-dibromo-eteno
Br
Isômero trans: os átomos de
bromo estão em lados opostos do
plano da dupla ligação.
H
C=C
H
Br
trans-1,2-dibromo-eteno
O isômero cis é mais polar que o trans, por isso possui também maior ponto de ebulição.
Cis-1,2-dibromo-eteno (p.e. = 112 ºC)
trans-1,2-dibromo-eteno (p.e. = 108 ºC)
A esse tipo de isomeria chamamos de cis-trans ou isomeria geométrica.
Como na ligação dupla um carbono não pode girar livremente em relação a outro, justificase a existência de duas estruturas diferentes. Esse fenômeno, denominado rotação inibida
(ou impedida), também ocorre em cadeias cíclicas. Veja um ex. com o 1,2-dibromo-ciclopropano.
Br
H
cis
Br
Br
H
H
H
Br
trans
Como saber se há isomeria cis-trans???
A condição necessária para que um alceno ou um ciclano apresente isomeria cis-trans é a
seguinte:
Nos alcenos, cada carbono da ligação dupla deve apresentar grupos diferentes entre
si.
R1
R3
R1 R2
R3 R4
C=C
R2
R4
Nos ciclanos, deve haver no mínimo dois carbonos com dois ligantes diferentes
entre si.
R1
R1 R2
R3 R4
R2
R3
R4
Observe que neste caso, os carbonos não precisam ser vizinhos.
3. Isomeria óptica
Esse tipo de isomeria é de fundamental importância biológica e também de grande
complexidade conceitual.
A luz comum é uma onda eletromagnética que vibra em vários planos ao longo de seu
eixo. Existem aparelhos, chamados polarizadores, que são capazes de filtrar todos os
planos de vibração da luz, com exceção de um deles. A luz quando atravessa o
polarizador, vibra em um único plano e passa denominar-se luz polarizada.
Em um polarímetro, a luz emitida pela fonte atravessa um prisma polarizador, que pode
ser visto por um observador quando a luz atravessar o prisma analisador.
Determinadas substâncias apresentam a propriedade de desviar o plano da luz
polarizada.
As substâncias capazes de desviar o plano da luz polarizada são denominadas
opticamente ativas. Se o desvio for para a direita do observador, a substância será
chamada de dextrógira (do latim dextro = direita). Caso contrário, a substância será
levógira (do latim laevu = esquerda).
Substância dextrógira d ou (+)
Quais substâncias são opticamente ativas???
Substância levógira l ou (-)
Para uma molécula possuir atividade óptica, ou seja, para que ela seja capaz de desviar
o plano de vibração da luz polarizada, é necessário que essa estrutura seja asssimétrica.
Faça a seguinte experiência: ponha sua mão direita diante de um espelho. Você verá
que a imagem corresponde à sua mão esquerda. Portanto, segundo os matemáticos e os
físicos, elas não possuem um plano de simetria.
Com as moléculas acontece algo semelhante. Algumas são assimétricas (como nossas
mãos) e denominam-se moléculas quirais.
A expressão quiral foi registrada pela primeira vez quando o físico e matemático
escocês William Thomson, o célebre lorde Kelvin escreveu:
“ Chamo quiral qualquer figura geométrica cuja respectiva imagem em um espelho
plano não coincida com a própria figura. Digo também que tal figura geométrica, ou
conjunto de pontos, apresenta uma propriedade chamada quiralidade”.
Como reconhecer uma molécula quiral???
Uma molécula assimétrica, ou quiral, pode der reconhecida facilmente na maioria dos
casos, porque apresenta quatro grupos diferentes entre si, ligados a um mesmo
carbono, que é chamado de carbono quiral ou centro de quiralidade. Vamos considerar
uma molécula quiral à frente de um espelho. Tudo se passa como se o objeto fosse um
isômero opticamente ativo (por exemplo: dextrógiro) e a imagem correspondesse a
outro isômero também opticamente ativo (levógiro).
R1
R1
R1
C
R2
R 2 – C – R4
C
R4
R4
R2
R3
R3
Dextrógiro (d)
R3
Levógiro (l)
Uma
molécula
quiral
R1 R2 R3 R4
Há algum tempo, um carbono com quatro ligantes diferentes era chamado de carbono
assimétrico. Atualmente, o nome mais apropriado é carbono quiral.