SIMONE FIUZA CONCEIÇÃO A SUBFAMÍLIA HELIOTROPIOIDEAE (BORAGINACEAE JUSS.) NO ESTADO DA BAHIA, BRASIL. FEIRA DE SANTANA – BAHIA 2007
UNIVERSIDADE ESTADUAL DE FEIRA DE SANTANA D EPARTAMENTO DE C IÊNCIAS B IOLÓGICAS PROGRAMA DE PÓS­G RADUAÇÃO EM B OTÂNICA A SUBFAMÍLIA HELIOTROPIOIDEAE (BORAGINACEAE JUSS.) NO ESTADO DA BAHIA, BRASIL. Simone Fiuza Conceição Dissertação apresentada ao Programa de Pós­Graduação em Botânica da Universidade Estadual de Feira de Santana como parte dos requisitos para a obtenção do título de Mestre em Botânica. ORIENTADOR: PROFA. D RA. TÂNIA REGINA DOS SANTOS SILVA (UEFS) FEIRA DE SANTANA – BA 2007
2 Banca Examinadora _____________________________________________ Prof. Dr. André Márcio Araújo Amorim (Universidade Estadual de Santa Cruz) _____________________________________________ Prof. Dr. Flávio França (Universidade Estadual de Feira de Santana) _____________________________________________ Profa. Dra. Tânia Regina dos Santos Silva (Universidade Estadual de Feira de Santana) Orientadora e Presidente da Banca Feira de Santana – BA 2007
3 Aos meus pais dedico.
4 Para cada lágrima triste que chorei Surgiram dez poemas diferentes Ao pai agradeço a estrada que passei Passei e se Ele quiser vou novamente Pois quem acredita em Deus Não tem medo da escuridão Aprende que quem faz o mal Só merece perdão Perdão que é o perfume da flor O abraço contra a solidão Sorriso no rosto e a bondade estampada nas mãos Para cada mentira que um dia suportei Em mim uma verdade falava docemente Que o bem não estava nas sobras que eu dei O pobre é aquele que ajuda indiferente Pergunte pro seu coração Se fez pensando em receber Se a gente pode ser feliz vendo o outro sofrer Pergunte pro seu coração Se foi certo o passo que deu Porque se a gente melhorar Vence você e eu O amor é benção que vem de Deus Há quem diga: é só meu! O amor é de quem quiser, quem tiver O amor é a chave de uma razão Que sempre tem solução Pra tudo que a gente quer... Marron Brasileiro
5 AGRADECIMENTOS Agradeço à Deus, por ter me concedido a vida e muito mais que isso: força para superar os obstáculos que apareceram nela. Aos meus pais, “seu Conrado” e “dona Tereza”, que entenderam todas as minhas dificuldades e me apoiaram e incentivaram incondicionalmente, aqui registro todo o meu amor e eterna gratidão. À minha orientadora Tânia Silva, por ter me conduzido desde a iniciação científica, contribuindo fundamentalmente na minha formação acadêmica. A grande amiga e pesquisadora Maria Stapf, pelas fotografias de tipos, bibliografia, discussões taxonômicas enfim, pelo enorme apoio concedido para realização deste estudo. À Universidade Estadual de Feira de Santana. A todos os curadores e funcionários dos herbários visitados, por terem me recebido e enviado os empréstimos solicitados. Ao curador do HUEFS e a todos os funcionários e amigos deste herbário. À todos do Laboratório de Taxonomia, em especial à Vanilda. A CAPES pela bolsa concedida e a todos os projetos de pesquisa que contribuíram financeiramente com este trabalho. Ao CNPq, pelo financiamento do Projeto Flora da Bahia. Aos coordenadores e professores da Pós­Graduação em Botânica. A todos os amigos da Pós­Graduação que sempre estiveram na torcida, em especial às amigas Déa e Daí!!!! Às amigas Paula e Edlane, minhas companheiras nas visitas aos herbários. A todos que concederam fotos das Heliotropioideae. Aos meus irmãos (Eliana, Beth, Rosália, Sandra e Ramon) e aos demais familiares, agradeço pelo incentivo e por sempre acreditar em mim. Às minhas companheiras de república, “Flavicolas” (que sempre me escutou nos momentos “críticos”...) e “Ezi” (por toda sua calma e “bons conselhos”). E às amigas Ednalva, Enne e Haydeé, por estarem sempre presente, não me deixando ficar triste nunca... Vocês conseguem tornar minha estada aqui em Feira muito mais divertida! Valeu!
6 INDICE INTRODUÇÃO.........................................................................................................1 1­ HISTÓRICO.........................................................................................................4 A­ Boraginaceae............................................................................................4 B­ Heliotropioideae........................................................................................6 C­ Heliotropioideae no Brasil.........................................................................9 MATERIAL E MÉTODOS.......................................................................................11 REFERÊNCIAS BIBLIOGRÁFICAS.......................................................................15 CAPÍTULO 1: MORFOLOGIA DA SUBFAMÍLIA HELIOTROPIOIDEAE NA BAHIA....................................................................................................................19 1­ Hábito......................................................................................................20 2­ Folha.......................................................................................................22 3­ Inflorescência..........................................................................................27 4­ Fruto........................................................................................................33 REFERÊNCIAS BIBLIOGRÁFICAS.......................................................................35 CAPÍTULO 2: FLORA DA BAHIA: Boraginaceae I – Heliotropioideae..................36 1­ Heliotropium L.........................................................................................39 1.1­ Heliotropium angiospermum Murray....................................................42 1.2­ Heliotropium barbatum DC...................................................................48 1.3­ Heliotropium elongatum (Lehm.) I.M.Johnst........................................50 1.4­ Heliotropium filiforme Lehm..................................................................54 1.5­ Heliotropium fruticosum L.....................................................................57 1.6­ Heliotropium indicum L.........................................................................60 1.7­ Heliotropium polyphyllum Lehm...........................................................62 1.8­ Heliotropium procumbens Mill..............................................................66 1.9­ Heliotropium salicoides Cham..............................................................68 1.10­ Heliotropium ternatum Vahl................................................................72 1.11­ Heliotropium transalpinum Vell..........................................................75 1.12­ Heliotropium sp..................................................................................78 2­ Schleidenia Endl.....................................................................................80 2.1­ Schleidenia paradoxa (Mart.) DC.........................................................81 3­ Tournefortia L..........................................................................................85 3.1­ Tournefortia bicolor Sw........................................................................88
7 3.2­ Tournefortia breviflora DC....................................................................92 3.3­ Tournefortia candidula (Miers.) I.M. Johnst..........................................94 3.4­ Tournefortia floribunda Humb., Bonpl. & Kunth....................................97 3.5­ Tournefortia gardneri A.DC................................................................102 3.6­ Tournefortia melanochaeta DC..........................................................105 3.7­ Tournefortia paniculata Cham............................................................107 3.8­ Tournefortia rubicunda Salzm. ex DC................................................111 3.9­ Tournefortia salicifolia (Gardn.) DC....................................................113 3.10­ Tournefortia subsessilis Cham.........................................................115 3.11­ Tournefortia villosa Salzm. ex DC....................................................118 3.12­ Tournefortia sp................................................................................121 AGRADECIMENTOS...........................................................................................122 REFERÊNCIAS BIBLIOGRÁFICAS.....................................................................122 LISTA DE EXSICATAS........................................................................................124 CONSIDERAÇÕES FINAIS.................................................................................128
8 ÍNDICE DE FIGURAS Figura 1. Mapa das principais formações vegetais do Estado da Bahia...............11 CAPÍTULO 1: Figura 1. Schleidenia paradoxa, Heliotropium polyphyllum, H. angiospermum e T. bicolor.....................................................................................................................21 Figura 2. Heliotropium angiospermum, Tournefortia floribunda, T. candidula, H. procumbens, H. elongatum e T. subsessilis..........................................................23 Figura 3. Indumento das folhas de Heliotropium...................................................25 Figura 4. Indumento das folhas de Tournerfortia e Schleidenia............................26 Figura 5. Flor..........................................................................................................30 Figura 6. Corola aberta..........................................................................................31 Figura 7. Gineceu...................................................................................................32 Figura 8. Fruto........................................................................................................34 CAPÍTULO 2: Figura 1. Heliotropium angiospermum, H. barbatum, H. elongatum, H. indicum, H. polyphyllum e H. procumbens................................................................................45 Figura 2. Heliotropium angiospermum e H. barbatum...........................................46 Figura 3. Mapa de distribuição geográfica de Heliotropium angiospermum, H. barbatum e H. elongatum.......................................................................................47 Figura 4. Heliotropium elongatum e H. filiforme.....................................................53 Figura 5. Mapa de distribuição geográfica de Heliotropium filiforme, H. fruticosum e H. indicum...........................................................................................................56 Figura 6. Heliotropium fruticosum e H. indicum.....................................................59 Figura 7. Heliotropium polyphyllum e H. procumbens...........................................64 Figura 8. Mapa de distribuição geográfica de Heliotropium polyphyllum, H. procumbens e H. salicoides...................................................................................65 Figura 9. Heliotropium salicoides, H. ternatum, H. transalpinum, Schleidenia E
paradoxa, Tournefortia bicolor e T. candidula........................................................70 Figura 10. Heliotropium salicoides e H. ternatum..................................................71 Figura 11. Mapa de distribuição geográfica de Heliotropium ternatum, H. transalpinum e Heliotropium sp..............................................................................74 Figura 12. Heliotropium transalpinum e Heliotropium sp.......................................77 9 Figura 13. Schleidenia paradoxa...........................................................................83 Figura 14. Mapa de distribuição geográfica de Schleidenia paradoxa..................84 Figura 15. Tournefortia bicolor e T. breviflora........................................................90 Figura 16. Mapa de distribuição geográfica de Tournefortia bicolor, T. breviflora e T. candidula............................................................................................................91 Figura 17. Tournefortia candidula e T. floribunda..................................................96 Tabela 1. Quadro comparativo de T. floribunda, T. membranacea e T. salzmannii, baseado nos opus princeps de cada espécie........................................................99 Figura 18. Tournefortia floribunda, T. melanochaeta, T. rubicunda, T. subsessilis e T. villosa...............................................................................................................100 Figura 19. Mapa de distribuição geográfica de Tournefortia floribunda, T. gardneri e T. melanochaeta...............................................................................................101 Figura 20. Tournefortia gardneri e T. melanochaeta............................................104 Figura 21. Tournefortia paniculata e T. rubicunda...............................................109 Figura 22. Mapa de distribuição geográfica de Tournefortia paniculata, T. rubicunda e T. salicifolia.......................................................................................110 Figura 23. Tournefortia salicifolia e T. subsessilis ...............................................114 Figura 24. Mapa de distribuição geográfica de Tournefortia subsessilis, T. villosa e Tournefortia sp.....................................................................................................117 Figura 25. Tournefortia villosa e Tournefortia sp.................................................120
10 INTRODUÇÃO A família Boraginaceae Juss. está incluída na subclasse Asteridae e é constituída por cerca de 148 gêneros e 2740 espécies (Stevens, 2001) distribuídas largamente nas regiões tropicais, subtropicais e temperadas, onde ocorre o maior número de táxons (Cronquist, 1981). Possui centros de diversidade genética na zona temperada do hemisfério Norte e nos trópicos (América Central e norte da América do Sul) (Al­Shehbaz, 1991). Boraginaceae compreende seis subfamílias: Boraginoideae, Cordioideae, Ehretioideae, Heliotropioideae, Hydrophylloideae e Lennoideae. Estas são separadas pela presença de clorofila, posição e divisão do estilete, tipos de frutos e cotilédones (Stevens, 2001). No Brasil a família é representada por doze gêneros com espécies nativas: Antiphytum DC. ex Meisn., Chamissoniophila Brand, Cordia L., Heliotropium L., Lepidocordia Ducke, Moritzia DC. ex Meisn., Phacelia Juss., Rotula Lour., Schleidenia Endl., Thaumatocaryum Baill, Tournefortia L. e Wigandia Kunth (Barroso, 1991; Förther 1998; Souza & Lorenzi 2005; Gottschling et al. 2005). Os gêneros Anchusa L., Borago L., Cynoglossum L., Echium L., Myosotis L. e Symphytum L. são espontâneos ou introduzidos (Barroso, 1991; Souza & Lorenzi 2005). Dos gêneros com espécies nativas do Brasil, cinco ocorrem na Bahia: Cordia, Rotula, Tournefortia, Heliotropium e Schleidenia. A subfamília Heliotropioideae é representada por ervas, subarbustos, arbustos, lianas ou pequenas árvores, que apresentam alcalóides pirrolizidínicos. As folhas são inteiras, geralmente alternas. As anteras às vezes apresentam­se coerentes; o estilete é terminal e o estigma cônico, séssil ou não. O fruto é uma drupa ou um esquizocarpo, com 2 ou 4 núculas, com endosperma ausente. Ocorre nas regiões temperadas e tropicais do mundo (Stevens, 2001). Heliotropioideae é representada por 8 gêneros (Heliotropium, Tournefortia, Schleidenia, Argusia Böhm., Ceballosia Kunkel, Ixorhea Fenzl, Nogalia Verdc. e Hilgeria Förther) e aproximadamente 450 espécies (Förther, 1998). Os maiores gêneros são Heliotropium, com cerca de 260 espécies e Tournefortia, com aproximadamente 150 espécies (Judd et al. 2002). No Brasil ocorrem mais de 25
11 espécies de Heliotropium (Melo & Sales, 2004), 16 espécies de Tournefortia (Johnston, 1930) e 5 espécies de Schleidenia (Förther, 1998). O gênero Heliotropium L. é composto por subarbustos ou arbustos. As flores são reunidas em inflorescências que geralmente possuem uma ou duas cimas, raro 3­4, e flores com ou sem brácteas. O fruto é seco, dividindo­se em 2 ou 4 núculas. A área de dispersão corresponde às regiões tropicais e subtropicais do mundo, especialmente as áridas (Candolle, 1845; Johnston, 1935; Smith, 1970; Förther, 1998; Melo & Sales, 2004). Schleidenia Endl. é pantropical e representado por ervas anuais ou perenes com flores solitárias, axilares, e fruto drupáceo (Candolle, 1845; Förther, 1998). O gênero Tournefortia L. é representado por subarbustos, arbustos, lianas ou mais raramente árvores. Possui flores agrupadas em inflorescências, as quais variam de duas até muitas cimas, com flores sempre sem brácteas; o fruto é drupáceo. Este gênero possui distribuição pantropical (Candolle, 1845; Johnston, 1935; Smith, 1970; Silva 2004). Poucos foram os levantamentos florísticos relacionados à subfamília Heliotropioideae para o Brasil. Podem ser destacadas as seguintes obras: Fresenius (1857), o qual considerou 69 espécies deste grupo para o Brasil, sendo que 21 destas ocorreriam na Bahia; Johnston (1928, 1930), o qual tratou taxonomicamente as espécies de Heliotropium da América do Sul (onde citou 20 espécies para o Brasil e 10 para a Bahia) e as espécies de Tournefortia do Brasil, Uruguai, Paraguai e Argentina (sendo 16 ocorrentes no Brasil e 6 no Estado da Bahia); Smith (1970), na “Flora Ilustrada Catarinense”, que registrou 5 espécies de Heliotropium e 7 espécies de Tournefortia para esse Estado; Melo & França (2003), que encontraram três espécies de Heliotropium em Grão­Mongol (Minas Gerais); Melo & Sales (2004), que realizaram um estudo das espécies de Heliotropium do Estado de Pernambuco, onde foram listadas 7 espécies deste gênero; Silva (2004), que estudou as espécies extra­amazônicas de Tournefortia e que encontrou 15 espécies, das quais 11 teriam ocorrência para Bahia. Para a Bahia destacam­se os seguintes trabalhos relacionados a Heliotropioideae: Harley & Mayo (1980), que listaram 21 espécies de Boraginaceae para a Bahia, entre elas 8 Heliotropium e 2 Tournefortia; Harvey (1995), na flora do Pico das Almas que levantou três espécies de Boraginaceae,
12 sendo uma delas (Heliotropium salicoides Cham.) pertencente à subfamília em estudo. A escassez de estudos das espécies de Heliotropioideae direcionados para o Estado da Bahia, torna necessário o presente trabalho, o qual teve como objetivos: 1­ Realizar um levantamento das espécies de Heliotropioideae no Estado da Bahia; 2­ Apresentar chaves de identificação para as subfamílias, para os gêneros e para as espécies; 3­ Identificar, descrever e ilustrar as espécies encontradas na área de estudo; 4­ Elaborar mapas de distribuição geográfica das espécies; 5­ Apresentar comentários taxonômicos das espécies estudadas; 6­ Historiar as principais contribuições para o estudo de Boraginaceae e Heliotropioideae; 7­ Detalhar as características morfológicas de Heliotropioideae; 8­ Enriquecer as coleções de Boraginaceae encontradas no Estado da Bahia.
13 1­ HISTÓRICO A­ Boraginaceae Candolle (1845) baseado no hábito, em características do ovário, do estilete, dos cotilédones e do endosperma apresentou a subdivisão de Borragineae em quatro tribos: Cordieae; Ehretieae; Heliotropeae e Borrageae. O autor incluiu o gênero Tournefortia L. na tribo Ehretieae. Ele descreveu o gênero Heliophytum DC. e o posicionou, juntamente com os gêneros Heliotropium L., Schleidenia Endl., Coldenia L., Pentacarya DC. e Euploca Nutt., na tribo Heliotropeae. Fresenius (1857) reconheceu para o Brasil a subtribo Boragineae, representada pelos gêneros Echium L., Moritzia DC. e Antiphytum DC. O autor considerou ainda outros dois grupos taxonômicos, sendo eles a família Cordiaceae (constituída pelos gêneros Cordia L. e Patagonula L.) e a tribo Heliotropieae, a qual pertencia Heliotropium e Tournefortia, juntamente com os gêneros Heliophytum e Schleidenia. Gürke (1893) foi o autor da monografia da família Boraginaceae intitulada “Die Natürlichen Pflanzenfamilien”, editada por Engler & Prantl. Nesta obra, Boraginaceae foi posicionada dentro da ordem Tubiflorae, baseado na presença de flores hipóginas (raro epígenas), corola gamopétala, óvulos geralmente anátropos e endosperma usualmente celular. Tubiflorae foi subdividida em seis Subordens: Boragineae, Convolvulineae, Verbenineae, Solanineae, Myoporineae e Phrymineae. Boraginaceae, foi incluída, juntamente com as famílias Lennoaceae e Hydrophyllaceae, na subordem Boragineae, pela presença de flores quase sempre actinomorfas, estames 5, raro 10 (Lennoaceae) e 2 carpelos, raro 6­14 (Lennoaceae). Gürke (1893) subdividiu Boraginaceae em 4 subfamílias (Boraginoideae, Heliotropioideae, Ehretioideae e Cordioideae), baseado principalmente na posição de inserção do estilete no ovário (ginobásico ou terminal), número de ramificação do estilete (1, 2 ou 4) e o tipo de fruto. Melchior (1964), na última edição do “Syllabus der Pflanzenfamillien” de Engler manteve as subfamílias propostas por Gürke (1893), acrescentando, entretanto a subfamília Wellstedioideae, formada pelo gênero Wellstedia Balf.,
14 antes incluído em Boraginoideae. Esta subfamília separou­se das demais pela presença de fruto capsular e estilete terminal. Cronquist (1981) inseriu Boraginaceae dentro das Asteridae, na ordem Lamiales, junto com as famílias Lennoaceae, Verbenaceae e Lamiaceae. Estas compartilham com Boraginaceae a presença de ovário bicarpelar (sendo que cada carpelo é dividido por um falso septo) e de estilete ginobásico (apenas com a subfamília Boraginoideae). Takhtajan (1987) considerou a família Boraginaceae junto com as Hydrophyllaceae, Tetrachondraceae, Hoplestigmataceae e Lennoaceae na Ordem Boraginales, baseado nas inflorescências cimosas e flores actinomorfas ou ligeiramente zigomorfas. Heubl et al. (1990) analisaram o número de cromossomos, a morfologia do grão de pólen e o padrão dos cristais na madeira dos gêneros Cordia, Tournefortia e outros gêneros de Boraginaceae. A configuração dos cristais apresentou valor taxonômico, pois, enquanto na subfamília Cordioideae estes eram cristais prismáticos ou colunares, em Heliotropioideae estes eram cristais de drusas. Estudos filogenéticos com dados moleculares têm sugerido que Boraginaceae é fortemente relacionada à parte da família Hydrophyllaceae. Boraginaceae senso lato seria um grupo parafilético, que só se tornaria monofilético com a inclusão de Hydrophyllaceae (excluindo Hydrolea L.) (Olmstead et al. 1992, 1993; Chase et al. 1993; Ferguson, 1999). Böhle & Hilger (1997) realizaram uma análise filogenética de Boraginaceae s.l. utilizando seqüências de DNA de cloroplasto. A partir deste estudo, os autores propuseram que o tradicional conceito de Boraginaceae com cinco subfamílias fosse abandonado. No novo conceito proposto por Böhle & Hilger (1997), Boraginaceae s.l. seria elevada à ordem (Boraginales), a qual englobaria cinco famílias: Boraginaceae s. str. (incluído Wellstedia Balf.), Cordiaceae, Ehretiaceae, Heliotropiaceae e Hydrophyllaceae. Os estudos de Gottschling et al. (2001) baseados na estrutura secundária da região nuclear ITS (“internal transcribed spacer”) confirmaram o parafiletismo de Boraginaceae s.l. Além disso, reforçaram a idéia de que Lennoaceae (representada por plantas aclorofiladas, parasitas de raízes) fosse associada à Boraginaceae (Engler & Prantl, 1893; Cronquist, 1968, 1981; Takhtajan, 1987).
15 Judd et al. (2002) posicionaram as Boraginaceae na ordem Solanales baseados nas corolas simpétalas, na simetria radial e nas folhas simples, alternas e sem estípulas. Segundo os autores, a esta ordem também pertenceriam as famílias Convolvulaceae, Solanaceae e Hydrophyllaceae. Buys & Hilger (2003) apresentaram uma discussão sobre a estrutura da inflorescência em Boraginaceae. Eles concluíram que tais estruturas são exclusivamente cimas escorpióides, embora tenha sido associadas erroneamente a cimas helicoidais. APG II (2003), baseando­se em estudos filogenéticos, posicionou a família Boraginaceae (incluindo Hydrophyllaceae) no clado “Asterids”. Entretanto, a família ocupou uma posição incerta, dentro do subclado “Euasterids I”. Soltis et al. (2005), apresentou dados modificados do APG II, onde Boraginaceae (incluindo Hydrophyllaceae e Lennoaceae) aparece como grupo irmão de Vahliaceae. Porém, este grupo ainda apareceu em uma posição incerta dentro das “Euasterids I”. B­ Heliotropioideae Os gêneros Heliotropium e Tournefortia foram publicados por Linnaeus (1753), na obra “Species Plantarum”. O nome Heliotropium provém do grego “helios”, sol e “trope”, virando e foi dado a este gênero devido às suas flores crescerem voltadas para cima, em direção ao sol. Já o epíteto genérico Tournefortia foi dado em homenagem ao renomado botânico francês, Joseph Pitton Tournefort (1656­1708). Schleidenia foi publicado por Endlicher (1839 apud Förther, 1998), sendo assim denominado em homenagem ao botânico alemão Matthias Jacob Schleiden (1804­1881). Candolle (1845) colocou os gêneros Tournefortia e Heliotropium em tribo distintas, baseado no hábito e em características dos frutos. Tournefortia foi posicionada na tribo Ehretieae e Heliotropium, juntamente com Heliophytum DC., Schleidenia, Coldenia L., Pentacarya DC. e Euploca Nutt., na tribo Heliotropee. O autor subdividiu Tournefortia em cinco seções (Tournefortia sect. Mallota A.DC.; Tournefortia sect. Arguzia DC.; Tournefortia sect. Pittonia Humb., Bonpl. & Kunth; Tournefortia sect. Tetrandra DC. & A.DC. e Tournefortia sect. Messerschmidia
16 DC.), baseando­se no forma e no número de lobos da corola e em características do estigma e dos frutos. Heliotropium, por sua vez, foi dividido em quatro seções (Heliotropium sect. Catimas A.DC.; Heliotropium sect. Piptoclaina Endl.; Heliotropium sect. Euheliotropium DC. e Heliotropium sect. Orthostachys A.DC.), com base na presença de tricomas no tubo da corola e no estigma, na forma do fruto e no número de sementes. Fresenius (1857) apresentou 69 espécies de Heliotropieae, assim distribuídas: Heliotropium (3), Heliophytum (12), Schleidenia (28) e Tournefortia (26). Estes gêneros foram separados com base nas anteras, no número de lóculos e tipo de fruto. As espécies que possuíam fruto seco, 4­carpelar, foram assim divididas: carpelos divididos em dois segmentos biloculares, corresponderiam ao gênero Heliophytum; as demais espécies que possuíam carpelos separados em quatro segmentos uniloculares, distinguiam­se pelas anteras: anteras com ápices pubescentes ou glanduloso, coerentes (Schleidenia) ou anteras com ápices glabros, livres (Heliotropium). As espécies com fruto drupáceo seriam do gênero Tournefortia. Benthan & Hooker (1873) transferiram o gênero Heliophytum para Heliotropium sect. Heliophytum (DC.) Benth. & Hook. Gürke (1893) reuniu os gêneros Heliotropium e Tournefortia na subfamília Heliotropioideae, juntamente com o gênero Cochranea Miers (que ocorreria no Brasil, na Argentina e na América do Norte). Ele subdividiu Heliotropium em sete seções: Heliotropium sect. Messerschmidia DC. (considerada por Candolle (1845) como Tournefortia sect. Messerschmidia DC.); Heliotropium sect. Catimas A.DC., Heliotropium sect. Piptoclaina Endl.; Heliotropium sect. Euheliotropium DC.; Heliotropium sect. Monimantha Franch.; Heliotropium sect. Heliophytum (DC.) Benth. & Hook.; e Heliotropium sect. Orthostachys A.DC. (para qual foi transferido o gênero Schleidenia). Johnston (1928) apresentou um estudo das espécies sul­americanas de Heliotropium. O trabalho incluiu descrições e chave de identificação para as 10 seções nas quais o gênero foi subdividido, além de descrições e chave de identificação para as espécies. O autor aceitou que o gênero Cochranea fosse transferido para Heliotropium sect. Cochranea (Miers.) Reiche. Johnston (1928) subdividiu Heliotropium sect. Orthostachys A.DC. em três subseções, (Heliotropium sect. Orthostachys subsect. Axillaria I.M.Johnst.; Heliotropium sect.
17 Orthostachys subsect. Ebracteata I.M.Johnst. e Heliotropium sect. Orthostachys subsect. Bracteata I.M.Johnst.). Johnston (1930) realizou um estudo com as espécies dos gêneros Cordia e Tournefortia conhecidas no Brasil, Paraguai, Uruguai e Argentina. Neste trabalho, Johnston apresentou 16 espécies de Tournefortia, contidas em duas seções: Tournefortia sect. Eutournefortia (caracterizada por possuir frutos obscuramente lobados, evidentemente bicarpelar, núculas irregulares com 1­2 sementes e embrião reto) e Tournefortia sect. Cyphocyema (que possui frutos evidentemente lobados, obscuramente bicarpelar, com quatro núculas aproximadamente do mesmo tamanho, com 1 semente cada e embrião curvo). Förther (1998) revisou e lectotipificou mais de 150 taxa do gênero Heliotropium e o classificou em 19 seções, com base na ramificação da inflorescência, na forma da corola e presença de tricomas no interior e exterior desta, na forma do gineceu e das anteras e nas formas dos frutos e das núculas. Segundo Förther (1998), Heliotropioideae seria formada pelos gêneros Heliotropium, Tournefortia, Schleidenia, Argusia Böhm., Ceballosia Kunkel, Ixorhea Fenzl, Nogalia Verdc. e Hilgeria Förther. O autor restabeleceu o gênero Schleidenia, baseado em dados morfológicos e anatômicos. Entretanto, Förther não considerou todas as espécies de Heliotropium s.l. que tivessem anteras com ápice glanduloso ou pubescente e coerentes, como Schleidenia, de acordo com o conceito de Fresenius (1857). Ele só considerou como Schleidenia as espécies que possuíam estas características do androceu, combinadas com a apresentação de flores solitárias e axilares. Assim, as espécies de Schleidenia corresponderiam às espécies de Heliotropium sect. Orthostachys subsect. Axillaria I.M. Johnst. Análises sistemáticas baseada em dados moleculares e morfológicos, realizadas por Diane et al. (2002), mostraram que Heliotropium e Tournefortia formam, juntamente com Schleidenia, Ixorhea Fenzl e Ceballosia Kunkel, um grupo monofilético. Entretanto, esse estudo revelou que o gênero Heliotropium é parafilético e Tournefortia, polifilético, sendo apenas estas as conclusões dos autores. Hilger & Diane (2003) ampliaram este estudo utilizando dados moleculares da região nuclear (ITS) e de plastidio (trnL), sendo que estes resultados suportam fortemente os dados obtidos por Diane et al. (2002), os quais são contrários às
18 tradicionais circunscrições taxonômicas dos gêneros Heliotropium e Tournefortia. Neste trabalho, Heliotropiaceae (= Boraginaceae subfamília Heliotropioideae) foi separada em dois grandes clados, sendo que o primeiro clado incluiu na sua posição basal o gênero Ixorhea. O gênero Myriopus Small (formado por Tournefortia sect. Cyphocyema) apareceu como grupo irmão de Euploca (constituído pelos gêneros Hilgeria Föther, Schleidenia Endl., Heliotropium L. sect. Orthostachys R.Br. subsect. Axillaria I.M.Johnst.). As demais seções de Heliotropium, Tournefortia sect. Tournefortia e três gêneros menores (Argusia, Ceballosia e Nogalia), segregados de Heliotropium formaram o segundo grande clado. Ainda assim, eles defenderam a manutenção do gênero Tournefortia, mesmo que com isso o gênero Heliotropium se tornasse parafilético e ressaltaram a necessidade de uma revisão deste gênero (Hilger & Diane, 2003). C­ Heliotropioideae no Brasil O primeiro trabalho relacionado aos gêneros em estudo, para o Brasil, foi a obra de Fresenius (1857), publicado na “Flora Brasiliensis” editada por Martius & Eichler. Nesta são apresentadas 69 espécies do que ele denominou tribo Heliotropieae. Smith (1970), na Flora Ilustrada Catarinense, apresentou um estudo sobre a família Boraginaceae para o Estado de Santa Catarina. Este trabalho apresentou chaves de identificação, ilustrações, descrições e mapas de distribuição geográfica das espécies, foram tratadas sete espécies de Tournefortia e cinco espécies de Heliotropium. Soares (1973) estudou cinco espécies de Boraginaceae, dentre elas duas espécies de Heliotropium, ocorrentes na cidade de Porto Alegre (RS) e arredores. O trabalho tem descrições das espécies encontradas e informações sobre a distribuição geográfica das mesmas. Ranga & Silva (1991) registraram três espécies de Tournefortia para a Ilha do Cardoso, em São Paulo. O trabalho traz chave para identificação e descrições das espécies. Vitta (1992) encontrou duas espécies de Boraginaceae na Serra do Cipó, em Minas Gerais. Uma delas foi Tournefortia paniculata Cham., a qual foi descrita e ilustrada.
19 Harvey (1995), na flora do Pico das Almas, encontrou uma espécie (Heliotropium salicoides Cham.) pertencente à subfamília em estudo, em meio às três espécies de Boraginaceae por ele registradas. O autor apresenta uma chave para identificação e descrição das espécies. Nagatani & Rossi (2000), em levantamento das espécies de Boraginaceae de reserva do Parque Estadual das Fontes do Ipiranga, em São Paulo, encontrou três espécies de Heliotropioideae, sendo uma espécie de Heliotropium e duas do gênero Tournefortia. Este trabalho apresentou chaves de identificação para os gêneros e espécies e descrições destas. Cavalheiro et al. (2003) reconheceram sete espécies de Boraginaceae para a planície litorânea de Picinguaba (Ubatuba – SP), dentre elas, uma espécie de Tournefortia (T. bicolor Sw.). No trabalho consta chave de identificação para os gêneros, descrição, ilustração e comentários taxonômicos sobre as espécies. Melo & França (2003) encontraram quatro espécies de Boraginaceae em Grão­Mongol (MG), sendo que três destas pertencentes ao gênero Heliotropium. Os autores apresentaram chave de identificação, descrições e ilustrações das espécies estudadas. Melo & Ranga (2003) registraram uma nova ocorrência de Heliotropium fruticosum L. para o Sudeste do Brasil. Os autores forneceram descrição, ilustração, dados sobre distribuição geográfica e comentários taxonômicos sobre esta espécie. Silva (2004) estudou as espécies extra­amazônicas do gênero Tournefortia, sendo que foram encontradas 15 espécies, sendo que uma delas (T. paniculata) possuía duas variedades. Segundo a autora, das espécies encontradas, onze teriam ocorrência na Bahia. O trabalho traz chave para identificação das espécies, descrições, comentários e informações sobre distribuição geográfica. Melo & Sales (2004) realizaram um estudo das espécies de Heliotropium de Pernambuco. As sete espécies encontradas foram descritas e ilustradas. Foram apresentados neste trabalho comentários sobre a morfologia e uma chave para identificação destas espécies.
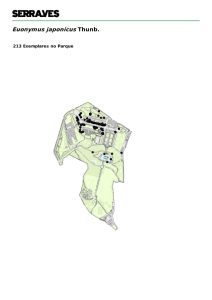
20 MATERIAL E MÉTODOS 1. Área Estudada O Estado da Bahia localiza­se na região Nordeste do Brasil, ocupando uma área de 567.295,03 Km 2 , o que corresponde a 36,34% do território desta região e a 6,64% do território brasileiro (Bahia, 2001). Está localizado entre as latitudes 8º – 19º Sul e 37º ­ 47º Oeste, limitando­se com os Estados de Sergipe, Alagoas, Pernambuco e Piauí ao norte, Goiás e Tocantins a oeste, Minas Gerais e Espírito Santo ao sul, e o Oceano Atlântico a leste. O Estado possui sete ilhas continentais e costeiras com aproximadamente 547km 2 , além de um arquipélago oceânico, o qual constitui o Parque Nacional Marinho de Abrolhos. Fig. 1: Mapa das principais formações vegetais do Estado da Bahia (Fonte: Queiroz, 1998).
21 A Bahia apresenta uma grande diversidade de formações vegetais, sendo que estão presentes no Estado os biomas Caatinga, Cerrado e Mata Atlântica. Dessa forma, são encontradas: florestas ombrófilas densa; restingas, dunas, e mangues (no litoral); floresta estacional semidecidual, floresta estacional decidual e savanas estépicas; savanas (a oeste do Rio São Francisco, com disjunções na Chapada Diamantina); e campos rupestres, nas áreas acima de 900m na chapada Diamantina. Além desses ecossistemas principais, ocorrem ainda formações locais como os “inselbergs”, as dunas do Rio São Francisco, as “matas de grotão”, florestas ciliares e de encostas e a “Mata de Cipó” (Giulietti et al., 2006). 2. Coleta do material botânico Foram realizadas excursões ao campo, com o objetivo de amostrar os mais diferentes tipos de vegetação por um período de quinze meses para observações das plantas “in loco”, onde foram feitos os registros das características que são perdidas no processo de herborização (cor das folhas, flores, textura, viscosidade dos ramos e folhas), coleta de material botânico para herborização, fixação das partes florais em álcool a 70% e fotografia dos espécimes em campo. Foram realizadas 10 expedições para as diferentes regiões da área de estudo: duas para a Chapada Diamantina; uma para o Oeste e Sudoeste baiano; duas para o Recôncavo; três para o semi­árido; uma para o Sul da Bahia; e uma expedição para o Litoral Norte. O material herborizado constou de folhas, flores e/ou frutos. Para cada número de coleta foi amostrado um mínimo de três exsicatas, exceto naqueles casos onde foi encontrado apenas um indivíduo. Este material foi processado de acordo com o método convencional de herborização, seguindo a metodologia proposta por Mori et al. (1989). Todo o material coletado está depositado no Herbário da Universidade Estadual de Feira de Santana (HUEFS). 3. Identificação do material botânico, sistema de classificação e revisões taxonômicas adotadas
22 A identificação taxonômica foi realizada com o auxílio de bibliografia especializada para a família: Candolle (1845); Fresenius (1857); Johnston (1928, 1930, 1935); Melo & Sales (2004) e Silva (2004). Além disso, utilizou­se a comparação com as coleções de herbário, com os opus princeps e com as fotografias de tipos, que estão disponibilizadas na rede, ou que foram obtidas através da colaboração de outros pesquisadores. Neste trabalho adotamos como sistema de classificação o APG II, o qual está sendo utilizado na Flora da Bahia. Os nomes utilizados e sinônimos citados para os gêneros Heliotropium e Schleidenia seguiram Förther (1998). Para as espécies de Tournefortia, foram seguidos os nomes e sinônimos listados por Johnston (1928, 1935). 4. Análise morfológica dos espécimes Para a análise do material botânico, inicialmente foi construída uma tabela de caracteres com as características mais importantes para identificação dos táxons. A partir dessa tabela foram elaboradas as descrições, onde se utilizou os valores máximos e mínimos das medidas obtidas. A terminologia utilizada para descrição dos tipos de indumento seguiu Hickey & King (2002). Para classificação dos tipos de venação utilizou­se Hickey (1973). A descrição das demais estruturas vegetativas e das estruturas reprodutivas seguiu Radford et al. (1974). As espécies foram analisadas com o auxílio de estereomicroscópio acoplado à câmara clara. Suas características foram anotadas e, aquelas mais relevantes para o reconhecimento das espécies, foram ilustradas. 5. Exame de espécimes de herbários Além dos materiais coletados com finalidade exclusiva para a dissertação, foram também utilizados os demais espécimes depositados no HUEFS e as coleções dos principais herbários do país. Foram visitados herbários e solicitado empréstimos de algumas exsicatas para análise mais detalhada e identificação do material.
23 Os herbários consultados foram os seguintes (siglas de acordo com o Holmgren et. al., 1990 e com o Index Herbariorum (disponível em: http://sciweb.nybg.org/science2/IndexHerbariorum.asp): ALCB – Herbário Alexandre Leal Costa (BA); CEPEC – Centro de Pesquisas do Cacau (BA); HB – Herbário Bradeanum (RJ); HRB – Herbário RADAMBRASIL (BA); HUEFS – Herbário do Departamento de Ciências Biológicas da Universidade Estadual de Feira de Santana (BA); MBM – Museu Botânico Municipal (PR); RB – Herbário do Jardim Botânico do Rio de janeiro (RJ); SP – Herbário do Estado “Maria Eneyda P. K. Fidalgo”, Instituto de Botânica (SP); SPF – Herbário do Instituto de Biociências da Universidade de São Paulo (SP); UEC – Herbário da Universidade Estadual de Campinas (SP). 6. Distribuição das espécies A distribuição geográfica das espécies na Bahia foi obtida com base nas informações das etiquetas de herbários e dados disponíveis na bibliografia. A distribuição geográfica das espécies está sendo apresentada de acordo com o modelo da Flora da Bahia (disponível em: www.uefs.br/floradabahia), que está sendo publicada na revista Sitientibus. 8. Formato da dissertação A dissertação é formada por dois capítulos, sendo que o capítulo 1 trata da morfologia das espécies estudadas e o capítulo 2 formatado de acordo com as normas para publicação da revista Sitientibus, na qual está sendo publicado a Flora da Bahia (Giulietti et al. 2006).
24 REFERÊNCIAS BIBLIOGRÁFICAS AL­SHEHBAZ, I. A. 1991. The genera of Boraginaceae in the southeastern United States. J. Arnold Arbor., série suplementar 1: 1­169. APG II (Angiosperm Phylogeny Group) 2003. A update of the Angiosperm Phylogeny classification for the orders and families of flowering plants. Bot. J. Linn. Soc. 141: 399­436. BARROSO, G.M. 1991. Sistematica de Angiospermas do Brasil. UFV, Impr. Univ., vol. 3, 3­5, 88­95 p. BÖHLE, R. & HILGER, H.H. 1997. Chloroplast DNA systematics of “Boraginaceae”and related families – a goodbye to the old and familiar concept of five subfamilies. In E. Smets; L.P. R. Decraene & E. Robbrecht (eds.) 13th Symp. Morph., Anat. & Syst., Progr. & Abstr. Scripta Bot. Belg. 15. BUYS, M.H. & HILGER, H.H. 2003. Boraginaceae cymes are exclusively scorpioid and not helicoids. Taxon 52: 719­724. CANDOLLE, A.P. 1845. Borragineae. Prodromus systematis naturalis regni vegetabilis. Parte 9: 467­563 p. CAVALHEIRO, L.; PERALTA, D.F.; FURLAN, A. 2003. Flora Fanerogâmica da planície litorânea de Picinguaba, Ubatuba, SP, Brasil: Boraginaceae. Hoehnea 30(3): 173­179. CHASE, M.W. et al. 1993. Phylogenetics of seed plants: an analysis of nucleotide sequences from the plastid gene rbcL. Ann. Missouri Bot. Gard. 80: 528­ 580. CRONQUIST, A. 1981. An intregated system of classification of flowering plants. New York, Columbia University Press. DIANE, N.; FÖRTHER, H.; HILGER, H.H. 2002. A systematic analysis of Heliotropium, Tournefortia, and allied taxa of the Heliotropiaceae (Boraginales) based on ITS1 sequences and morphological data. Amer. J. Bot. 89: 287­295. FERGUSON, D.M. 1999. Phylogenetic analysis and relationships in Hydrophyllaceae based on ndhF sequence data. Syst. Bot. 23(3): 253­268.
25 FÖRTHER, H. 1998. Die infragenerische Gliderrung der Gattung Heliotropium L. und ihre Stellung innerhalb der subfam. Heliotropioideae (Schrad.) Arn. (Boraginaceae). Sendtnera 5: 35­241. FRESENIUS, G. 1857. Boraginaceae; Heliotropiaceae. In C.F.P. Martius & A.G. Eichler (eds.). Flora Brasiliensis 8(1): 5­58. GIULIETTI, A.M.; QUEIROZ, L.P.; SILVA, T.R.S.; FRANÇA, F.; GUEDES, M.L.; AMORIM, A.M. 2006. Flora da Bahia. Sitientibus 6(3): 169­173. GOTTSCHLING, M.; HILGER, H.H.; WOLF, M.; DIANE, N. 2001. Secondary Structure of the ITS1 Transcript and its Application in Reconstruction of the Phylogeny of Boraginales. Plant. Biol. 3: 629­636. GOTTSCHLING, M.; MILLER, J.S.; WEIGEND, M.; HILGER, H.H. 2005. Congruence of a phylogeny of Cordiaceae (Boraginales) inferred from ITS1 sequence data with morphology, ecology, and biogeography. Ann. Missouri Bot. Gard. 92: 425­437. GÜRKE, M. 1893. Borraginaceae. In: ENGLER, A. & PRANTL, K. (eds.) Die Natürlichen Pflanzenfamilien 4 (3a): 71­131. HARLEY, R.M. & MAYO, S.J. 1980. Towards a checklist of the Flora of Bahia. London, Royal Botanic Gardens, Kew. HARVEY, Y.B. 1995. Boraginaceae, p. 155­157. In: STANNARD, B.L. (ed.). Flora of the Pico das Almas: Chapada Diamantina – Bahia, Brazil. London, Royal Botanic Gardens, Kew. HEUBL, G.R.; GAVIRIA, J.C.; WANNER, G. 1990. A contribution to the taxonomy and evolution of Cordia (Boraginaceae) and allied genera. Bot. Jahrb. Syst. 112(2): 129­165. HILGER, H.H. & DIANE, N. 2003. A systematic analysis of Heliotropiaceae (Boraginales) based on trnL and ITS1 sequence data. Bot. Jahrb. Syst. 125(1): 19­51. HICKEY, L.J. 1973. Classification of the architecture of dicotyledonous leaves. Amer. J. Bot. 60(1): 17­33 p. HICKEY, M. & KING, C. 2002. The Cambridge illustrated glossary of botanical terms. Cambridge University Press. HOLMGREN, P.K., HOLMGREN, N.H.; BARNETT, L.C. 1990. Index Herbariorum: Part I: The Herbaria of the World. New York Botanical Garden. 693 p.
26 JOHNSTON, I.M. 1928. Studies in the Boraginaceae – VII: The South American Species of Heliotropium. Contr. Gray Herb. 81: 3­83. JOHNSTON, I.M. 1930. Studies in the Boraginaceae – VIII: Observations on the species of Cordia and Tournefortia known Brazil, Paraguay, Uruguay and Argentina. Contr. Gray Herb. 92: 3­95. JOHNSTON, I.M. 1935. Studies in the Boraginaceae – X: The Boraginaceae of Northeastern South America. J. Arnold Arbor. 1(16): 1­64. JUDD, W.S.; CAMPBELL, C.S.; KELLOGG, E.A.; STEVENS, P.F.; DONOGUE, M.J. 2002. Plant Systematics: a Phylogenetic approach. Sunderland, Massachusetts: Sinauer. LINNAEUS, C. 1753. Species Plantarum. Stockholm, 130­149 p. MELCHIOR, H. 1964. In A. Engler. Syllabus der Pflanzenfamilien. Berlim, 2: 1­ 666. MELO, E. & FRANÇA, F. 2003. Flora de Grão­Mongol, Minas Gerais: Boraginaceae. Bol. Bot. Univ. São Paulo 21 (1):127­129 p. MELO, J.I.M. & RANGA, N.T. 2003. Nova ocorrência de Heliotropium L. (Boraginaceae, Heliotropioideae) para o Sudeste do Brasil. Acta Scientiarum, Biological Sciences 25(2): 403­405. MELO, J.I.M. & SALES, M.F. 2004. Heliotropium L. (Boraginaceae – Heliotropioideae) de Pernambuco, Nordeste do Brasil. Rodriguésia 55(84): 65­87. MORI, S.A.; A.M.SILVA; G. LISBOA & L. CORADIN. 1985. Manual de manejo do Herbário fanerogâmico. Centro de Pesquisas do Cacau. CEPLAC. 97p. NAGATANI, Y. & ROSSI, L. 2000. Flora Fanerogâmica da Reserva do Parque Estadual das fontes do Ipiranga (São Paulo, Brasil): Boraginaceae. Hoehnea, 27(1): 95­98. OLMSTEAD, R.G.; MICHAELS, B.H.J.; SCOTT, K.M.; PALMER. J.D. 1992. Monophyly of the Asteridae and identification of their major lineages inferred from DNA sequences of rbc L. Ann. Missouri Bot. Gard. 79: 249­ 265.
27 OLMSTEAD, R.G.; BREMER, B.; SCOTT, K.M.; PALMER, J.D. 1993. A parsimony analysis of the Asteridae sensu lato based on rbcL sequences. Ann. Missouri Bot. Gard. 80: 700–722. QUEIROZ , L.P. 1998. Leguminosas da Caatinga, espécies com potencial forrageiro. UEFS, Kew, APNE, CNPq. Relatório. RADFORD, A.E.; DICKISON, W.C.; MASSEY, J.R.; BELL, C.R. et al. 1974. Vascular Plant Systematics. Harper & Row, Pubblishers, 83­166 p. RANGA, N.T. & SILVA, L.C. 2002. Flora Fanerogâmica da Ilha do Cardoso (São Paulo, Brasil): Boraginaceae. In: MELO, M.M.R.F.; BARROS, F.; CHIEA, S.A.C.; KIRIZAWA, M.; JUNG­MENDAÇOLLI, S.L.; WANDERLEY, M.G.L. (eds.). Flora Fanerogâmica da Ilha do Cardoso, São Paulo. Instituto de Botânica, SMA, vol. 9, 105­114 p. BAHIA. 2001. Anuário Estatístico da Bahia. Vol. 15. SILVA, L.C. 2004. Estudos taxonômicos das espécies extra­amazônicas de Tournefortia L. (Boraginaceae s.l.). Universidade Estadual Paulista “Julio Mesquita Filho”, Dissertação de Mestrado. SMITH, L.B. 1970. Boragináceas. In Flora Ilustrada Catarinense pp. 1­85. Herbário "Barbosa Rodrigues", Itajaí, Brasil. SOARES, Z.F. 1973. Nota sobre as Boragináceas da região de Porto Alegre e arredores. Iheringia – Botânica 17: 28­33 p. SOLTIS, D.E., P.S. SOLTIS, P.K. Edress & M.W. Chase. 2005. Phylogeny and evolution of angiosperms. Massachusetts, Sinauer, Sunderland. SOUZA, V.C. & LORENZI, H. 2005. Botânica Sistemática: guia ilustrado para identificação das famílias de Angiospermas da flora brasileira, baseado em APG II. Nova Odessa, Instituto Plantarum, 461­463 p. STEVENS, P. F. (2001 onwards). Angiosperm Phylogeny Website. Version 7, May 2006 [and more or less continuously updated since]. Disponível em: http://www.mobot.org/MOBOT/research/APweb/ Acessado em: 29/01/2007. TAKHTAJAN, A. 1987. Diversity and classification of flowering plants. New York, Columbia University Press, VITTA, F.A. 1992. Flora da Serra do Cipó, Minas Gerais: Boraginaceae. Bolm Botânica, Univ. São Paulo: 13: 235­239.
28 CAPÍTULO 1 MORFOLOGIA DA SUBFAMÍLIA HELIOTROPIOIDEAE NA BAHIA
29 MORFOLOGIA DA SUBFAMÍLIA HELIOTROPIOIDEAE NA BAHIA 1. Hábito As espécies de Heliotropioideae da Bahia apresentaram os seguintes tipos de hábito: ­ Ervas: o hábito herbáceo é encontrado apenas na espécie Schleidenia paradoxa. Trata­se de uma erva totalmente prostrada, bastante ramificada (Fig. 1A­B). ­ Subarbustos: este tipo de hábito foi encontrado em todas as espécies de Heliotropium (Fig. 1C­D) e em alguns espécimes de Tournefortia subsessilis . Os subarbustos variaram entre 0,1­1,5 m de altura, podendo ser prostrados, decumbentes ou eretos. Algumas espécies variaram entre até duas dessas formas. As espécies que apresentaram hábito subarbustivo prostrado foram: H. barbatum, H. elongatum, H. polyphyllum (Fig. 1C), H. procumbens, H. salicoides, H. ternatum e Tournefortia subsessilis. Os subarbustos com ramos decumbentes foram: H. filiforme, H. fruticosum e H. polyphyllum. E as espécies de Heliotropium que são subarbustos eretos são: H. angiospermum (Fig. 1D), H. barbatum, H. elongatum, H. filiforme, H. indicum, H. procumbens, H. salicoides, H. ternatum, H. transalpinum e Heliotropium sp. Ritidoma está presente nas seguintes espécies: H. polyphyllum, H. salicoides, H. ternatum e Heliotropium sp. ­ Arbustos: todas as espécies do gênero Tournefortia e apenas uma espécie de Heliotropium (H. transalpinum) apresentaram­se como arbustos. Estes arbustos variaram de 1,0­6,0 m de altura, podendo ser: decumbentes (T. bicolor (Fig. 1 E­F), T. candidula, T. floribunda, T. rubicunda e T. villosa); escandentes (T. bicolor, T. breviflora, T. floribunda, T. gardneri e T. melanochaeta); ou eretos (H. transalpinum). Algumas espécies não vistas em campo (Tournefortia salicifolia, T. paniculata e Tournefortia sp.) não possuíam nas exsicatas informações quanto ao hábito.
30 31
Em algumas espécies arbustivas lenticelas e/ou ritidoma estão presentes, nos ramos maduros. As espécies que tem presença de lenticelas são: T. floribunda, T. rubicunda e Tournefortia sp. As que possuem ritidoma são T. breviflora e Tournefortia sp. 2. Folha As folhas possuem disposição alternas, subopostas ou opostas. Em Tournefortia, Schleidenia e em H. fruticosum, H. polyphyllum, H. procumbens e H. salicoides, as folhas são sempre alternas. Em H. elongatum as folhas variam de alternas a subopostas. As demais espécies de Heliotropium (H. angiospermum, H. barbatum, H. elongatum, H. filiforme, H. indicum, H. ternatum, H. transalpinum e Heliotropium sp.) possuem, no mesmo indivíduo, folhas alternas, subopostas e opostas. As folhas são sempre pecioladas, com exceção de H. salicoides que geralmente apresenta folhas sésseis. O pecíolo variou entre 0,5­58 mm de comprimento. A lâmina foliar varia muito dentro deste grupo, consistindo em um caráter taxonômico importante. As maiores folhas foram encontradas em T. breviflora (ca. 17,9 C 5,3 cm) e as menores em Heliotropium filiforme (ca. 0,5 C 0,1 cm). Quanto à textura, as folhas podem ser membranáceas (H. angiospermum (Fig. 2 A), H. barbatum, H. elongatum (Fig. 2E), H. indicum, H. transalpinum, S. paradoxa, T. breviflora, T. rubicunda e Tournefortia sp.), cartáceas (H. filiforme, H. fruticosum, H. polyphyllum, H. salicoides, H. ternatum, Heliotropium sp., T. bicolor, T. candidula (Fig. 2C) , T. gardneri, T. melanochaeta, T. paniculata, T. salicifolia e T. villosa) ou crassas (em H. procumbens (Fig. 2D) e em T. subsessilis (Fig. 2F). As folhas de T. floribunda variaram de membranáceas (Fig. 2B) a cartáceas. A margem pode ser inteira (H. barbatum, H. polyphyllum, H. procumbens (Fig. 2D), Heliotropium sp., S. paradoxa (Fig. 1 A­B), T. candidula (Fig. 2C), T. rubicunda e Tournefortia sp.), crenada a crenulada (H. elongatum (Fig. 2E) e H. indicum), levemente revoluta (H. filiforme) ou revoluta (H. salicoides e H. ternatum). Em H. fruticosum e T. subsessilis (Fig. 2E) as folhas variaram de margem inteira a levemente revoluta. Em H. angiospermum as folhas podem ter
32 33
margem inteira (Fig. 2A) a crenulada (Fig. 1D). Já em H. transalpinum, T. bicolor, T. breviflora, T. floribunda (Fig. 2B), T. gardneri, T. melanochaeta, T. paniculata, T. salicifolia e T. villosa as margens foliares variaram de inteira a levemente sinuosa. Segundo Diane et al. (2003), a superfície foliar em Heliotropioideae pode ser plana ou bulada. Nesse estudo foi encontrado apenas em H. elongatum (Fig. 2E) e em alguns espécimes de H. angiospermum (Fig. 1D) e H. indicum folhas com superfície bulada. Os integrantes da subfamília Heliotropioideae geralmente possuem um denso indumento, sendo raras espécies com folhas glabras (Diane et al. 2003). Todas as espécies estudadas apresentaram tricomas, pelo menos em uma das faces das folhas (Fig. 3A­L; Fig. 4A­M). A face adaxial pode possuir tricomas esparsos [H. angiospermum (Fig. 3A1) e H. indicum (Fig. 3F1], apenas concentrados nas nervuras principal e secundárias [T. villosa (Fig. 4K1)] ou ser glabra [T. subsessilis (Fig. 4 J1)]. Nas demais espécies o indumento na face adaxial pode ser: ­ pubescente [T. floribunda e (Fig. 4 D1)]; ­ serício [H. barbatum, H. filiforme, H. polyphyllum, H. procumbens e S. paradoxa (Fig. 3 B1; D1; G1­H1 e Fig. 4 M1)]; ­ tomentoso [ T. candidula (Fig. 4 C1)]; ­ viloso [T. salicifolia (Fig. 4 I1)]; ­ hirsuto [Tournefortia sp. (Fig. 4 L1)]; ­ híspido [T. bicolor, T. breviflora, T. melanochaeta, T. paniculata e T. rubicunda (Fig. 4 A1­B1; F1­H1)]; ­ estrigoso [H. fruticosum, H. salicoides, H. ternatum, Heliotropium sp., T. gardneri, (Fig. 3 E2; I2­J2; L1 e Fig. 4 B1; E1)]; O indumento na face abaxial das folhas das espécies estudadas podem ser: ­ serício [H. barbatum, H. filiforme, H. polyphyllum e S. paradoxa (Fig. 3 B2; D2; G2; Fig. 4 M2)]; ­ pubescente [T. subsessilis (Fig. 4 J2)]; ­ híspido [T. bicolor (Fig. 4 A2)]; ­ tomentoso [T. candidula e T. floribunda (Fig. 4 C2; C3)]; ­ viloso [T. gardneri , T. salicifolia e T. villosa (Fig. 4 E2; I2; K2)];
34 35
36
­ estrigoso [H. fruticosum, H. salicoides e H. ternatum, T. paniculata, T. rubicunda (Fig. 3 E2; I2; J2; Fig. 4 G2;H2)]; ­ hirsuto [Tournefortia sp. (Fig. 4L2)]; ­ hispidula [T. breviflora (Fig. 4 B2)]. Em H. transalpinum os tricomas são bífidos e concentrados nas nervuras principal e secundárias. Em Heliotropium indicum (face abaxial) e H. elongatum (ambas as faces) foram encontrados tricomas curtos intercalados com tricomas longos, sendo que em H. indicum os tricomas longos são concentrados nas nervuras principal e secundárias. Os tricomas da face abaxial das folhas de H. procumbens possuem base discóide. O indumento na face abaxial das folhas de T. melanochaeta variou de híspido a tomentoso. Heliotropium angiospermum possui, na face abaxial de suas folhas, tricomas concentrados apenas nas nervuras principal e secundárias. Diane et al. (2003) considerou que os caracteres foliares em Heliotropioideae podem ter uma interpretação ecológica. Espécies com folhas lineares a lanceoladas, com margem revoluta e indumento denso seriam propícias ao ambiente semi­árido (Diane et al. 2003). Estas características foliares em associação às condições ambientais citadas também foram encontradas neste estudo, nas espécies H. filiforme, H. salicoides e H. ternatum, que ocorrem em ambientes áridos. 3. Inflorescência Em Heliotropium e Tournefortia as flores são reunidas em cimas escorpióides (Buys & Hilger, 2003). Em Heliotropium as inflorescências podem ser inteiras (Fig. 1D; 2A; 2E) ou bifurcadas (Fig. 2D) e em Tournefortia as inflorescências são sempre ramificadas (Fig.2B), geralmente com mais de três ramos. As flores apresentam­se solitárias apenas em Schleidenia paradoxa (Fig. 1A­E). Em muitas espécies de Boraginaceae, Solanaceae e Polemoniaceae ocorrem fenômenos metatópicos, que é o deslocamento de órgãos por um crescimento diferenciado. Um destes fenômenos é a concaulescência, onde ocorre o afastamento da inflorescência da axila da folha pelo crescimento
37 meristemático intercalar da gema que a originou. Assim, as inflorescências aparecem em posições extra­axilares ou internodais (Weberling, 1992). Em algumas espécies estudadas de Tournefortia as inflorescências aparecem em posição internodal (T. bicolor, T. candidula (Fig. 2C), T. floribunda, T. gardneri, T. melanochaeta, T. subsessilis, T. villosa). Tournefortia breviflora possui inflorescências exclusivamente axilares. As demais espécies estudadas de Tournefortia possuem inflorescências terminais, sendo que podem ou não apresentar ramos axilares e/ou internodais. As espécies que possuem apenas inflorescências terminais são T. paniculata e em T. rubicunda. As que apresentam inflorescências terminais e axilares são: T. gardneri, Tournefortia sp. e, mais raramente, T. melanochaeta e T. salicifolia. As inflorescências em Heliotropium são terminais. Apenas H. fruticosum, H. procumbens e H. ternatum possuem em alguns indivíduos inflorescências axilares, além das terminais. As flores são axilares em Schleidenia paradoxa (Fig. 1A­B). Os cálices das espécies analisadas possuem tubo muito curto e cinco lobos ovais, com ápice agudo (Fig. 5A­Z). Geralmente o cálice não supera o tamanho do tubo da corola, com exceção de T. melanochaeta (Fig. 5S), onde essa estrutura é maior do que a corola. O cálice pode ser acrescente [em H. filiforme, H. fruticosum, H. polyphyllum, H. procumbens , H. salicoides, H. ternatum, T. gardneri e em T. paniculata (Fig. 5 D­E, G­J, R e T)] ou não na frutificação. Comumente a parte acrescente são os lobos do cálice. Entretanto, alguns espécimes de T. gardneri apresentaram tanto cálice com lobos acrescentes, como cálices com tubo acrescente na frutificação (neste caso, cobrindo totalmente o fruto). Em algumas exsicatas desta espécie foram encontrados os dois tipos de cálice citados. A corola pode variar em relação ao tamanho do tubo e em relação à forma e tamanho dos lobos (Fig. 6A­Z). Os lobos das corolas podem ser: ­ obovais: H. angiospermum (Fig. 7 A); ­ ovais: H. barbatum (Fig. 7 B); ­ ovais com ápice agudo: H. fruticosum, H. polyphyllum, H. procumbens , H. salicoides, H. ternatum, H. transalpinum, Heliotropium sp., H. filiforme e em Tournefortia, sendo que em geral os lobos da corola das espécies de Heliotropium são mais largos (Fig. 7 E; G­L; N­Z);
38 ­ rotundos: H. elongatum e H. indicum (Fig. 7 C; F); ­ plicados: S. paradoxa (Fig. 7 M); Heliotropium filiforme têm os lobos da corola ovais, com ápice agudo, porém desiguais entre si em relação ao tamanho (Fig. 7 D). As corolas das espécies de Tournefortia estudadas são geralmente verdes, com ou sem os lobos laranja, podendo ser também brancas (Fig. 1E­F) ou vermelhas (apenas em T. rubicunda). Nas espécies de Heliotropium da Bahia, a corola pode ser: branca ou lilás com fauce amarela (H. angiospermum (Fig. 1D; 2A), H. elongatum (Fig. 2E) e H. indicum); branca com fauce amarela (H. barbatum, H. filiforme, H. polyphyllum (Fig. 1C), H. procumbens (Fig. 2D), H. salicoides e H. ternatum), amarela (H. fruticosum, H. polyphyllum e H. salicoides e Schleidenia paradoxa (Fig. 1A­B) ou totalmente branca (H. transalpinum e Heliotropium sp.). Em campo só foram visualizados espécimes de H. salicoides com corola amarela. Entretanto, em algumas exsicatas foi citada, para a corola desta espécie, a cor branca com fauce amarela e, em apenas uma exsicata, a cor rosa. As anteras podem ser livres (Tournefortia, com exceção de Tournefortia sp.; H. angiospermum, H. elongatum, H. filiforme, H. indicum, H. transalpinum e Heliotropium sp.) ou unidas pelo ápice (sendo denominadas anteras coerentes) nas demais espécies. Podem ser inseridas no terço inferior (H. elongatum, H. polyphyllum, H. salicoides e H. ternatum), no meio (H. filiforme, H. indicum e T. bicolor) ou no terço superior do tubo (H. angiospermum, H. barbatum, H. fruticosum, H. procumbens, H. transalpinum, Heliotropium sp. e Tournefortia, com exceção de T. bicolor). O ovário possui sempre dois carpelos, que em geral apresentam­se divididos por um falso septo. Esta divisão origina um ovário pseudo­tetralocular. O número de óvulos por lóculo varia de 1­2, de acordo com a presença deste falso septo. O estigma (Fig. 8A­Z) pode ser séssil [H. angiospermum, H. barbatum, H. procumbens, H. transalpinum T. bicolor (Fig. 7 A­B; H; N)] ou não, nas demais espécies. A base do estigma é espessa, sendo denominada disco por alguns autores (Silva, 2004).
39 40
41
42
4. Fruto Os frutos das espécies de Heliotropium (Fig. 8A­L) são esquizocárpicos, e podem ter duas ou quatro núculas. As espécies que possuem duas núculas são: H. angiospermum, H. elongatum e H. transalpinum (Fig. 8 A, C e K); as demais espécies (H. barbatum, H. elongatum, H. filiforme, H. fruticosum, H. indicum, H. polyphyllum, H. procumbens, H. salicoides, H. ternatum e Heliotropium sp.) têm quatro núculas (Fig. 8 B, D­J e L). As núculas geralmente separam­se na maturidade, com exceção de H. elongatum e H. transalpinum. O fruto é uma drupa em S. paradoxa e em Tournefortia (Fig. 8M­Z). A cor do fruto de S. paradoxa é verde. Já em Tournefortia, os frutos podem ser verdes (T. bicolor. T. breviflora T. gardneri, T. paniculata, T.salicifolia e Tournefortia sp.), vermelho, laranja ou raramente amarelo (em T. rubicunda) e branco com quatro manchas esféricas pretas (T. floribunda, T. subsessilis e T. villosa). Em uma exsicata foi referida a cor roxa para os frutos de T. melanochaeta, porém em campo só foram vistos frutos com cor verde. Os frutos podem ser glabros [H. elongatum, T. bicolor, T. breviflora, floribunda, T. paniculata, T. rubicunda, T. subsessilis e T. villosa (Fig. 8 C, N­O, Q, T­U, X­Y)] ou com indumento que varia entre pubescente [H. indicum, T. gardneri e T. melanochaeta (Fig. 8 F, R­S)] serício [H. barbatum, H. filiforme, H. polyphyllum, H. procumbens e S. paradoxa (Fig. 8 B, D, G­H e M)] tomentoso [T. candidula ( Fig. 8 P)], hirsuto [Tournefortia sp. (Fig. 8 Z)], híspido [H. salicoides, H. ternatum e Heliotropium sp.(Fig. 8 I­J e L)] estrigoso [H. fruticosum e T. salicifolia (Fig. 8 E e V)] ou verrucoso [H. angiospermum (Fig. 8 A)]. Os frutos de H. transalpinum (Fig. 8 K) são cobertos por tricomas bífidos.
43 44
REFERÊNCIAS BIBLIOGRAFICAS BUYS, M.H. & HILGER, H.H. 2003. Boraginaceae cymes are exclusively scorpioid and not helicoids. Taxon 52: 719­724. DIANE, N.; JACOB. C. & HILGER, H.H. 2003. Leaf anatomy and foliar trichomes in Heliotropiaceae and their systematic relevance. Flora 198: 468­485. HICKEY, L.J. 1973. Classification of the architecture of dicotyledonous leaves. Amer. J. Bot. 60(1): 17­33 p. HICKEY, M. & KING, C. 2002. The Cambridge illustrated glossary of botanical terms. Cambridge University Press. RADFORD, A.E.; DICKISON, W.C.; MASSEY, J.R.; BELL, C.R. et al. 1974. Vascular Plant Systematics. Harper & Row, Pubblishers, 83­166 p. SILVA, L.C. 2004. Estudos taxonômicos das espécies extra­amazônicas de Tournefortia L. (Boraginaceae s.l.). Universidade Estadual Paulista “Julio Mesquita Filho”, Dissertação de Mestrado. WEBERLING, F. 1992. Morphology of flowers and inflorescences. Cambridge, Univ. Press. 216­218 p.
45 CAPÍTULO 2 FLORA DA BAHIA: Boraginaceae I – Heliotropioideae
46 FLORA DA BAHIA: Boraginaceae I – Heliotropioideae (Flora da Bahia: Boraginaceae I – Heliotropioideae) – Este trabalho apresenta o resultado do levantamento da subfamília Heliotropioideae (Boraginaceae Juss.) para o Estado da Bahia. Foram registrados três gêneros e 25 espécies. São apresentados: chaves de identificação, descrições, comentários, ilustrações, fotos e mapa de distribuição das espécies. Palavras­chave: Boraginaceae, Heliotropioideae, flora, Bahia. (Flora of Bahia: Boraginaceae I – Heliotropioideae) – This paper presents a survey of the species of Heliotropioideae in Bahia State. Three genus are listed and 25 species. Descriptions, illustrations, comments, photos, maps and key of the taxa are presented. Key­words: Boraginaceae, Heliotropioideae, flora, Bahia. Boraginaceae Juss. Ervas, subarbustos ou árvores, raramente lianas, raro parasitas de raízes; glabras ou com tricomas com cistólitos ou corpos semelhantes a cistólitos basais e/ou parede calcificadas; alcalóides presentes ou não. Folhas geralmente alternas, raro opostas ou verticiladas, simples, raro fortemente lobadas a compostas; estípulas ausentes. Flores solitárias ou em cimeiras, monóclinas ou díclinas, geralmente actinomorfas, raro assimétricas, gamosépalas, gamopétalas, geralmente pentâmeras; estames geralmente cinco; gineceu súpero, sincárpico, 2­(6­14) carpelar, 1 a muitos óvulos por lóculo, placentação parietal ou axilar, estilete presente ou ausente, ginobásico ou terminal. Fruto drupa, esquizocarpo ou cápsula. A família é distribuída largamente nas regiões tropicais, subtropicais e temperadas, onde ocorre o maior número de táxons (Cronquist, 1981). Os centros de diversidade genética são na zona temperada do hemisfério Norte e nos trópicos (América Central e norte da América do Sul) (Al­Shehbaz, 1991). Possui
47 cerca de 148 gêneros e 2740 espécies, sendo os maiores gêneros: Cordia L. (ca. 320 spp.), Heliotropium L. (ca. 260) e Tournefortia L. (ca. 150) (Judd, 2002). No Brasil ocorrem 12 gêneros com espécies nativas, sendo que cinco deles estão presentes na Bahia (Cordia, Heliotropium, Tournefortia, Rotula Lour. e Schleidenia Endl.) (Barroso, 1991). CANDOLLE, A.P. 1845. Prodromus systematis naturalis regni vegetabilis. Parte 9: 467­563 p. FRESENIUS, G. 1857. Boraginaceae; Heliotropiaceae. In C.F.P. Martius & A.G. Eichler (eds.). Flora Brasiliensis 8(1): 5­58. GÜRKE, M. 1893. Borraginaceae. In: ENGLER, A. & PRANTL, K. (eds.) Die Natürlichen Pflanzenfamilien 4 (3a): 71­131. Chave para as subfamílias 1­ Plantas parasitas de raízes................................................................Lennoideae 1’­ Plantas clorofiladas, nunca parasitas. 2­ Estilete ginobásico........................................................................Boraginoideae 2’­ Estilete terminal. 3­ Óvulos com placentação parietal, fruto capsula loculicida, sementes numerosas (4­
%)..............................................................................................Hydrophyloideae 3’­ Óvulos com placentação axilar, raro apical, fruto drupáceo ou esquizocárpico, sementes 1­4. 4­ Estilete inteiro, estigma capitado...............................................Heliotropioideae 4’­ Estilete 1­2 vezes dividido, estigma clavado ou cilíndrico. 5­ Estigma bífido, cotilédones lisos............................................Ehretioideae 5’­ Estigma duas vezes dividido, cotilédones plicados...............Cordioideae Chave para Heliotropioideae 1­ Erva, flores solitárias, axilares..................................................Schleidenia Endl. 1’­ Subarbustos, arbustos ou lianas, raro árvores, flores reunidas em cimeiras. 2­ Fruto esquizocárpico.........................................................Heliotropium L.
48 2’­ Fruto drupáceo..................................................................Tournefortia L. 1. Heliotropium L. Subarbustos ou arbustos, eretos, decumbentes ou prostrados, anuais ou perenes. Folhas margens inteiras, crenadas a crenuladas ou revolutas, alternas, subopostas a opostas, sésseis ou pecioladas. Inflorescências em cimeiras escorpióides, inteiras ou bifurcadas, raro 3­4 cimas, com ou sem brácteas. Flores cálice 5 lobos iguais ou desiguais entre si; corola tubo cilíndrico, tricomas presentes ou ausentes internamente, branca, amarela ou lilás; estames 5, epipétalos, filete curto ou ausente, anteras livres ou coerentes; estilete presente ou ausente; estigma cônico. Fruto esquizocárpico, 2 ou 4 núculas. Este gênero é representado por cerca de 260 espécies, as quais ocorrem nas regiões tropicais e subtropicais do mundo. No Brasil existem cerca de 25 espécies de Heliotropium L.; destas 12 ocorrem na Bahia, sendo que uma delas (Heliotropium barbatum DC.) é endêmica do Estado. FÖRTHER, H. 1998. Die infragenerische Gliderrung der Gattung Heliotropium L. und ihre Stellung innerhalb der subfam. Heliotropioideae (Schrad.) Arn. (Boraginaceae). Sendtnera 5: 35­241. FRESENIUS, G. 1857. Boraginaceae; Heliotropiaceae. In C.F.P. Martius & A.G. Eichler (eds.). Flora Brasiliensis 8(1): 5­58. JOHNSTON, I.M. 1928. Studies in the Boraginaceae – VII: The South American Species of Heliotropium. Contr. Gray Herb. 81: 3­83. JOHNSTON, I.M. 1935. Studies in the Boraginaceae – X: The Boraginaceae of Northeastern South America. J. Arnold Arbor. 1(16): 1­64.
49 Chave para Heliotropium 1­ Planta coberta por tricomas bífidos, frutos com cavidades laterais............................................................................................H. transalpinum 1’­ Planta sem tricomas bífidos, frutos sem cavidades laterais 2­ Inflorescências com brácteas. 3­ Anteras livres, brácteas ca. 1 C 0,3 mm,..................................H. filiforme 3’­ Anteras coerentes, brácteas 2,5­4,5 C 1­2 mm. 4­ Ritidoma presente, folhas com venação hifódroma. 5­ Folhas margem inteira..................................H. polyphyllum 5’­ Folhas margem revoluta. 6­ Folhas ovais, congestas, estilete 0,8­1,5 mm compr.........................................................H. salicoides 6’­ Folhas elípticas, esparsas, estilete ca. 0,2 mm compr...........................................................H. ternatum 4’­ Ritidoma ausente, folhas com venação eucamptódroma.............................................................H. fruticosum 2’­ Inflorescências sem brácteas. 7­ Anteras coerentes. 8­ Folhas e frutos híspidos, corola totalmente branca.......................................................................Heliotropium sp. 8­ Folhas e frutos serícios, corola branca, fauce amarela. 9­ Face abaxial tricomas com base discóide, flores 3­4,5 mm comp., estigma com tricomas curtos, esparsos......................H. procumbens 9’­ Face abaxial tricomas sem base discóide, flores 6­7,5 mm comp., estigma com tricomas longos, concentrados no ápice.................................................................................H. barbatum 7’­ Anteras livres entre si. 10­ Folhas com tricomas de tamanhos aproximadamente iguais, fruto verrucoso................................................................H. angiospermum 10’­ Folhas com tricomas curtos intercalados com tricomas longos, fruto glabro ou finamente pubescente. 11­ Cálice 1­1,5 mm comp., fruto 2 núculas, conadas, glabro, com estrias verticais............................................H. elongatum
50 11’­ Cálice 2­3,5 mm comp., fruto 4 núculas, divergentes, finamente pubescente..............................................H. indicum
51 1.1. Heliotropium angiospermum Murray, Prodr. Stirp. Gott.: 217. 1770. Heliotropium parviflorum L., Mant. Pl. 2:201. 1771. Heliophytum parviflorum (L.) DC., Prodr. 9: 553. 1845. Heliophytum foetidum DC., Prodr. 9: 553. 1845. Heliotropium foetidum (DC.) Gürke, Nat. Pflanzenfam. 4(3a): 96. 1893 non Salisb. 1796. Fig. 1A; 2 A­G; 3. Nomes populares: balaio­de­velho (Jacobina); crista­de­galo (Campo Formoso, Ipirá, Feira de Santana); crista­de­galo­da­flor­miúda (Castro Alves, Muritiba); erva­ferro (Jacobina). Subarbusto ereto 0,2­1,5 m alt.; caule tricomas brancos, esparsos, ramos maduros sulcados, ritidoma ausente. Folhas alternas, subopostas ou opostas, 1,8­11,2 C 0,5­3,6 cm, membranáceas, verdes, levemente discolores ou discolores, elípticas ou ovais, ápice acuminado, base oblíqua, atenuada, margem inteira a crenulada, ciliada, tricomas brancos, superfície plana a bulada, face adaxial tricomas esparsos, face abaxial tricomas concentrados nas nervuras principal e secundárias, venação broquidódroma; pecíolo 0,2­1,5 cm compr., ca. 0,5 mm espessura, tomentoso, tricomas brancos. Inflorescências terminais, inteira ou bifurcada, brácteas ausentes. Flores 2,5­4 mm compr., sésseis; cálice verde, lobos ovais, ápice agudo 1­2 mm compr., tomentoso externamente e internamente, margem ciliada; corola branca ou lilás, fauce amarela, tubo 1,5­2,5
C 1 mm, pubescente externamente e internamente, no terço superior do tubo, tricomas brancos, lobos 1­1,5 mm compr., obovais; anteras sésseis ovais, ápice agudo, livres, inseridas no terço superior do tubo; ovário ca. 0,5 mm compr., estigma séssil, ca. 1 mm, capitado, com tricomas longos, esparsos. Frutos núculas 2, subglobosas, 1,5­2 C 2,5­3 mm, verrucosas, imaturo verde, maduro marrom; sementes 4. Sul dos Estados Unidos, México, América Central, Antilhas, Chile e Brasil (Alagoas, Bahia, Ceará, Paraíba, Pernambuco, Rio de Janeiro, Sergipe). B7, B9, C7, C8, D7, D6, E6, D8, D9, E8, E9, F4, F5, F6, F7, G5, G6, G7: caatinga, dunas, bordas e interiores de matas, vegetações ciliares, margens de lagoas, beira de
52 estradas e encostas de "inselbergs", em solos arenosos, com ou sem afloramentos rochosos, ou argilosos, seco ou encharcado. A espécie floresce e frutifica durante todo o ano. Materiais examinados: Boa Nova, mar.1977, Shepherd et al. 4488 (MBM); Brumado, abr.2005, Conceição et al. 222 (HUEFS); Caetité, abr.2005, Conceição et al. 200 (HUEFS); Feira de Santana, set.2004, Conceição et al. 26 (HUEFS); Jacobina, jul.1996, Harley et al. in PCD 3406 (CEPEC, HUEFS); Jequié, fev.2003, F. França et al. 4346 (HUEFS); João Dourado, mai.2004, Silva 219 (HUEFS); Juazeiro, out.1967, Duarte et al. 10553 (HB, RB); Lagoa Real, fev.2003, França et al. 4673 (HUEFS); Morro do Chapéu, jan.2005, Conceição et al. 119 (HUEFS); Paulo Afonso, ago.2005, Miranda et al. 858 (HUEFS); Pindaí, jan.1997, Hatschbach et al. 65783 (MBM); São Félix do Coribe, abr.2005, Conceição et al. 196 (HUEFS); Senhor do Bomfim, out.2005, Conceição et al. 285 (HUEFS); Serrinha, mar.2005, Conceição et al. 126 (HUEFS); Souto Soares, mai.1980, Harley et al. 22135 (SPF); Tucano, jan.2006, Queiroz et al. 9022 (HUEFS); Vitória da Conquista, s/data, Santos et al. 24354 (HB). Os materiais examinados de Heliotropium angiospermum mostraram a ocorrência de variação nas folhas, sendo que os espécimes coletados em ambientes secos apresentaram folhas menores (1,8­6,3 C 0,5­1,8 cm) e com nervuras mais proeminentes do que as dos espécimes coletados em locais úmidos, que apresentaram folhas maiores (7,2­11,2 C 2,1­3,6 cm). Os espécimes que possuem folhas maiores, sem nervuras proeminentes, se assemelham vegetativamente com os espécimes analisados de H. transalpinum, que também possuem folhas elípticas, membranáceas e de dimensões parecidas. Entretanto, H. angiospermum pode ser facilmente distinta destas e das demais espécies de Heliotropium encontradas na Bahia, por ser a única a apresentar frutos com pericarpo verrucoso. Na ausência de frutos, H. angiospermum pode ser separado de H. transalpinum com base na presença de tricomas bífidos, que são encontrados apenas em H. transalpinum. Os sinônimos listados para Heliotropium angiospermum seguem Förther (1998). Este autor ainda citou como sinônimos de H. angiospermum as espécies Heliophytum odorum Fresen. e Heliophytum crispulum Fresen., publicadas na
53 “Flora Brasiliensis”, e descritas com materiais provenientes do Estado de Minas Gerais.
54 55
56
Fig. 3. Mapa de distribuição geográfica de Heliotropium angiospermum, H. barbatum e H. elongatum.
57 1.2. Heliotropium barbatum DC., Prodr. 9: 541. 1845. Schleidenia barbata (DC.) Fresen., Fl. Bras. 8(1): 43. 1857. Fig. 1B; 2 H­N; 3. Subarbusto ereto ou prostrado, até 0,3 m alt.; caule tricomas brancos, esparsos, flexíveis, ramos maduros levemente sulcados, ritidoma ausente. Folhas alternas, subopostas ou opostas, 0,7­2,6 C 0,2­0,7 cm, membranáceas, verdes, concolores ou levemente discolores, oboval ou elíptica, raro oval, ápice acuminado, base atenuada, margem inteira, serício, tricomas brancos, superfície plana, face adaxial tricomas esparsos ou densos, face abaxial tricomas densos, venação hifódroma; pecíolo 0,1­0,4 cm compr., ca. 0,5 mm espessura, serício, tricomas brancos. Inflorescências terminais, inteira ou bifurcada, brácteas ausentes. Flores 6­7,5 mm compr., sésseis; cálice verde, lobos ovais, ápice agudo, 3­3,5 mm compr., serício externamente; corola branca, fauce amarela, tubo 4­5 C 1 mm, serício externamente e internamente, no terço superior do tubo, tricomas brancos, lobos 2­2,5 mm compr., lobos ovais; anteras sésseis, ovais, ápice agudo, ápice pubescente, coerentes, inseridas no terço superior do tubo; ovário ca. 0,5 mm compr., estigma séssil, ca. 0,5 mm, cônico, ápice com tricomas longos, concentrados. Frutos núculas 4, subglobosas, 1­1,5 C 1,5­2 mm, serício, imaturo verde; sementes 4. Brasil (Bahia). C5, C6, D6, F6: caatinga, em solo úmido ou vegetação aquática. A espécie floresce e frutifica nos meses de fevereiro a abril e novembro a dezembro. Materiais examinados: Dom Basílio, dez.1989, Carvalho et al. 2683 (SP); Jacobina, mar.2004, Stapf et al. 243 (HUEFS); Morro do Chapéu, mai.2003, Junqueira et al. 207 (HUEFS); Xique­Xique, fev.1977, Harley et al. 19076 (CEPEC, HUEFS, RB). O material tipo de Heliotropium barbatum (Blanchet 2726) é procedente da Serra Jacobina. A fotografia do isótipo depositado no K e o opus princeps da
58 espécie foram obtidas, o que teve grande contribuição para identificação desta espécie. Heliotropium barbatum é vegetativamente muito semelhante a H. procumbens. No entanto, estas espécies diferenciam­se porque H. barbatum possui flores de 6­7,5 mm compr. e estigma com tricomas longos concentrados no ápice, enquanto H. procumbens apresenta flores de 3­4,5 mm compr. e estigma com tricomas curtos esparsos. A presença do estigma com tal característica faz com que H. barbatum seja distinguida das demais espécies estudadas, sendo assim de fácil reconhecimento.
59 1.3. Heliotropium elongatum (Lehm.) I.M.Johnst., Contr. Gray Herb. 81: 18. 1928. Basiônimo: Tiaridium elongatum Lehm., Asperif. nucif. 14. 1818. Heliophytum elongatum (Lehm.) DC., Prodr. 9: 555. 1845. Fig. 1C; 3; 4 A­G. Nome popular: crista­de­galo (Canudos, Casa Nova, Cruz das Almas, Feira de Santana, São Felipe). Subarbusto prostrado ou ereto, 0,4­1,0m alt.; caule sulcado, hirsuto, tricomas brancos, ritidoma ausente. Folhas alternas ou subopostas, 2,5­12,3 C
1,2­5,9 cm, membranáceas, verdes, levemente discolores ou discolores, ovais ou cordiformes, ápice agudo, base oblíqua, atenuada ou cordada, margem crenulada, superfície bulada, pubescente, tricomas curtos abundantes, tricomas longos esparsos, brancos, venação reticulódroma; pecíolo 0,5­5,4 cm compr., ca. 2 mm espessura, parcialmente alado, hirsuto, tricomas brancos. Inflorescências terminais, inteira, brácteas ausentes. Flores 5­6 mm compr., sésseis, cálice verde, lobos lanceolados, 1­1,5 mm compr., hirsuto; corola branca ou lilás, fauce amarela, tubo 4­5 C 1 mm, pubescente externamente e internamente, no terço médio do tubo, tricomas brancos, lobos ca. 1 mm compr., lobos rotundos; estames filete ca. 0,1 mm, anteras ovais, ápice agudo, livres, inseridas na metade inferior do tubo; ovário 0,3­0,4 mm compr., estilete cilíndrico, ca. 0,2 mm, estigma ca. 0,3 mm, capitado, glabro. Frutos núculas 2, conadas, com estrias verticais, ápice denticulado, 2­5 C 1,5­3,5 mm, glabras, verdes; sementes 4. Argentina, Bolívia, Paraguai, Uruguai e Brasil (Bahia, Ceará, Goiás, Maranhão, Mato Grosso, Mato Grosso do Sul, Minas Gerais, Paraíba, Pernambuco, Piauí, Rio Grande do Norte, Rio de Janeiro, São Paulo, Sergipe e Rio Grande do Sul). B6, B7, B8, B9, C7, C8, E8, E9, E10, F5, F6, G7, I8: caatinga, cerrado, borda de mata, margem de lagoas, beira de estrada, áreas antropizadas, em solo arenoso, com afloramentos rochosos, argiloso ou em arenito vermelho. Foram observados materiais com flores e frutos coletados nos meses de junho, julho e de setembro a março.
60 Heliotropium elongatum é utilizada na medicina popular pela suas características adstringente, diurética, e antiasmática. Suas raízes e folhas são empregadas popularmente na cura do antraz, icterícia, afecções no fígado, baço ou bexiga, inflamações no ânus e úlceras de origem sifilítica. Já suas flores são utilizadas no tratamento de resfriados (Corrêa, 1926). Materiais examinados: Caetité, mar.1994, Souza et al. 5399 (SPF); Canudos, jun.2003, Silva et al. 413 (HUEFS); Casa Nova, out.2004, Queiroz et al. 9647 (HUEFS); Feira da Santana, jul.2002, Santos et al. 27 (HUEFS); Juazeiro, dez.1922, Porto 1438 (RB); Mata de São João, nov.2005, Conceição et al. 424 (HUEFS); Milagres, jun.2003, Hatschbach et al. 75775 (MBM); Paulo Afonso, nov.2005, França et al. 5324 (HUEFS); Rio de Contas, nov.1998, Silva et al. 177 (HUEFS); Santa Cruz Cabrália, dez.2005, Nunes et al. 1423 (HUEFS); Senhor do Bomfim, out.2005, Conceição et al. 286 (HUEFS); Vitória da Conquista, nov.1988, Wanderley et al. 1642 (SP). Heliotropium elongatum é uma espécie que muitas vezes é confundida com Heliotropium indicum, sendo que estas espécies algumas vezes ocorrem simpatricamente. No entanto, H. elongatum distingue­se de H. indicum principalmente pelo fruto, o qual possui núculas conadas e com estrias verticais em H. elongatum e núculas divergentes, sem presença de estrias em H. indicum. Johnston (1928) reconheceu, com base no comprimento do tubo e lobos da corola, duas variedades para esta espécie: Heliotropium elongatum var. genuina I.M.Johnst. (tubo 3­4,5 mm compr. e lobos 2­3 mm compr.) e Heliotropium elongatum var. burchellii I.M.Johnst. (tubo 5­7 mm compr. e lobos 7­10 mm compr.). Heliotropium elongatum var. genuina teria ocorrência no Uruguai, Argentina, Paraguai, Bolívia e Brasil (Bahia, Ceará e Minas Gerais) e H. elongatum var. burchellii ocorreria apenas no Brasil, no Estado de Goiás. Ao analisar os espécimes de H. elongatum, não foi encontrada essa correlação entre o tamanho do tubo e dos lobos da corola. Por esse motivo, as variedades não foram adotadas neste trabalho. Hoffmansegg, no exemplar Herb. Willd. n.115, manuscreveu o binômio Heliotropium elongatum. Roemer & Schultes (1819 apud Förther 1998) trataram esta espécie como Tiaridium elongatum, e listaram como sinônimo o nome
61 Heliotropium elongatum dado por Hoffmansegg. Johnston (1928) considerou como autor de H. elongatum Hoffm. ex Roem. & Schult. No entanto, quem fez essa combinação e a publicou pela primeira vez foi o próprio Johnston, em 1928 (Förther, 1998; Melo & Sales, 2004). Os sinônimos listados para H. elongatum seguem Förther (1998).
62 63
1.4. Heliotropium filiforme Lehm., Gött. Gel. Anz. 3(152): 1515. 1817. Heliotropium filiforme Humb., Bonpl. & Kunth, Nov. gen. sp. 3: 86. 1818 non Lehm. 1817. Schleidenia filiformis Fresen., Fl. bras. 8(1): 40. 1857. Fig. 4 H­Q; 5. Subarbusto ereto ou decumbente, 0,1­0,25 m alt.; caule ramos jovens serícios, tricomas brancos ou ferrugíneos, ritidoma ausente. Folhas alternas, subopostas ou opostas, 0,5­1,9 C 0,1­0,3 cm, cartácea, verdes, concolores, elípticas, ápice e base agudos, margem levemente revoluta, superfície plana, serício, tricomas ferrugíneos, venação hifódroma; pecíolo 0,1­0,3 cm compr., ca. 0,5 mm espessura, serício, tricomas ferrugíneos. Inflorescências terminais, inteira ou bifurcada, brácteas ovais, ápice agudo, ca. 1 C 0,3 mm. Flores pedicelo ca. 0,5 mm; cálice verde, lobos ovais, ápice agudo, desiguais entre si, ca. 1,5 mm compr., maiores ca. 1 mm diâm., menores ca. 0,5 mm diâm., acrescente, ca. 3 mm compr., serícios; corola branca, fauce amarela, tubo ca. 1,5 C 1 mm, serício externamente, tricomas brancos, lobos desiguais entre si, maiores ca. 0,5 mm compr., menores ca. 0,3 mm compr., lobos ovais, ápice agudo; anteras sésseis, ovais, ápice agudo, livres, inseridas no terço médio do tubo; ovário ca. 0,3 mm compr., estilete 0,1­0,2 mm compr., estigma 0,2­0,3 mm compr., capitado. Fruto núculas 4, subglobosas, 1­1,5 C 1,5­2 mm, serício, imaturo verde, maduro marrom; sementes 4. Argentina, Bolívia, Guianas, Honduras, Paraguai, Trindade, Venezuela e Brasil (Amazonas, Bahia, Goiás, Mato Grosso, Minas Gerais, Pará, Rio de Janeiro, Tocantins). C6, F5, I8: caatinga, mata atlântica, em beira de estrada, lagoa temporária. A espécie floresce e frutifica em março e em dezembro. Materiais examinados: Caetité, mar.1994, Souza et al. 5386 (HUEFS); Jacobina, dez.1984, Furlan et al. in CFCR 7485 (SPF); Santa Cruz Cabrália, dez.2005, Nunes et al. 1424 (HUEFS).
64 Esta espécie assemelha­se a Heliotropium polyphyllum por possuir lobos do cálice desiguais entre si e pela presença de folhas de margem plana associada a presença de brácteas. Entretanto, H. filiforme distingue­se desta espécie e das demais por apresentar folhas e brácteas estreitamente elípticas, sendo as brácteas inconspícuas. Na “Flora Brasiliensis” esta espécie foi tratada por Schleidenia filiformis (Humb., Bonpl. & Kunth) Fresen. Este nome baseou­se em um homônimo posterior, visto que H. filiforme já tinha sido publicado anteriormente pelo Lehmann. O artigo 58 do Código Internacional de Nomenclatura Botânica (2007) diz que o epíteto em um nome ilegítimo pode ser usado, se disponível, numa combinação diferente, se nenhum epíteto de um nome que tiver prioridade naquele nível estiver disponível. O nome resultante dessa combinação é tratado como um nome novo, portanto, a autoria de Schleidenia filiformis é de Fresenius(1857). Os sinônimos listados para H. filiforme seguem Förther (1998). A espécie S. stenostachya Fresen., descrita na “Flora Brasiliensis” para a Paraíba, também foi citada por este autor como sinônimo de H. filiforme.
65 Fig. 5. Mapa de distribuição geográfica de Heliotropium filiforme, H. fruticosum e H. indicum.
66 1.5. Heliotropium fruticosum L., Syst. Nat. Ed.10 (2): 913. 1759. Schleidenia dasycarpa Fresen., Fl. Bras. 8(1): 37. 1857. Fig. 5; 6 A­H. Subarbusto decumbente 0,3­0,4 m alt.; caule estrigoso, tricomas brancos, ritidoma ausente. Folhas alternas, 1,1­2,7 C 0,2­0,9 cm, cartáceas, verdes, levemente discolores, elípticas, ápice e base agudas, margem inteira a levemente revoluta, ciliada, superfície plana, estrigoso, tricomas brancos, venação eucamptódroma; pecíolo 1­2,5 mm compr., ca. 0,5 mm espessura, tomentoso, tricomas brancos. Inflorescências terminais, inteira ou bifurcada, brácteas foliáceas, ovais, ápice agudo, 3­4,5 C 1­2 m. Flores pedicelo 0,5­1 mm; cálice verde, lobos ovais, ápice agudo, 3,5­4,5 mm compr., acrescente na frutificação, até 5,5 mm, estrigoso externamente; corola amarela, tubo 4­5 C 1 mm, estrigoso externamente e internamente, tricomas brancos, lobos 1­1,5 mm compr., ovais, ápice agudo; estames filete ca. 0,2 mm, anteras ovais, ápice agudo, coerentes, inseridas no terço superior do tubo; ovário 0,5­0,7 mm compr., estilete ca. 0,8 mm, estigma ca. 1 mm, capitado. Frutos núculas 4, subglobosos, estrigoso, 1­1,5 C 1,5­2 mm, imaturo verde, maduro marrom; sementes 4. Sul dos Estados Unidos, Antilhas, Argentina, Venezuela, Colômbia e Brasil (Bahia, Goiás, Piauí e São Paulo). E6, F4, F5: cerrado, em beira de estrada e caatinga com brejo e lagoa temporária. A espécie floresce e frutifica em fevereiro e em abril e em dezembro. Materiais examinados: Bom Jesus da Lapa, fev.2000, Queiroz et al. 5779 (HUEFS); Caetité, abr.2005, Conceição et al. 199 (HUEFS); Palmeiras, dez.2002, França et al. 3949 (HUEFS). Heliotropium fruticosum é uma espécie muito semelhante a Heliotropium salicoides, pelas flores de corola amarela e a margem foliar que às vezes se apresenta revoluta em H. fruticosum. Tais espécies separam­se porque H. fruticosum possui folhas elípticas e brácteas maiores (3­4,5 C 1­2 mm) com
67 aspecto foliáceo, enquanto H. salicoides possui folhas ovais e brácteas menores (2­3 C 1­1,5 mm), sem aspecto foliáceo. Schleidenia dasycarpa foi descrita por Fresenius, em 1857, na “Flora Brasiliensis”, sendo o material tipo procedente da Bahia. Tal espécie foi listada por Förther (1998) como sinônimo de Heliotropium fruticosum.
68 69
1.6. Heliotropium indicum L., Sp. Pl. 1: 130. 1753. Heliophytum indicum (L.) DC., Prodr. 9: 556. 1845. Fig. 1D; 5; 6 I­P. Nomes populares: bico­de­galo (Ilhéus); borragem brava (Cachoeira); crista­de­ galo (Amélia Rodrigues, Cachoeira, Itabuna, Itaetê, Rodelas, Salvador, Simões Filho, Uruçuca); cravo­de­urubu (Cachoeira); crista­de­peru (Conde). Subarbusto ereto 0,5­1,0 m alt.; caule hirsuto, tricomas brancos, ramos jovens sulcados. Folhas alternas, subopostas ou opostas, 3,2­22,0 C 1,2­10,5 cm, membranáceas, verdes, discolores, ovais ou elípticas, ápice agudo, base atenuada, margem crenada a crenulada, superfície plana a bulada, face adaxial tricomas brancos, esparsos, face abaxial tricomas brancos, tricomas curtos intercalados com os tricomas longos, concentrados nas nervuras principal e secundárias, venação broquidódroma; pecíolo 0,8­5,8 cm compr., ca. 1 mm espessura, tomentoso, tricomas brancos. Inflorescências terminais, inteira ou bifurcada, brácteas ausentes. Flores sésseis, cálice verde, lobos ovais, ápice agudo, 2­3,5 mm compr., pubescente externamente; corola branca ou lilás, fauce amarela, tubo 4­6 C 1,5 mm, pubescente externamente, tricomas brancos, lobos 1,5­2 mm compr., lobos rotundos; anteras sésseis, ovais, ápice agudo, livres, inseridas no terço médio do tubo; ovário ca. 0,3 mm compr., 4­lobado, estilete 0,4­ 0,6 mm compr., estigma 0,2­0,3 mm compr., capitado. Frutos núculas 4, subglobosas, pubescentes, ápices divergentes, 2­4 C 3,5­7 mm, verde; sementes 4. Cosmopolita. Brasil (Acre, Alagoas, Amazonas, Bahia, Ceará, Espírito Santo, Goiás, Maranhão, Mato Grosso, Mato Grosso do Sul, Minas Gerais, Pará, Paraná, Pernambuco, Rio de Janeiro, São Paulo, Tocantins). B9, D4, D10, E6, E8, E9, F9, G6, G8, H8, I9: caatinga, restinga, beira de estrada, margem de rios e em áreas antropizadas em geral. A espécie floresce e frutifica durante todo o ano. As folhas de Heliotropium indicum são utilizadas popularmente em Uruçuca (BA) para o tratamento da gripe, na forma de chá ou xarope, também chamado de
70 “lambedor” (M.B. Jogaib et al. 93). Também em Amélia Rodrigues é tida como planta medicinal, sem indicação de uso específico (D.L. Santana et al. 33). A espécie é utilizada para tratamento de algumas doenças de pele, de aftas, úlceras, furúnculos, faringites, estomatites, antrazes, hemorróidas, entre outras (Corrêa, 1926; Cruz, 1995). A planta também é utilizada em queimaduras (Corrêa, 1926) e em banhos contra reumatismo articular, no Litoral Norte da Bahia (Corrêa, 1931). Materiais examinados: Belmonte, mar.1974, Harley 17447 (CEPEC, RB); Brumado, fev.1990, Miranda et al. 99 (HRB); Conde, mar.1996, Ferreira et al. 867 (RB); Ibotirama, out.1981, Hatschbach 44164 (CEPEC, MBM); Ilhéus, jun.1981, Hage 975 (CEPEC, HUEFS, RB); Itabuna, dez.1982, Ferreira 232 (HRB); Lençóis, jun.1996, França et al. 1654 (HRB, HUEFS); Rodelas, jan.1987, Silva et al. 46 (HRB); São Felipe, abr.2006, Conceição et al. 488 (HUEFS); São Sebastião do Passé, nov.2005, Conceição et al. 426 (HUEFS); Salvador, set.2004, Queiroz et al. 1498 (HRB). Heliotropium indicum é uma espécie amplamente distribuída, sendo que o epíteto específico, segundo Smith (1970), provém da Índia, país de onde procedeu o tipo. A espécie assemelha­se muito a H. elongatum, diferindo­se pelo ovário o qual é falsamente 4­locular em H. indicum e bilocular em H. elongatum e principalmente pelo fruto, o qual possui núculas divergentes em H. indicum e conadas em H. elongatum. Melo & Sales (2004) afirmaram que a superfície das folhas de H. indicum são planas. Contudo, os espécimes de H. indicum analisados nesse estudo apresentaram folhas com superfície foliar variando de plana a bulada.
71 1.7. Heliotropium polyphyllum Lehm., Neue Schrift. Naturf. Ges. Halle 3(2). 1817. Heliotropium bahiensis DC., Prodr. 9: 544. 1845. Schleidenia bahiensis (DC.) Fresen., Fl. Bras. 8(1): 37. 1857. S. polyphylla (Lehm.) Fresen., Fl. Bras. 8(1): 36. 1857. Fig. 1E; 7 A­I; 8. Subarbusto prostrado ou decumbente, 0,1­0,6 m alt.; caule ramos jovens serícios, tricomas brancos, maduros ritidoma presente. Folhas alternas, 0,5­1,9 C
0,2­0,4 cm, cartáceas, verdes, concolores, elípticas a ovais, ápice agudo, base aguda ou obtusa, margem inteira, superfície plana, serício, tricomas esparsos a densos, brancos, venação hifódroma; pecíolo 0,5­2 mm compr., ca. 0,2 mm espessura, serício, tricomas ferrugíneos. Inflorescências terminais, inteira ou bifurcada, brácteas ovais, 2,5­4 C 1­1,5 mm. Flores pedicelo ca. 0,5 mm; cálice verde, lobos ovais, ápice agudo, desiguais entre si, maiores 3­4 mm compr., menores 2­2,5 mm diâm., acrescente, até 8 mm compr., serícios; corola amarela ou branca com fauce amarela, tubo 3,5 C 4,5 mm, serício externamente e internamente, no terço superior do tubo, tricomas brancos, lobos 2­3,5 mm compr., lobos ovais, ápice agudo; anteras sésseis, ovais, ápice agudo, coerentes, inseridas no terço inferior do tubo, coerentes; ovário ca. 0,5 mm comp., estilete 0,2­0,3 mm compr., estigma 0,3­0,4 mm compr., capitado, pubescente. Fruto núculas 4, subglobosas, serício, 1­1,5 C 1,5­2 mm, imaturo verde, maduro marrom; sementes 4. Américas do Norte, Central e do Sul, incluindo Antilhas e Brasil (Bahia, Ceará, Maranhão, Minas Gerais, Pará, Pernambuco, Rio de Janeiro e Rio Grande do Norte). B5, C5, D4, D10, E9: restinga ou caatinga, em solo arenoso. A espécie floresce e frutifica durante todo o ano. Materiais examinados: Camaçari, mai.1998, Gomes 1 (HUEFS); Conde, nov.2005, Conceição et al. 381 (HUEFS); Mucugê, mar.2006, Queiroz et al. 12183 (HUEFS); Remanso, out.2004, Queiroz et al. 9669 (HUEFS); Xique­Xique, nov.1984, Noblick 3466 (HUEFS).
72 Heliotropium polyphyllum foi encontrada sempre associada a substrato arenoso, tanto no litoral, em restinga quanto na caatinga. Foi observada uma variação na coloração da corola, sendo que os espécimes coletados no litoral apresentaram corola branca com fauce amarela, enquanto alguns espécimes coletados no interior apresentaram corola totalmente amarela. Esta espécie pode ser confundida com Schleidenia paradoxa (Mart.) DC., porque alguns indivíduos de H. polyphyllum compartilham as seguintes características com tal espécie: hábito prostrado, flores amarelas e ocorrência em áreas de caatinga com substrato arenoso. Entretanto, distinguem­se por apresentar flores reunidas em inflorescências terminais, ao contrário de S. paradoxa, que possui flores solitárias e axilares. Candolle (1845) publicou uma nova variedade para esta espécie, H. polyphyllum var. blanchettii DC., sendo o tipo desta variedade procedente da Serra Jacobina, Bahia. O opus princeps e a foto do isótipo desta variedade, o qual está depositado no herbário NY (Blanchet 2651) foram consultadas, o que contribuiu para identificação da espécie. Entretanto, como não foram consultados os tipos das demais variedades (H. polyphyllum Lehm. var. polyphyllum e H. polyphyllum var. horizontale (Small) R.W. Long.), optamos por não considerar as variedades neste trabalho. Os sinônimos relacionados e o nome das variedades válidas seguem Förther (1998). O autor considerou Schleidenia pubescens Fresen. e S. linifolia (A. St.­Hil.) DC. como sinônimos de H. polyphyllum var. blanchettii. Estas espécies também estão na “Flora Brasiliensis”, porém não foram citadas para a Bahia.
73 74
Fig. 8. Mapa de distribuição geográfica de Heliotropium polyphyllum, H. procumbens e H. salicoides.
75 1.8. Heliotropium procumbens Mill., Gard. Dict. Ed. 8:10. 1768. Schleidenia eliptica Fresen., Fl. Bras. 8(1): 42. 1857. S. leptostachya Fresen., Fl. Bras. 8(1): 43. 1857. Fig. 1E; 7 J­P; 8. Nomes populares: azulão (s/ localidade especificada), crista­de­galo­pequeno, moto­de­lagoa (Barro Alto), crista­de­galinha (Ipirá), meloria (Morro do Chapéu). Subarbusto ereto ou prostrado, até 5­40 cm alt.; caule serício, tricomas brancos, base discóide. Folhas alternas, 0,8­5,8 C 0,4­1,7 cm, ligeiramente crassas, verdes, concolores ou levemente discolores, elíptica ou oboval, ápice acuminado, base atenuada, margem inteira, superfície plana, face adaxial serício, face abaxial tricomas com base discóide, brancos, venação eucamptódroma; pecíolo 0,3­1,6 cm compr., ca. 0,5 mm espessura, serício, tricomas brancos. Inflorescências terminais ou axilares, inteira ou bifurcada, brácteas ausentes. Flores 3­4,5 mm compr., pedicelo 0,5­1 mm compr.; cálice verde, lobos ovais, ápice agudo, 1­1,5 mm compr., acrescente na frutificação, até 2,5 mm, serício externamente; corola branca, fauce amarela, tubo 1­2 C 1 mm, serício externamente e internamente, no terço superior do tubo, tricomas brancos, lobos 2­2,5 mm compr., lobos ovais, ápice agudo; anteras sésseis, ovais, ápice agudo, coerentes, inseridas no terço superior do tubo; ovário ca. 0,5 mm compr., estigma séssil, ca. 0,5 mm, cônico, com tricomas curtos, esparsos. Frutos núculas 4, subglobosas, serício, 1­1,5 C 1,5­2 mm, imaturo verde; sementes 4. Sul dos Estados Unidos, América Central, Antilhas, Argentina, Bolívia, Paraguai, Uruguai, Guiana, Venezuela, Colômbia, Equador, Peru, Chile e Brasil (Amazonas, Bahia, Ceará, Goiás, Mato Grosso, Mato Grosso do Sul, Minas Gerais, Pará, Paraíba, Pernambuco, Piauí, Rio de Janeiro, Rio Grande do Sul, Santa Catarina, São Paulo). B6, B7, B9, C5, C7, D6, D7, D9, E6, E8, E9, F4, F6, F7, F8, G4, G5, G6, G7, H7, H8, I8: caatinga, cerrado, beira de estrada, manguezal degradado, em rio ou lagoa (na margem ou emersa), entre rochas em e áreas perturbadas em geral, em solo úmido, arenoso ou argiloso, com ou sem cobertura rochosa e laterita. A espécie floresce e frutifica durante todo o ano.
76 Foi citado o uso da espécie como forragem para o gado, em Barro Alto (T.S. Nunes et al. 303). Materiais examinados: Barro Alto, abr.2001, Nunes et al. 303 (HUEFS); Brumado, abr.2005, Conceição et al. 221 (HUEFS); Casa Nova, fev.2004, Queiroz et al. 9068 (HUEFS); Feira de Santana, jun.2005, Conceição et al. 233 (HUEFS); Jaguarari, jul.2004, Carneiro­Torres et al. 373 (HUEFS); Jequié, fev.2003, França et al. 4345 (HUEFS); Lençóis, ago.2005, Conceição et al. 268 (HUEFS); Licínio de Almeida, nov.2006, Silva et al. 243 (HUEFS); Malhada, abr.2001, Jardim et al. 3379 (ALCB, HUEFS); Salvador, mai.2002, Alves et al. 434 (ALCB); Santa Cruz Cabrália, dez.2005, Nunes et al. 1422 (HUEFS); Senhor do Bonfim, out.2005, Conceição et al. 372 (HUEFS); Serra do Ramalho, abr.2004, Jardim et al. 3456 (HUEFS); Paulo Afonso, nov.2005, França et al. 5331 (HUEFS); Pilão Arcado, nov.2005, Conceição et al. 1583 (HUEFS). Heliotropium procumbens pode ser facilmente identificado pelo tamanho diminuto de suas flores (3­4,5 mm), de corola branca e fauce amarela e pelas folhas ligeiramente crassas. Pode ser confundida com H. barbatum, diferindo­se, no entanto, principalmente pelas dimensões florais, que são superiores nesta espécie (6­7,5 mm). O epíteto específico, segundo Smith (1970), provém do hábito reclinado da planta. Os sinônimos listados seguem Förther (1998). Duas outras espécies da “Flora Brasiliensis” (S. longipetiolata Fresen. e S. inundata (Sw.) Fresen., descritas com materiais procedentes, respectivamente, de Goiás e do Pará) foram consideradas como sinônimos de H. procumbens por Förther (1998).
77 1.9. Heliotropium salicoides Cham., Linnaea 8: 117. 1833. Schleidenia glomerata (A.DC.) Fresen., Fl. Bras. 8(1): 39. 1857. Heliotropium strictissimum A.DC., Prod. 9: 544. 1845. Heliotropium strictissimum Moric., Pl. nouv. Amer. 146: tab. 87. 1847. non A.DC. 1845. S. strictissima (A.DC.) Fresen., Fl. Bras. 8(1): 39. 1857. Fig. 8; 9 A; 10 A­I. Nome popular: crista­de­galo (Morro do Chapéu). Subarbusto ereto ou prostrado, 0,1­1,0 m alt.; caule híspido, tricomas brancos, ritidoma presente. Folhas alternas, 0,3­2,2 C 0,2­0,7 cm, cartáceas, verdes, levemente discolores, ovais, ápice agudos, base obtusa, margem revoluta, superfície plana, estrigoso, tricomas brancos, venação hifódroma; sésseis ou curto pecioladas, pecíolo até 0,1 cm compr., ca. 0,5 mm espessura, híspido, tricomas brancos. Inflorescências terminais, inteiras, brácteas ovais, ápice agudo, 2­3 C 1­1,5 mm. Flores pedicelo ca. 0,5 mm compr.; cálice verde, lobos ovais, ápice agudo, 3­5 mm comp., externamente híspido, acrescente na frutificação, até 7 mm; corola amarela, raro rosa ou branca com fauce amarela, tubo 6­7 C 1,5­2 mm, híspido externamente, tricomas brancos, lobos 1,5­2,5 mm compr., lobos ovais, ápice agudo; anteras sésseis, ovais, ápice agudo, coerentes, inseridas no terço inferior tubo; ovário ca. 0,5 mm comp., estilete 0,7­1 mm compr., estigma 0,8­1,5 mm compr., capitado, base estigmática espessa, ápice 4­ lobado. Frutos núculas 4, subglobosas, híspido, 1­1,5 C 1,5­2 mm, imaturo verde, maduro marrom; sementes 4. Argentina, Bolívia, Colômbia, Paraguai e Brasil (Bahia, Goiás, Mato Grosso e Minas Gerais). C6, C8, D6, D7, D10, E6, E9, F6, G3: caatinga, campo rupestre, cerrado, em solo argiloso ou arenoso, com ou sem afloramentos rochosos. A espécie floresce e frutifica durante todo o ano. Materiais examinados: Alagoinhas, jan.2002, França et al. 3213 (HUEFS); Bela Vista, mar.2004, Moraes et al. 637 (HUEFS); Cocos, abr.2005, Conceição et al. 178 (HUEFS); Conde, set.2004, Guedes et al. 11230 (ALCB);
78 Jacobina, jan.1997, Arbo et al. 5391 (HUEFS); Morro do Chapéu, jan.2005, Conceição et al. 102 (HUEFS); Palmeiras, set.2006, Carvalho et al. 341 (HUEFS); Piatã, fev.2006, Santos et al. 745 (HUEFS); Umburanas, jun.2004, Machado et al. 238 (HUEFS). O tipo de Heliotropium salicoides (Sellow, s/n) é procedente do Brasil, porém sem localidade especificada. O isótipo desta espécie está depositado no K, sendo que foi obtida a sua foto. As análises da foto do isótipo e do opus princeps da espécie contribuíram para a identificação da mesma. Heliotropium salicoides é uma espécie muito semelhante a H. fruticosum, diferindo­se desta por apresentar brácteas em dimensões menores (2­3 C 1­1,5 mm, ao passo que as de H. fruticosum variam de 3­4,5 C 1­2 mm), sem aspecto foliáceo. Além disso, possuem folhas ovais, enquanto H. fruticosum possuem folhas elípticas. Assemelha­se a H. polyphyllum por ter folhas curto pecioladas e congestas; entretanto, as folhas de H. polyphyllum possuem margem plana, facilitando a distinção. A espécie também pode ser confundida com H. ternatum, por possuir folha com margem revoluta; porém é separada pela forma e disposição das folhas, que são ovais e congestas em H. salicoides e elípticas e esparsas em H. ternatum. Em apenas uma exsicata foi relatado flores com corola rosa, porém em campo foram observadas apenas flores com corola amarela. Os sinônimos aqui apresentados seguem Förther (1998). Na “Flora Brasiliensis” são apresentadas outras espécies, não citadas para a Bahia, as quais Förther (1998) listou como sinônimo de H. salicoides: Schleidenia incana Fresen.; S. salicoides (Cham.) Fresen.; S. clausseni (A.DC.) Fresen. e S. macrantha Fresen.
79 80
81
1.10. Heliotropium ternatum Vahl, Symb. Bot. 3:21.1794. Schleidenia fumana Fresen., Fl. Bras. 8(1): 40. 1857. Heliotropium fumana (Fresen.) Gürke, Nat. Pflanzenf. 4(3a): 97. 1893. Fig. 9B; 10 J­R; 11. Subarbusto ereto ou procumbente, 0,2­0,6 m alt.; caule híspido, tricomas brancos, ritidoma presente. Folhas alternas, subopostas ou opostas, 0,4­2,9 C
0,1­0,5 cm, cartáceas, verdes, concolores ou levemente discolores, elípticas, ápice e base agudos, margem revoluta, superfície plana, híspido, tricomas brancos, tricomas densos na face abaxial, venação hifódroma; pecíolo 0,1­0,3 cm compr., ca. 0,5 mm espessura, estrigoso, tricomas brancos. Inflorescências terminais ou axilares, inteiras ou bifurcadas, brácteas ovais, ápices agudos, 3­4 C
1­2 cm. Flores pedicelo 0,5­1 mm compr.; cálice verde, lobos ovais, ápice agudo, 1,5­2,5 mm compr., serício externamente, acrescente na frutificação, até 3,5 mm; corola branca, fauce amarela, tubo 2,5­3,5 C 1­1,5 mm, pubescente externamente e internamente, no terço superior do tubo, tricomas brancos, lobos 1,5­2,5 mm compr., lobos ovais, ápice agudo; anteras sésseis, ovais, ápice agudo, ápice pubescente, coerentes, inseridas no terço inferior do tubo; ovário ca. 0,5 mm compr., estilete ca. 0,5 mm compr., estigma ca. 0,2 mm compr., capitado, pubescente. Frutos núculas 4, subglobosas, híspido, 1­1,5 C 1,5­2 mm, imaturo verde, maduro marrom; sementes 4. México, Antilhas, Guiana Inglesa, Venezuela e Brasil (Bahia, Minas Gerais, Paraíba, Pernambuco, Piauí, Rio Grande do Norte e Sergipe). B7, D6, D8, E6, F3, F4, F6, H5: caatinga, campo rupestre, em beira de estrada, em solo arenoso, com ou sem afloramentos rochosos ou em afloramentos calcáreos. A espécie floresce e frutifica de dezembro a março e em julho. Materiais examinados: Abaíra, fev.2003, França et al. 4223 (HUEFS); Barra da Estiva, fev.1994, Santos et al. in CFCR 14422 (SPF); Bom Jesus da Lapa, fev.2000, Queiroz et al. 5722 (HUEFS); Jaguarari, fev.2006, Melo et al. 4290 (HUEFS); Licínio de Almeida, jan.2006, Nunes 1663 (HUEFS); Morro do
82 Chapéu, jan.2003, França et al. 4104 (HUEFS); Palmeiras, fev.1994, Harley et al. 14236 (HUEFS); Serrinha, mar.2005, Conceição et al. 132 (HUEFS). Johnston (1935) publicou Heliotropium ternatum var. fumana (Fresen.) I.M. Johnst. com base nos materiais procedentes das Guianas e da Venezuela, que possuiam folhas estreitamente elípticas. Neste trabalho encontramos espécimes com folhas estreitamente elípticas (0,4­0,8 C 0,1cm) até exemplares cujas dimensões alcançavam ca. 2,9 C 0,5 cm, existindo, no entanto, as formas intermediárias, as quais também foram observadas por Johnston. Por esse motivo, resolvemos desconsiderar as variedades neste estudo. Os exemplares de H. ternatum que apresentam folhas estreitamente elípticas assemelham­se com H. filiforme, diferindo­se porque H. ternatum apresenta tal característica associada à presença de margem revoluta. A margem revoluta, por outro lado faz com que esta espécie possa ser confundida com H. salicoides; entretanto, as folhas, bem como as flores são menos congestas em H. ternatum. Além disso, as folhas têm formas distintas sendo elípticas em H. ternatum e ovais em H. salicoides. A face abaxial das folhas de H. ternatum possui um aspecto cinéreo, não observado em H. salicoides. A cor referida e observada para a corola de H. ternatum foi sempre branca, com fauce amarela, enquanto a corola de H. salicoides é geralmente amarela.
83 Fig. 11. Mapa de distribuição geográfica de Heliotropium ternatum, H. transalpinum e Heliotropium sp.
84 1.11. Heliotropium transalpinum Vell., Fl. Flumin.: 68. 1829. Heliophytum monostachyum (Cham.) DC., Prodr. 9: 556. 1845. Fig. 9C; 11; 12 A­G. Nome popular: pau­de­sapo (Itapetinga). Subarbusto ou arbusto 0,5­1,5 m alt.; caule com tricomas bífidos, brancos, esparsos, ramos jovens sulcados, ritidoma ausente. Folhas alternas, subopostas ou opostas, 2,4­17,2 C 1­6,2 cm, membranáceas, verdes, discolores, elípticas, ápice acuminado, base oblíqua, aguda a atenuada, margem inteira ou levemente sinuosa, superfície plana, adaxial tricomas bífidos esparsos, face abaxial tricomas bífidos concentrados nas nervuras principal e secundárias, tricomas brancos, venação broquidódroma; pecíolo 0,2­1,1 cm compr., ca. 1 mm espessura, tricomas bífidos, brancos ou ferrugíneos. Inflorescências terminais, inteira ou bifurcada, brácteas ausentes. Flores sésseis; cálice verde, lobos ovais, ápice acuminado, 3­4 mm compr., híspido externamente; corola branca, tubo 3­3,5 C 1­ 1,5 mm, híspido externamente, tricomas brancos, lobos ca. 1 mm compr., ovais, ápice agudo; anteras sésseis, ovais, ápice agudo, livres, inseridas no terço superior do tubo; ovário ca. 0,5 mm compr., estigma séssil, ca. 0,5 mm compr., capitado. Frutos núculas 2, subglobosas, com duas cavidades laterais, cobertas por tricomas bífidos, 2­3 C 3­4 mm, imaturo verde, maduro marrom; sementes 4. Argentina, Bolívia, Equador, Paraguai e Brasil (Bahia, Minas Gerais, Paraná, Rio de Janeiro, Rio Grande do Sul, Santa Catarina, São Paulo). E2, E3, E6, E7, F3, F5, F6, H8: cerrado, caatinga, em áreas alagadas, beira de estrada ou margem de rios, em solos úmidos, calcáreos, com ou sem afloramentos rochosos. A espécie floresce em janeiro, março, abril e novembro e frutificam em janeiro, abril e novembro. Materiais examinados: Caetité, abr.2005, Conceição et al. 202 (HUEFS); Correntina, abr.2005, Conceição et al. 133 (HUEFS); Itaberaba, nov.1983, Bautista et al. 1240 (CEPEC, RB); Itapetinga, abr.1979, Silva et al. 159 (CEPEC); Lençóis, jan.1997, Guedes et al. in PCD 4630 (CEPEC, HUEFS); Rio de Contas,
85 mar.1994, Souza et al. 5259 (HUEFS); São Desidério, abr.2005, Carvalho­ Sobrinho et al. 467 (HUEFS). Heliotropium transalpinum assemelha­se a H. angiospermum, diferindo­se desta espécie por apresentar tricomas bífidos e fruto com cavidades laterais. Tais características são típicas de Heliotropium sect. Coeloma (DC.) I.M.Johnst., na qual H. transalpinum se enquadra, segundo Förther (1998). O nome da seção (Coeloma) provém das cavidades laterais do fruto. Fresenius (1857), na “Flora Brasiliensis”, considerou como válidas as espécies Heliophytum monostachyum (ocorrente no Rio de Janeiro e na Bahia), Heliophytum persicariaefolium DC. (com ocorrência em Minas Gerais) e Heliophytum tiaridioides (Cham.) DC. (coletada em “Brasília meridionalis” e “Brasília occidentalis”). Johnston (1928) aceitou a espécie Heliotropium tiaridioides Cham. e ainda duas variedades: H. tiaridioides var. genuina I.M.Jhonst. (com distribuição no noroeste da Argentina, Bolívia, Paraguai e sul do Brasil) e H. tiaridioides var. schizocarpum I.M.Jhonst. (nordeste da Argentina, Paraguai, leste do Brasil, Equador e América Central). Todas essas espécies, incluindo as variedades, foram tidas como sinônimos de Heliotropium transalpinum por Förther (1998).
86 87
1.12. Heliotropium sp. Fig. 11; 12 H­O. Subarbusto ca. 40 cm alt.; caule estrigoso, tricomas brancos, esparsos, ramos maduros sulcados, ritidoma presente. Folhas alternas, subopostas ou opostas, 1,2­3,5 C 0,8­1,6 cm, cartáceas, verdes, discolores, elípticas ou ovais, ápice agudo ou acuminado, base obtusa, margem inteira, superfície plana, estrigoso, tricomas brancos, venação eucamptódroma, nervuras proeminentes; pecíolo 0,1­0,3 cm compr., ca. 1 mm espessura, híspido, tricomas brancos. Inflorescências terminais, inteira ou bifurcada, brácteas ausentes. Flores pedicelo ca. 1 mm; cálice verde, lobos ovais, ápice agudo, ca. 0,4 mm compr., serício; corola branca, tubo 5­6 C 2 mm, serício externamente e internamente, no terço superior do tubo, tricomas brancos, lobos ca. 2 mm compr., lobos ovais, ápice agudo; estames filete ca. 0,1 mm, anteras globosa, ápice pubescente, coerentes, inseridos no terço superior do tubo; ovário ca. 0,8 mm compr., estilete ca. 1,2 mm compr., estigma ca. 1 mm, cônico. Frutos núculas 4, subglobosas, híspido, ca. 2 C 3 mm, verde; sementes 4. Brasil (Bahia). E6, F5, G7, H7: caatinga, beira de estrada. A espécie floresce e frutifica em fevereiro, abril e em julho. Materiais examinados: Caetité, fev.1997, Saar et al. in PCD 5242 (SPF); Palmeiras, abr.2006, Carvalho et al. 308 (HUEFS); Poções, jul.1964, Duarte s/n (HB); Vitória da Conquista, jul.1964, Duarte 322 (HB). Esta espécie compartilha algumas características com as demais espécies de Heliotropium estudadas. Uma dessas características é a presença de ritidoma, que também está presente em H. polyphyllum, H. salicoides e em H. ternatum. Porém diferenciam­se porque Heliotropium sp. possui flores sem brácteas, enquanto H. polyphyllum, H. salicoides e em H. ternatum possuem flores com brácteas.
88 Heliotropium sp. e H. transalpinum possuem flores com corola totalmente branca. Estas espécies distinguem­se facilmente pela textura das folhas (cartáceas em Heliotropium sp. e membranáceas em H. transalpinum). As folhas de Heliotropium sp. têm venação eucamptódroma e anteras coerentes, também presentes em H. procumbens e H. fruticosum. Entretanto, as nervuras em Heliotropium sp. são bastante proeminentes, sendo este um caráter que facilita o reconhecimento desta espécie.
89 2. Schleidenia Endl. Ervas prostradas, ramificadas. Folhas alternas ou subopostas, lineares a ovais, ápice agudo, margens inteiras, alternas, pecioladas. Flores cálice 5 lobos; corola infundibuliforme, plicada, pubescente, lobos ovais, amarela ou branca; estames 5, anteras coerentes, inseridas no terço inferior do tubo da corola, inclusas, lineares ou ovais, com ápice agudo, pubescente; estigma capitado, estilete presente ou ausente. Fruto drupáceo, lobos muito ou pouco acentuados; sementes 4. Schleidenia é representada por cinco espécies (Förther, 1998) que ocorrem na América do Sul, sendo que os tipos destas foram procedentes do Brasil. Na Bahia ocorre apenas S. paradoxa (Mart.) DC. CANDOLLE, A.P. 1845. Borragineae. Prodromus systematis naturalis regni vegetabilis. Parte 9: 467­563 p. FÖRTHER, H. 1998. Die infragenerische Gliderrung der Gattung Heliotropium L. und ihre Stellung innerhalb der subfam. Heliotropioideae (Schrad.) Arn. (Boraginaceae). Sendtnera 5: 35­241. FRESENIUS, G. 1857. Boraginaceae; Heliotropiaceae. In C.F.P. Martius & A.G. Eichler (eds.). Flora Brasiliensis 8(1): 5­58.
90 2.1. Schleidenia paradoxa (Mart.) DC., Prodr. 9: 557. 1845. Basiônimo: Preslaea paradoxa Mart., Nov. gen. sp. pl. 2: 76. 1827. Fig. 9D; 13 A­I; 14. Caule serício, tricomas brancos. Folhas alternas, 0,8­1,3 C 0,3­0,6 cm, membranáceas, verdes, concolores, elípticas, ápice agudo, base obtusa, margem inteira, serício, tricomas brancos, venação hifódroma; pecíolo 0,15­0,3 cm compr., ca. 0,5 mm espessura, serício, tricomas brancos. Flores axilares, brácteas ausentes, pedicelo 2­3 mm compr.; cálice verde, lobos ovais, ápice agudo, 3­4,5 mm compr., pubescente externamente; corola amarela, tubo 8­12 C 1 mm, pubescente externamente e internamente, no terço médio do tubo, tricomas brancos, 3­4 mm compr., lobos plicados; anteras sésseis, ovais, ápice agudo; ovário ca. 1 mm compr., estilete ca. 0,2 mm compr., estigma ca. 0,3 mm compr. Frutos globoso, 2,5­3 C 1,5­2 mm, serício, verde. Brasil (Bahia, Goiás, Minas Gerais e Piauí). B5, B6, B7, C5, F3, F6. Caatinga, floresta estacional, beira de lagos, áreas antropizadas, em solo arenoso.
Materiais examinados: Casa Nova, abr.2001, R.M. Harley et al. 54333 (HUEFS); Juazeiro, dez.1922, P.C. Porto et al. 1434 (SPF); Livramento de Nossa Senhora, jan.2005, J. Paula­Souza et al. 5189 (HUEFS); Rio de Contas, nov.1996, H.P. Bautista et al. in P.C.D. 4376 (CEPEC); Santa Maria da Vitória, nov.1980, S.B. Silva et al. 166 (RB); Xique­Xique, fev.1977, R.M. Harley et al. 19111 (SPF). Martius publicou Preslaea paradoxa Mart. (Martius 1827 apud Förther 1998). Em 1845, Candolle fez uma nova combinação deste binômio e publicou Schleidenia paradoxa (Mart.) DC. Fresenius (1857) aceitou a circunscrição proposta por Candolle (1845). Gürke (1893) transferiu S. paradoxa para Heliotropium paradoxum (Mart.) Gürke, que também teve como basiônimo P. paradoxa. No entanto, este binômio foi usado primeiramente por Vatke (1875 apud Förther, 1998). Portanto, a nova
91 combinação de Gürke, a qual foi aceita por Johnston (1928), trata­se de um nome ilegítimo.
Förther (1998) restabeleceu o gênero Schleidenia e elegeu a espécie­tipo deste gênero, sendo o lectótipo escolhido S. paradoxa (Mart.) DC. Este teve como basiônimo Preslaea paradoxa Mart. Förther (1998) afirmou que o nome Preslaea é ilegítimo, devido ao fato de já existir um gênero com um nome muito parecido (Preslia Opz), publicado anteriormente, em 1824. Schleidenia paradoxa assemelha­se com algumas espécies estudadas do gênero Heliotropium, tais como H. procumbens e H. polyphyllum. Tal semelhança da­se principalmente por S. paradoxa possuir hábito prostrado, assim como alguns espécimes de H. procumbens e H. polyphyllum. Entretanto, diferencia­se por apresentar flores solitárias, axilares, característica que faz com que esta espécie seja facilmente reconhecida.
92 93
Fig. 14. Mapa de distribuição geográfica de Schleidenia paradoxa.
94 3. Tournefortia L. Arbustos, lianas, raro árvores. Folhas alternas, raro opostas, margens inteiras ou levemente onduladas, pecioladas. Inflorescências ramificadas, terminais, axilares ou internodais (pelo processo de concaulescência). Flores cálice 5 lobos, raro 4, geralmente só unidos na base; corola tubo cilíndrico, glabra internamente, lobos ovais a lineares, branca, amarela, verde, laranja ou vermelha; estames geralmente cinco, com anteras livres ou coerentes, inseridas na extremidade ou na metade do tubo da corola, inclusas, lineares ou ovais, com ápice agudo; estigma com um anel geralmente presente, ápice cônico/triangular, estilete presente ou ausente. Fruto drupáceo, 2­carpelar, lobos muito ou pouco acentuados, desfeito em 1 ou 2 núculas irregulares, com 1 ou 2 sementes providas de embrião reto ou curvo. O gênero Tournefortia é representado por cerca de 150 espécies, sendo que a grande maioria delas são Neotropicais, tendo como centro de diversidade a América do Sul (Al­Shehbaz, 1991). No Brasil ocorrem cerca de 16 espécies de Tournefortia, das quais 13 ocorrem na Bahia. CANDOLLE, A.P. 1845. Borragineae. Prodromus systematis naturalis regni vegetabilis. Parte 9: 467­563 p. FRESENIUS, G. 1857. Boraginaceae; Heliotropiaceae. In C.F.P. Martius & A.G. Eichler (eds.). Flora Brasiliensis 8(1): 5­58. JOHNSTON, I.M. 1930. Studies in the Boraginaceae – VIII: Observations on the species of Cordia and Tournefortia known Brazil, Paraguay, Uruguay and Argentina. Contr. Gray Herb. 92: 3­95. JOHNSTON, I.M. 1935. Studies in the Boraginaceae – X: The Boraginaceae of Northeastern South America. J. Arnold Arbor. 1(16): 1­64. SILVA, L.C. 2004. Estudos taxonômicos das espécies extra­amazônicas de Tournefortia L. (Boraginaceae s.l.). Universidade Estadual Paulista “Julio Mesquita Filho”, Dissertação de Mestrado.
95 Chave para Tournefortia 1­ Estames inseridos no terço médio do tubo da corola, estigma séssil..........................................................................................................T. bicolor 1’­ Estames inseridos no terço superior do tubo da corola, estilete presente. 2­ Caule com lenticelas. 3­ Caule apresentando ritidoma, fruto hirsuto......................Tournefortia sp. 3’­ Caule não apresentando ritidoma, fruto glabro. 4­ Folhas indumento híspido, frutos vermelhos ou laranjas na maturidade......................................................................T. rubicunda 4’­ Folhas indumento pubescente a tomentoso, fruto branco com manchas esféricas pretas na maturidade.......................T. floribunda 2’­ Caule sem lenticelas. 5­ Folhas com indumento tomentoso em ambas as faces, com aspecto cinéreo, fruto tomentoso.............................................................T. candidula 5’­ Folhas com indumento pubescente, híspido, hispidulo, viloso, raro tomentoso (mas neste caso apenas na face abaxial), sem aspecto cinéreo, fruto glabro, pubescente ou estrigoso. 6­ Ritidoma presente...................................................................T. breviflora 6’­ Ritidoma ausente. 7­ Folhas crassas, venação craspedódroma, nervuras proeminentes na face abaxial..............................................................................T. subsessilis 7’­ Folhas membranáceas ou cartáceas, venação broquidódroma, nervuras não proeminentes na face abaxial. 8­ Lobos do cálice superando o tamanho da corola, tricomas comumente negros...................................................T. melanochaeta 8’­ Lobos do cálice não superando o tamanho da corola, tricomas nunca negros. 9­ Folhas face adaxial com indumento pubescente, híspido ou com tricomas concentrados apenas nas nervuras principal e secundárias, fruto glabro.
96 10­ Fruto verde, folhas face abaxial indumento híspido,............................................T. paniculata 10’­ Fruto branco com 4 manchas esféricas negras, folhas face abaxial indumento viloso ou tomentoso. 11­ Ramos vilosos, tricomas ferrugíneos, folhas face adaxial tricomas concentrados apenas nas secundárias, nervuras abaxial principal e indumento viloso...........................................T. villosa 11’­ Ramos pubescentes a tomentosos, tricomas brancos, folhas face adaxial pubescente, abaxial indumento tomentoso.............................T. floribunda 9’­ Folhas face adaxial com indumento estrigoso ou viloso, fruto estrigoso ou pubescente. 12­ Flores 6­7 mm compr., sésseis..............................................T. salicifolia 12’­ Flores 3­3,5 mm compr., pedicelo 1­2 mm compr..................................................T. gardneri
97 3.1. Tournefortia bicolor Sw., Prodr. Veg. Ind. Occ. 40: 344. 1788. T. laevigata Lam., Illustr. 1: 416. 1791. T. glaberrima Salzm. ex DC., Prodr. 9: 519. 1845. Fig. 9E; 15 A­G; 16. Nome popular: cipó sabugueiro (Água Preta). Arbusto decumbente ou escandente até 6,0 m alt.; caule arredondado, ramos jovens sulcados, pubescentes, tricomas brancos, ritidoma e lenticelas ausentes. Folhas 5,2­13,2 C 2,1­6,6 cm, cartáceas, verdes, discolores, face adaxial verde escuro, face abaxial verde claro, elípticas, ápice caudado, base rotunda ou aguda, margem inteira ou levemente sinuosa, híspido, tricomas brancos, face adaxial glabrescente, face abaxial com tricomas concentrados nas nervuras principal e secundárias, venação broquidódroma; pecíolo 0,7­1,9 cm compr., 1­2 mm espessura, pubescente, tricomas brancos. Inflorescência terminal ou internodal, 3,4­6,7 cm compr., pedúnculo 1,3­3,5 cm. Flores 5­7 mm compr., sésseis; cálice verde, lobos ovais, ápice agudo, 1­2 mm compr., pubescente; corola branca, tubo 4­5 C 1 mm, pubescente, tricomas ferrugíneos, lobos ovais, ápice agudo, 1­2 mm compr.; anteras ovais, ápice agudo, inseridas no terço médio do tubo; ovário ca. 1 C 0,5 mm, estigma séssil, ca. 0,5 mm compr., capitado, base estigmática espessa. Fruto obscuramente 4­lobado, verde, 4­6 C
3­5 mm, glabro; sementes 2­4. México, Paraguai, Guiana, Guiana Francesa, Suriname, Venezuela e Brasil (Alagoas, Amazonas, Bahia, Ceará, Espírito Santo, Goiás, Mato Grosso, Minas Gerais, Pará, Paraíba, Paraná, Pernambuco, Rio de Janeiro, Rio Grande do Sul, Rondônia, Roraima, Santa Catarina, São Paulo, Sergipe e Tocantins). E9, E10, F8, G8, H7, H8, H9, J8: mata, mata ciliar, restinga e em áreas antropizadas. Floresce e frutifica em fevereiro, março e de junho até dezembro. Material selecionado: Almadina, mar.1971, R.S.P. 1118 (CEPEC); Canavieiras, nov.2002, Jardim et al. 4065 (HUEFS); Cruz das Almas, nov.1989, Bautista 1467 (RB); Ilhéus, out.2004, Stapf et al. 364 (HUEFS); Itanagra, out.1975, Gusmão 371 (ALCB); Porto Seguro, nov.1996, Thomas et al. 11245
98 (CEPEC, HUEFS); Prado, out.1993, Thomas et al. 10111 (CEPEC); Uruçuca, set.1991, de Carvalho et al. 3589 (CEPEC, HUEFS); Wenceslau Guimarães, dez.2001, Guedes et al. s/n (CEPEC). Tournefortia bicolor diferencia­se das demais espécies de Tournefortia encontradas na Bahia por possuir estigma séssil e estames inseridos no terço médio do tubo da corola. Além disso, pode ser facilmente reconhecida por ter fruto obscuramente lobado (característica de Tournefortia sect. Eutournefortia I.M.Johnst., seção a qual a espécie pertence), caráter não observado nas demais espécies estudadas. Assemelha­se a T. subsessilis, principalmente por possuir a face adaxial das folhas glabrescente. Entretanto diferenciam­se porque as folhas de T. subsessilis têm a face adaxial totalmente glabra e, além disso, são crassas. Tournefortia laevigata e T. glaberrima foram consideradas espécies válidas por Fresenius (1857) na “Flora Brasiliensis”, sendo que ambas foram citadas para a Bahia. Entretanto, Johnston (1930) considerou estas espécies como sinônimas de T. bicolor. As folhas discolores de T. bicolor, segundo Smith (1970), deu origem ao epíteto específico.
99 100
Fig. 16. Mapa de distribuição geográfica de Tournefortia bicolor, T. breviflora e T. candidula.
101 3.2. Tournefortia breviflora DC., Prodr. 9: 520. 1845. Fig. 15 H­N; 16. Arbusto escandente ca. 3,0 m alt.; caule arredondado, glabro, ritidoma presente, lenticelas ausentes. Folhas 4,9­17,9 C 2,8­5,3 cm, membranáceas, verdes, discolores, elípticas ou obovais, ápice caudado, base aguda, levemente atenuada, margem inteira ou levemente sinuosa, face adaxial híspido, tricomas brancos, glabrescente, face abaxial hispidula, tricomas brancos, esparsos, venação broquidódroma; pecíolo 0,8­2,1 cm compr., 0,5­1 mm espessura, hispidula, tricomas brancos. Inflorescências axilares, 2,5­6,4 cm compr., pedúnculo 0,5­1,7 cm. Flores 3,5­5 mm compr., pedicelo ca. 0,5 mm; cálice verde, lobos ovais, ápice agudo, ca. 1 mm compr., estiguloso; corola verde ou amarela, tubo 2­3 C 1 mm, hispidula, tricomas brancos, lobos ovais, ápice agudo, 1,5­2 mm compr.; anteras ovais, ápice agudo, inseridas no terço superior do tubo; ovário ca. 1 C 0,4 mm, estilete 1,5­2 mm, estigma ca. 0,5 mm compr., capitado, base estigmática espessa. Fruto 4­lobado, verde, 3­4 C 6­8 mm, glabro; sementes 4. Argentina, Paraguai e Brasil (Alagoas, Bahia, Ceará, Distrito Federal, Espírito Santo, Goiás, Minas Gerais, Paraná, Pernambuco, Rio de Janeiro, Rio Grande do Sul, Santa Catarina, São Paulo e Tocantins), G8, H8, J8: mata higrófila sul baiana, em solo argiloso­silicoso com afloramentos de rochas. A espécie floresce e frutifica em março e abril. Material selecionado: Itabuna, mar.1986, Santos et al. 4132 (CEPEC, RB); Itamarajú, abr.1971, Santos 1560 (CEPEC); Jussari, abr.1998, Amorim et al. 2349 (CEPEC); Pau Brasil, abr.1997, Thomas et al. 11547 (CEPEC). Está espécie sempre foi separada das demais por apresentar inflorescências distintamente axilares. Neste trabalho verificou­se que este caráter está presente em outras espécies (em Tournefortia sp. e, mais raramente, em T. gardneri, T. melanochaeta e T. salicifolia), sendo que nestas espécies estão presentes tanto inflorescências axilares quanto terminais. Tournefortia breviflora
102 assemelha­se a Tournefortia sp., diferindo­se desta pela ausência de lenticelas, tipo de indumento, fruto glabro e tamanho dos lobos da corola (1,5­2 mm compr. em T. breviflora e ca. 1 mm compr. em Tournefortia sp.). Candolle (1845) descreveu a espécie T. vauthieri DC., sendo o tipo proveniente do Rio de Janeiro. Esta espécie foi considerada válida por Fresenius (1857), na “Flora Brasiliensis”. No entanto, Johnston (1930) citou T. vauthieri como sinônimo de T. breviflora. Segundo Smith (1970) o epíteto breviflora provém do tamanho diminuto das flores.
103 3.3. Tournefortia candidula (Miers) I.M.Johnst., Contr. Gray Herb. 92: 84. 1930. Basiônimo: Messerschmidtia candidula Miers, Ann. & Mag., Nat. Hist. ser. 4, 2: 202. 1868. Fig. 9F; 16; 17 A­H. Arbusto decumbente 1,5­3,0 m alt.; caule arredondado, ramos jovens sulcados, tomentoso, tricomas brancos, ritidoma e lenticelas ausentes. Folhas 3,9­8,4 C 1,4­3,2 cm, cartácea, face adaxial verde, face abaxial cinza, elíptica ou oval, ápice acuminado, base aguda a obtusa, margem inteira, tomentoso, tricomas brancos, venação broquidódroma; pecíolo 0,2­0,6 cm compr., ca. 2 mm espessura, tomentoso, tricomas brancos ou ferrugíneos. Inflorescência terminal ou internodal, 2,6­15,5 cm compr., pedúnculo 0,5­3,2 cm. Flores 4­7 mm compr., sésseis; cálice lobos ovais, ápice agudo, 2­4 mm compr., tomentoso; corola branca, tubo 3­5 C 1 mm, tomentoso, tricomas brancos, lobos lineares, 1­2 mm compr.; anteras ovais, ápice agudo, inseridas no terço superior do tubo; ovário ca. 0,8 C 0,4 mm, estilete 2­2,5 mm, estigma ca. 0,5 mm compr., capitado, base estigmática espessa. Fruto 4­lobado, imaturo verde, maduro marrom, 2­3 C 4­5 mm, tomentoso; sementes 4. Venezuela e Brasil (Bahia, Ceará, Maranhão, Pará, Pernambuco, Rio de Janeiro, Rio Grande do Norte, São Paulo). C7, C9, D6, D7, E6, E7, E8, E9, F6, F7, F8, H8, I8: caatinga, cerrado, restinga, mata antropizada, em borda de matas ou beira da estrada, em solo argiloso ou arenoso. A espécie floresce e frutifica durante todo o ano. Material selecionado: Aramari, dez.1922, Porto et al. 1406 (RB); Barra da Estiva, nov.1988, Harley et al. 26489 (HUEFS, SPF); Belmonte, jul.1966, Belém et al. 2480 (CEPEC); Brejões, fev.2000, Jardim et al. 2922 (CEPEC); Campo Formoso, fev.2006, França et al. 5427 (HUEFS); Feira de Santana, mai.1983, Noblick et al. 2658 (CEPEC); Jacobina, jun.1999, França et al. 3065 (HUEFS); Jaguaquara, mai.1969, Jesus et al. 406 (CEPEC); Jequié, fev.2004, Thomas et al. 13865 (CEPEC); Maracás, jan.1965, Pereira et al. 9699 (HB); Morro do Chapéu, jan.2005, Conceição et al. 118 (HUEFS); Mucugê,
104 out.2005, Carvalho­Sobrinho et al. 673 (HUEFS); Mundo Novo, out.1981, Hatschbach et al. 44273 (CEPEC, MBM); Santa Cruz Cabrália, jun.2005, Stapf et al. 472 (HUEFS); Santa Terezinha, mar.2006, Conceição et al. 485 (HUEFS); Tucano, jun.1994, Santana et al. 511 (MBM). Tournefortia candidula pode ser facilmente reconhecida pela presença de um indumento branco característico, o que faz com que a planta apresente um aspecto cinéreo. A espécie assemelha­se a T. villosa, podendo ser distinguida pela cor do indumento e por possuir tricomas no fruto. O tipo de T. candidula é procedente de Pernambuco (Gardner 1078), sendo que a foto do isótipo depositado no K foi obtida, tendo grande contribuição na identificação desta espécie. Candolle (1845) e Fresenius (1857) consideraram como válida a espécie T. sericea Vahl. Porém, segundo Johnston (1930), o que estes autores analisaram não se tratava da T. sericia de Vahl, mas de T. candidula.
105 106
3.4. Tournefortia floribunda Humb., Bonpl. & Kunth, Nov. Gen. Sp. 3: 79. 1818. Fig. 17 I­P; 18 A; 19. Arbusto decumbente ou escandente, 1,5­3,0 m alt.; caule arredondado, ramos jovens sulcados, pubescentes a tomentosos, tricomas brancos, ramos maduros com lenticelas, ritidoma ausente. Folhas 2,2­13,1 C 1,1­5,3 cm, membranáceas a cartáceas, verdes, discolores, ovais ou elípticas, ápice acuminado a levemente caudado, base obtusa a aguda, margem inteira ou levemente sinuosa, face adaxial pubescente, tricomas brancos ou ferrugíneos, face abaxial tomentoso, tricomas brancos ou ferrugíneos, venação broquidódroma; pecíolo 0,1­1,5 cm compr., 0,5­1 mm espessura, tomentoso, tricomas ferrugíneos. Inflorescências terminais ou internodais, 5,3­28,1 cm compr., pedúnculo 1,5­17,0 cm. Flores 3­6 mm compr., sésseis; cálice verde, lobos ovais, ápice agudo, 1­2 mm compr., pubescente; corola tubo verde 2­4 C 1 mm, pubescente, tricomas ferrugíneos, lobos verde ou laranja, ovais, ápice agudo, 1­2 mm compr.; anteras ovais, ápice agudo, inseridas no terço superior do tubo; ovário 1 C 0,4­0,5 mm, estilete 1,5­2 mm compr., estigma 0,4­0,5 mm, capitado, base estigmática espessa. Fruto 4­lobado, imaturo verde, maduro branco com 4 manchas esféricas pretas, 3­4 C 4­6 mm, glabro; sementes 4. Pantropical (Brasil: Amazonas, Bahia, Ceará, Espírito Santo, Goiás, Minas Gerais, Pernambuco, Piauí, Rio de Janeiro, Rio Grande do Sul, Roraima, Santa Catarina e São Paulo). B7, C9, D6, D7, D8, E6, E8, F6, F7, F9, G5, H6, H7, I8: caatinga, mata atlântica, restinga, em borda de matas ou em beira de estrada. Tournefortia floribunda floresce e frutifica durante todo o ano. Materiais examinados: Abaíra, nov.1992, Ganev et al. 1538 (SPF); Cruz das Almas, abr.2006, Conceição et al. 486(HUEFS); Encruzilhada, fev.1976, Gusmão 278 (ALCB); Feira de Santana, jun.2005, Conceição et al. 228 (HUEFS); Jequié, nov.2001, Loureiro et al. 346 (ALCB, MBM); Juazeiro, mar.2000, Jesus et al. 889 (ALCB, HRB, HUEFS); Licínio de Almeida, nov.2006, Carvalho 345 (HUEFS); Maracás, fev.2004, Moraes 604 (HUEFS); Milagres, abr.1995, Melo et al. 1202 (HUEFS); Morro do Chapéu, jan.2005, Conceição et al. 116 (HUEFS);
107 Mundo Novo, fev.1970, Costa s/n (ALCB); Palmeiras, mar.2003, Melo et al. 3553 (HUEFS); Piatã, nov.1996, Harley et al. 28444 (HUEFS); Rio de Contas, nov.1988, Harley et al. 25837 (CEPEC, HUEFS, MBM, SPF); Salvador, out.1987, Guedes et al. s/n (ALCB 21103); Santa Cruz Cabrália, jul.1984, Webster 25033 (CEPEC); Serrinha, mar.2005, Conceição et al. 122 (HUEFS); Tucano, jun.1994, Sant’ana et al. 506 (MBM); Vitória da Conquista, out.1988, Harley et al. 25286 (HUEFS). Tournefortia floribunda foi descrita em 1818, com base em um material proveniente de Nova Andalusia (Venezuela). Posteriormente, Candolle (1845) publicou as espécies T. membranacea e T. salzmannii, sendo os tipos provenientes, respectivamente, do Rio de Janeiro e da Bahia. Candolle (1845) considerou válido o binômio T. floribunda. Fresenius (1857), na “Flora Brasiliensis”, admitiu para o Brasil as espécies T. floribunda e T. salzmannii. Em seus comentários cita que T. floribunda seria uma espécie agregada a T. salzmannii, sendo distinguida pelas folhas brevemente acuminadas. Johnston (1930) relata para o Brasil T. membranacea e T. salzmannii. Ele comenta que o que Fresenius chamou de T. floribunda, tratava­se de T. membranacea. Johnston considera que T. membranacea seria uma possível forma local de T. salzmannii, espécie amplamente distribuída, diferindo­se por ser menos pubescente e possuir flores menores e com lobos menos prolongados. Além disso, as folhas de T. salzmannii seriam mais largas e agudas. O autor ainda admite que tanto T. membranacea quanto T. salzmanni seriam relacionadas à T. floribunda, sendo que T. membranacea aparentava ser separada apenas por possuir folhas mais obtusas e T. salzmannii por possuir flores maiores. Silva (2004) considerou estas três espécies como ocorrentes no Brasil. Como características para distinção das espécies ela utilizou a presença de lenticelas e variações na forma e ápice das folhas, bem como na espessura da base estigmática. Ao analisar os espécimes Harley 25286, Harley 25837 e Harley 26488 citados por Silva (2004), foram verificados que os caracteres utilizados para separar as espécies não se sustentaram. Nestas exsicatas, identificadas por Silva como T. membranacea, foram encontradas lenticelas, característica exclusiva de T. salzmannii, segundo a autora.
108 Foram vistas as fotos dos tipos de T. membranacea e do holótipo de T. salzmannii (coletado em Jacobina, em 1841 por Blanchet 3289 e depositado no NY), onde pode ser verificada a grande semelhança entre estas espécies, o que torna difícil a diferenciação entre elas. Além da análise das fotos dos tipos, foram consultadas também as obras prncips de todas estas espécies em discussão. A partir desta consulta, construiu­se um quadro comparando as características das três espécies, sendo que, a partir deste, foi novamente constatada muitas sobreposições entre T. floribunda, T. membranacea e T. salzmannii (Tabela 1). Dessa forma, optou­se por considerar como nome válido, seguindo o princípio de prioridade de publicação, T. floribunda Humb., Bonpl. & Kunth. ESPÉCIE/CARÁTER T. floribunda HÁBITO FOLHA TEXTURA FOLHA FORMA FOLHA ÁPICE escandente membranacea oval­oblonga acuminado T. membranacea T. salzmannii subescandente membranacea oval­oblonga ­ subcordada a acuminada ­ ­ oval­lanceolada acuminado obtusa ou subcordada pubescente pubescente densamente tomentoso FOLHA BASE INDUMENTO FACE ADAXIAL INDUMENTO FACE ABAXIAL rotunda finamente pubescente INFLORESCÊNCIAS FLORES PEDICELO laterais ausente lobos acuminados, tomentosos subtomentoso terminais ou laterais subsésseis lobos lineares, pilosos breve, tomentoso subcônico glabro verde, pilosa capitado­cônico ­ CÁLICE COROLA ESTIGMA FRUTO tomentoso terminais e laterais ­ lobos acuminados um pouco maior que o cálice, viloso ­ glabro Tabela 1. Quadro comparativo de T. floribunda, T. membranacea e T. salzmannii, baseado nos opus princeps de cada espécie.
109 110
Fig. 19. Mapa de distribuição geográfica de Tournefortia floribunda, T. gardneri e T. melanochaeta.
111 3.5. Tournefortia gardneri A.DC. , Prodr. 9: 526. 1845. Fig. 19; 20 A­G. Arbusto escandente, 1,0­4,0 m alt.; caule arredondado, ramos jovens tomentosos, tricomas ferrugíneos, ritidoma e lenticelas ausentes. Folhas 2,4­13,5
C 0,6­3,3 cm, cartáceas, verdes, discolores, elípticas ou ovais, ápice caudado, raro apiculado, base obtusa a aguda, levemente atenuada, margem inteira ou levemente sinuosa, face adaxial estrigoso, tricomas brancos, face abaxial viloso, tricomas ferrugíneos, venação broquidódroma; pecíolo 0,1­0,6 cm compr., 0,5­2 mm espessura, tomentoso, tricomas ferrugíneos. Inflorescências terminais, axilares ou internodais, 2,1­14,4 cm comp., pedúnculo 0,6 – 4,9 cm. Flores 3­3,5 mm compr., pedicelo 1­2 mm; cálice lobos ovais, ápice agudo, ca. 1 mm compr., tomentoso, acrescente, 4­7 mm, cobrindo o fruto ou não; corola verde ou amarela, tubo 2­2,5 C 1 mm, tomentoso, tricomas ferrugíneos, lobos ovais, ápice agudo, ca. 1 mm compr.; anteras ovais, ápice agudo, inseridas no terço superior do tubo; ovário ca. 1 C 0,5 mm, estilete ca. 1,5 mm compr., estigma ca. 0,5 mm, capitado. Fruto 4­lobado, verde, 2­3 C 5 mm, pubescente; sementes 4. Brasil (Bahia, Rio de Janeiro, Rio Grande do Sul, Santa Catarina, São Paulo). D10, E9, F8, F9, G8, H7, H8, I8: Restinga, em solo arenoso e Mata Atlântica, em borda de matas. A espécie floresce e frutifica durante todo o ano. Material selecionado: Esplanada, mai.2000, Ribeiro et al. 88 (ALCB); Itacaré, mar.1974, Harley 15505 (CEPEC); Lamarão do Passé, jun.1994, Guedes et al. 3253 (HUEFS); Nilo Peçanha, fev.2000, Jardim et al. 2789 (ALCB, CEPEC, HUEFS); Porto Seguro, nov.1996, Thomas et al. 11250 (CEPEC, HUEFS); Santa Cruz Cabrália, set.1981, Brito et al. 146 (HUEFS); Una, ago.1995, Carvalho et al. 6072 (CEPEC). Tournefortia gardneri às vezes pode ser confundida com T. villosa e T. salicifolia, devido à presença de um indumento ferrugíneo. Entretanto, T. gardneri apresenta fruto pubescente, o qual é estrigoso em T. salicifolia e glabro em T.
112 villosa. Além disso, os lobos do cálice atingem a extremidade do tubo da corola em T. gardneri, o que não é observado nas demais espécies acima citadas.
113 114
3.6. Tournefortia melanochaeta DC., Prodr. 9: 520. 1845. Fig. 18B; 19; 20 H­O. Arbusto escandente 1,5­3,0 m alt.; caule arredondado, ramos jovens sulcados, tomentoso, tricomas negros ou ferrugíneos, ritidoma e lenticelas ausentes. Folhas 4,7­13,9 C 2,0­7,7 cm, cartácea, verde, discolores, cordiformes ou ovais, raro elípticas, ápice acuminado a caudado, base oblíqua, obtusa a cordada, margem inteira ou levemente sinuosa, face adaxial híspido, tricomas negros ou brancos, face abaxial híspido ou tomentoso, tricomas negros, brancos ou ferrugíneos, venação broquidódroma; pecíolo 0,2­1,2 cm compr., 1­2 mm espessura, tomentoso, tricomas negros ou ferrugíneos. Inflorescência terminal ou internodal, raro axilar, 7,9­18,9 cm compr., pedúnculo 1,2­5,6 cm. Flores 3­5 mm compr., sésseis; cálice tubo ca. 2 mm compr., lobos ovais, ápice agudo, reflexos, 2,5­4 mm compr., pubescente externamente; corola tubo verde ou amarelo, 2­3 C 1 mm, pubescente, tricomas ferrugíneos, lobos ovais, ápice agudo, amarelos, verdes ou laranja, 1­2 mm compr.; anteras globosas, inseridas no terço superior do tubo; ovário ca. 1 C 0,5 mm, estilete ca. 2 mm, estigma ca. 0,5 mm compr., capitado. Fruto obscuramente lobado ou 2­4­lobado, imaturo verde, maduro roxo, 2­4 C 3­8 mm, pubescente; sementes 2 ­ 4. Guiana Francesa e Brasil (Bahia). G8, H8, I8: restinga, mata higrófila sul baiana, em solo arenoso ou argilo­silicoso. A espécie floresce e frutifica durante os meses de janeiro, abril, de junho a outubro e em dezembro. Material selecionado: Ilhéus, jun.1979, Mattos et al. 519 (CEPEC); Santa Cruz Cabrália, set.1971, Santos 1909 (CEPEC); Una, dez.2005, Conceição et al. 455 (HUEFS). Esta espécie é facilmente reconhecida pelos lobos do cálice que superam o tamanho da corola e, em campo, pela presença de tricomas negros. Entretanto foi observada que, após a herborização, esta coloração se perde e os tricomas tornam­se ferrugíneos. Também com a herborização as folhas desta espécie que, em campo, apresentam um aspecto cartáceo, passam a ter uma textura coriácea.
115 Foram referidas em algumas exsicatas corola com cor amarela ou verde com lobos laranja, mas em observação do material no campo foi visualizada apenas flores inteiramente de cor verde.
116 3.7. Tournefortia paniculata Cham., Linnaea 4: 468. 1829. Fig. 21 A­H; 22. Arbusto, caule arredondado, ramos jovens sulcados, puberulentos, tricomas brancos, ritidoma e lenticelas ausentes. Folhas 4,5­6,7 C 2,1­2,4 cm, cartáceas, verdes, levemente discolores, elípticas, ápice caudado, base aguda, levemente atenuada, margem inteira ou levemente sinuosa, híspido, tricomas brancos, concentrados nas nervuras principal e secundárias, venação broquidódroma; pecíolo 1,0­1,3 cm compr., ca. 1 mm espessura, híspido, tricomas brancos. Inflorescências terminais, ca. 10,4 cm compr., pedúnculo ca. 2,6 cm. Flores 5­7 mm compr., sésseis; cálice verde, lobos lineares, 1­2 mm compr., pubescente, acrescente, até 4mm compr.; corola verde, tubo 3­4 C 1 mm, pubescente, tricomas ferrugíneos, lobos ovais, ápice agudo, 2­3 mm compr.; anteras ovais, ápice agudo, inseridas no terço superior do tubo; ovário ca. 1 C 0,6 mm, estilete 1,5 mm compr., estigma ca. 0,5 mm, capitado, base estigmática espessa. Fruto 4­lobado, verde, ca. 2 C 4 mm, glabro; sementes 4. Argentina, Bolívia e Brasil (Acre, Bahia, Ceará, Distrito Federal, Espírito Santo, Goiás, Mato Grosso, Minas Gerais, Paraná, Pernambuco, Rio de Janeiro, Rio Grande do Sul, Santa Catarina, São Paulo, Tocantins). G7, J8: Mata Atlântica. Materiais selecionado: Planalto, abr.1995, Melo et al. 1179 (SPF); Prado, nov.1996, Thomas et al. s/n (HUEFS). Material adicional examinado: PARANÁ: Campina Grande do Sul, nov.1998, Melo et al. 2519 (HUEFS); SÃO PAULO: Santo Antônio do Pinhal, jan.2004, França et al. 4858 (HUEFS). Johnston (1930) considerou que a T. paniculata era amplamente variável em relação à forma e indumento das folhas, forma da inflorescência, tamanho do tubo da corola e proporção dos lobos da corola em relação ao tubo. Entretanto, alguns espécimes provenientes da Argentina e da Bolívia apresentavam segundo Johnston (1930), inflorescência muito distinta, com ramos mais longos e difusos.
117 Para separar estas plantas que apresentavam estas características citadas para a inflorescência, combinadas a presença de lobos proporcionalmente maiores, o autor publicou T. paniculata var. austrina I.M.Johnst. No entanto, Johnston (1930) não forneceu as medidas desses caracteres, o que seria necessário para a identificação. Silva (2004) considerou que, além da variedade típica, ocorreria no Brasil (Bahia) T. paniculata var. austrina, podendo ser distinguida pelas inflorescências com cimas longas e com flores laxas e delicadas. Porém há muitas sobreposições nas descrições apresentada por Silva (2004), para essas variedades, inclusive em relação ao tamanho dos ramos da inflorescência. Os materiais analisados procedentes da Bahia apresentaram em comparação com outros espécimes examinados de T. paniculata coletados em outros Estados do Brasil, algumas variações. As inflorescências destes espécimes possuem ramos maiores e irregulares, assim como os lobos do cálice têm proporções maiores em relação à corola. Entretanto, neste estudo optamos por não considerar as variedades, pois as mesmas apresentam muitos caracteres sobrepostos. Esta espécie assemelha­se à T. rubicunda por apresentar folhas elípticas e com indumento híspido, diferindo­se pela coloração da corola e dos frutos e por não possuir lenticelas.
118 119
Fig. 22. Mapa de distribuição geográfica de Tournefortia paniculata, T. rubicunda e T. salicifolia.
120 3.8. Tournefortia rubicunda Salzm. ex DC., Prodr. 9: 526. 1845. T. martii Fresen., Fl. Bras. 8(1): 55. 1857. Fig. 18 C­D; 21 I­P; 22. Nomes populares: canela­de­anu (Itaetê), pimenta­brava (Quinjingue). Arbusto decumbente 1,0­3,0m alt.; caule arredondado, ramos jovens sulcados, puberulentos, tricomas brancos, maduros com lenticelas, ritidoma ausente. Folhas (1,0­) 2,2­11,1 C (0,5­)0,9­4,7 m, membranáceas, verdes, concolores ou levemente discolores, elípticas ou ovais, ápice acuminado, base oblíqua, obtusa a levemente atenuada, margem inteira, híspido, tricomas brancos, face abaxial glabrescente, venação broquidódroma; pecíolo 0,2­1,6 cm compr., ca. 0,5 mm espessura, híspido, tricomas brancos. Inflorescências terminais, 3,2­ 11,0 cm compr., pedúnculo 0,8­3,2 cm. Flores 3­5 mm compr., sésseis; cálice verde, lobos lineares, 1­2 mm compr., pubescente; corola tubo verde ou vermelho, 2­4 C 1 mm, pubescente, tricomas brancos, lobos laranja ou vermelho, ovais, ápice agudo, ca. 1 mm compr.; anteras ovais, ápice agudo, inseridas no terço superior do tubo; ovário ca. 1 C 0,5 mm, estilete 1,5­2 mm compr., estigma ca. 0,5 mm, capitado, base estigmática espessa. Fruto 4­lobado, imaturo verde, maduro amarelo, laranja, marrom ou vermelho, 2­4 C 3­5mm, glabro; sementes 4. Bolívia, Paraguai, norte da Argentina e Brasil. B9, C5, C8, C9, D8, D9, E6, E8, F5, F6, F8, F9, G8, H8: caatinga, dunas, borda de matas, beira de estrada e encostas de "inselbergs", em solo vermelho­argiloso, arenoso ou calcáreo. Floresce e frutifica de dezembro até julho e em outubro. Foi citado o consumo das sementes desta espécie por pássaros, em Cruz das Almas (D. Vidal 01). Material selecionado: Almadina, mar.2005, Fiaschi et al. 2759 (SPF); Caetité, fev.1992, Carvalho et al. 3765 (CEPEC, MBM); Feira de Santana, jun.2005, Conceição et al. 234 (HUEFS); Iaçú, mar.2005, França et al. 5158 (HUEFS); Itaetê, jul.2003, França et al. 4782 (HUEFS); Jeremoabo, mai.1981, Pinto 105/81 (RB, CEPEC); Jitaúna, mar.1967, Belém et al. 3380 (CEPEC); Jussari, fev.2004, Fiaschi et al. 1969 (CEPEC); Monte Santo, fev.2000, Giulietti
121 et al. 1850 (HUEFS); Pilão Arcado, mar.2006, Miranda et al. 923 (HUEFS); Quinjingue, mai.2005, Cardoso et al. 552 (HUEFS); Rio de Contas, mar.1994, Souza et al. 5269 (HUEFS, SPF); Salvador, abr.1995, Ribeiro et al. s/n (ALCB); Serrinha, mar.2005, Conceição et al. 127(HUEFS); Tucano, jan.2006, Cardoso et al. 899 (HUEFS). Segundo Smith (1970) o epíteto específico provém da corola cinabarina, sendo que ambos os termos fazem alusão à cor vermelha da corola. Esta característica faz com que esta espécie possa ser facilmente reconhecida. Além disso, T. rubicunda caracteriza­se pela presença dos tricomas com base insuflada principalmente na superfície adaxial da folha. Tais tricomas também estão presentes em T. melanochaeta DC., no entanto os tricomas nesta espécie são negros, o que difere de T. rubicunda que possui tais tricomas com coloração branca. O sinônimo listado segue Johnston (1930).
122 3.9. Tournefortia salicifolia (Gardn.) DC., Prodr. 9: 530. 1845. Basiônimo: Messerschmidia salicifolia Gardn., Lond. Jour. Bot. 1: 181. 1842. Fig. 22; 23 A­H. Arbusto, caule arredondado, velutíneo, tricomas ferrugíneos, ramos jovens sulcados, ritidoma e lenticelas ausentes. Folhas 4,1­13,3 C 1,7­4,7 cm, cartáceas, verdes, discolores, ovais ou elípticas, ápice caudado, base obtusa a aguda, margem inteira ou levemente sinuosa, viloso, tricomas ferrugíneos, venação broquidódroma; pecíolo 0,2­1,0 cm compr., ca. 2 mm espessura, viloso, tricomas ferrugíneos. Inflorescências terminais, raro axilares, 4,6­20,5 cm compr., pedúnculo 2,0­4,5 cm. Flores 6­7 mm compr., sésseis; cálice verde, lobos ovais, ápice agudo,, 2­3 mm compr., velutíneo; corola verde, tubo ca. 5 mm, velutínea, tricomas ferrugíneos, lobos ovais, ápice agudo,, 1­2 mm compr.; anteras ovais, ápice agudo, inseridas no terço superior do tubo; ovário ca. 1 C 0,5 mm, estilete ca. 1,5 mm compr., estigma ca. 0,5 mm, capitado, base estigmática espessa. Fruto 4­lobado, verde, 2­2 C 4 mm, estrigoso; sementes 4. Brasil (Bahia, Distrito Federal, Minas Gerais, Paraná, Rio de Janeiro e Rio Grande do Sul). D9, E9, G8, H7, J8: caatinga (mata de cipó) e mata atlântica. A espécie floresce e frutifica em fevereiro, março, julho, outubro e novembro. Material selecionado: Esplanada, fev.2002, Pirani et al. 4968 (SPF); Itacaré, jul.1995, Jardim et al. 646 (CEPEC); Prado, out.1993, Thomas et al. 10109 (CEPÉC); Salvador, fev.1992, Guedes et al. 2540 (CEPEC); Vitória da Conquista, fev.1992, Carvalho et al. 3810 (CEPEC). É a primeira vez que esta espécie está sendo citada para Bahia. Trata­se de uma espécie muito semelhante à Tournefortia villosa, sendo que muitos materiais encontrados de T. salicifolia estavam identificados como T. villosa. Entretanto a espécie pode ser facilmente distinguida por apresentar um denso indumento viloso e ferrugíneo na face adaxial das folhas e fruto estrigoso. Tais características não são observadas em T. villosa, a qual possui a face adaxial das folhas glabrescente e frutos glabros.
123 124
3.10. Tournefortia subsessilis Cham., Linnaea 8: 119. 1833 T. maritima Salzm. ex DC., Prodr. (DC.) 9: 526. 1845. T. pyrrhotricha Fresen., Fl. Bras. 8(1): 53. 1857. Fig. 18 E; 23 I­O; 24. Nome popular: crista­de­galo (Mata de São João). Subarbusto prostrado ou arbusto decumbentes, até 2,0 m alt.; caule ramos jovens sulcados, pubescentes, tricomas brancos, ritidoma e lenticelas ausentes. Folhas 4,5­10,7 C 2,1­5,7 cm, crassas, verdes, levemente discolores, cordiformes, ou ovais, ápice apiculado, base cordada, obtusa ou aguda, margem inteira ou levemente revoluta, face adaxial glabra, face abaxial pubescente, tricomas brancos, concentrados nas nervuras, venação craspedódroma, nervuras proeminentes na face abaxial; pecíolo 0,2­0,5 cm compr., 1­2 mm espessura, piloso, tricomas brancos. Inflorescências terminais ou internodais, 2,7­9,6 cm compr., pedúnculo 0,9­5,1 cm. Flores 5­6 mm compr., sésseis; cálice verde, lobos ovais, ápice agudo, 1­2 mm compr., pubescente; corola tubo verde, ca. 4 C 1 mm, pubescente, tricomas brancos ou ferrugíneos, lobos laranja, ovais, ápice agudo, 1­2 mm compr.; anteras ovais, ápice agudo, inseridas no terço superior do tubo; ovário ca. 1 C 0,5 mm, estilete ca. 2 mm compr., estigma ca. 0,5 mm, capitado, base estigmática espessa. Fruto 4­lobado, imaturo verde, maduro branco com 4 manchas esféricas pretas, 2­4 C 4­5 mm, glabro; sementes 4. Brasil (Bahia e Sergipe). D10, E9, E10, F9: restinga, solo arenoso. A espécie floresce e frutifica de outubro a janeiro e de junho a agosto. Material selecionado: Conde, nov.2005, Conceição et al. 382 (HUEFS); Camaçari, jul.1991, Guedes et al. s/n (HUEFS); Entre Rios, nov.2005, Conceição et al. 407 (HUEFS); Salvador, out.1984, Noblick et al. 3448 (CEPEC). Tournefortia subsessilis distingue­se das demais espécies de Tournefortia estudadas para a Bahia por possuir folhas crassas com margem levemente revoluta, venação craspedódroma e nervuras proeminentes na face abaxial. Por
125 possuir folhas com face adaxial glabra, assemelha­se a T. bicolor e a T. villosa que são glabrescente na face adaxial de suas folhas. Os frutos na maturidade são brancos, com quatro manchas esféricas pretas, caráter também observado em T. floribunda e T. villosa. Os sinônimos listados seguem Johnston (1930).
126 Fig. 24. Mapa de distribuição geográfica de Tournefortia subsessilis, T. villosa e Tournefortia sp.
127 3.11. Tournefortia villosa Salzm. ex DC., Prodr. 9: 524. 1845. Fig. 18F; 24; 25 A­G. Arbusto decumbente 1,5­2,5 m alt.; caule arredondado, ramos jovens sulcados, viloso, tricomas ferrugíneos, ritidoma e lenticelas ausentes. Folhas 5,8­ 19,7 C 1,5­8,7 cm, cartáceas, verdes, discolores, elípticas, ovais ou oboval, ápice caudado, base obtusa a aguda, levemente atenuada, margem inteira ou levemente sinuosa, face adaxial tricomas brancos, concentrados nas nervuras principal e secundárias, face abaxial viloso, tricomas ferrugíneos, venação broquidódroma; pecíolo 0,8­1,6 cm compr., 1­2 mm espessura, viloso, tricomas ferrugíneos. Inflorescências terminais ou internodais, 3,4­10,2 cm compr., pedúnculo 1,7­4,3 cm. Flores 3­5 mm compr., sésseis; cálice verde, lobos ovais, ápice agudo, 2­3 mm compr., viloso; corola tubo verde, ca. 5 C 1 mm, pilosa, tricomas ferrugíneos, lobos laranja, ovais, ápice agudo, 1­2 mm compr.; anteras ovais, ápice agudo, inseridas no terço superior do tubo; ovário ca. 1 C 0,5 mm, estilete 1,5­2 mm compr., estigma ca. 0,5 mm, capitado, base estigmática espessa. Fruto 4­lobado, imaturo verde, maduro branco com manchas pretas, ca. 3 C 5 mm, glabro; sementes 4. Brasil (Bahia, Espírito Santo, Minas Gerais, Piauí, Rio de Janeiro, Rio Grande do Sul, Santa Catarina, São Paulo, Sergipe). E5, E8, F7, F9: caatinga, mata de cipó, em borda de matas. A espécie floresce e frutifica de janeiro a abril. Material selecionado: Maracás, jan.1997, Arbo et al. 7701 (CEPEC); Jaguaquara, fev.1999, França et al. 2617 (HUEFS); Salvador, jul.1959, Costa 277 (ALCB); Santa Terezinha, mar.2006, Conceição et al. 484 (HUEFS). Tournefortia villosa pode ser facilmente reconhecida pelo indumento viloso de coloração ferrugínea que cobre a face abaxial de suas folhas. Assemelha­se a T. salicifolia, por esta característica, diferindo­se desta por apresentar a face adaxial pubescente, com tricomas concentrados nas nervuras e fruto glabro, enquanto em T. salicifolia a face adaxial das folhas possui indumento viloso e os frutos indumento estrigoso.
128 Candolle (1845) não apresentou características do fruto de Tournefortia villosa, ao descrever esta espécie, e comentou que essa estrutura não foi observada. Segundo Johnston (1930), os frutos de T. villosa seriam glabros; contudo, Silva (2004) afirmou que os frutos de T. villosa são finamente estrigosos e, raramente glabros. Entretanto, não foi encontrada a presença de tal indumento nos frutos dos espécimes analisados neste trabalho. Tournefortia pohlii Fresen. foi descrita por Fresenius (1857), na “Flora Brasiliensis”, mas sem indicação de ocorrência na Bahia. Johnston (1930) considerou esta espécie como sinônima de T. villosa.
129 130
3.12. Tournefortia sp. Fig. 24; 25 H­O. Arbusto, caule arredondado, glabro, ritidoma e lenticelas presentes. Folhas 2,2­8,2 C 0,8­2,6 cm, membranáceas, verdes, levemente discolores, face adaxial verde escuro, face abaxial verde claro, elípticas, ápice caudado, base aguda, levemente atenuada, margem inteira, hirsuto, tricomas brancos, venação boquidódroma; pecíolo 0,3­0,6 cm compr., 0,5­1 mm espessura, hirsuto, tricomas brancos. Inflorescências axilares, raro terminais, 2,3­7,3 cm compr., pedúnculo 0,5­2,8 cm. Flores ca. 5 mm compr., sésseis; cálice verde, lobos lineares, 2­3 mm compr., hirtelo; corola verde, ca. 4 C 1 mm, hirtela, tricomas brancos, lobos ovais, ápice agudo, ca. 1 mm compr.; anteras ovais, ápice agudo, inseridas no terço superior do tubo; ovário ca. 1 C 0,5 mm, estilete 1,5­2 mm, estigma ca. 0,5 mm compr., capitado, base estigmática espessa. Fruto 4­lobado, verde, 2­3 C 3­4 mm, hirsuto; sementes 4. Brasil (Bahia e Pernambuco). E6, E7: caatinga, em solo calcáreo. A espécie floresce e frutifica em novembro e dezembro. Material selecionado: Ibicoara, nov.2003, Melo et al. 3660 (HUEFS); Itaberaba, dez.1996, Harley et al. 28449 (HUEFS). Material adicional examinado: PERNAMBUCO: s/data, Giulietti et al. 1372 (HUEFS). Tournefortia sp. pode ser facilmente reconhecida pela presença de inflorescências axilares (raro terminal) e presença de lenticelas. A espécie assemelha­se muito a T. breviflora, tanto pela presença de ritidoma, quanto pelas inflorescências axilares, forma e ápice das folhas. Entretanto, os lobos da corola são menores em Tournefortia sp. (ca. 1 mm compr. e, em T. breviflora, 1,5­2 mm compr). Além disso, o fruto em Tournefortia sp. é hirsuto, enquanto em T. breviflora é glabro.
131 AGRADECIMENTOS Agradeço aos curadores de herbário que gentilmente nos receberam e enviaram empréstimos; à CAPES pela bolsa concedida e ao CNPq, pelo financiamento do Projeto Flora da Bahia. REFERÊNCIAS BIBLIOGRÁFICAS AL­SHEHBAZ, I. A. 1991. The genera of Boraginaceae in the southeastern United States. J. Arnold Arbor., série suplementar 1: 1­169. BARROSO, G.M. 1991. Sistematica de Angiospermas do Brasil. UFV, Impr. Univ., vol. 3, 3­5, 88­95 p. CANDOLLE, A.P. 1845. Borragineae. Prodromus systematis naturalis regni vegetabilis. Parte 9: 467­563 p. CORRÊA, M.P. 1926. Diccionario das plantas úteis do Brasil e das exóticas cultivadas. Rio de Janeiro, Ministério da Agricultura, Indústria e Comércio, Imprensa Nacional. 44 e 322 p. CORRÊA, M.P. 1931. Diccionario das plantas úteis do Brasil e das exóticas cultivadas. Ministério da Agricultura, Rio de Janeiro, vol. 2, 101, 209, 448­ 449 p. CRONQUIST, A. 1981. An intregated system of classification of flowering plants. New York, Columbia University Press. CRUZ, G.L. 1995. Dicionário das plantas úteis do Brasil. Bertrand Brasil, Rio de Janeiro, 5ª ed., 166 e 321 p. FÖRTHER, H. 1998. Die infragenerische Gliderrung der Gattung Heliotropium L. und ihre Stellung innerhalb der subfam. Heliotropioideae (Schrad.) Arn. (Boraginaceae). Sendtnera 5: 35­241. FRESENIUS, G. 1857. Boraginaceae; Heliotropiaceae. In C.F.P. Martius & A.G. Eichler (eds.). Flora Brasiliensis 8(1): 5­58. GREUTER, W.; MCNEILL, J.; BARRIE, F.R.; BURDET, H.M.; DEMOULIN, V. FILGUEIRAS, T.S.; NICOLSON, D.H.; SILVA, P.C.; SKOG, J.E.; TREHANE, P.; TURLAND, N.J.; HAWKSWORTH, D.L. 2003. Código
132 Internacional de Nomenclatura Botânica (Código de Saint Louis, 2000). São Paulo, IBt, IAPT & SBSP. GÜRKE, M. 1893. Borraginaceae. In: ENGLER, A. & PRANTL, K. (eds.) Die Natürlichen Pflanzenfamilien 4 (3a): 71­131. JOHNSTON, I.M. 1928. Studies in the Boraginaceae – VII: The South American Species of Heliotropium. Contr. Gray Herb. 81: 3­83. JOHNSTON, I.M. 1930. Studies in the Boraginaceae – VIII: Observations on the species of Cordia and Tournefortia known Brazil, Paraguay, Uruguay and Argentina. Contr. Gray Herb. 92: 3­95. JOHNSTON, I.M. 1935. Studies in the Boraginaceae – X: The Boraginaceae of Northeastern South America. J. Arnold Arbor. 1(16): 1­64. LINNAEUS, C. 1753. Species Plantarum. Stockholm, 130­149 p. MELO, J.I.M. & SALES, M.F. 2004. Heliotropium L. (Boraginaceae – Heliotropioideae) de Pernambuco, Nordeste do Brasil. Rodriguésia 55(84): 65­87. SILVA, L.C. 2004. Estudos taxonômicos das espécies extra­amazônicas de Tournefortia L. (Boraginaceae s.l.). Universidade Estadual Paulista “Julio Mesquita Filho”, Dissertação de Mestrado. SMITH, L.B. 1970. Boragináceas. In Flora Ilustrada Catarinense pp. 1­85. Herbário "Barbosa Rodrigues", Itajaí, Brasil.
133 LISTA DE EXSICATAS Adorno, J.M.S.: 2 (1.1). Alves, L.J.: 434 (1.8) Amorim, A.M.: 1014 (1.8), 2349 (3.2), 2992 (1.9); 6132 (3.5). Carvalho, P.D.: 308 (1.12), 341 (1.9); 345 (3.4). Carvalho­Sobrinho, J.G.: 133 (1.1), 178 (3.8), 467 (1.11), 673 (3.3). Amorim, A.M.A.: 1014 (1.8), 1446 (3.5). Araújo­Nóbrega, M.: 25 (1.9). Castellanos, A.: 24353 (1.8), 25036 (1.8), 25831 (1.10), 25911 (1.1), 26050 (1.1). Arbo, M.M.: 5391 (1.9), 7241 (1.1), 7298 (1.8), 7300 (1.1), 7420 (1.9), 7701 (3.11). Castro, R.M.: 1285 (1.1). Arouck­Ferreira, J.D.C.: 260 (3.8). Cerqueira, J.: 21 (1.8). Arrais, M.G.: CFCR 6724 (1.8). Conceição, A.A.: 102 (1.9), 1583 (1.8), 1692 (1.9). Bandeira, F.P.: 231(3.8). Barreto, J.D.: s/n (1.8). Barreto, V.: 4 (1.8), 152 (1.3), 156 (1.8), 243 (3.8). Bastos, B.C.: 491 (1.8). Bautista, H.P.: 398 (1.9), 916 (1.10), 1240 (1.11), 1450 (1.7), 1467 (3.1), 3451 (1.1), 3460 (1.8), 4376 (2.1). Belém, R.P.: 597 (3.1), 607 (3.1), 1439 (3.1), 2480 (3.3), 2557 (3.6), 3380 (3.8). Brito, H.S.: 146 (3.5), 221(3.4), 247 (3.4). Conceição, S.F.: 26 (1.1), 79 (1.1), 96 (1.9), 97 (1.9), 116 (3.4) 118 (3.3), 119 (1.1), 120 (1.8), 122 (3.4), 126 (1.1), 127 (3.8), 130 (3.8), 131 (3.4), 132 (1.10), 133 (1.11), 178 (1.9), 196 (1.1), 198 (2.1), 199 (1.5), 200 (1.1), 202 (1.11), 221 (1.8), 222 (1.1), 228 (3.4), 233 (1.8), 234 (3.8), 236 (1.1), 268 (1.8), 380 (1.8), 381 (1.7), 382 (3.10), 285 (1.1), 286 (1.3), 372 (1.8), 373 (1.3), 407 (3.10), 424 (1.3), 425 (1.3), 426 (1.6), 454 (3.5), 455 (3.6), 484 (3.11), 485 (3.3), 486 (3.4), 487 (1.1), 448 (1.6), 489 (3.8). Correia, C.: 119 (1.9). Costa, A.L.: s/n ALCB (3.4). Britto, K.B.: s/n (1.8). Costa, G.: 12 (1.9), 45 (1.9). Cardoso, D.: 552 (3.8), 984 (3.9), 899 (3.8), 1195 (3.8). Costa, J.: 164 (1.7). Carneiro­Torres, D: 373 (1.8). Couto, A.P.L.: 21 (3.8), 34 (1.1), 43 (3.8). Carvalho, A.M.: 519 (1.1), 1302 (3.5), 1318 (3.6), 1460 (3.9), 1944 (1.1), 1951 (3.3), 2012 (3.5), 2070 (3.8), 2657 (1.8), 2683 (1.2), 2692 (1.1), 2793 (1.1), 3589 (3.1), 3589 (3.1), 3765 (3.8), 3810 (3.9), 3900 (1.9), 4094 (3.6), 6072 (3.5), 6363 (1.9), 6959 (3.4). Cruz, N.R.S.: 31 (3.11). Duarte A.P.: 6033 (3.4), 9319 (1.8), 10553 (1.1), 10561 (1.8). Duarte, D.P.: 10533 (1.1).
134 Duarte, L.: 312 (1.8), 322 (1.12), 336 (1.1), s/n (1.12). Grupo Pedra do Cavalo: 164 (1.6), 166 (3.8), 262 (1.8), 300 (1.11), 614 (1.8), 1080 (3.8). Emmerich, C.: 26 (1.1). Felix, L.P.: 9506 (1.8), 9538 (1.9). Guedes, M.L.: 514 (1.8), 1098 (1.9), 2540 (3.9), PCD 3071 (1.8), 3253 (3.5), 3422 (3.9), 4630 (1.11), 5425 (3.4), 7064 (3.4), 7382 (1.7), 7923 (3.8), 7927 (3.8), 10508 (3.3), 10509 (3.4), 11230 (1.9), s/n (3.1), s/n (3.10), s/n (1.8), s/n ALCB 21103 (3.4). Ferreira, J.A.C.A.: 232 (1.6). Gusmão, E.: 278 (3.6), 371 (3.1). Ferreira, M.C.: 867 (1.6), 897 (1.6). Hage, J.L.: 473 (3.1), 818 (3.6), 975 (1.6), 1220 (1.6), 1788 (1.6), 1932 (1.6). Emperaire, L.: s/n (1.10). Euponino, A.: 185 (3.5), 295 (3.1), 321 (3.1), 327 (3.1), 395 (3.1), 472 (3.4). Ferruci, M.S.: 1026 (1.1). Fiaschi, P.: 1684 (3.5), 1969 (3.8), 2759 (3.8). Filho, L.C.O.: 88 (1.1). Fonseca, W.N.: 382 (1.10). França, F.: 1100 (3.11), 1654 (1.6), 1745 (1.1), 1921 (3.4), 1976 (1.8), 2005 (1.8), 2394 (1.8), 2612 (3.11), 2617 (3.11), 2730 (1.8), 2988 (1.8), 3065 (3.3), 3120 (1.8), 3213 (1.9), 3460 (1.10), 3926 (1.8), 3949 (1.5), 4104 (1.10), 4117 (1.9), 4175 (1.9), 4223 (1.10), 4345 (1.8), 4346 (1.1), 4673 (1.1), 4742 (3.3), 4765 (3.3), 4782 (3.8), 4858 (3.7), 5127 (3.8), 5158 (3.8), 5324 (1.3), 5427 (3.3), 5331 (1.8). Freire­Fierro, A.: s/n (2.1), s/n (1.9). Ferreira, M.C.: 1305 (3.5). Furlan, A.: 7485 (1.4), 7499 (1.9). Ganev, W.: 1388 (3.4), 1538 (3.4), 1738 (1.9), 3116 (1.9). Giulietti, A.M.: 1322 (1.9), 1339 (1.9), 1372 (3.12), 1783 (1.10), 1784 (1.10), 1850 (3.8), 2206 (1.9), s/n (1.7). Gomes, L.: 1 (1.7). Costa, A.L.: 277 (3.11) Grillo, A.A.: 147 (1.9). Harley, R.M.: 3182 (1.9), 3406 (1.1), 5126 (1.1), PCD 5128 (2.1), PCD 5943 (1.9), 6002 (1.8), 14236 (1.10), 15248 (1.1), 15505 (3.5), 15509 (1.9), 15844 (1.9), 16150 (1.1), 16391 (1.4), 16401 (3.8), 16655 (1.9), 16846 (1.9), 17175 (3.5), 17432 (1.10), 17447 (1.6), 18180 (3.6), 19076 (1.2), 19076A (1.7), 19111 (2.1), 19343 (1.9), 19468 (1.1), 19950 (1.9), 20517 (1.8), 20518 (1.1), 20788 (1.9), 20953 (1.9), 21905 (1.9), 21925 (1.11), 22017 (1.8), 22018 (1.1), 22019 (1.8), 22135 (1.1), 22285 (1.9), 22735 (1.1), 22739 (1.9), 22993 (3.3), 23024 (1.1), 23025 (1.8), 24141 (1.9), 24226 (3.4), 25286 (3.4), 25832 (1.3), 25837 (3.4), 25853 (1.8), 26006 (1.9), 26064 (1.9), 26488 (3.4), 26489 (3.3), 26514 (1.9), 26933 (1.9), 26968 (1.9), 28444 (3.4), 28449 (3.12), 53548 (1.9), 54333 (2.1). Hatschbach, G.: 39595 (1.9), (1.1), 44164 (1.6), 44273 (3.3), (3.1), 55170 (2.1), 55184 (1.8), (1.7), 63216 (1.1), 65782 (1.8), (1.1), 65808 (2.1), 67763 (2.1), (1.8), 75709 (1.1), 75739 (1.8), (1.3), 75824 (1.1), 77788 (1.1), (1.10). 39678 50743 63147 65783 75705 75775 78693 Hind, D.J.N.: H50464 (3.4), H50477 (1.8), H50931 (1.9), s/n (1.3). Jardim, J.G.: 646 (3.9), 695 (1.8), 2038 (3.8), 2789 (3.5), 2922 (3.3), 3379 (1.8), 3390 (1.1), 3416 (1.8), 3456 (1.8), 3616 (1.8), 4065 (3.1).
135 Jesus, J.A.: 406 (3.3), 502 (3.6). Moraes, A.O.: 26 (1.1), 86 (1.8), 236 (1.9). Jesus, N.G.: 889 (3.4), 1460 (3.10), 1554 (1.7), 1653 (3.10), 1777 (1.7), 1929302 (3.10). Moraes, M.V.: 470 (1.8), 567 (3.8), 604 (3.4), 637 (1.9), 754 (1.6). Jogaib, M.B.: 93 (1.6). Morin, S.: 13545 (1.9). Juchum, F.: 36 (3.6). Mori, S.A.: 9425 (3.9), 9588 (3.2), 10023 (3.11), 10149 (3.1), 10770 (3.1), 11223 (1.1), 13279 (1.8), 13545 (1.9), 14430 (1.1), 14479 (1.9), s/n (1.8), s/n (1.1). Junqueira, M.E.R.: 207 (1.2), 210 (1,9). Kallunki, J.A.: 413 (3.1). Nascimento, A.F.S.: 91 (1.8). Kral, R.: s/n (1.1). Nascimento, J.G.A.: 249 (1.9). Krapovickas, A.: 37899 (2.1). Lewis, G.P.: 7431 (3.8). Lima, A.: 61­3941 (1.8). Lima, C.T.: 27 (3.8). Lima, J.C.A.: 72 (1.3). Lima, J.R.: s/n (3.8). Lima, L.R.: 265 (1.9). Lopes, M.M.M.: 340 (3.5). Loureiro, D.M.: 346 (3.4), 606 (3.1). Machado, M.: 101 (1.11), 238 (1.9). Mattos, L.A.: 519 (3.6), 2276 (3.3). Noblick, L.R.: 1869 (1.8), 2221 (3.10), 2342 (1.6), 2658 (3.3), 2933 (1.8), 3206 (3.8), 3286 (3.8), 3448 (3.10), 3466 (1.7), 3686 (3.8), s/n (1.11). Nunes, T.S.: 303 (1.8), 456 (1.7), 654 (1.7), 663 (1.7), 1240 (1.1), 1404 (3.3), 1422 (1.8), 1423 (1.3), 1424 (1.4), 1488 (1.9), 1663 (1.10). Oliveira, A.: 6 (3.3). Oliveira, E.L.P.G.: 725 (1.1). Oliveira, R.P.: 435 (1.1). Orlandi, R.P.: 129 (1.10), 475 (1.9). Paula­Souza, J.: 4814 (1.9), 5189 (2.1). Matos, M.L.S.: 6 (1.8). Pereira, E.: 2019 (1.9), 9745 (1.8), 10032 (1.10). Melo, A.C.: 7 (3.8). Pereira, E.P.: 9699 (3.3). Melo, E.: 1146 (3.8), 1160 (3.4), 1179 (3.7), 1202 (3.4), 1868 (3.8), 1949 (3.8), 2010 (1.8), 2012 (1.6), 2059 (3.8), 2519 (3.7), 3070 (3.1), 3094 (1.1), 3116 (1.8), 3147 (1.2), 3429 (1.1), 3448 (1.9), 3462 (1.9), 3553 (3.4), 3660 (3.12), 4290 (1.10), 4335 (1.1), 4420 (1.8). Pereira, M.V.L.: 163 (1.1). Pilio, R.: 34 (3.1). Pinheiro, R.S.: 307 (3.1), 1392 (3.6). Pinto, G.: 105/81 (3.8), 125/81 (1.1), 281 (1.1). Miranda, A.M.: 99 (1.6). Pinto, G.C.P.: 38/83 (3.4), 384/83 (1.1). Miranda, E.B.: 858 (1.1), 873 (1.8), 923 (3.8), 977 (2.1). Pirani, J.R.: 2335 (3.1), 4968 (3.9).
136 Porto, P.C.: 1406 (3.3), 1434 (2.1), 1438 (1.3), s/n (3.8), s/n RB 22580 (1.10). Shepherd, G.J.: 4488 (1.1). Silva, F.H.M.: 413 (1.3). Queiroz, E.P.: 536 (3.10), 1498 (1.6), s/n (3.10). Silva, L.A.M.: 159 (1.11), 519 (3.6). Queiroz, L.P.: 1157 (1.8), 1499 (1.3), 4320 (1.8), 4323 (1.1), 5701 (3.3), 5722 (1.10), 5779 (1.5), 6952 (1.8), 9022 (1.1), 9068 (1.8), 9647 (1.3), 9669 (1.7), 9672 (2.1); 12183 (1.7); 12270 (1.11); 12308 (1.10). Silva, L.B.: 46 (1.6). Ribeira­Filho, A.A.: 138 (1.3). Silva, P.R.O.: s/n (3.1). Ribeiro, A.J.: s/n ALCB (3.8); s/n RB 334565 (3.4). Silva, R.F.S.: 126 (1.7), 203 (1.8); 243 (1.8); 244 (1.1). Ribeiro, T.: 67 (1.7), 88 (3.5). Silva, S.B.: 166 (2.1), 268 (3.4). R.S.P.: 1118 (3,1). Silva, T.R.S.: 208 (1.9), 218 (1.8), 219 (1.1). Saar, E.: PCD 5242 (1.12), 5701 (3.3), PCD 5765 (1.9). Sobral, M.: 5841 (3.11). Salgado, A.O.: 308 (2.1). Soeiro, R.: 11/96 (3.10), 20/96 (1.7). Santana, D.L.: 33 (1.6), 505 (3.4). Souza, H.F.: 78 (1.8). Santana, S.C.: 506 (3.4), 511 (3.3), 759 (1.9), 887 (3.6). Souza, V.C.: 5261 (1.8), 5259 (1.11), 5262 (1.1), 5269 (3.8), 5386 (1.4), 5399 (1.3), 22733 (1.9). Santos, A.K.A.: 69 (3.8), 210 (3.10), 410 (1.9), 438 (3.10), 723 (1.9), 745 (1.9), 786 (1.9). Santos, E.B.: 180 (3.1), 186 (3.5), 4132 (3.2). Silva, M.F.B.L.: 17 (3.8). Silva, M.M.: 177 (1.3), 184 (1.8), 303 (1.1). Stannard, B.: 2446 (3.3), 5199 (1.12), CFCR 6834 (1.9), H52749 (1.9), 5536 (1.9). Stapf, M.N.S.: 243 (1.2), 364 (3.1), 400 (1.5), 410 (1.4), 472 (3.3). Santos, P.T.: CFCR 14422 (1.10). Taylor, E.L.: E1179 (3.1). Santos, R.S.: 24353 (1.8), 24354 (1.1). Santos, S.: 27 (1.3). Santos, T.S.: 425 (3.8), 439 (1.6), 847 (1.8), 1021 (3.6), 1200 (3.1), 1560 (3.2), 1909 (3.6), 3069 (1.8), 3238 (3.1), 3484 (1.8), 14375 (3.1). Thomas, W.W.: 10109 (3.9), 10111 (3.1), 11245 (3.1), 11250 (3.5), 11547 (3.2), 11915 (3.1), 13553 (3.3), 13865 (3.3), s/n (3.7). Torrend, C.: s/n (3.3). Van den Berg, C.: 955 (1.1). Santos, V.J.: 425 (1.1). Schinini, A.: 33374 (1.5). Wanderley, M.G.L.: 1642 (1.3), 1643 (1.1), 13865 (3.3), 75505 (1.9). Senna, L.R.: 11 (1.1). Webster, G.L.: 25033 (3.4).
137 CONSIDERAÇÕES FINAIS Na realização deste trabalho, algumas dificuldades foram encontradas. As espécies Heliotropium sp., Tournefortia breviflora, T. gardneri, T. paniculata, T. salicifolia e Tournefortia sp. não foram recoletadas. Assim não foi possível a visualização do material vivo, bem como a obtenção de fotos dos mesmos. Algumas espécies, a exemplo de T. gardneri, T. floribunda e H. salicoides são muito variáveis em relação ao indumento e tamanho das folhas, o que em alguns momentos dificultou o seu reconhecimento. Além disso, foram encontradas variações em relação aos cálices, que são acrescente em algumas espécies e em relação às inflorescências, que apareceram em posição internodal em muitas espécies de Tournefortia. Por serem caracteres pouco estudados, futuros estudos seriam oportunos para maior compreensão dos mesmos e para contribuir com a delimitação das espécies.
138