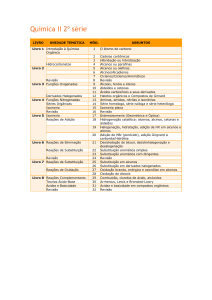
DQ-FCT-UNL
QUÍMICA II
RESUMOS DE QUÍMICA ORGÂNICA
CAPÍTULO VII
JOÃO PAULO NORONHA
2012
Química II.2012
Capítulo 7 – ALCENOS E ALCINOS I. PROPRIEDADES E SÍNTESES
7.1 INTRODUÇÃO
1. Os alcenos são hidrocarbonetos cujas moléculas contêm a ligação dupla C=C.
1) Olefinas:
i) O etileno foi chamado gás olefiante (América: oleum, óleo + facere, para fazer) porque o
etano gasoso (C2H4) reage com cloro para formar C2H4Cl2, um líquido (óleo).
2. Os alcinos são hidrocarbonetos cujas moléculas contêm a ligação tripla C≡C.
1) Acetilenos:
7.1A PROPRIEDADES FÍSICAS DE ALCENOS E ALCINOS
1. Os alcenos e alcinos têm propriedades físicas semelhantes às dos alcanos correspondentes.
1) Os alcenos e alcinos até quatro carbonos (excepto o 2-butino) são gases à temperatura
ambiente.
2) Os alcenos e alcinos dissolvem-se em solventes não polares ou em solventes de polaridade
baixa.
i) Os alcenos e alcinos são apenas muito ligeiramente solúveis em água (com os alcinos sendo
ligeiramente mais solúveis do que alcenos).
ii) Os alcenos e alcinos têm densidades mais baixas que a da água.
7.2 NOMENCLATURA DE ALCENOS E CICLOALCENOS
1. Determinar o nome de base, selecionando a cadeia mais longa que contém a ligação dupla e
mudar o sufixo (final do nome) do alcano de comprimento idêntico de -ano para -eno.
2. Numerar a cadeia de modo a incluir ambos os átomos de carbono da ligação dupla, e começar a
numeração na extremidade da cadeia mais perto da ligação dupla. Designar o local da ligação
dupla, usando o número do primeiro átomo da ligação dupla como um prefixo:
3. Indicar a localização dos grupos substituintes por numeração dos átomos de carbono aos quais
estão ligados.
4. Numerar cicloalcenos substituídos da mesma maneira que dá aos átomos de carbono da ligação
dupla as posições 1 e 2 e que também dá aos grupos substituintes os números mais baixos, no
primeiro ponto de diferença.
2
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
5. Nomear os compostos contendo uma ligação dupla e um grupo álcool como alcenol (ou
cicloalcenol) e dar ao carbono álcool o menor número.
6. Dois grupos alcenilo frequentemente encontrados são o grupo de vinilo e o grupo alilo.
7. Se dois grupos idênticos estão no mesmo lado da ligação dupla, o composto pode ser designado
cis-; se eles estão em lados opostos pode ser designado trans-.
7.2A O SISTEMA (E) - (Z) PARA DESIGNAÇÃO DE DIASTEREÓMEROS DE ALCENOS
1. As designações cis- e trans- da estereoquímica dos diastereómeros de alcenos são inequívocas
apenas quando aplicadas a alcenos dissubstituídos.
2. O Sistema (E) - (Z):
1) O grupo de prioridade mais alta num átomo de carbono é comparado com o grupo de prioridade
mais elevada no outro átomo de carbono:
i) (Z)-alceno: Se os dois grupos de maior prioridade estão do mesmo lado da ligação dupla (alemão:
zusammen, significando juntos).
ii) (E)-alceno: Se os dois grupos de maior prioridade estão do lado oposto da ligação dupla (alemão:
entgegen, significando opostos).
3
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
7.3 ESTABILIDADES RELATIVAS DE ALCENOS
7.3A CALORES DE HIDROGENAÇÃO
1. A reação de um alceno com hidrogénio é uma reação exotérmica, a variação de entalpia
envolvida é chamada de calor de hidrogenação.
1) A maioria dos alcenos tem calores de hidrogenação próximos de -120 kJ mol-1.
H° ≈ – 120 kJ mol–1
2) Alcenos individuais têm calores de hidrogenação que podem ser diferentes deste valor por
mais de 8 kJ mol-1.
3) As diferenças permitem a medição das estabilidades relativas de isómeros de alcenos
quando a hidrogenação converte-os no mesmo produto.
3. Em cada reação:
1) O produto (butano) é o mesmo.
4
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
2) Um dos reagentes (hidrogénio) é o mesmo.
3) A diferente quantidade de calor desenvolvida está relacionada com as diferentes
estabilidades (diferentes conteúdos de calor) dos butenos individuais.
Figura 7.1 Um diagrama de energia para os três isómeros do buteno. A ordem de
estabilidade é trans-2-buteno > cis-2-buteno > 1-buteno.
4) O 1-buteno quando hidrogenado desenvolve maior quantidade de calor, e o trans-2-buteno
desenvolve a mínima quantidade de calor.
i) O 1-buteno deve ter a maior energia (entalpia) e é o isómero menos estável.
ii) O trans-2-buteno deve ter a menor energia (entalpia) e é o isómero mais estável.
3. Tendência de estabilidades: isómero trans > isómero cis
5
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
4. A maior a entalpia dos isómeros cis pode ser atribuída à tensão causada pela proximidade dos
dois grupos alquilo no mesmo lado da ligação dupla.
Figura 7.2 Isómeros cis- e trans-alceno. O isómero cis menos estável tem uma maior tensão.
7.3B ESTABILIDADES RELATIVAS DOS CALORES DE COMBUSTÃO
1.
Quando a hidrogenação de alcenos isoméricos não produz o mesmo alcano, os calores de
combustão pode ser usados para medir as suas estabilidades relativas.
1) O 2-metilpropeno não pode ser comparado diretamente com outros isómeros do buteno.
2) O isobutano e o butano não possuem a mesma entalpia assim não é possível uma
comparação direta dos calores de hidrogenação.
2.
O 2-metilpropeno é o mais estável dos quatro isómeros C4H8:
6
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
3.
A estabilidade dos isómeros do buteno:
7.3C RESUMO DAS ESTABILIDADES RELATIVAS DE ALCENOS
1. Quanto maior for o número de grupos alquilo ligados (isto é, mais substituídos os átomos de
carbono da ligação dupla), maior é a estabilidade do alceno.
7.4 CICLOALCENOS
1. Os anéis de cicloalcenos contendo cinco átomos de carbono ou menos existem apenas na forma
cis.
Ciclopropeno
Ciclobuteno
Figura 7.3
Ciclopenteno
Ciclo-hexeno
cis-Cicloalcanos.
7
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
2. Há evidências de que o trans-ciclo-hexeno pode ser formado em algumas reações químicas como
um intermediário muito reativo de curta duração.
Figura 7.4 Hipotético trans-ciclo-hexeno. Esta molécula é aparentemente demasiado
tensa para existir à temperatura ambiente.
3. O trans-Ciclo-hepteno tem sido observado espectroscopicamente, mas é uma substância com
tempo de vida muito curto e não foi isolado.
4. O trans-cicloocteno foi isolado.
1) O anel do trans-cicloocteno é suficientemente grande para acomodar a geometria exigida pela
ligação dupla trans e ainda ser estável à temperatura ambiente.
2) O trans-cicloocteno é quiral e existe como um par de enantiómeros.
cis-Cicloocteno
trans-Cicloocteno
Figura 7.5 As formas cis- e trans- do cicloocteno.
7.5
1.
SÍNTESES DE ALCENOS VIA REAÇÕES DE ELIMINAÇÃO
Desidrohalogenação de Halogenetos de Alquilo
8
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
2.
Desidratação de Álcoois
3.
Desbromação de Dibrometos vicinais
7.6
DESIDROHALOGENAÇÃO DE HALOGENETOS DE ALQUILO
1. A síntese de um alceno por desidrohalogenação é quase sempre melhor conseguida por uma
reação de E2:
2. É utilizado um halogeneto de alquilo secundário ou terciário, se possível, a fim de provocar uma
reação E2.
3. É utilizada uma concentração elevada de uma base forte relativamente não polarizável, como o
ião alcóxido, para evitar a reação E1.
4. É empregue um solvente relativamente polar, como um álcool.
5. Para favorecer a eliminação geralmente é usada, uma temperatura relativamente elevada.
6. O etóxido de sódio em etanol e o terc-butóxido de potássio em álcool terc-butílico são
reagentes típicos.
7. Por vezes é usado hidróxido de potássio em etanol:
OH– + C2H5OH
H2O + C2H5O–
9
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
7.6A REAÇÕES E2: A ORIENTAÇÃO DA LIGAÇÃO DUPLA NA REGRA DE PRODUTO
ZAITSEV
1. Para algumas reações de desidrohalogenação, é possível um único produto de eliminação:
2. A desidrohalogenação de muitos halogenetos de alquilo produz mais que um produto:
1) Quando é usada uma pequena base tal como o ião etóxido ou iões de hidróxido, o produto
principal da reação será o alceno mais estável.
10
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
i) O alceno mais estável tem a ligação dupla mais substituída.
3. O estado de transição para a reação:
1) O estado de transição para a reação levando ao 2-metil-2-buteno tem o carácter de
desenvolvimento de uma ligação dupla num alceno trissubstituído.
2) O estado de transição para a reação levando ao 2-metil-1-buteno tem o carácter de
desenvolvimento de uma ligação dupla num alceno dissubstituído.
3) Uma vez que o estado de transição levando ao 2-metil-2-buteno se assemelha a um alceno
mais estável, este estado de transição é mais estável.
Figura 7.6 A reação (2) que conduz ao alceno mais estável ocorre mais rapidamente do que a
reação (1) que conduz ao alceno menos estável; G‡(2) é menor do que G‡(1).
i) Uma vez que este estado de transição é mais estável (ocorre a menor energia livre), a energia
livre de ativação para esta reação é menor e o 2-metil-2-buteno é formado mais rapidamente.
11
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
4) Estas reações são conhecidas por estarem sob controlo cinético.
5. Regra de Zaitsev: uma eliminação ocorre para dar o alceno mais estável, mais altamente
substituído.
1) Químico russo A. N. Zaitsev (1841-1910).
2) O nome Zaitsev é também transcrito como Zaitzev, Saytzeff, ou Saytzev.
7.6B UMA EXCEÇÃO À REGRA DE ZAITSEV
1. Uma base volumosa, como o terc-butóxido de potássio em álcool terc-butílico favorece a
formação do alceno menos substituído em reações desidrohalgenação.
1) A razão para levar ao produto de Hofmann:
i) A base estereoquimicamente impedida.
ii) A associação da base com as moléculas de solvente torna-a ainda maior.
iii) O terc-butóxido remove um dos átomos de hidrogénio (1°) mais expostos em vez dos átomos
de hidrogénio internos (2°) devido à sua maior aglomeração no estado de transição.
7.6C
1.
A ESTEREOQUÍMICA DAS REAÇÕES E2: A ORIENTAÇÃO DOS GRUPOS NO
ESTADO DE TRANSIÇÃO
Periplanar:
1) O requisito para coplanaridade da unidade de H–C–C–L surge a partir de uma necessidade da
adequada sobreposição de orbitais no desenvolvimento da ligação do alceno que está a ser
formado.
2) Conformação Anti-periplanar:
i) O estado de transição anti-periplanar é em estrela (escalonado) (e, portanto, de menor
energia) e, portanto, é o preferido.
12
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
3) Conformação Syn periplanar:
i) O estado de transição syn periplanar é eclipsado e só ocorre com as moléculas rígidas que são
incapazes de assumir o arranjo anti.
2. Cloreto de neomentilo e cloreto de mentilo:
1) O hidrogénio e o grupo de saída num anel de ciclo-hexano pode assumir uma conformação
anti-periplanar apenas quando eles são ambos axiais:
2) A conformação mais estável do cloreto de neomentilo:
i) Os grupos alquilo são ambos equatoriais e o cloro é axial.
ii) Há também átomos de hidrogénio axiais em ambos C1 e C3.
ii) A base pode atacar qualquer um destes átomos de hidrogénio e alcançar um estado de
transição anti-periplanar para uma reação E2.
ii) Os produtos correspondentes a cada um destes estados de transição (2-menteno e 1menteno) são formados rapidamente.
v) O 1-menteno (com a ligação dupla mais substituída) é o produto principal (regra de Zaitsev).
13
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
Um Mecanismo para a Reação de Eliminação do Cloreto de Neomentilo
Eliminação E2 onde existem dois Hidrogénios Axiais do Ciclo-hexano
Um Mecanismo para a Reação de Eliminação do Cloreto de Mentilo
Eliminação E2 onde o único Hidrogénio Axial elegível do Ciclo-hexano é de um Confórmero Menos
Estável
14
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
3) A conformação mais estável do cloreto de mentilo:
i) Os grupos alquilo e o cloro estão equatoriais.
ii) Para o cloro se tornar axial, o cloreto de mentilo tem de assumir uma conformação em que o
grupo volumoso isopropilo e o grupo metilo estão também axiais.
ii) Esta conformação é de energia muito mais elevada, e a energia livre de ativação para a reação
é grande, porque inclui a energia necessária para a alteração conformacional.
ii) O cloreto de mentilo sofre uma reação E2 muito lentamente, e o produto é unicamente o 2menteno (produto Hofmann).
7.7
1.
DESIDRATAÇÃO DE ÁLCOOIS
Desidratação de álcoois:
1) O aquecimento da maioria dos álcoois com um ácido forte faz com que eles percam uma
molécula de água e formem um alceno:
2. A reação é uma eliminação e é favorecida a temperaturas mais elevadas.
1) Os ácidos mais comumente utilizados em laboratório são os ácidos de Bronsted ––– dadores
de protões tal como ácido sulfúrico e ácido fosfórico.
2) Os ácidos de Lewis, tais como a alumina (Al2O3) são frequentemente utilizados em aplicações
industriais, desidratações em fase gasosa.
3. Características das reações de desidratação:
1) As condições experimentais ––– temperatura e concentração de ácido ––– que são
necessárias para provocar a desidratação estão intimamente relacionadas com a estrutura
individual do álcool.
i) Os álcoois primários são os mais difíceis de desidratar:
ii) Os álcoois secundários geralmente desidratam sob condições mais suaves:
15
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
iii) Os álcoois terciários são geralmente desidratados sob condições extremamente suaves:
iv) A facilidade relativa da ordem de desidratação de álcoois:
2) Alguns álcoois primários e secundários também sofrem rearranjo do seu esqueleto
carbonado durante a desidratação.
i) A desidratação do 3,3-dimetil-2-butanol:
ii) O esqueleto carbonado do reagente é
16
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
7.7A MECANISMO DE DESIDRATAÇÃO DE ÁLCOOIS: UMA REAÇÃO E1
1. O mecanismo é uma reação E1 em que o substrato é um álcool protonado (ou um ião
alquiloxónio).
Passo 1
1) No passo 2, o grupo de saída é uma molécula de água.
2) A ligação carbono-oxigénio quebra heteroliticamente.
3) É um passo altamente endergónico e, portanto, é o passo mais lento.
Passo 2
Passo 3
7.7B ESTABILIDADE DO CARBOCATIÃO E O ESTADO DE TRANSIÇÃO
1. A ordem de estabilidade de carbocatiões é 3° > 2° > 1° > metilo:
17
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
Um Mecanismo para a Reação
Desidratação Catalisada por Ácido de Álcoois Secundários ou Terciários: Uma Reação E1
Passo 1
Passo 2
Passo 3
2. A ordem da energia livre de ativação para a desidratação de álcoois é 3 °> 2 °> 1 °> metilo:
18
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
Figura 7.7 Diagramas de energia livre para a formação de carbocatiões de álcoois protonados terciários,
secundários e primários. As energias livres de ativação relativas são terciário < secundário « primário.
3. Postulado de Hammond-Leffler:
1) Há uma forte semelhança entre o estado de transição e o produto catião.
2) O estado de transição que leva ao carbocatião 3° é o de energia livre mais baixa porque se
assemelha ao produto mais estável.
3) O estado de transição que leva ao carbocatião 1° é o de energia livre mais elevada porque
se assemelha o produto menos estável.
4. A deslocalização de carga estabiliza o estado de transição e o carbocatião.
1) O carbono começa a desenvolver uma carga parcial positiva porque está a perder os eletrões
que o ligavam ao átomo de oxigénio.
2) Esta carga positiva em desenvolvimento é mais eficazmente deslocalizada no estado de
transição que conduz a um carbocatião 3° por causa da presença de três grupos alquilo
dadores de eletrões.
19
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
3) Devido a este desenvolvimento carga positiva ser menos eficazmente deslocalizado no estado
de transição conduzindo a um carbocatião 1°, a desidratação de um álcool 1° ocorre através de
um mecanismo diferente ––– um mecanismo E2.
7.7C
UM MECANISMO PARA A DESIDRATAÇÃO DE ÁLCOOIS PRIMÁRIOS:
UMA REAÇÃO E2
Um Mecanismo para a Reação
Desidratação de um Álcool Primário: Uma Reação E2
20
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
7.8
ESTABILIDADE DO CARBOCATIÃO E A OCORRÊNCIA DE REARRANJOS
MOLECULARES
7.8A REARRANJOS DURANTE A DESIDRATAÇÃO DE ÁLCOOIS SECUNDÁRIOS
Passo 1
Passo 2
1.
O carbocatião 2°, menos estável, rearranja num carbocatião 3° mais estável.
Passo 3
2. O grupo metilo migra com o seu par de eletrões, tal como um anião metilo, -:CH3 (um ião
metanido).
3. Troca 1,2:
4. No estado de transição o metilo que troca fica ligado parcialmente a ambos os átomos de
carbono pelo par de eletrões com o qual ele migra. Nunca deixa o esqueleto carbonado.
21
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
5. Há duas maneiras de remover um protão do carbocatião:
1) Via (b) conduz a um alceno altamente estável tetrassubstituido, e este é a via seguida pela
maioria dos carbocatiões.
2) Via (a) conduz a um alceno menos estável, dissubstituído e produz o produto minoritário da
reação.
3) A regra geral (regra de Zaitsev) é a formação do alceno mais estável nas reações de
desidratação de álcoois catalisadas por ácido.
Passo 4
6. Os rearranjos ocorrem quase invariavelmente quando a migração de iões alcanido ou de um
ião hidreto pode levar a um carbocatião mais estável.
22
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
7.8B REARRANJOS APÓS DESIDRATAÇÃO DE UM ÁLCOOL PRIMÁRIO
1. O alceno que é formado inicialmente a partir de um álcool 1 ° surge por um mecanismo de
E2.
1) Um alceno pode aceitar um protão para gerar um carbocatião num processo que é
essencialmente o inverso do passo de desprotonação no mecanismo E1 para a
desidratação de um álcool.
2) Quando um alceno terminal se protona usando os seus eletrões para ligar um protão
no carbono terminal, forma-se um carbocatião no 2º carbono da cadeia (O carbocatião
também pode formar-se diretamente a partir do álcool 1° por uma troca de hidreto a partir
do seu carbono para o carbono terminal à medida que o grupo hidroxilo protonado se
afasta).
3) Vários processos podem ocorrer a partir deste carbocatião:
i) Pode ser removido um hidrogénio diferente, levando a um alceno mais estável do que
o alceno terminal inicialmente formado.
ii) Pode ocorrer um rearranjo hidreto ou alcanido levando a um carbocatião mais estável,
após o que pode ser concluída a eliminação.
iii) Um nucleófilo pode atacar qualquer um destes carbocatiões para formar um produto de
substituição.
v) A temperaturas elevadas os principais produtos da desidratação de álcoois serão alcenos
em vez de produtos de substituição.
23
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
Um Mecanismo para a Reação
Formação de um Alceno com Rearranjo Durante a Desidratação de um Álcool Primário
24
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
7.9
ALCENOS POR DESBROMAÇÃO DE DIBROMETOS VICINAIS
1.
1)
Dihalogenetos Vicinais (ou vic) e geminais (ou gem):
vic-Dibrometos sofrem desbromação:
Um Mecanismo para a Reação
Mecanismo:
Passo 1
Passo 2
25
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
1. A desbromação pelo zinco tem lugar na superfície do metal e o mecanismo é incerto.
1) Outros metais eletropositivos (por exemplo, Na, Ca e Mg) também causam desbromação de
vic-dibrometos.
2. A vic-desbromações são geralmente preparadas através da adição de bromo a um alceno.
3. A bromação seguida de desbromação é útil na purificação de alcenos e em "proteger" a ligação
dupla.
7.10 SÍNTESE DE ALCINOS VIA REAÇÕES DE ELIMINAÇÃO
1. Os alcinos podem ser sintetizados a partir de alcenos.
1) Um vic-dibrometo é desidrohalogenado através da sua reação com uma base forte.
2) Uma desidrohalogenação ocorre em dois passos. Dependendo das condições, estas duas
reações de desidrohalogenação podem ser efetuadas separadamente, ou podem ser realizadas
consecutivamente numa mistura única.
i) A base forte, NaNH2, é capaz de efetuar ambas as desidrohalogenações numa mistura reacional
única.
ii) Devem ser usados pelo menos dois equivalentes molares de NaNH2 por mole do dihalogeneto, e se o produto é um alcino terminal, devem ser usados três equivalentes molares
porque o alcino terminal é desprotonado pelo NaNH2 à medida que é formado na mistura.
iii) As desidrohalogenações com NaNH2 são geralmente efetuadas em amoníaco líquido ou num
meio inerte tal como óleo mineral.
Um Mecanismo para a Reação
Desidrohalogenação de vic-Dibrometos para formar Alcinos
Reação:
Mecanismo:
26
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
Passo 1
Passo 2
2. Exemplos:
3. As cetonas podem ser convertidas em dicloretos geminais através da sua reação com
pentacloreto de fósforo que pode ser usado para sintetizar alcinos.
27
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
7.11 A ACIDEZ DOS ALCINOS TERMINAIS
1. Os átomos de hidrogénio do etino são consideravelmente mais ácidos do que os do eteno ou
etano:
1) A ordem de basicidade dos aniões é oposta à acidez relativa dos hidrocarbonetos.
Basicidade Relativa dos iões etanido, etenido, e etinido:
CH3CH2:– > CH2=CH:– > HC≡C:–
Acidez Relativa dos compostos de hidrogénio dos elementos do primeiro período da
tabela periódica:
H–OH > H–OR > H–C≡CR > H–NH2 > H–CH=CH2 > H–CH2CH3
Basicidade Relativa dos compostos de hidrogénio dos elementos do primeiro
período da tabela periódica:
–
:OH < –:OR < –:C≡CR < –:NH2 < –:CH=CH2 < –:CH2CH3
2) Em solução, os alcinos terminais são mais ácidos do que a amónia, no entanto, eles são
menos ácidos do que os álcoois e são menos ácidos do que a água.
3) Na fase gasosa, o ião hidróxido é uma base mais forte do que o ião acetileto.
i) Em solução, os iões mais pequenos (por exemplo, iões de hidróxido) são mais eficazmente
solvatados do que os maiores (por exemplo, iões etinido) e assim, eles são mais estáveis e,
portanto, menos básicos.
ii) Na fase gasosa, os iões grandes são estabilizados pela polarização dos seus eletrões
ligantes, e quanto maior for um grupo mais polarizável será e consequentemente os iões
maiores são menos básicos.
28
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
7.12 A SUBSTITUIÇÃO DO ÁTOMO DE HIDROGÉNIO ACETILÉNICO DE
ALCINO TERMINAL
1. Os alcinidos de sódio podem ser preparados por tratamento de alcinos terminais com NaNH2
em amoníaco líquido.
H–C≡C–H + NaNH2
H–C≡C:– Na+ + NH3
CH3C≡C–H + NaNH2
CH3C≡C:– Na+ + NH3
1) O ião amideto (amónia, pKa = 38) é capaz de remover completamente os protões acetilénicos
do alcino terminal (pKa = 25).
2. Os alcinidos de sódio são intermediários úteis para a síntese de outros alcinos.
Alcinido de sódio
Halogeneto de Alquilo 1°
Acetileno mono- ou dissubstituído
3-Hexino (75%)
3.
Uma reação SN2:
4. Esta síntese falha quando são utilizados halogenetos secundários ou terciários porque o ião
alcinido atua como uma base, em vez de nucleófilo, e o principal resultado é uma eliminação E2.
7.13 HIDROGENAÇÃO DE ALCENOS
1. Hidrogenação catalítica (uma reação de adição):
1) Adiciona um átomo de hidrogénio a cada carbono da ligação dupla.
2) Sem um catalisador a reação não ocorre a uma velocidade apreciável.
29
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
CH2=CH2 + H2
CH3–CH3
CH3CH=CH2 + H2
CH3CH2–CH3
2. Compostos saturados:
3. Compostos insaturados:
4. O processo de adição de hidrogénio a um alceno é uma redução.
7.14 HIDROGENAÇÃO: A FUNÇÃO DO CATALISADOR
1. A hidrogenação de um alceno é uma reação exotérmica (° ≈ -120 kJ mol-1).
R–CH=CH–R + H2
R–CH2–CH2–R + calor
1) As reações de hidrogenação geralmente têm altas energias livres de ativação.
2) A reação de um alceno com hidrogénio molecular não tem lugar à temperatura ambiente na
ausência de um catalisador, mas muitas vezes tem lugar à temperatura ambiente quando
um catalisador de metal é adicionado.
Figura 7.8 Diagrama de energia livre para a hidrogenação de um alceno na presença de um
catalisador e a reação hipotética, na ausência de um catalisador. A energia livre de ativação [G‡(1)] é
muito maior que a maior energia livre de ativação para a reação catalisada [G‡(2)].
30
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
2. Os catalisadores mais geralmente usados para hidrogenação (platina finamente dividida, níquel,
paládio, ródio e ruténio) aparentemente servem para adsorver as moléculas de hidrogénio na
sua superfície.
1) Os eletrões desemparelhados na superfície do metal emparelham com os eletrões do
hidrogénio e ligam o hidrogénio à superfície.
2) A colisão de um alceno com a superfície do catalisador com hidrogénio adsorvido faz com que
ocorra a adsorção do alceno.
3) Tem lugar uma transferência gradual de átomos de hidrogénio, e isto produz um alcano antes
da molécula orgânica deixar a superfície do catalisador.
4) Ambos os átomos de hidrogénio geralmente adicionam do mesmo lado da molécula (adição
syn).
Figura 7.9 O mecanismo para a hidrogenação de um alceno catalisada por metal de platina finamente
dividida: (a) adsorção de hidrogénio, (b) adsorção do alceno, (c) e (d), transferência por passos de ambos
os átomos de hidrogénio para a mesma face do alceno (adição syn).
7.14A ADIÇÕES SYN E ANTI
1.
Adição Syn:
31
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
2.
Adição Anti:
7.15 HIDROGENAÇÃO DE ALCINOS
1.
Dependendo das condições e do catalisador utilizados, um ou dois equivalentes molares de
hidrogénio irão adicionar a uma ligação tripla carbono-carbono.
1) Um catalisador de platina catalisa a reação de um alcino com dois equivalentes molares de
hidrogénio para dar um alcano.
CH3C≡CCH3
7.15A
1.
[CH3CH=CHCH3]
CH3CH2CH2CH3
ADIÇÃO SYN DE HIDROGÉNIO: SÍNTESE DE CIS-ALCENOS
Um catalisador que permite a hidrogenação de um alcino a um alceno é o boreto de níquel
chamado catalisador P-2.
1) A hidrogenação de alcinos, na presença do catalisador P-2 faz com que tenha lugar a adição
syn de hidrogénio, e que é formado a partir de um alcino o alceno com uma ligação dupla
interna com configuração (Z) ou cis.
2) A reação tem lugar sobre a superfície do catalisador promovendo a adição syn.
2.
O catalisador de Lindlar: paládio metálico depositado sobre carbonato de cálcio e é envenenado
com acetato de chumbo e quinolina.
32
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
7.15B ADIÇÃO ANTI DE HIDROGÉNIO: SÍNTESE DE TRANS-ALCENOS
1. Ocorre uma adição anti de átomos de hidrogénio à ligação tripla quando os alcinos são reduzidos
com lítio ou sódio metálico em amoníaco ou etilamina a baixas temperaturas.
1) Esta reação, chamada uma redução de dissolução de metal, produz um (E)-, ou trans-alceno.
Um Mecanismo para a Reação de Redução
A Redução de Dissolução de Metal de um Alcino
33
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
7.16 FÓRMULAS MOLECULARES DE HIDROCARBONETOS:
O ÍNDICE DE DEFICIÊNCIA DE HIDROGÉNIO
1. O 1-hexeno e o ciclo-hexano têm a mesma fórmula molecular (C6H12):
CH2=CHCH2CH2CH2CH3
1-Hexeno
Ciclo-hexano
1) O ciclo-hexano e o 1-hexeno são isómeros constitucionais.
2. Alcinos e alcenos com duas ligações duplas (alcadienos) têm a fórmula geral CnH2n-2.
1) Os hidrocarbonetos com uma ligação tripla e uma ligação dupla (alceninos) e alcenos com três
ligações duplas têm a fórmula geral CnH2n-4.
CH2=CH–CH=CH2
CH2=CH–CH=CH–CH=CH2
1,3-Butadieno (C4H6)
1,3,5-Hexatrieno (C6H8)
2. O Índice de Deficiência de Hidrogénio (grau de insaturação, o número de equivalência de
ligações duplas):
1) É uma informação importante sobre a sua estrutura de um composto desconhecido.
2) O índice de deficiência de hidrogénio é definido como o número de pares de átomos de
hidrogénio que deve ser subtraído à fórmula molecular do alcano correspondente para dar a
fórmula molecular do composto em causa.
3) O índice de deficiência de hidrogénio do 1-hexeno e ciclo-hexano:
C6H14 = fórmula do alcano correspondente (hexano)
C6H12 = fórmula do composto (1-hexeno e ciclo-hexano)
H2 = diferença = 1 par de átomos de hidrogénio
Índice de deficiência de hidrogénio = 1
4. Determinação do número de anéis:
1) Cada dupla ligação consome um equivalente molar de hidrogénio, cada ligação tripla consome
dois.
2) Os anéis não são afetados por hidrogenação à temperatura ambiente.
CH2=CH(CH2)3CH3 + H2
+ H2
CH3(CH2)4CH3
Não há reação
34
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
+ H2
Ciclo-hexeno
CH2=CHCH=CHCH2CH3 + 2 H2
CH3(CH2)4CH3
1,3-Hexadieno
3. Cálculo do índice de deficiência de hidrogénio (IDH):
1) Para compostos contendo átomos de halogénio: basta contar os átomos de halogénio como
átomos de hidrogénio.
C4H6Cl2 = C4H8
IDH = 1
2) Para os compostos que contêm átomos de oxigénio: ignorar os átomos de oxigénio e calcular
a IDH da restante parte da fórmula.
C4H8O = C4H8
CH2=CHCH2CH2OH
IDH = 1
CH3CH2=CHCH2OH
e assim por diante
3) Para os compostos contendo átomos de azoto: subtrair um hidrogénio por cada átomo de
azoto, e depois ignorar os átomos de azoto.
C4H9N = C4H8
CH2=CHCH2CH2NH2
IDH = 1
CH3CH2=CHCH2NH2
e assim por diante
35
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
Resumo dos Métodos de Preparação
de Alcenos e Alcinos
1. Desidrohalogenação de halogenetos de alquilo (Secção 7.6)
Reação Geral
Exemplos Específicos
2. Desidratação de álcoois (Secção 7.7 e 7.8)
Reação Geral
Exemplos Específicos
CH3CH2OH
CH2=CH2 + H2O
+ H2O
36
Doutor João Paulo Noronha, FCT-UNL.2012
Química II.2012
Resumo dos Métodos de Preparação
de Alcenos e Alcinos
3. Desbromação de dibrometos vicinais (Secção 7.9)
Reação Geral
4. Hidrogenação de alcinos (Secção 7.15)
Reação Geral
5. Desidrohalogenação de dibrometos vicinais (Secção 7.15)
Reação Geral
37
Doutor João Paulo Noronha, FCT-UNL.2012