VÂNIA FLORIANI NOLDIN
ESTUDO FITOQUÍMICO DAS FOLHAS E RIZOMAS
DE Simaba ferruginea ST. HIL. E AVALIAÇÃO DA
ATIVIDADE ANTIÚLCERA E ANTINOCICEPTIVA
DOS EXTRATOS E COMPOSTOS ISOLADOS.
ITAJAÍ - 2005
2
UNIVERSIDADE DO VALE DO ITAJAÍ
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE MESTRADO ACADÊMICO EM CIÊNCIAS
FARMACÊUTICAS
ESTUDO FITOQUÍMICO DAS FOLHAS E RIZOMAS
DE Simaba ferruginea ST. HIL. E AVALIAÇÃO DA
ATIVIDADE ANTIÚLCERA E ANTINOCICEPTIVA
DOS EXTRATOS E COMPOSTOS ISOLADOS.
Dissertação submetida à
Universidade do Vale do Itajaí
Como parte dos requisitos para a
Obtenção do grau de Mestre em Ciências Farmacêuticas.
VÂNIA FLORIANI NOLDIN
Itajaí, Agosto de 2005.
3
ESTUDO FITOQUÍMICO DAS FOLHAS E RIZOMAS DE
Simaba ferruginea ST. HIL. E AVALIAÇÃO DA ATIVIDADE
ANTIÚLCERA E ANTINOCICEPTIVA DOS EXTRATOS E
COMPOSTOS ISOLADOS.
Vânia Floriani Noldin
‘Esta Dissertação foi julgada adequada para obtenção do Título de Mestre em Ciências
Farmacêuticas, Área de Concentração em Produtos Naturais, e aprovada em sua forma final
pelo Programa de Mestrado em Ciências Farmacêuticas da Universidade do Vale do Itajaí.’
____________________________________
Valdir Cechinel Filho, Dr.
__________________________________________________________
Tania Mari Bellé Bresolin, Dra.
Coordenadora do Programa de Pós-Graduação em Ciências Farmacêuticas
Banca Examinadora:
______________________________________
Valdir Cechinel Filho, Dr.
Presidente
______________________________________
Brás H. de Oliveira, Dr.
______________________________________
Ângela Malheiros, Dra.
4
AGRADECIMENTOS
... À Deus pela vida, fé e força.
... Ao Ângelo, pelo amor, compreensão, dedicação e estímulo. Você foi o alicerce para
construir e realizar mais este sonho.
... À minha mãe por suas orações, força e pelo amor incondicional em todos os momentos de
minha vida.
... Ao Dionei e Vanessa, por todo o carinho e força.
... À família e aos amigos pelas orações e torcida, especialmente ao pessoal da farmácia e Pe
Alcides.
... Ao Pedro e a Diva por toda a prestatividade.
... A Rosélia por toda a amizade, prestatividade e carinho.
... Aos professores do NIQFAR por toda a amizade, por todos os ensinamentos e apoio na
construção do conhecimento, especialmente: Niero, Fátima, Cris, Ângela e Clóvis.
... Ao professor Dr. Domingos T. O. Martins e seus colaboradores pelos testes
farmacológicos.
... Ao professor Dr. Franco Delle Monache pelas análises espectrocópicas.
... Aos professores da banca interna, em especial Ângela e Márcia pelas considerações.
.... Aos colegas de sala, pela amizade e apoio, especialmente Karina, companheira de
bancada.
... Aos colegas de laboratório, pela amizade e força, especialmente a Cláudia.
... Ao professor e amigo Cechinel, pela parceria e confiança em mais uma etapa de minha
formação.
... A todos que de alguma forma me auxiliaram ou torceram por mim, cujos nomes são muitos
e que posso ter esquecido, todo o meu carinho e meu muito obrigada por tudo.
5
Resumo da Dissertação apresentada à UNIVALI como parte dos requisitos necessários para a
obtenção do grau de Mestre em Ciências Farmacêuticas.
ESTUDO FITOQUÍMICO DAS FOLHAS E RIZOMAS DE Simaba
ferruginea ST. HIL. E AVALIAÇÃO DA ATIVIDADE ANTIÚLCERA E
ANTINOCICEPTIVA DOS EXTRATOS E COMPOSTOS ISOLADOS.
Vânia Floriani Noldin
Agosto / 2005.
Orientador: Valdir Cechinel Filho, Dr.
Área de Concentração: Produtos Naturais.
Palavras-chave: Simaba ferruginea, alcalóides, atividade antiúlcera.
Número de Páginas: 82
RESUMO
Simaba ferruginea (Calunga) é uma espécie típica do cerrado brasileiro, cujos rizomas são
utilizados para tratar diarréias, úlceras gástricas, febres.Com este estudo objetiva-se investigar
a constituição química e atividade farmacológica das folhas e rizomas de S. ferruginea. Os
materiais vegetais foram macerados separadamente com metanol, de onde foram preparados
os extratos metanólicos brutos (EMB), que após particionados renderam as frações hexano
(H), diclorometano (DCM) e acetato de etila (AE) das folhas e rizomas. Dos rizomas foi
obtido também a fração alcaloídica (FA). As frações foram purificadas e analisadas através de
métodos cromatográficos. Os compostos puros foram identificados através de técnicas
espectroscópicas. Os EMB, frações e compostos isolados foram avaliados quanto à atividade
antiúlcera (úlcera induzida por etanol e indometacina) e atividade antinociceptiva (modelo de
contorções abdominais/ácido acético). Das frações H, DCM e FA dos rizomas, foram isolados
os alcalóides: cantin-6-ona e 4-metoxicantin-6-ona. Da fração H das folhas foi isolado o sitosterol e da fração AE a quercitrina. Na ulceração induzida por etanol, o EMB dos rizomas
e folhas apresentaram inibição acima de 80 % assim como a fração alcaloídica, que foi efetiva
em diferentes vias de administração, superando a ação dos alcalóides isolados ou associados.
Na ulceração induzida por indometacina somente a fração DCM-RA foi efetiva. Ambos os
alcalóides apresentaram significante antinocicepção. Conclui-se que a S. ferruginea apresenta
atividade antiulcerogênica, principalmente os rizomas cuja atividade é atribuída aos
alcalóides. Esses resultados confirmam os dados etnofarmacológicos sobre a planta.
6
Abstract of dissertation presented to UNIVALI as a partial fulfillment of the requirements for
the degree of Master in Pharmaceutical Sciences.
PHYTOCHEMICAL STUDIES OF THE LEAVES END RHIZOME OF
Simaba ferruginea ST. HIL. AND EVALUATE ULCER GASTRIC AND
ANTINOCICEPTIVA ACTIVITY OF EXTRACTS AND ISOLATED
COMPOUNDS.
VÂNIA FLORIANI NOLDIN
August/2005
Advisor: Valdir Cechinel Filho, Dr
Area of Concentrations: Natural products
Keywords: Simaba ferruginea, alkaloids ulcer gastric activity.
Number of Pages: 82
Simaba ferruginea (calunga) is a typical species of Brazilian Cerrado, and the rhizomes are
used to treat diarrhea, gastric ulcer, fever, among other. The aim of the present study was the
examination of the chemical composition and pharmacological activity of leaves and rhizome
of S. ferruginea. The plant material was macerated with methanol, and the respective
methanolic extracts (EMB) were sucessively partitioned with n-hexane (H), dichloromethane
(DCM) and ethyl acetate (EA), giving the respective fractions of leaves and rhizome. From
rhizome it was obtained the alkaloid fraction (FA). The fractions were fractioned through
chromatographic methods, and the isolated compounds were identified by spectroscopic data.
The EMB, fractions and isolated compounds were examined for the possible gastric ulcer
activity (induced by ethanol and indomethacin) and antinociceptive activity (writhing test).
From H, DCM and FA (rhizome) were isolated the following alkaloids: canthin-6-one and
4-metoxicanthin-6-one. From H fraction (leaves) was isolated the β-sitosterol and from EA
fraction it was isolated the the quercitrin. In the ulceration induced by ethanol, the EMB from
rhizome and leaves presented approximately 80 % of inhibition in the ulceration. The FA
fraction was effective in the distinct administration form. The FA fraction was more effective
than isolated for associated alkaloids. In the ulceration induced by indomethacin, only DCMRA fraction was effective. The alkaloids presented significant antinociceptive activity. In
conclusion, S. ferruginea present promising antiulcerogenic activity, specially the rhizome,
which is related to the presence of the alkaloids. These results confirm and justify the
ethnophamacological data about this plant.
7
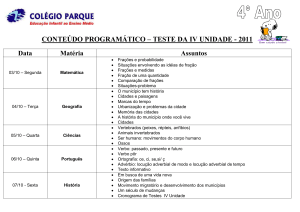
SUMÁRIO
1 INTRODUÇÃO .............................................................................................................01
2 OBJETIVOS ...................................................................................................................03
2.1 Objetivo geral................................................................................................................03
2.2 Objetivo específico........................................................................................................03
3 REVISÃO BIBLIOGRÁFICA ...................................................................................04
3.1 Importância das plantas medicinais............................................................................04
3.2 Biomas brasileiros: Cerrado ...................................................................................... 08
3.3 Família Simaroubaceae .............................................................................................. 09
3.3.1 Simaba multiflora ...................................................................................................... 10
3.3.2 Simaba orinocensis ................................................................................................... 10
3.3.3 Simaba guianensis …………………………….……………………………………11
3.3.4 Simaba cuspidata ……………………………….…………………………………. 11
3.3.5 Simaba cedron …………………………………………………………………....... 11
3.3.6 Simaba polyphylla .....………………………….………………..…………………. 14
3.3.7 Simaba subcymosa .................................................................................................... 14
3.3.8 Simaba ferruginea St. Hil.......................................................................................... 14
3.3.9 Outros gêneros relevantes da família Simaroubaceae .......................................... 15
4 METODOLOGIA .......................................................................................................... 17
4.1 Análise fitoquímicados rizomas.................................................................................. 17
4.1.1 Material vegetal......................................................................................................... 17
4.1.2 Preparação do extrato bruto.................................................................................... 17
4.1.3 Obtenção das frações................................................................................................ 17
4.1.4 Análise cromatográfica............................................................................................. 18
4.1.5 Separação e purificação dos compostos.................................................................. 18
4.1.6 Identificação e elucidação estrutural dos compostos isolados............................... 19
4.2 Análise fitoquímica das folhas .................................................................................... 19
4.2.1 Material vegetal ........................................................................................................ 19
4.2.2 Obtenção dos extratos ... .......................................................................................... 19
4.2.3 Preparação das frações ............................................................................................ 20
4.2.4 Análise cromatográfica ............................................................................................ 20
4.2.5 Separação e purificação dos compostos ................................................................. 20
4.2.6 Identificação dos compostos isolados...................................................................... 20
8
4.3 Atividade farmacológica ............................................................................................. 23
4.3.1 Atividade antinociceptiva......................................................................................... 23
4.3.2 Atividade antiúlcera ................................................................................................. 24
4.3.3 Análise estatística ..................................................................................................... 26
5 RESULTADOS E DISCUSSÃO .................................................................................. 27
5.1 Análise fitoquímica.... .................................................................................................. 27
5.1.1 Frações do Rizoma – Extração Convencional ...................................................... 28
5.1.1.1 Caracterização química e revisão da literatura do composto C ....................... 30
5.1.1.2 Caracterização química e revisão da literatura do composto D ....................... 34
5.1.2 Frações do Rizoma – Extração Específica para Alcalóides ................................. 39
5.1.3 Frações das Folhas de S. ferruginea ........................................................................ 42
5.1.3.1 Caracterização química e revisão da literatura do composto FA .................... 43
5.1.3.2 Caracterização química e revisão da literatura do composto FB ..................... 46
5.2 Atividade farmacológica ............................................................................................. 51
5.2.1 Atividade antiúlcera dos rizomas ........................................................................... 52
5.2.2 Atividade antinociceptiva dos rizomas de S. ferruginea ........................................ 62
5.2.3 Atividade antiúlcera das folhas de S. ferruginea .................................................... 64
6 CONSIDERAÇÕES FINAIS ....................................................................................... 69
7 REFERÊNCIAS BIBLIOGRÁFICAS......................................................................... 71
8 ANEXOS ......................................................................................................................... 77
9
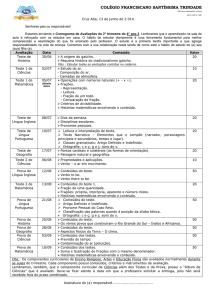
LISTA DE FIGURAS
Figura 01 Simaba ferruginea: folhas e rizoma......................................................... 15
Figura 02 Fluxograma da extração convencional dos rizomas ...............................21
Figura 03 Fluxograma do processo extrativo de alcalóides......................................22
Figura 04 Fluxograma da extração convencional das folhas ..................................23
Figura 05 Espectro de RMN-1H do composto C em CDCl3.....................................32
Figura 06 Espectro de RMN-13C do composto C em CDCl3....................................33
Figura 07 Espectro de RMN-1H do composto D em CDCl3.....................................36
Figura 08 Espectro de RMN-13C do composto D em CDCl3....................................37
Figura 09 Espectro de IV do composto β -sitosterol..................................................46
Figura 10 Espectro de IV do composto quercitrina..................................................47
Figura 11 Espectro de RMN-1H (300 Mz) da quercitrina........................................49
Figura 12 Espectro de RMN-13C do composto quercitrina..................................... 50
Figura 13 Atividade antiúlcera do extrato metanólico bruto via i.p. .................... 53
Figura 14 Atividade antiúlcera das frações via oral ............................................... 53
Figura 15 Atividade antiúlcera da Fr. AE e DCM-RA via oral ........................... 54
Figura 16 Atividade antiúlcera da fração alcaloídica via oral .............................. 55
Figura 17 Atividade antiúlcera da fração alcaloídica e dos alcalóides 5 mg/kg.... 56
Figura 18 Atividade antiúlcera da fração alcaloídica e dos alcalóides 20 mg/kg.. 56
Figura 19 Atividade antiúlcera dos alcalóides associados via i.p. .......................... 58
Figura 20 Atividade antiúlcera dos alcalóides associados via i.p. e oral ............... 59
Figura 21 Atividade antinociceptiva na dose de 5 mg/kg ....................................... 63
Figura 22 Atividade antinociceptiva na dose de 20 mg/kg...................................... 64
Figura 23 Atividade antiúlcera do extrato metanólico bruto das folhas ............... 65
Figura 24 Atividade antiúlcera da quercitrina......................................................... 66
10
1 INTRODUÇÃO
A utilização de plantas para o tratamento e cura de enfermidades é tão antigo quanto à
espécie humana, representando muitas vezes, o único recurso terapêutico de algumas
comunidades. Desde então, o homem adquiriu conhecimentos empíricos sobre plantas
medicinais, repassando-os às demais gerações. Os produtos naturais exerceram importante
papel na descoberta de muitos medicamentos e constituíram a base da medicina moderna, a
qual está estritamente ligada às plantas medicinais (CECHINEL FILHO; YUNES, 2001;
YUNES et al., 2001; BUTLER, 2005; VEIGA JUNIOR et al., 2005).
Muitas vezes as propriedades terapêuticas das plantas, são relatadas pela população, as
quais são confirmadas em sua maioria nos estudos científicos, comprovando a importância da
pesquisa etnofarmacológica. Tais propriedades propiciaram o desenvolvimento de vários
medicamentos descobertos há muito tempo e ainda utilizados na medicina, sejam estes
obtidos por síntese a partir de molécula protótipo ou através de isolamento de produtos
naturais, cujos principais exemplos são: os digitálicos, quinina, morfina, atropina, ácido acetil
salicílico, entre outros (MACIEL et al., 2002; KINGHORN, 2002; HOSTETTMANN et al.,
2003; NIERO et al., 2003; BUTLER, 2004).
Segundo Tulp e Bohlin (2002), há várias razões pelas quais os estudos com extratos
vegetais continuarão a ser o alvo da maioria dos pesquisadores das diversas áreas biológicas,
uma vez que muitos medicamentos disponíveis hoje no mercado são de origem natural, ou
foram sintetizados a partir de compostos naturais. Além disso, muitos destes compostos têm
apresentado atividades similares às de compostos sintéticos já disponíveis no mercado, cujo
apelo comercial da origem natural faz com que ganhem ainda mais espaço no mercado.
De acordo com Koehn e Carter (2005), no período entre 1981 e 2002 foram registradas
877 novas substâncias químicas, sendo que 49 % destas originaram-se de produtos naturais,
semi-síntese de produtos naturais e ou compostos sintéticos baseados no grupo farmacofórico
de compostos isolados de plantas.
Deve-se salientar ainda, que alguns compostos naturais com significativa atividade
biológica são obtidos exclusivamente através de isolamento, mesmo que em pequenas
concentrações, pois apresentam estrutura química complexa o que inviabiliza sua síntese. Tal
característica demonstra a importância do metabolismo secundário dos vegetais, que através
de suas rotas biossintéticas podem fornecer compostos com inovadoras estruturas moleculares
e atividades farmacológicas promissoras (TULP; BOHLIN, 2002).
11
Na determinação dos efeitos terapêuticos de produtos oriundos de plantas, é muito
importante a colaboração entre grupos multidisciplinares, os quais destacam-se: a fitoquímica,
a farmacologia, a microbiologia, a toxicologia, farmacotécnica e outras áreas afins
(CECHINEL FILHO; YUNES, 1998; SIMÕES et al., 2002).
Acredita-se que "somente cerca de 5% das espécies vegetais tem sido estudadas
fitoquimicamente" (CECHINEL FILHO; YUNES, 1998), mas a comunidade científica tem
constantemente demonstrado grande interesse em validar as plantas utilizadas na medicina
popular, principalmente quando se refere ao desenvolvimento e produção de novos
fitoterápicos e fitofármacos, os quais beneficiariam as indústrias brasileiras e a população. É
importante mencionar que em países desenvolvidos, a prescrição de fitomedicamentos é
superior a 25% das prescrições totais, demonstrando a credibilidade da eficácia desta terapia
pelos pacientes e médicos, e também, a promissora fonte de obtenção de novos medicamentos
baseados na imensa biodiversidade brasileira, distribuída em seus distintos biomas
(CECHINEL FILHO, 1995; CECHINEL FILHO; YUNES, 1998; YUNES et al., 2001;
MACIEL et al., 2002; HOSTETTMANN et al., 2003).
Sob
este
aspecto,
o
Núcleo
de
Investigações
Químico-Farmacêuticas
(NIQFAR/CCS/UNIVALI) vem pesquisando e avaliando várias plantas utilizadas na
medicina popular, onde os resultados obtidos são bastante promissores sob o ponto de vista
químico-medicinal (CECHINEL FILHO, 2000).
Diante do exposto, é de interesse do grupo dar continuidade a estudos realizados
preliminarmente com a planta Simaba ferruginea St. Hil., como parte de um programa de
intercâmbio científico envolvendo a UNIVALI (NIQFAR) e a Faculdade de Medicina da
UFMT (Cuibá – MT). O extrato metanólico bruto desta planta apresentou considerável
atividade antiúlcera, confirmando dados etnofarmacológicos (MARCELLO, 2001). No
entanto, esta espécie típica do cerrado brasileiro, nunca foi estudada fitoquimicamente,
tornando relevante a determinação de sua composição química, bem como elucidar quais os
compostos responsáveis pelos efeitos biológicos encontrados na planta.
12
2 OBJETIVOS
2.1 Objetivo geral
Investigar a constituição química e atividade farmacológica das folhas e rizomas de
Simaba ferruginea e elucidar a estrutura de seus principais constituintes bioativos.
2.2 Objetivos específicos
-
Analisar fitoquimicamente os extratos brutos e semi purificados das folhas e rizomas de
Simaba ferruginea, através de cromatografia em camada delgada (CCD) para determinar
as principais classes de compostos presentes na planta;
-
Isolar e purificar os constituintes bioativos presentes na planta utilizando estudo biomonitorado “in vivo” e técnicas cromatográficas (cromatografia em coluna aberta,
cromatografia centrífuga ou preparativa);
-
Identificar os compostos isolados através de métodos espectroscópicos, tais como: (IV,
RMN-1H, RMN-13C);
-
Avaliar a atividade farmacológica (atividades antinociceptiva e antiúlcera) de extratos,
frações semi purificadas e compostos isolados de Simaba ferruginea.
13
3 REVISÃO BIBLIOGRÁFICA
3.1 Importância das plantas medicinais
Os produtos naturais causam intenso fascínio à ciência, especialmente por suas
atividades medicinais, as quais vêm recebendo especial atenção de inúmeros pesquisadores,
pois muitos dos compostos naturais, sejam de origem vegetal ou animal, tem apresentado
atividade biológica relevante, possibilitando que estes se tornem potenciais candidatos ao
desenvolvimento de novos medicamentos (CECHINEL FILHO; YUNES, 2001; RASKIN et
al., 2002; NIERO et al., 2003).
Ainda segundo Nash (2004), não somente a indústria farmacêutica vem utilizando
produtos naturais para fins terapêuticos, mas também a indústria de alimentos busca
enriquecer seus produtos com as propriedades medicinais dos vegetais, promovendo ainda
mais a busca por produtos naturais aliados as inúmeras atividades biológicas relatadas na
literatura.
Nos últimos anos, a pesquisa com produtos naturais tem sido um sucesso devido à
descoberta de vários compostos farmacologicamente ativos, e ao alto faturamento das
indústrias farmacêuticas com a venda de medicamentos de origem natural. Estima-se que
somente os vinte fitomedicamentos mais vendidos no mundo, renderam nesta última década
mais de US$ 20 bilhões à indústria farmacêutica (NIERO et al., 2003; TULP; BOHLIN,
2002, 2004).
O emprego de plantas medicinais pelo homem para tratamentos de enfermidades, é
documentado desde as primeiras civilizações, que as utilizavam para tratamento de
determinadas doenças onde observavam seus efeitos, que podiam curar ou agravar o estado
patológico, iniciando assim a primeira seleção de plantas com ação terapêutica. Desde então,
as plantas medicinais tornaram-se fonte inesgotável de propriedades medicinais, ainda que
seus constituintes químicos não sejam conhecidos (PHILLIPSON, 2001; SARDESAI, 2002;
MACIEL et al., 2002).
No Brasil, a utilização de plantas medicinais está relacionada com a cultura dos índios
que aqui habitavam na época da colonização, já que os primeiros portugueses a explorarem o
país, expuseram-se às doenças endêmicas e diante da escassez de medicamentos, recorreram
aos remédios utilizados pelos povos indígenas, os quais constituíam-se de ervas nativas, cujo
poder de curar logo tornou-se conhecido. Os efeitos observados vêm despertando até os dias
14
de hoje, grande interesse em identificar e investigar fitoquimicamente e biologicamente tais
plantas. Por outro lado, os estrangeiros também contribuíram por aumentar o arsenal
terapêutico de origem vegetal, trazendo ao Brasil, espécies vegetais conhecidas por estes,
nativas da Europa, África, e de outras partes da América (CECHINEL FILHO; YUNES,
1998; PINTO et al., 2002; SIMÕES et al., 2002).
Ultimamente observa-se grande tendência por parte da população em utilizar terapias
alternativas e complementares para o tratamento ou cura de suas enfermidades, o que
aumentou consideravelmente a utilização de produtos derivados de plantas. Tais produtos
naturais são empregados de diversas maneiras e diferentes propósitos, sendo os mais
utilizados: in natura através de preparações caseiras, onde o chá é a forma mais consumida;
sob a forma pulverizada ou extrato bruto seco, comercializados geralmente em cápsulas ou
tinturas, podendo conter mais de uma espécie vegetal; os fitofármacos que são substâncias
ativas, isoladas de matérias-primas vegetais ou mesmo, mistura de substâncias ativas de
origem vegetal (RATES, 2001b; VEIGA JUNIOR et al., 2005).
Nos países da América do Norte e Europa, há maior controle no registro e
comercialização de fitoterápicos, havendo portanto, maior rigidez nas normas para
certificação de qualidade das preparações fitoterápicas. Talvez por isso, na Alemanha, onde
são consumidos mais da metade dos extratos vegetais produzidos na Europa, 70 % dos
clínicos gerais prescrevem as centenas de ervas licenciadas para comercialização (VEIGA
JUNIOR et al., 2005).
Em 1998 na Alemanha, o fitoterápico Gingko biloba estava presente em 5,4 milhões
de prescrições médicas. Também deve-se ressaltar os fitoterápicos a base de Hypericum
perforatum, o qual vem sendo amplamente utilizado no tratamento de depressão leve à
moderada, substituindo o tratamento convencional com antidepressivos tricíclicos ou os
seletivos, como Prozac®, especialmente por apresentar menos efeitos indesejáveis que os
compostos sintéticos (TULP; BOHLIN, 2002; VEIGA JUNIOR et al., 2005).
Segundo Sardesai (2002) e Raskin et al. (2002), este crescente consumo de produtos
naturais deve-se a várias razões, desde a insatisfação com os medicamentos disponíveis no
mercado como o fácil acesso a estes produtos, pois são comercializados sob a forma de venda
livre, cuja aquisição não está vinculada à prescrição médica, ou ainda, como nos EUA, onde
estes são comercializados como suplementos dietéticos.
A crescente procura de plantas com propriedades terapêuticas por pessoas de
diferentes classes sociais deve-se ainda, à decepção de alguns pacientes com tratamentos
convencionais, tanto devido aos efeitos adversos bem como a inexistência de medicamentos
15
para determinadas patologias; além da tendência generalizada dos consumidores em utilizar
preferencialmente produtos naturais, a fim de diminuir efeitos colaterais e toxicidade, devido
à crença equivocada de que todo produto natural é inofensivo (RATES, 2001a; SIMÕES et
al., 2002; VEIGA JUNIOR et al., 2005).
As
pesquisas
com
produtos
naturais
têm
dois
enforques
importantes:
a
etnofarmacologia e a toxicologia, cuja estratégia tem se revelado eficiente, pois dinamiza os
trabalhos de investigação científica, por indicar espécies a serem estudadas e os testes
biológicos a serem realizados, ainda que, inúmeras vezes são descobertas atividades não
relatadas pela medicina tradicional para determinada espécie vegetal (TULP; BOHLIN,
2004).
Através da etnofarmacologia, que estuda a relação entre as pessoas e as plantas,
especialmente índios e curandeiros, foram descobertas substâncias como a vincristina,
pilocarpina, fisostigmina, reserpina, digitálicos e outros, estimando-se que 74% das 119
substâncias descobertas de plantas sejam resultados de pesquisas etnofarmacológicas (COX;
HEINRICH, 2001).
A importância das plantas medicinais deve-se também, ao fato de propiciarem, através
de técnicas de isolamento, o acesso a novos constituintes químicos, biologicamente ativos,
que podem ser empregados como protótipos para a síntese de novos fármacos (CECHINEL
FILHO, 1995; CECHINEL FILHO; YUNES, 1998). O mercado mundial de fitoterápicos
movimenta cerca de US$ 22 bilhões por ano, seduzindo cada vez mais adeptos ao setor. No
Brasil, não há dados confiáveis sobre o consumo de fitoterápicos, por serem produtos
comercializados na forma de “venda livre”, mas estima-se que nos últimos dois anos houve
um crescimento de 15%. Segundo a ABIFITO (Associação Brasileira da Indústria de
Fitoterápicos), esse mercado movimenta cerca de US$ 500 milhões de dólares por ano. Esse
crescimento do consumo de fitoterápicos é visto pelos fenômenos mercadológicos como os
medicamentos a base de Panax ginseng, Ginkgo biloba, Hypericum perforatum, Cassia
senna, entre outros (MORETTO, 2000; YUNES et al., 2001; MARTINS, 2003).
A Resolução RDC nº 17 de 24/2/2000 da ANVISA, revogada pela RDC nº 48 de
16/03/2004 da ANVISA, dispõe sobre a regulamentação da produção e registro de
fitoterápicos no Brasil. A RDC nº 48 define que os fitoterápicos são medicamentos
exclusivamente de origem vegetal, cuja eficácia e segurança devem ser assegurados por
levantamentos etnofarmacológicos e ensaios biológicos. Assim, a legislação de fitoterápicos,
exige que as empresas realizem estudos de eficácia e toxicidade de todos os produtos
fitoterápicos, garantindo qualidade e confiabilidade a estes medicamentos, além de promover
16
o uso racional, já que são empregados para tratar diversas patologias, sendo as mais comuns:
problemas alérgicos, respiratórios, digestivos, insônia, ansiedade, depressão e outros
(SIMÕES; SCHNKEL, 2001; ANVISA, 2004).
Para o desenvolvimento de um fitoterápico ou sua adequação às leis vigentes, a
indústria farmacêutica necessita de pessoas com qualificação em diversas áreas, muitas vezes
estabelecendo parcerias com universidades, a fim de reunir pesquisadores que trabalhem com
grupos multidisciplinares. Estes trabalhos de cooperação, visam agilizar e garantir o sucesso
no desenvolvimento das pesquisas, as quais iniciam com a identificação da espécie vegetal até
o desenvolvimento final do fitoterápico, envolvendo diversas áreas do conhecimento como:
botânica, química orgânica, farmacologia, química medicinal, farmacotécnica e outras
(MARQUES, 1999; MACIEL et al., 2002; CAÑIGUERAL, 2002; MORAES, 2003).
Cabe ressaltar que, o uso indiscriminado de fitoterápicos e de plantas medicinais in
natura para fins curativos tem ocasionado muitas intoxicações, sendo a hipersensibilidade e a
hepatotoxicidade os efeitos indesejáveis mais comuns. Pesquisas demonstram que
determinadas plantas são potencialmente perigosas devido aos efeitos tóxicos de algumas
substâncias naturalmente presentes nestas. As intoxicações podem ocorrer ainda por
adulterações, pelo uso errado de uma planta devido ao equívoco na identificação das espécies
(RATES, 2001a,b; SARDESAI, 2002; VEIGA JUNIOR et al., 2005).
O consumo exacerbado e predatório de plantas medicinais tem promovido à
degradação do meio ambiente e a extinção de muitas espécies, ainda que a diversidade da
flora brasileira seja imensa, porém não consegue regenerar-se tão fugazmente quanto à mão
destruidora do homem (RATES, 2001a,b; KINGHORN, 2002; SIMÕES et al., 2002).
A biodiversidade vegetal do Brasil tem atraído investimentos de grandes grupos de
indústrias farmacêuticas com o propósito de obterem novos medicamentos, mas tem sido alvo
também, da biopirataria, especialmente de espécies vegetais da Amazônia. Tal evento
demonstra a necessidade de uma política governamental que incentive os grupos de pesquisa
do país, a explorarem de forma sustentável, a biodiversidade vegetal, e criar formas de
fiscalizar e punir a degradação da fauna e flora brasileira e o envio de plantas para o exterior
(KATO, 2001).
Quanto a biopirataria, deve-se salientar também, a dificuldade em realizar trabalhos de
colaboração com determinados grupos estrangeiros, os quais nem sempre visam o mesmo
objetivo. No entanto, muitos trabalhos realizados em colaboração são essenciais devido a
equipamentos e metodologias de alta tecnologia, disponíveis nos países desenvolvidos, onde
os grupos de pesquisa recebem apoio financeiro do governo e instituições privadas. Outro
17
aspecto preocupante da biopirataria é a aproximação de pesquisadores com o povo indígena,
os quais apropriam-se da sabedoria destes para beneficiarem-se com a indicação de espécies
vegetais promissoras quanto à atividade biológica, sem que as tribos indígenas recebam
posteriormente os méritos de sua sabedoria milenar (CALIXTO, 2000; PLOTKIN, 2001).
3.2 Biomas brasileiros: Cerrado
O Brasil, por ser detentor de uma grande diversidade vegetal, possui um enorme
potencial para o desenvolvimento de novos medicamentos (sejam fitoterápicos ou moléculas
isoladas) a partir de suas plantas medicinais. O Brasil abriga cerca de 50 mil espécies de
plantas superiores, distribuídas em grandes biomas, como a Amazônia com 25-30 mil
espécies, a Mata Atlântica com 16 mil, o Cerrado com 7 mil, e as demais espécies distribuídas
na Caatinga e na Floresta Subtropical (VIEIRA; MARTINS, 2002).
Além da floresta Amazônica, bioma brasileiro com maior destaque nacional e
internacional devido à diversidade biológica, e principalmente pela grande área territorial e
reserva de água doce, o Cerrado e a Mata Atlântica destacam-se pela biodiversidade, e
também, pelas imensas áreas de matas destruídas pelo avanço da ocupação humana e suas
atividades exploratórias (VIEIRA, 1999; VIEIRA; MARTINS, 2002).
O cerrado é o segundo maior bioma do Brasil. Ocupa uma área de aproximadamente 2
milhões de km2, e apenas 1,5 % desta extensão está protegida por lei. “É considerado um
complexo vegetacional de grande heterogeneidade fito fisionômica” (GUARIM NETO;
MORAIS, 2003).
A diversidade de táxons no Cerrado ressalta ainda mais a importância de pesquisas
com plantas, porque quanto maior a diversidade taxonômica em níveis superiores, maior é o
distanciamento filogenético entre as espécies e maior a diferença e diversidade química entre
as plantas, indicando o forte potencial desta região para a descoberta de novos agentes
terapêuticos (Ibidem).
No Brasil, o número de pesquisadores que atuam nessa nova realidade de pesquisa é
expressivo, e pode ser comprovado pela considerável quantidade de artigos publicados por
autores brasileiros em revistas nacionais e internacionais do ramo. Isso mostra que há uma
consciência sobre o potencial da biodiversidade brasileira, portanto um celeiro para a busca de
novas substâncias. Embora os pesquisadores tenham a mão a matéria-prima mais abundante e
diversificada do planeta, deve-se priorizar os estudos nas áreas com elevada degradação
18
ambiental, cujas espécies que apresentam maior risco de extinção concentram-se no Cerrado e
Mata Atlântica (PINTO et al., 2002).
A importância de se estudar estes ecossistemas, visa não somente o conhecimento do
seu perfil químico e a descoberta de novas substâncias úteis ao homem, mas também sua
preservação (PINTO et al., 2002; GUARIM NETO; MORAIS, 2003).
A flora do Estado de Mato Grosso caracteriza-se por uma grande diversidade de
espécies sendo formada pelas áreas biogeográficas do Cerrado, Pantanal, Amazônia e áreas de
transição, sendo que a presença de árvores de médio e grande porte é uma das características
mais significantes da região (LEITZKE; GUARIM NETO, 2002).
Visto o alto grau de endemismo que cada estado possui em relação a certas espécies do
cerrado, algumas espécies são comuns a todos os estados e outras são particulares de cada um.
São relatadas 561 espécies vegetais para este bioma (GUARIM NETO; MORAIS, 2003).
3.3 Família Simaroubaceae
Esta família compreende 32 gêneros, de distribuição pantropical, sendo todos
representantes lenhosos, arbustos ou árvores com folhas alternas compostas ou às vezes
inteiras, sem pontuações, podendo ou não ter espinhos. Flores, em geral, reunidas em
inflorescências axilares. Flores hermafroditas ou, por aborto, masculinas e hermafroditas,
trímeras. Sépalas livres ou soldadas. Pétalas sempre livres, raramente faltam. Estames em
número duplo ao das pétalas, filetes muitas vezes com apêndices (escamas). Ovário súpero
sobre um curto ginóforo ou sobre um disco em geral com 4 a 5 carpelos (ou menos), em geral
livres na base e soldados pelo estilete com 1 (Quassia) ou 2 óvulos por carpelo. Fruto
drupáceo, em geral separando-se em frutículos (JOLY, 1998; MUHAMMAD et al., 2004).
Diversos gêneros da família Simaroubaceae são distinguidos pela quantidade de
substâncias amargas, sendo os derivados quassinóides os mais relevantes. Provavelmente é a
presença destas substâncias que conferem as propriedades farmacológicas atribuídas a estas
plantas. A Quassia amara L, é o exemplo de espécie mais estudada desta família, a qual
apresenta vários compostos com atividades para distúrbios gastrintestinais. As principais
atividades biológicas atribuídas aos gêneros desta família são: antitumoral, antimalárica,
amebicida, antiinflamatória, inseticida, herbicida, etc (TOMA et al., 2002; TAMURA et al.,
2003; MUHAMMAD et al., 2004).
As espécies do gênero Simaba citadas em literatura estão descritas abaixo, sendo que
apenas a S. cedron é que apresenta vários estudos químicos e biológicos.
19
3.3.1 Simaba multiflora
A partir do fracionamento do extrato do lenho de Simaba multiflora foram isolados
dois quassinóides denominados de 6-α-senecioiloxichaparrinona e chaparrina, sendo que o
primeiro composto apresentou atividade antineoplásica contra várias linhagens de células em
camundongos (WANI et al., 1978). Esta atividade antineoplásica também foi observada em
outro estudo, onde também foi isolado o quassinóide 6-α-senecioiloxichaparrina (ARISAWA
et al., 1983a).
Desta espécie foram isolados vários alcalóides derivados do cantin-6-ona como: 10metoxicantin-6-ona, 10-hidroxicantin-6-ona, cantin-2,6-diona, 3-metoxicantin-2,6-diona e
escopoletina (ARISAWA et al., 1983b). Foram isolados ainda, os quassinóides 13,18dehidro-6-α-senecioiloxichaparrina e 12-dehidro-6-α-senecioiloxichaparrina (MORETTI et
al., 1986).
3.3.2 Simaba orinocensis
Desta espécie foram isolados o quassinóide orinocinolida (1) e o composto
simalikalactona D (2), sendo que ambos apresentaram boa atividade contra Plasmodium
falciparum, e ainda, o quassinóide (1) também apresentou melhor atividade contra
Leishamania donovani quando comparado com fármacos como pentamidina e anfotericina B
(MUHAMMAD et al., 2004).
(1) orinocinolida
(2) simalikalactona D
20
3.3.3 Simaba guianensis
Em um estudo com a S. guianensis, coletada em Manaus – AM, foram isolados os
quassinóides gutolactona e simalikalactona D, sendo que ambos apresentaram atividade
antimalárica em testes in vitro (CABRAL et al., 1993).
3.3.4 Simaba cuspidata Spruce
A S. cuspidata é encontrada em várias regiões da América do Sul, cujo extrato foi
investigado quanto à atividade antineoplásica. Os resultados foram significativos na inibição
do crescimento do tumor da linhagem de células leucêmicas P388. Foram isolados os
quassinóides 6-α-tigloiloxichaparrinona e 6-α-tigloiloxichaparrina, isolados posteriormente
da Ailanthus grandis Prain (Simaroubaceae), os quais também apresentaram atividade
antineoplásica no modelo analisado (POLONSKY et al., 1980).
3.3.5 Simaba cedron Planchon
Esta espécie é conhecida como "cedron", a qual é amplamente utilizada para o
tratamento de febres e picadas de cobras. Suas sementes foram introduzidas recentemente no
mercado por serem utilizadas no tratamento de problemas estomacais e infecções hepáticas.
Os frutos são usados para cólica e tratamento da malária, enquanto a casca é usada como
antiespasmódica (GUPTA, 1995).
Dentre os vários relatos da composição química da Simaba cedron, destacam-se os
compostos: cedronolactonas A, B, C, D (3-6) E, chaparrinona (7), chaparrina (8),
glaucarubolona (9), glaucarubol (10), samaderina Z, guanepolida (11), ailanquassina A (12),
poliandrol (13), cedronina e simalikalactone D (MORETTI et al., 1994; OZEKI et al., 1998,
HITOTSUYANAGI et al., 2001).
21
(9) glaucarubolona
(8) chaparrina
(7) chaparrinona
(6) cedronolactona D
(5) cedronolactona C
(4) cedronolactona B
(3) cedronolactona A
(10) glaucarubol
22
(11) guanepolia
(12) ailanquassina A
(13) poliandrol
Os quassinóides cedronolactonas A-E apresentaram nestes estudos significante
atividade citotóxica contra linhagens de células P388 (OZEKI et al., 1998). O composto
cedronina quando testado in vitro e in vivo contra o Plasmodium vinkei no modelo clássico de
4 dias, apresentou maior atividade e menor índice de resistência quando comparado com a
cloroquina, porém a relação dose terapêutica/ dose tóxica é menor que a relação
dose
tóxica/dose terapêutica para a cloroquina, restringindo assim sua utilização terapêutica
(MORETTI et al., 1994).
3.3.6 Simaba polyphylla Caval.
Esta espécie é conhecida na Amazônia como marupazinho, utilizada principalmente
como antipirética. Do extrato hexânico e da fração clorofórmica dos galhos desta espécie
foram isolados os triterpenos: nilocitina, diidronilocitina, taraxerona e o alcalóide 9metoxicantinona (SARAIVA, 2004).
23
3.3.7 Simaba subcymosa
Das cascas de S. subcymosa foi isolado um novo quassinóide denominado de
cimosanina, além dos outros conhecidos como: cedronina, chaparinona e simarolida (DE
SOUZA et al., 2005).
3.3.8 Simaba ferruginea St. Hil.
A Simaba ferruginea é conhecida popularmente como calunga ou féo-da-terra e é a
planta de interesse nesse estudo. Está distribuída amplamente na região do cerrado Matogrossense. É utilizada pela população local para tratar distúrbios gastrintestinais e obesidade
(MARCELLO et al., 2002 a, b).
A árvore possui de 3-5 metros de altura e é pouco ramificada. Possui folhas compostas
imparipenadas, com 2-4 pares de folíolos, os quais são coriáceos, elípticos, subsésseis, de cor
amarelada, dispostas em panículas terminais compostas e mais curtas que a folhagem (Fig. 1).
Os frutos são drupas oblongas de cor marrom-esverdeada quando maduras e reproduz-se por
sementes (LORENZI; MATOS, 2002).
Está distribuída nas regiões Centro-Oeste e Norte do Brasil, e também na América
Central. O decocto das cascas e rizoma da S. ferruginea, é utilizado na medicina popular
como antifebrífugo, antidiarreico, anti-reumático e contra hidropisia. Esta espécie faz parte
também de um projeto nacional da EMBRAPA com a UFMT de estudos de conservação e
pesquisa de plantas medicinais, por ser uma planta de amplo uso popular, com forte pressão
antrópica e ser obtida exclusivamente por extrativismo (LORENZI; MATOS, 2002; VIEIRA;
MARTINS, 2002).
Na literatura científica não há relatos sobre a composição química ou atividade
biológica da S. ferruginea, exceto alguns estudos publicados em resumos de congressos, onde
foram utilizados extratos de rizomas e cascas do caule, os quais apresentaram atividades
antiúlcera, antiinflamatória, ação estimulante da propulsão intestinal e uma possível ação
estimulante central (MARCELLO et al., 2002 a, b).
24
Figura 1: Simaba ferruginea: folhas e rizoma
3.3.9 Outros gêneros relevantes da família Simaroubaceae
A espécie Eurycoma longifolia Jack vem sendo amplamente citada na literatura devido
à presença de vários constituintes com atividade citotóxica e antimalárica, sendo esta última
propriedade terapêutica mencionada na medicina tradicional. Das raízes desta planta foram
isolados inúmeros compostos: quassinóides (euricomanona, 13,21-dihidroeuricomanona, 13-α
-(21)-epoxieuricomanona, euricomalactona, euricolactona D, E, F) e os alcalóides (9hidroxicantin-6-ona (15), 9-metoxicantin-6-ona (16), 1-hidroxi-9-metoxicantin-6-ona (17), 5hidroximetil-9-metoxicantin-6-ona (18), 9-metoxicantin-6-ona-N-oxide), (KARDONO et al.,
1991; ANG et al., 2002; CHOO et al., 2002; TAN et al., 2002; KUO et al., 2003; CHAN
et al., 2004).
Das folhas de Eurycoma longifolia foram isolados alguns quassinóides como: 14,15βdihidroxikalaineanona,
15-β-O-acetil-14-hidroxikalaineanona,
longilactona,
os
quais
apresentaram atividades antiesquistossomal, antitumoral e antimalárica (JIWAJINDA et al.,
2002).
Estudos com o lenho da Quassia amara L. tem demonstrado atividade inibitória da
secreção basal do hormônio luteinizante (LH) e folículo estimulante (FSH) e também redução
25
dos níveis de testosterona pelas células Leydig em teste in vitro e in vivo, cujo efeito biológico
foi similar entre os compostos 2-metoxicantin-6-ona (19) e quassina, ambos isolados desta
planta e que demonstraram efeitos antifertilidade (NJAR et al., 1995; RAJI, BOLARINWA,
1997).
(15) 9-hidroxicantin-6-ona
(16) 9-metoxicantin-6-ona
)
))
,
+
! #
##
&
(17) 1-hidroxi-9-metoxicantin-6-ona
-
#'
).
(
*
(19) 2-metoxicantin-6-ona
$
%
" (18) 5-hidroximetil-9-metoxicantin-6-ona
26
4 METODOLOGIA
4.1 Análise fitoquímica dos rizomas
4.1.1
Material vegetal
Os rizomas da árvore Simaba ferruginea St. Hil. foram coletados em outubro de 2001,
no município de Cuiabá – MT, bairro Jardim Itália, cuja exsicata nº 21.883 foi depositada no
Herbário Central da Universidade Federal do Mato Grosso. Os rizomas foram secos em estufa
a 40 ºC, posteriormente moídos e pesados.
4.1.2 Preparação do extrato bruto
Utilizou-se 2 kg de rizomas secos, que foram igualmente divididos em duas porções de
1 kg, e macerados separadamente com metanol por sete dias em percolador. Após este
período, o macerado foi filtrado e recolhido em recipientes apropriados. Em seguida, foram
concentrados em evaporador rotatório sob pressão reduzida até volume desejado, cujos
recipientes foram armazenados em geladeira. A partir desses extratos foi realizada à extração
específica para alcalóides e o fracionamento convencional (CECHINEL FILHO; YUNES,
1998).
4.1.3 Preparação das frações
a) Particionamento Convencional
O solvente do extrato foi evaporado até secura, cujo rendimento foi de 40 g de extrato
metanólico bruto. Deste, foram reservados 5 g para testes farmacológicos, e o restante foi
suspenso em 250 mL de metanol e 100 mL de água e posteriormente particionado com
solventes de polaridade crescente (Fig. 2), onde obteve-se as respectivas frações: Hexano
(4,16 g), Diclorometano (1,53 g) e Acetato de Etila (0,6 g), propiciando desta forma, uma
semi-purificação conforme a polaridade de seus constituintes e do solvente aplicado para a
extração (CECHINEL FILHO; YUNES, 1998).
b) Extração Específica para Alcalóides
O outro recipiente com extrato metanólico bruto permaneceu reservado em geladeira
por determinado tempo, e ao iniciar a evaporação do solvente foi percebido o acúmulo de
precipitado no béquer, o qual foi filtrado, seco (2,528 g) e reservado para análises posteriores.
27
Obteve-se um rendimento de 38 g de extrato metanólico bruto após a evaporação do solvente
(Fig. 3).
Deste extrato, utilizou-se 15 g, que foram dissolvidos com 150 mL de metanol e 75
mL de água, cuja suspensão foi alcalinizada com amônia (10 %) até pH 9 e extraída
sucessivamente com clorofórmio, obtendo-se duas soluções: clorofórmio e resíduo do extrato
bruto alcalino aquoso. Em seguida a solução clorofórmica foi acidificada com uma solução de
ácido clorídrico (0,1 M) até pH 4-5 a qual foi recolhida separadamente através do funil de
separação. Por fim, esta solução aquosa foi alcalinizada novamente com amônia e extraída
três vezes consecutivamente com clorofórmio, obtendo-se a Fração de Alcalóides (1,015 g)
(UGAZ, 1994; SIMÕES et al., 2002).
O resíduo aquoso alcalino do extrato bruto foi novamente extraído com DCM por 3
vezes consecutivas de 100 mL, seguido de extração com AE e butanol, resultando em 3
frações: Fração DCM-RA (0,28 g), Fração AE-RA (0,46 g) e Fração Butanólica-RA (3,6 g).
4.1.4 Análise cromatográfica
Todas as frações foram submetidas à cromatografia em camada delgada (CCD),
visando uma análise fitoquímica preliminar, utilizando-se sistemas de eluentes e reveladores
usuais para “screening” fitoquímico.
Para este procedimento foram utilizadas placas de cromatografia de sílica Gel 60 F254
adquiridas da Merck como fase estacionária, e diversos eluentes como fase móvel, variando o
tipo e a proporção conforme o comportamento da fração analisada, sendo eles: clorofórmio,
metanol, hexano, acetato de etila.
Para revelar as classes dos compostos foram utilizados reveladores universais como
Ultra-Violeta e Ácido sulfúrico 10%, e reveladores específicos como: anisaldeído sulfúrico
para terpenóides e esteróides que se apresentam em manchas coradas de rosa ou roxo, cloreto
férrico 3% para flavonóides e compostos fenólicos cujas manchas apresentam-se coloridas,
Dragendorff para alcalóides através da cor laranja, e outros (UGAZ, 1994).
4.1.5 Separação e purificação dos compostos
Após determinação do perfil fitoquímico, as frações com melhor rendimento foram
submetidas a procedimentos de cromatografia em coluna (CC), onde utilizou-se sílica Gel 60
(70-230 mesh) da Merck, para as colunas das frações brutas. No intuito de purificar as
subfrações, estas foram recromatografadas conforme o sistema citado anteriormente e também
através de cromatografia flash, utilizando sílica gel Merck (250-400 mesh) como fase
28
estacionária. Para purificação de subfrações muito polares, foi utilizado como fase
estacionária o polímero Sephadex LH-20, cujo mecanismo de separação é a exclusão de
tamanho.
Os eluentes da fase móvel foram selecionados de acordo com a análise feita em CCD,
tendo aumento gradual de polaridade conforme a fração utilizada. O eluente mais o produto
carreado foram recolhidos por gotejamento em frascos de aproximadamente 10 mL,
numerados seqüencialmente, sendo que cada frasco foi analisado por CCD. Após a análise do
perfil cromatográfico, os frascos semelhantes foram reunidos formando uma subfração, sendo
que as que se encontravam com maior grau de pureza e bom rendimento, foram novamente
cromatografadas até obtenção de compostos puros.
4.1.6 Identificação e elucidação estrutural dos compostos isolados
Os compostos puros ou semi-puros foram identificados por métodos espectroscópicos
usuais, como Infra-Vermelho (IV – BOMEM-100) existente na Central Analítica do curso de
Farmácia na UNIVALI, Ressonância Magnética de Hidrogênio (RMN-1H) e Carbono-13
(RMN13C Varian XL-300) que foram realizados na Itália (CNR/Roma) pelo professor Dr.
Franco Delle Monache.
Compostos conhecidos, como esteróides, foram identificados apenas através de Infra
Vermelho, Ponto de Fusão e Co-CCD.
4.2 Análise fitoquímica das folhas
4.2.1 Material vegetal
As folhas de Simaba ferruginea, oriundas da cidade de Santo Antônio de Leverger –
MT (30 Km ao Sul de Cuiabá), foram coletadas em outubro de 2001, e identificadas por
comparação com a exsicata n° 21.883. Estas foram secas em temperatura ambiente, moídas e
pesadas.
4.2.2 Obtenção dos extratos
O material vegetal (400 g) foi macerado durante sete dias com metanol e após este
período foi concentrado em evaporador rotatório sob pressão reduzida até secura a fim de
obter o extrato metanólico bruto (EMB) (Fig. 4).
4.2.3 Preparação das frações
29
O EMB foi suspenso com acréscimo de metanol/água (150:75 mL) e em seguida
particionado com solventes de polaridade crescente como: Hexano (HEX), Diclorometano
(DCM) e Acetato de Etila (AE), a fim de realizar uma semi-purificação conforme a polaridade
dos compostos. As frações obtidas foram evaporadas até a secura e armazenadas no
dessecador a fim de obter-se o rendimento real e evitar proliferação de fungos (CECHINEL
FILHO; YUNES, 1998).
4.2.4 Análise Cromatográfica
Todas as frações foram analisadas através de cromatografia de camada delgada (CCD)
a fim de identificar as principais classes de compostos presentes em cada uma, conforme
método descrito em 4.1.4.
4.2.5 Separação e purificação dos compostos
As frações foram submetidas a procedimentos de cromatografia em coluna (CC),
utilizando-se sílica gel Merck 60 (70-230 mesh) como fase estacionária e vários sistemas de
eluentes como fase móvel, escolhidos previamente pela análise em CCD. Os compostos
eluídos foram coletados em frascos de aproximadamente 10 mL, que após secos foram
analisados por CCD e reunidos conforme perfil cromatográfico, formando as subfrações, as
quais foram recromatografadas até obter-se compostos puros. Conforme perfil da fração que
estava sendo purificada, foi utilizado ainda, cromatografia centrífuga (Cromatotron) que
auxiliou no isolamento de compostos a partir de subfrações quase puras, e cromatografia em
coluna com Sephadex LH-20 para substâncias muito polares.
As subfrações obtidas foram monitoradas quanto ao grau de pureza através de CCD. O
critério de pureza adotado foi aquele em que variando-se o sistema de solvente empregado,
observou-se apenas uma única mancha uniforme em CCD.
4.2.6 Identificação dos compostos
Idem item 4.1.6
30
Simaba ferruginea
(rizoma- 1kg)
Extrato Metanólico Bruto de Simaba ferruginea (35 g)
Fração AE (0,6 g)
Fração Hexano (4,16 g)
4-9
(450 mg)
Fração DCM (1,53 g)
CC sílica gel
1,5 g
66-110
(127 mg)
CC sílica gel
1g
12-54 (87 mg)
55-174 (83 mg)
4 sub-frações
5 sub-frações
C
C
A
175-246
(136 mg)
10-40
(250 mg)
140-179
(45 mg)
5 sub-frações
B
D
D
Figura 2: Fluxograma dos processos realizados com o extrato bruto dos rizomas de Simaba
ferruginea (DCM: diclorometano, AE: acetato de etila).
31
Simaba ferruginea
(rizomas- 1kg)
Maceração c/ MeOH por 7 dias
Extrato Metanólico Bruto de Simaba ferruginea (15 g)
Suspensão do Ext. Bruto
(metanol /água 150:75)
Hidróxido de amônio – pH 9-10
Resíduo Ext. Bruto Alcalino
Fr. DCM (280 mg)
Fração de Clorofórmio
Alcalina (500 mL)
Acidificação pH 4-5 c/ HCl
Res. Ext. Bruto
CHCl3
ácido
Res. Ext. Bruto
Fr. AE ( 467 mg)
Fr. Butanólica (3,6 g)
Figura 3: Fluxograma do processo extrativo de alcalóides
Fração
Aquosa
Alcalinização e extração
com CHCl3
Fração
Alcaloídica
(1,015 g)
32
Simaba ferruginea
(folhas – 400 g)
Extrato Metanólico Bruto de Simaba ferruginea (19 g)
CC sílica gel
CC sílica gel
Fração DCM
(0,857 g)
Fração Hexano (2,2 g)
1-11
12-18
46-153
(189 mg)
(81 mg)
(127 mg)
Vários
Compostos
FA
Fração AE (4,42 g)
25-54 (635 mg)
55-70 (444 mg)
FB
FB + outro
composto
Vários
Compostos
88 - 144 (298 mg)
FB
Figura 4: Fluxograma dos processos de preparação das frações e purificação dos compostos
isolados das folhas de Simaba ferruginea.
4.3 Atividade Farmacológica
As avaliações dos efeitos antiúlcera e antinociceptivo, foram realizadas na Faculdade
de Medicina/UFMT, sob a coordenação do professor Dr. Domingos Tabajara de Oliveira
Martins, através dos modelos experimentais descritos a seguir.
4.3.1 Atividade antinociceptiva
A) Teste das contorções abdominais induzidas por ácido acético
Este modelo de nocicepção desenvolvido por Collier et al. (1968), é relativamente
simples, mas avalia atividade antinociceptiva das substâncias testadas de forma inespecífica
33
(atividade central ou periférica), sendo amplamente utilizada pelos farmacologistas (SOUZA
et al., 2003).
Os animais foram divididos em onze grupos distintos com 8 animais cada, sendo um
controle, cujo pré-tratamento constituiu-se apenas de veículo, e os demais grupos tratados
conforme as amostras testadas: extrato metanólico 5 mg/kg e 20 mg/kg, fração alcaloídica 5
mg/kg e 20 mg/kg, compostos C, D e FB 5 mg/kg e 20 mg/kg cada, por via intraperitoneal 30
minutos antes da injeção de ácido acético. O ácido acético 0,6 % foi diluído em salina 0,9%
(10 mL/kg). Em seguida os animais foram colocados na bancada sob funis de vidro
individualmente, onde anotou-se o número de contorções a cada 5 minutos por 30 minutos.
Ao final relacionou-se graficamente as médias acumuladas em função do tempo.
4.3.2 Atividade antiúlcera
A) Úlcera gástrica aguda induzida por etanol
Este modelo de lesão gástrica ocorre independentemente de qualquer efeito sobre a
secreção ácida gástrica, pois está relacionada com a geração de espécies reativas de oxigênio a
partir de sua metabolização, causando focos hiperêmicos e hemorrágicos por todo o
estômago, indicando ainda, comprometimento do fluxo sanguíneo neste órgão (LAPA et al.,
2002).
Camundongos machos pesando entre 30-35 g, em jejum por 12 hs, distribuídos nos
respectivos grupos a serem analisados receberam as amostras (extrato metanólico dos rizomas
e folhas, frações dos rizomas e folhas, compostos isolados (C, D, FB) nas doses de 5 mg/kg
ou 20 mg/kg, via oral (1 h) ou via intraperitoneal 30 minutos antes da administração de etanol
50% (10 mL/kg) via oral.
Após 30 minutos da administração do etanol, os animais foram sacrificados sob
anestesia etérea e seus estômagos foram removidos e abertos pela grande curvatura,
posteriormente lavados com salina 0,9% e mantidos em béquer contendo salina a 0,9%
gelada. Após esse procedimento, os estômagos foram estendidos e prendidos em placa de
Petri com fundo parafinado por meio de alfinetes, e as lesões gástricas foram avaliadas por
meio de lupa estereoscópica (ROBERT et al., 1979).
B) Úlcera gástrica induzida por indometacina
34
Este modelo avalia a formação de úlceras por inibição da síntese de prostaglandinas
(PGE2 e PGI2), as quais são responsáveis pela formação e secreção do muco, cuja atividade é
inibida na presença de medicamentos que atuam sobre a ciclooxigenase 1, mecanismo de ação
dos AINES, como a indometacina (LAPA et al., 2002).
Ratos machos pesando em média 200 g para cada dose de cada amostra, foram
submetidos a jejum por 18 h com água ad libidum. Após esse tempo, os animais receberam os
tratamentos conforme os respectivos grupos (extrato metanólico dos rizomas, frações,
compostos isolados – C, D, FB) nas doses de 5 mg/kg e 20 mg/kg via oral e intraperitoneal,
enquanto o grupo controle recebeu somente veículo.
As lesões gástricas foram induzidas pela administração de 30 mg/kg de indometacina
dissolvida em bicarbonato de sódio a 2% após 1 hora do tratamento com a planta. Após 3
horas da administração do agente ulcerogênico, repetiu-se o tratamento com as amostras da
planta e veículo.
Passados 6 horas da administração do agente lesivo, os animais foram sacrificados por
anestesia etérea, os estômagos retirados, abertos pela grande curvatura, lavados com salina
0,9% e mantidos imersos em béquer contendo salina 0,9 % gelada. As lesões gástricas foram
quantificadas para atribuição do número e índice de úlceras (DJAHANGUIRI, 1969).
Para se determinar à magnitude da ulceração foi utilizado um índice de ulceração,
além do número médio de úlceras para cada grupo experimental e controle. O índice de
ulcerações foi considerado como sendo a soma total dos pontos obtidos após o exame da
mucosa gástrica, levando-se em conta, o número total de úlceras e a média dos índices de
lesão de acordo com o grau e a pontuação atribuída conforme dados citados abaixo.
35
Quadro 1: Escores para avaliação das lesões gástricas induzidas por indometacina
ÍTENS
ATRIBUIÇÕES DE
ANALISADOS
ESCORES
a) Coloração da
mucosa
Normal
(0 ponto)
b) Perda de pregas
da mucosa
c) Petéquias
(1ponto)
Hiperêmica
(1 ponto)
Descorada
(1 ponto)
Leve
Moderado
Intenso
(1ponto)
(2 pontos)
(3 pontos)
d) Edema
Leve
Moderado
Intenso
(1ponto)
(2 pontos)
(3 pontos)
e) Hemorragia
Leve
Moderado
Intenso
(1ponto)
(2 pontos)
(3 pontos)
f) Perda de muco
Leve
Moderado
Intenso
(1ponto)
(2 pontos)
(3 pontos)
g) Lesões necroAté 1 mm
Maior que 1mm
Perfuradas
hemorrágicas (úlcera
(ponto)
(1,5pontos x mm)
(5pontos x mm)
Foi considerado o grau de lesão leve quando a área afetada foi < 25 %, moderado =50% e
intensa > 50 %.
4.3.3 Análise estatística
Os dados dos gráficos foram expressos em Média ± Erro Padrão Médio. Aos dados
não paramétricos, usou-se a mediana com os limites mínimo e máximo.
A comparação entre duas médias foi realizada através do teste “T” de Student, não
pareado, bicaudal. Para comparação múltipla dos dados paramétricos foi utilizada a análise de
variância (ANOVA), seguida de Student-Newman-Keuls.
Em todas as análises estatísticas, considerou-se o nível crítico para rejeição da hipótese
de nulidade menor que 0,05 (p<0,05). Os asterísticos (* p< 0,05; ** p < 0,01 e *** p <0,001)
serviram para caracterizar o grau de significância estatística entre o grupo controle e o grupo
analisado (STUDENT, 1908; SNEDECOR, 1963).
36
5 RESULTADOS E DISCUSSÃO
5.1 Análise fitoquímica
Para realizar as análises da constituição química dos rizomas e folhas de Simaba
ferruginea, logo após secagem destes materiais vegetais, os mesmos foram macerados com
metanol, onde obteve-se os três extratos brutos, que foram utilizados no decorrer do trabalho
de pesquisa. Os extratos metanólicos brutos dos rizomas apresentaram bom rendimento, pois
ambos partiram de 1 kg de material vegetal e renderam 40 g e 38 g de EMB cada, o que
corresponde a aproximadamente 4 % e 3,8 % de massa bruta, sendo que o último foi
reservado para extração específica de alcalóides.
As folhas de S. ferruginea, após maceradas com metanol, renderam 21 g de EMB, o
que corresponde a aproximadamente 5,25% de massa bruta, sendo este considerado um bom
rendimento já que a quantidade de material vegetal utilizado foi relativamente pequena em
vista dos rizomas, porém neste extrato havia considerável quantidade de clorofila e outros
pigmentos. Após particionamento de 19 g do EMB obteve-se as seguintes frações com seus
respectivos rendimentos: Fr. Hexano (2,2 g), Fr. DCM (0,857 g), Fr. AE (4,42 g) e Fr. Aquosa
(10,15 g). Observa-se, através dos rendimentos obtidos durante o fracionamento do extrato
bruto, que a maioria dos compostos apresenta alta polaridade, pois foram extraídos com
quantidade relativamente suficiente para purificação, somente às frações AE e Aquosa,
considerando que de cada fração, necessita-se de aproximadamente 1 g para testes biológicos.
Para o fracionamento dos rizomas, foi utilizado 35 g de extrato metanólico bruto que
foi dissolvido em metanol: água (250:100 mL), sendo que restou uma massa insolúvel que foi
armazenada em geladeira, denominada de resíduo do extrato bruto. Obteve-se as frações
Hexano (4,16 g), DCM (1,53), AE (0,6 g) e Aquosa (15 g). Deve-se ressaltar, que a extração
foi repetida 5 vezes de 100 mL com cada solvente, e ainda assim, o rendimento das frações foi
baixo, principalmente da fração AE, que não foi cromatografada devida a pequena quantidade
obtida.
Posteriormente, alíquotas de cada fração, dos rizomas e das folhas, foram submetidas a
procedimentos cromatográficos em camada delgada (CCD) a fim de estabelecer o perfil
fitoquímico, determinando as principais classes de compostos presentes em cada parte da
planta, e também selecionar as frações a serem cromatografadas, bem como os solventes a
serem utilizados no processo de purificação das frações.
37
Verificou-se que os rizomas e as folhas apresentam constituição química distinta,
sendo que nos rizomas há predomínio de compostos alcaloídicos e nas folhas presença
majoritária de compostos fenólicos. Conforme pode ser observado no quadro abaixo, nos
rizomas praticamente não há compostos fenólicos, enquanto nas folhas não foi detectado à
presença de alcalóides, demonstrando a variabilidade metabólica de uma planta em suas
diferentes partes, o que pode conferir distintas propriedades terapêuticas e maior
probabilidade de encontrar novos compostos de interesse biológico.
Quadro 2: Perfil fitoquímico das frações das folhas e rizomas de S. ferruginea observados em
CCD através de reveladores específicos para algumas classes de compostos.
Frações
Anisaldeído
FeCl3
Dragendorff
KOH
Hexano rizomas
XXX
-
XX
-
DCM rizomas
XX
-
XXX
-
AE rizomas
X
X
-
-
Hexano folhas
XXX
-
-
-
DCM folhas
XXX
-
-
-
AE folhas
-
XXX
-
-
Desenvolvimento de “n” manchas coloridas: X (1-2 ), XX (até 4), XXX (várias e ou predominantes)
Devido o interesse da equipe em trabalhar com alcalóides, constituintes químicos que
geralmente apresentam atividade biológica relevante, realizou-se a extração específica para
alcalóides a partir do extrato bruto metanólico (15 g), conforme foi demonstrado na figura 3,
que rendeu a fração alcaloídica (1,015 g). A fim de tentar extrair mais compostos, foi
particionado o resíduo do extrato aquoso bruto oriundo do processo de obtenção da fração
alcaloídica, o qual rendeu as frações: DCM-RA (280 mg), AE-RA (467 mg) e fração
butanólica-RA (3,6 g).
5.1.1 Frações do Rizoma – Extração convencional
A) Fração Hexano
A partir de processo cromatográfico em coluna aberta (CC) com sílica gel como fase
estacionária, e proporções distintas e crescentes de hexano/ acetona como fase móvel, obtevese 9 subfrações que foram analisadas por CCD, e as que apresentaram maior rendimento e
melhor perfil, foram recromatografadas.
38
A subfração 4-9 (450 mg) rendeu mais 5 subfrações (A-E) após recromatografada,
sendo que a subfração 4-9 B (78 mg) que apresentava-se mais pura, tratava-se de uma mistura
de ácidos graxos insaturados (A), assim como as demais subfrações oriundas desta CC.
A subfração 10-40 (250 mg) quando recromatografada também rendeu 5 subfrações
(A-E), sendo que a subfração 10-40 A (82 mg), foi novamente recromatografada, mas não
houve sucesso na purificação, mas provavelmente há presença de resíduos de ácidos graxos e
esteróides (B), pois algumas manchas reveladas com anisaldeído, apresentaram o mesmo Rf
de esteróides comumente encontrados nas plantas.
Após recromatografar a subfração 66-110 (127 mg) com sílica gel e hexano / acetona,
obteve-se 17 mg do composto C, encontrado posteriormente com maior rendimento nas
frações DCM, DCM-RA, AE-RA e fração alcaloídica. Da subfração 140-179 (45 mg) após
cromatografia obteve-se o composto D (9 mg), o qual também foi isolado nas frações citadas
acima.
B) Fração DCM
Esta fração (1 g) foi cromatografada em CC de sílica gel, hexano / acetona, rendendo 5
subfrações: 1-11 (21 mg), 12-54 (87 mg), 55-174 (83 mg), 175-246 (136 mg), 247-300 (49
mg). Três destas subfrações foram novamente recromatografadas, devido melhor rendimento
e melhor perfil fitoquímico observado em CCD.
Da subfração 12-54 (87 mg) obteve-se 4 subfrações (A-D), cuja subfração 12-54 C foi
lavada com metanol gelado, e o composto obtido provavelmente é uma mistura dos esteróides
estigmasterol e β-sitosterol (22 mg).
A subfração 55-174 (83 mg) quando purificada rendeu 5 subfrações, sendo a subfração
A foi identificada como sendo o composto C (12 mg), e as demais subfrações 55-174 B-E não
apresentaram-se puras.
Obteve-se 6 subfrações da subfração 175-246 (136 mg), sendo a subfração 175-246 C
(11 mg) identificada como sendo o composto D, e a subfração 175-246 E, uma mistura do
composto D com outro alcalóide não identificado, que devido Rf muito semelhante não foi
possível isolar.
5.1.1.1 Caracterização química e revisão da literatura do composto C
39
O composto C isolado de algumas frações dos rizomas de Simaba ferruginea foi
identificado como sendo o alcalóide cantin-6-ona (20) ou cantinona, sendo relatado pela
primeira vez para esta espécie vegetal.
/
//
/6
5
4
3
0
2
1
(20) Cantin-6-ona
O composto C foi isolado sob a forma de um óleo viscoso de coloração amarela. É
facilmente dissolvido em acetona e evidenciado em CCD, eluído com hexano/acetona (6:4),
pelo desenvolvimento da coloração laranja, quando revelado com o reativo Dragendorff. Foi
identificado por técnicas espectroscópicas de ressonância magnética nuclear de hidrogênio e
carbono-13, comparadas com a literatura conforme tabela 1.
O composto foi dissolvido em CDCl3, cujos sinais relevantes de hidrogênios vistos no
espectro abaixo (Fig. 5) são:
- dublete em 7 ppm referente ao H-5, e dublete em 8,03 referente ao H-4, um pouco mais
deslocado devido proximidade a carbonila.
- dublete em 8,68 ppm referente ao H-8; triplete em 7,54 ppm referente H-9; duplo dublete
em 7,78 ppm referente H-10; dublete em 8,11 ppm referente H-11, região típica de
hidrogênios de aromáticos, sendo apenas o deslocamento do H-8 mais acentuado devido
proximidade ao nitrogênio.
- dublete em 7,97 ppm referente ao H-1, e dublete em 8,83 ppm referente ao H-2 próximo ao
nitrogênio. Esses deslocamentos são também citados em literatura (KOIKE; OHMOTO,
1985; FACUNDO et al., 2002).
Os sinais observados no espectro de carbono-13 (Fig. 6) correspondem aos citados na
literatura (FACUNDO et al., 2002), sendo:
- sinais em 117,32; 130,9; 125,67 e 122,69 ppm correspondem respectivamente aos C-8, 9,
10 e 11, todos do tipo C-H conforme pode ser observado no espectro APT.
40
- sinais em 135,23; 139,6; 124,4; 130,3; 132,0 correspondem aos respectivos carbonos
quaternários C3a, C7a, 11 a,b,c, sendo os carbonos mais próximos ao nitrogênio com maior
deslocamento.
- o sinal em 159,5 ppm é relativo ao C6 (carbonila).
Tabela 01: Valores dos deslocamentos químicos (ppm) de 13C e 1H para o alcalóide cantin-6ona conforme dados da literatura e valores obtidos para o composto C.
Carbono
13
C
DMSO-d6
1
H (J=Hz)
Composto C
CDCl3
CDCl3 -
13
C
Composto C
CDCl3 -
1
H (J=Hz)
C
3a
135,53
136,23
6
158,21
159,5
7a
138,24
139,6
11a
123,63
124,4
11b
129,43
130,3
11c
130,91
132,0
CH
1
115,90
7,59 (d J =5,0)
116,42
7,97 (d J= 5,0)
2
145,33
8,58 (d J = 5,0)
145,85
8,83 (d J= 5,0)
4
139,00
7,77 (d J = 9,7)
144,08
8,01 (d J= 9,8)
5
128,37
6,75 (d J = 9,7)
128,94
7,00 (d J= 9,8)
8
116,60
8,28 (d J = 7,7)
117,32
8,69 (d J= 7,7)
9
130,29
7,45 (t J =7,7)
130,89
7,53 (td J= 7,5; 1,1)
10
125,13
7,28 (t J =7,7)
125,67
7,71 (td J= 7,5; 1,1)
11
122,03
7,73 (d J = 7,7)
122,66
8,12 (d J= 7,7)
Fonte: KOIKE; OHMOTO, 1985; FACUNDO et al., 2002.
41
Figura 5: Espectro de RMN-1H do composto C em CDCl3 (300 MHz).
42
Figura 6: Espectro de RMN-13C do composto C em CDCl3 (75.5 MHz).
43
Os alcalóides constituem um vasto grupo de metabólitos com imensa diversidade
estrutural, classificados de acordo com o aminoácido precursor de sua rota biossintética. O
alcalóide cantin-6-ona é classificado como um alcalóide indólico, cujo aminoácido precursor
é o triptofano. Esta classe de alcalóides apresenta grande importância econômica e
farmacológica, sendo os principais compostos desta classe: vincristina e vimblastina,
alcalóides com atividade antineoplásica isolados da Catharanthus roseus; ergotamina que é
utilizada para tratamento da enxaqueca devida atividade adrenérgica sobre receptores α-2,
isolada da Claviceps purpurea; ajmalicina (Rauwolfia serpentina) e ioimbina (Pausinystalia
yohimbe) agentes simpatolíticos utilizados para hipertensão e impotência masculina
respectivamente; entre vários outros alcalóides indólicos com significativa atividade
terapêutica (DEWICK, 2002; SIMÕES et al., 2002; HOSTETTMANN et al., 2003).
Dentre as várias atividades do alcalóide cantin-6-ona citadas na literatura, destacam-se
os estudos que demonstraram atividade contra Leishmania amazonensis, sendo mais
significativa no tratamento de infecção tópica (FERREIRA et al., 2002); atividade inibitória
sobre a ativação do Epstein-Barr (MURAKAMI et al., 2004); a citotoxicidade observada
sobre queratinócitos de cobaia (ANDERSON et al., 1983) e ainda mais relevante, a efetiva
atividade citotóxica contra várias linhagens humanas de células cancerosas como: melanoma,
fibrosarcoma, pulmão, mama, antileucêmico e outras (FUKAMIYA et al., 1986; KARDONO
et al., 1991; KUO et al., 2003).
Deve-se ressaltar ainda, um estudo bio-monitorado da planta Zanthoxylum chiloperone
por bioautografia, onde foi isolado o alcalóide cantin-6-ona que exibiu atividade antifúngica
de amplo espectro, sendo efetivo contra cepas de: Aspergillus fumigatus, A. niger, A. terreus,
Cândida albicans, C. tropicalis, C. glabrata, Saccharomyces cerevisiae, entre outros, cujo
MIC (concentração inibitória mínima) variou entre 5,3 a 46 micro mol/L (THOUVENEL et
al., 2003). A atividade fungicida do cantin-6-ona encontra-se relatada também em um estudo
biodirecionado das raízes e cascas de Zanthoxylum usambarense (HE et al., 2002).
5.1.1.2 Caracterização química e revisão da literatura do composto D
O composto D foi identificado como sendo o alcalóide indólico 4-metoxicantin-6-ona
(21) ou 4-metoxicantinona. Assim como o composto C, este foi isolado em grande quantidade
na fração alcaloídica e demais frações, sendo também, descrito pela primeira vez para esta
espécie vegetal.
44
Este alcalóide foi isolado sob a forma de pó amorfo e cristais de coloração amarela,
solúvel em acetona. Detectado em CCD quando eluído com hexano/acetona (6:4) e revelado
com Dragendorff, cuja reação demonstrava forte cor laranja.
8
88
<
;
:
9
7
(21) 4-metoxicantin-6-ona
O alcalóide 4-metoxicantin-6-ona apresenta espectro de RMN-1H (Fig. 7) semelhante
ao cantin-6-ona, cujos sinais que os diferenciam referem-se aos hidrogênios 4 e 5, que antes
eram dois dubletes, estão representados agora por dois singletes em
em
7,31 referente à H-5 e
4,07 referente ao H da metoxila que encontra-se ligada ao carbono 4, cujos resultados
coincidem com os citados na literatura, conforme tabela 2.
45
Figura 7: Espectro de RMN-1H do composto D em CDCl3 (300 MHz).
46
Figura 8: Espectro de RMN-13C do composto D em CDCl3 (75.5 MHz).
47
O espectro de carbono do composto D (Fig. 8) também é semelhante ao do alcalóide
cantin-6-ona, cujos sinais que os diferenciam são:
- 109,1 ppm referente ao C-5 que foi deslocado para campo baixo devido proximidade do
carbono que tem ligado uma metoxila
- observa-se também um sinal adicional em 56,7 ppm referente ao carbono da metoxila, e em
154,34 ppm referente ao C-4, cujo grupo metoxila está ligado, deslocando-o para campo alto
no espectro, bem próximo ao sinal da carbonila (155,2 ppm).
Tabela 02: Valores dos deslocamentos químicos (ppm) de
13
C e 1H para o alcalóide 4,5-
dimetoxicantin-6-ona conforme dados da literatura e valores obtidos para o composto D.
Carbono
13
C
CDCl3
1
H (J= Hz)
Composto D
CDCl3
CDCl3 -
13
C
Composto D
CDCl3 -
1
H (J = Hz)
C
3a
132,71
136,28
4
152,05
154,34
6
157,43
155,2
7a
138,22
139,81
11a
123,96
124,88
11b
129,15
129,58
11c
127,61
127,20
CH
1
114,89
7,47 (d J =5,0)
113,87
8,07 ( d J= 5,0)
2
144,48
8,54 (d J = 5,0)
145,33
8,77 ( d J= 5,0)
5
127,98
109,73
7,31
8
116,24
8,16 (d J = 7,7)
117,07
8,64 (d J= 7,7)
9
130,01
7,37 (t J =7,7)
130,47
7,78 (dt J= 7,5; 1,1)
10
124,59
7,19 (t J =7,7)
125,77
7,63 (dt J= 7,5; 1,1)
11
121,78
7,54 (d J = 7,7)
122,57
8,33 (d J= 7,7)
61,17
4,40 (s)
56,63
4,07
-
CH3
4-OCH3
Fonte: KOIKE; OHMOTO, 1985; FACUNDO et al., 2002.
48
O alcalóide cantin-6-ona pode ter várias substituições em seu núcleo fundamental,
sendo o grupamento metoxila um dos mais constantes, distribuídos em vários carbonos,
conferindo maior lipossolubilidade ao composto e também diferentes ou potentes atividades
biológicas. Em uma avaliação com compostos alcaloídicos tipo beta-carbolinas, indólicos e
isoquinolínicos quanto à afinidade em receptores benzodiazepínicos, observou-se que apenas
as moléculas metoxiladas e ou com grupamentos carbonilas foram capazes de ligarem-se aos
receptores benzodiazepínicos (GUZMAN et al., 1984).
Em outro estudo com os derivados metoxilados do cantin-6-ona foi observado
atividade citotóxica in vitro contra cultura de células KB e, atividade contra o Plasmodium
falciparum (CHAN et al., 2004).
5.1.2 Frações do Rizoma – Extração Específica para Alcalóides
A partir de 15 g do extrato metanólico bruto dos rizomas, dissolvidos em metanol /
água (150:75 mL), seguiu-se à metodologia descrita por UGAZ (1994), para extração
específica de alcalóides (Fig. 3), até obtenção da fração alcaloídica (1,015 g), da qual, 400 mg
foram enviados para testes farmacológicos.
Devido o volume do resíduo do extrato bruto ser relativamente grande
(aproximadamente 120 mL), procedeu-se partição deste com solventes de polaridade
crescente, que rendeu as frações: DCM-RA (280 mg), AE-RA (467 mg), Butanólica –RA (3,6
g), tendo a denominação final de RA (resíduo da fração alcaloídica) para diferenciar do
particionamento convencional.
Durante o processo de preparação deste extrato bruto, houve a formação de um
precipitado amarelo no fundo do béquer, que foi filtrado, seco, pesado (2,528 g) e
denominado de fração PPT.
A) Fração alcaloídica
Foi cromatografado 300 mg desta fração em CC de sílica gel, eluída com hexano /
acetona, onde obteve-se 4 subfrações: 2-7 (19 mg), 8-16 (10 mg), 17-80 (34 mg) e 81-113 (29
mg). Devido ao baixo rendimento, ficou inviável a purificação destas subfrações, mas através
de CCD, eluída sempre com a mistura Hexano / Acetona 6:4 e revelada com Dragendorff,
constatou-se que a subfração 2-7 continha 4-metoxicantin-6-ona e outro alcalóide, assim
49
como a subfração 17-80 é constituída por cantin-6-ona mais outro alcalóide, com Rf distinto
do alcalóide observado na subfração 2-7.
Mesmo não sendo possível o isolamento e a identificação destes dois alcalóides
presentes nesta fração, a constatação da presença de outros alcalóides foi muito importante,
pois justificam as atividades farmacológicas encontradas e discutidas mais adiante, visto que,
os alcalóides cantin-6-ona e 4-metoxicantin-6-ona são os compostos majoritários na planta,
mas podem ter suas propriedades terapêuticas potencializadas por outros alcalóides, mesmo
que estes encontrem-se em quantidade muito pequena, o que é muito comum para esta classe
de metabólitos, que muitas vezes até são relatados como ausentes em determinadas plantas
devido ao baixo rendimento e difícil detecção.
B) Fração PPT
Utilizou-se 2,5 g desta fração para cromatografia em coluna aberta com sílica gel,
eluída com hexano / acetona com aumento gradativo de polaridade. Obteve-se 10 subfrações:
1-6 (369 mg), 7-13 (110 mg), 14-56 (225 mg), 57-69 (46 mg), 70-99 (130 mg), 100-102 (4
mg), 103-140 (31 mg), 141-159 (12 mg), 160-221 (90 mg), 222-250 (497 mg). Estas
subfrações foram analisadas em CCD com vários reveladores, onde detectou-se a presença
majoritária dos dois alcalóides já identificados e também da presença de outros alcalóides,
sendo que alguns provavelmente são os mesmos obtidos na fração alcaloídica segundo Rf
destes.
Da subfração 14-56 após recromatografada obteve-se o alcalóide cantin-6-ona (179
mg) e, da subfração 70-99, 188 mg de 4-metoxicantin-6-ona.
C) Fração DCM-RA
Através de análise em CCD, constatou-se a presença majoritária dos compostos
alcaloídicos C e D, sendo esta fração reservada para testes biológicos.
D) Fração AE-RA
Através de análise em CCD, observou-se que esta fração é constituída
majoritariamente pelos dois alcalóides (C e D), a qual foi reservada para isolamento destes
quando necessário para testes biológicos.
50
E) Fração Butanólica
Esta fração foi cromatografada em sílica gel, eluída com clorofórmio / metanol em
diversas proporções, ainda que a grande maioria dos compostos ficaram retidos na sílica,
devido à alta polaridade destes. Obteve-se 6 subfrações: 1-14 (24 mg), 15-27 (26 mg), 28-40
(92 mg), 41-62 (234 mg), 63-74 (209 mg), 75-111 (30 mg).
A subfração 41-62 foi recromatografada em CC com Sephadex LH-20 que rendeu
mais 7 subfrações (A-G), sendo que a subfração 41-62 E, foi novamente recromatografada em
Sephadex LH-20, que assim como as demais, não houve sucesso no isolamento de compostos,
senão açúcares, detectados através de análises espectroscópicas.
Os resultados obtidos da análise fitoquímica dos rizomas da S. ferruginea, permitem
afirmar que a constituição majoritária desta parte da planta são os alcalóides cantin-6-ona e 4metoxicantin-6-ona, além de outros alcalóides evidenciados em CCD, porém alguns não
foram isolados e dois obtiveram rendimento de 2 mg, não sendo possível identificá-los.
Observou-se através da revisão bibliográfica, que a família Simaroubaceae, bem como
o gênero Simaba, apresentam inúmeros triterpenóides do tipo quassinóides, geralmente
responsáveis pelo sabor amargo da planta e por inúmeras atividades biológicas, como:
antiinflamatória, antiparasitária, antitumoral, antimalárica, citotóxica, amebicida, fungicida,
inseticida, etc (MORETTI et al., 1994; OZEKI et al., 1998; JIWAJINDA et al., 2003;
TAMURA et al., 2003).
A S. ferruginea, provavelmente deve apresentar compostos do tipo quassinóides em
sua constituição, mas em concentração relativamente baixa, pois foi observado em CCD, a
presença de compostos terpenóides, ainda que não foram isolados, devido ao baixo
rendimento das subfrações após procedimento cromatográfico de purificação em sílica. Além
disso, o intenso sabor amargo da S. ferruginea, é outro indicativo da presença destes
compostos, característica organoléptica atribuída a esta classe de compostos, explicando o
porquê da denominação féo-da-terra.
Sendo assim, a composição química dos rizomas de S. ferruginea, diferem
significativamente da maioria das espécies do gênero Simaba, pois na literatura, apenas outras
duas espécies, S. multiflora e S. polyphylla, apresentam relatos de que em sua constituição
química são encontrados alcalóides, pois nestas espécies, os compostos predominantes
também são os quassinóides. Outro aspecto importante, é a concentração destes alcalóides nos
rizomas, dos quais foram isolados
mais de 200 mg de cada, quantidade considerada
51
extremamente relevante para produtos naturais, especialmente alcalóides, que geralmente
encontram-se ou são isolados em quantidades muito inferiores a estas obtidas neste trabalho.
Deve-se salientar ainda, que a melhor metodologia para obtenção destes alcalóides é a
extração específica para alcalóides, tanto pela via ácida, a qual foi descrita neste trabalho,
como pela via alcalina. A via alcalina foi utilizada apenas a fim de estabelecer a melhor forma
de extração, sendo que, apresenta a desvantagem de extrair outros compostos. A extração
específica para alcalóides permite uma purificação rápida dos compostos além do bom
rendimento, facilitando o processo de obtenção dos alcalóides desejados.
5.1.3 Frações das folhas de S. ferruginea
A) Fração Hexano
A partir de 1,5 g desta fração foi realizada CC de sílica gel eluída com hexano /
acetona, onde obteve-se 7 subfrações: 1-11 (189 mg); 12-18 (81 mg); 19-31 (29 mg); 32-45
(25 mg); 46-153 (127 mg); 154-187 (128 mg) e 188-224 (45 mg). Todas foram analisadas em
CCD, cujos resultados demonstraram a presença de inúmeros compostos em cada subfração.
As subfrações com maior rendimento ou que se encontravam mais puras (22) foram
novamente recromatografadas em CC de sílica gel, sendo que apenas houve êxito na
purificação da subfração 12-18 (81 mg) que rendeu 14 mg do composto FA.
B) Fração DCM
Devido ao baixo rendimento desta fração (0,857 g) não foi realizado procedimento de
purificação, pois em análises de CCD esta fração também apresentou uma diversificada
composição química e nenhum composto majoritário que propiciasse sua purificação.
C) Fração AE
Esta fração foi a que melhor apresentou rendimento (4,42 g), dos quais 2 g foram
utilizados para purificação em CC de sílica gel eluída com CHCl3/ metanol, onde obteve-se 9
subfrações: 1-3 (15 mg); 4-13 (48 mg); 14-24 (146 mg); 25-54 (635 mg); 55-70 (444 mg); 7187 (146 mg); 88-144 (298 mg); 145-200 (61 mg).
Algumas subfrações apresentaram um bom rendimento e quando analisadas em CCD
constatou-se a presença majoritária de um composto fenólico dentre os demais. A primeira
subfração eleita para processos de purificação foi a subfração 25-54 (635 mg) por apresentar
maior rendimento e também pelo interesse em isolar o composto majoritário desta subfração.
52
Esta subfração foi eluída com clorofórmio / metanol e rendeu mais 7 subfrações, sendo
uma delas um precipitado de 50 mg do composto FB. Após novos processos de purificação
destas subfrações obteve-se mais 106 mg de FB.
Posteriormente foi cromatografada a subfração 55-70 (200 mg) em CC de sílica gel
eluída com clorofórmio / metanol, mas grande parte da amostra ficou retida na fase
estacionária, obtendo-se 5 subfrações com rendimento muito baixo e ainda impuras.
Visando ainda isolar os compostos fenólicos presentes na amostra, cromatografou-se
os 244 mg restantes da subfração (55-70), em CC com Sephadex LH-20 a fim de separar os
dois compostos majoritários desta subfração, sendo um deles o composto FB. Obteve-se 5
subfrações, sendo a subfração 8-20 (55-70) com rendimento de 130 mg. Esta foi então
recromatografada através de cromatografia em camada delgada centrífuga, utilizando o
aparelho Cromatotron e os eluentes clorofórmio/ metanol num fluxo contínuo de 3,2 mL/
minuto. Deste procedimento cromatográfico obteve-se 6 subfrações, sendo uma delas o
composto FB (26 mg), e novamente insucesso no isolamento do outro composto fenólico
presente na amostra. A subfração que continha a mistura dos dois flavonóides (31 mg) foi
então
submetida
à
cromatografia
em
camada
delgada
preparativa,
eluída
com
clorofórmio/metanol (7:3), da qual também não houve êxito na separação.
A subfração 88-144 (298 mg) foi cromatografada em CC de sílica gel com pressão
(CC “flash”), cuja granulometria da sílica é menor e confere maior resolução e rapidez no
processo de purificação. Obteve-se 8 subfrações, sendo uma delas o composto FB (29 mg), e
as demais subfrações permaneceram impuras e com rendimento inferior a 10 mg, sendo então
reservadas.
5.1.3.1 Caracterização química e revisão da literatura do composto FA
O composto FA foi identificado através de análise em IV, ponto de fusão e Co-CCD
como sendo o esteróide β-sitosterol (22). Foi isolado sob a forma de pó amorfo de coloração
branca, com odor característico (levemente adocicado), cujo ponto de fusão é 139,1 – 140,2
ºC, conforme relatado na literatura (MERCK INDEX).
Em análise por Co-CCD com padrão autêntico, observou-se à presença de uma única
mancha, conferindo o bom grau de pureza do composto e a confirmação de que se tratava
deste esteróide, já que não é possível diferenciar através de CCD a presença de estigmasterol
e β-sitosterol, por apresentarem o mesmo Rf.
53
=? >
> =?
> =?
=A@
=
=
=
> A= ?
=
> =A?
> =A?
=
(22) β-sitosterol
O espectro de infravermelho (Fig. 9) deste esteróide mostra bandas de absorções
referentes a deformações axiais de OH na região de 3400 cm-1; absorção intensa na faixa de
2943 cm-1 referente a estiramento de grupos CH. As absorções na região de 1464, 1371 e 1047
cm-1 representam, respectivamente, deformações angulares de CH2, CH3 e deformação axial
de CO.
Os esteróides são compostos importantes não só por fazerem parte da composição das
membranas biológicas ou por serem precursores da biossíntese de hormônios esteroidais, mas
também pelas demais atividades biológicas atribuídas a estes, tais como: antiinflamatória,
antibacteriana, antifúngica, e mais recentemente como protetor de tumores no cólon intestinal
e inibidor da promoção e indução de células tumorais (OVESNA et al., 2004).
Estudos vêm comprovando cientificamente várias atividades biológicas dos esteróides
vegetais, como o β-sitosterol, que mostrou ser efetivo no combate a hiperlipidemias, cuja
ingestão cumulativa não promove arteriosclerose e ainda facilita a síntese de HDL, a
lipoproteína que promove a limpeza das veias e artérias (CICERO et al., 2004; FARKAS et
al., 2004; TOMOYORI et al., 2004).
Há relatos de atividades estrogênicas do β-sitosterol e seu glicosídeo, assim como
atividade citotóxica contra células cancerosas da linhagem Bowes (JU et al., 2004; NGUYEN
et al., 2004).
Um estudo com camundongos que tiveram sua dieta adicionada por fitoesteróides,
principalmente beta-sitosterol, demonstrou um aumento plasmático dos hormônios
testosterona e estradiol respectivamente em camundongos machos e fêmeas. Este estudo
54
confirma as atividades estrogênicas e progestogênicas desta classe de compostos
(RYOKKNEN et al., 2005).
Das folhas, caules e raízes da Phyllanthus corcovadensis foram isolados alguns
esteróides, os quais foram avaliados quanto à atividade antinociceptiva no modelo de
contorções induzidas por ácido acético comparados com a aspirina. Todos os esteróides
testados apresentaram significativa resposta antinociceptiva, sendo o β-sitosterol, o composto
mais efetivo neste modelo, cuja DI50 9 mg/kg foi inferior a da aspirina 24 mg/kg (SANTOS et
al., 1995).
Além destas, alguns autores atribuem atividades analgésicas, antiulcerogênicas,
antihiperglicemiantes e antimicrobianas ao composto β-sitosterol (ABOUTABL et al., 2002;
RAMESH et al., 2001).
Figura 9: Espectro de IV do composto β-sitosterol (pastilha KBr).
5.1.3.2 Caracterização química e revisão da literatura do composto FB
55
O composto FB isolado de várias subfrações da fração AE das folhas de S. ferruginea,
foi identificado como sendo o flavonóide quercitrina (23). Este composto, é também
denominado de quercetina-3-α-O-ramnosil, sendo este o constituinte majoritário da fração AE
e provavelmente das folhas, visto baixo rendimento das demais frações.
B C
HR
B C
GR
TI R
OQP B
C B
UL R
FC E
G JSR M R B
N
D WI V B C
H
LSV
M
L JK I B JV GV HV B C
C B
B C B
(23) quercitrina
A quercitrina é um flavonóide heterosídico cujo núcleo fundamental apresenta
substituição na posição C-3 por uma hidroxila, por isso, denominado de flavonol. Isolado sob
a forma de pó amorfo e cristais de coloração amarela, com ponto de fusão entre 176-179 ºC.,
num rendimento total de 211 mg.
A identificação deste composto foi realizada através de análises espectrais comparadas
com as citadas em literatura.
Observa-se no espectro de IV (Fig. 10) banda de deformação axial de OH em 3400
-1
cm , em 1656 cm-1 sinal correspondente à deformação axial C= O e em 1610 cm-1
deformação axial de C=C, como os principais sinais de absorção de energia no infravermelho
(JEONG; SHIM, 2004).
56
Figura 10: Espectro de IV do composto quercitrina (pastilha KBr).
O espectro de RMN-1H (Fig. 11) apresenta sinais característicos deste composto
conforme descrito em literatura, sendo alguns destes:
- 13,4 ppm referente ao OH-5;
- 8,04 ppm referente ao H-2’; 7,7 ppm ao H-6’ e 7,34 ppm ao H-5’
- 6,72 ppm e 6,67 ppm referentes ao H-6 e H-8. Os hidrogênios referentes ao açúcar
encontram-se na região 6,29-1,49 ppm. Os valores de RMN-1H e 13C encontram-se na tabela
3.
57
Tabela 03: Valores dos deslocamentos químicos (ppm) de
13
C e
1
H para a quercitrina
conforme dados da literatura e valores obtidos para o composto FB (piridina-d5).
Carbono
13
C
1
H (J=Hz)
Composto FB
Composto FB
CD3OD (100 MHz)
DMSO-d6 (600 MHz)
13
2
158,6
-
157,5
-
3
136,3
-
135,8
-
4
179,7
-
178,9
-
5
163,3
-
162,7
13,4
6
99,8
6,3 (d J= 2,0)
99,5
6,7 (d J= 2,0)
7
165,9
-
165,6
-
8
94,7
6,4 (s J= 2,0)
94,3
6,6 (d J= 2,0)
9
159,3
-
158,0
-
10
105,9
-
105,2
-
1`
122,9
-
122,1
-
2`
116,9
7,4 (d J= 2,3)
116,3
8,0 (d J= 2,1)
3`
146,4
-
147,1
-
4`
149,8
-
150,3,
-
5`
116,4
7,1 (d J= 8,2)
116,9
7,3 (d J= 8,3)
6`
123,0
7,4 (dd J= 8,2; 2,3)
121,9
7,7 (dd J= 8,3; 2,1)
1a
103,6
5,48 (d J= 1,6)
103,8
6,3 (d J= 1,4)
2a
72,1
4,3 (dd J= 1,6; 3,0)
73,1
5,1 (dd J= 1,5; 2,5)
3a
72,1
3,9 (dd J= 3,2; 9,5)
72,3
4,6 (dd J= 3,3; 9,0)
4a
73,3
3,5 (t J= 9,5)
71,9
4,32 (t)
5a
71,9
3,5 (dd J= 9,5; 6,2)
71,8
4,35 (m)
6a
17,7
1,1 (d J= 6,2)
18,2
1,5 (d J= 6,0)
Fonte: ZHONG et al., 1997.
C
1
H (J=Hz)
58
Figura 11: Espectro de RMN-1H (300 Mz) da quercitrina em piridina-d5.
59
Figura 12: Espectro de RMN-13C do composto quercitrina em piridina-d5.
60
O espectro de RMN-13C apresenta os sinais:
- na região de 73,7 e 71,7 ppm referentes aos carbonos da C-2a e C-5a . Em 103,8 ppm sinal
referente ao carbono anomérico.
- Em 94,3; 99,5; 105,2; 157,4; 158,0; 162,7; 165,6 e 178,9 ppm referentes aos respectivos
carbonos: 8, 6, 10, 2, 9, 5, 7 e 4. Demais sinais correspondem aos citados em literatura (XIZING et al., 1997).
Os flavonóides são metabólitos secundários encontrados abundantemente em muitas
espécies vegetais, sob a forma livre ou heterosídica em sua maioria, com atividades biológicas
relevantes, das quais destacam-se: antioxidantes, antiinflamatórias, antivirais, antitumorais,
anti-hemorrágica, antivirais, antimicrobianas, antilipidêmica, hepatoprotetora entre outras
(NARAYANA et al., 2001; SIMÕES et al., 2002; SANTOS et al., 2004).
A capacidade antioxidante dos polifenóis como a quercitrina, é sem dúvida uma das
atividades mais relevantes destes compostos, atribuídas a capacidade destas substâncias
unirem-se aos complexos biológicos e quelarem íons metálicos transitórios, catalisarem o
transporte de íons e depurarem os radicais livres, sendo portanto, agentes protetores em
doenças como diabetes, infecções virais e alérgicas, cardiopatias, úlceras. Esta atividade
antioxidante deve-se a presença da estrutura O-dihidroxi do anel B do núcleo fundamental dos
flavonóides, além da insaturação no carbono 3. Ainda, presença de hidroxilas nas posições C3 e C-5 conferem máxima potência antioxidante a molécula, sendo assim, os flavonóis
quercetina e quercitrina, apresentam os requisitos para exercerem excelente atividade
antioxidante (MARTINEZ-FLOREZ et al., 2002; TRUEBA, 2003).
A quercitrina isolada da Bauhinia microstachya foi avaliada quanto à atividade
antinociceptiva no modelo de contorções induzidas por ácido acético, demonstrando
significativa inibição do processo doloroso, justificando a utilização desta planta pela
população como analgésica (SILVA-MEYRE et al., 2001).
Em outro estudo, após observado o efeito antidiarreico e mucolítico da quercitrina,
também foi avaliado a atividade antiinflamatória em colite intestinal induzida em ratos, cujos
resultados demonstraram efeito regulador da quercitrina sobre a cascata da inflamação além
de interferir no transporte hidroeletrolítico, principal injúria causada por esta patologia, que
pode ocasionar óbito por choque hipovolêmico (GALVEZ et al., 1995; SANCHES et al.,
2002; CAMUESCO et al., 2004; COMALADA et al., 2005).
61
5.2 Atividade farmacológica
5.2.1 Atividade antiúlcera dos rizomas
As úlceras gástrica e duodenal afetam grande parte da população mundial, sendo os
principais fatores desencadeantes o estresse, deficiência nutricional, cigarro, uso de
antiinflamatórios não esteroidais, entre outros. Assim, numerosas pesquisas buscam através de
extratos vegetais e seus princípios ativos, novas formas de tratamento contra os processos
ulcerogênicos e seus sintomas (TOMA et al., 2002; BATISTA et al., 2004).
Foram avaliadas as atividades antiúlcera e antinociceptiva dos extratos, frações e
compostos isolados da S. ferruginea conforme modelos descritos anteriormente, cujos
resultados obtidos serão discutidos a seguir.
Inicialmente foi avaliado o índice de ulceração em camundongos tratados com o
extrato metanólico bruto administrado intraperitonealmente, que inibiu 95% do índice de
ulceração na dose de 20 mg/kg (Fig. 13). Entretanto, as frações hexânica e diclorometânica
derivadas do extrato metanólico foram testadas no mesmo modelo, porém administradas por
via oral, não apresentaram perfil antiulcerogênico (Fig. 14).
Acreditava-se que as frações hexano e diclorometano seriam efetivas neste modelo de
ulceração, pois além de apresentarem rendimento significativo, foi a partir destas frações que
foram isolados os alcalóides cantin-6-ona e metoxicantin-6-ona, que quando testados
isoladamente foram efetivos contra ulceração induzida por etanol via oral e intraperitoneal,
portanto, independente da via de administração.
Sugere-se que os resultados obtidos e demonstrado na figura 14, devem-se a
quantidade significativa de ácidos graxos presentes nestas frações, principalmente na fração
hexano, que possam estar interferindo no processo de absorção dos compostos ativos, ou
mesmo, que estes compostos ativos encontrarem-se muito diluídos entre os demais
constituintes da fração, pois conforme citado anteriormente, observou-se em outros testes que
os alcalóides isolados são agentes antiulcerogênicos eficazes, conforme mostrado mais
adiante.
62
25
Índ. Ulceração
20
15
Controle
MeOH 5 mg/Kg
10
82 %
***
5
MeOH 20 mg/Kg
95 %
***
0
Figura 13: Atividade antiúlcera do extrato metanólico bruto de Simaba ferruginea nas doses
de 5 mg/kg e 20 mg/kg administradas via intraperitoneal em relação à ulceração induzida por
etanol 50% (10 mL/kg) em camundongos. Cada grupo representa a média de 5 a 7 animais, e
as barras verticais, os EPM. Difere significativamente do controle, *p < 0,05, ** p < 0,01,
p*** < 0,001.
30
Índ. Ulceração
25
20 %
20 %
20
16 %
40 %
15
Controle
Hex 5 mg/kg
Hex 20 mg/kg
DCM 5 mg/kg
10
DCM 20 mg/kg
5
0
Fração Hexano
(5, 20 mg/kg)
Fração DCM
(5,20 mg/kg)
Figura 14: Atividade antiúlcera das frações hexano e diclorometano nas doses de 5
mg/kg e 20 mg/kg administradas via oral em relação à ulceração induzida por etanol
50 % (10 mL/kg) em camundongos. Cada grupo representa a média de 5 a 7 animais, e
as barras verticais, os EPM. Difere significativamente do controle, *p < 0,05, ** p <
0,01.
63
As frações AE e DCM-RA (Fig. 15), também foram testadas no mesmo modelo de
ulceração, sendo que a fração AE não foi efetiva nas duas doses testadas, enquanto a fração
DCM-RA na dose de 20 mg/kg apresentou uma inibição de 92% sobre a indução da
ulceração. Estes dados indicam que a atividade antiúlcera está relacionada à presença dos
alcalóides, uma vez que a fração AE que não apresenta tais componente químicos não foi
efetiva, enquanto a fração DCM-RA, rica em alcalóides, apresentou efeito significativo na
inibição da atividade ulcerogênica causada pelo etanol.
16
14
Índ. Ulceração
12
10
8
50 %
Controle
50 %
AE 5 mg/kg
AE 20 mg/kg
DCM-RA 5 mg/kg
6
4
92 %
**
2
0
Fração AE
(5, 20 mg/kg)
DCM-RA 20 mg/kg
Fração DCM-RA
(5, 20 mg/kg)
Figura 15: Atividade antiúlcera da Fr. AE e DCM-RA de Simaba ferruginea nas doses de 5
mg/kg e 20 mg/kg administradas via oral em relação à ulceração induzida por etanol 50% (10
mL/kg) em camundongos. Cada grupo representa a média de 5 a 7 animais, e as barras
verticais, os EPM. Difere significativamente do controle, *p < 0,05, ** p < 0,01, p*** <
0,001.
Posteriormente, avaliou-se a atividade antiulcerogênica da fração alcaloídica através
do modelo de úlcera induzida por etanol (Fig. 16), a qual apresentou inibição dose-dependente
da ulceração, onde a concentração de 5 mg/kg inibiu 66% e a dose de 20 mg/kg inibiu 80% a
formação de úlceras nos animais testados. Esses resultados são bastante significativos, uma
vez que as doses analisadas são relativamente baixas e a via de administração coincide com a
utilizada pela população, que também emprega a infusão dos rizomas para o tratamento de
úlcera (MARCELLO, 2001).
64
A inibição da ulceração pela fração alcaloídica, também é relevante devido à dose
estar muito abaixo da DL50 (1800 mg/kg v.o.), determinada em outro estudo utilizando extrato
hidroalcoólico de rizomas de Simaba ferruginea, onde também é citado que a dose letal é
muito superior aquela pela população do Mato Grosso, que ingere geralmente 1 colher de
sopa duas vezes ao dia, de uma solução aquosa dos rizomas da planta, o que corresponde no
máximo a 50 mg/kg de extrato (MARCELLO, 2001).
20
18
índ. Ulceração
16
14
12
10
8
6
4
Controle
66 %
**
F. Alc. 5 mg/kg
80 %
**
F. Alc. 20 mg/kg
2
0
Figura 16: Atividade antiúlcera da fração alcaloídica de Simaba ferruginea nas doses de 5
mg/kg e 20 mg/kg administradas via oral em relação à ulceração induzida por etanol 50% (10
mL/kg) em camundongos. Cada grupo representa a média de 5 a 7 animais, e as barras
verticais, os EPM. Difere significativamente do controle, *p < 0,05, ** p < 0,01, p*** <
0,001.
A fração alcaloídica foi novamente analisada no modelo de ulceração induzida por
etanol, administrada por via intraperitoneal e comparada com os alcalóides cantin-6-ona e 4metoxicantin-6-ona, que são os componentes majoritários dessa fração, conforme análise em
CCD e Co-CCD. Além deles, foi detectada ainda a presença de pelo menos mais dois
alcalóides, os quais não foram isolados. Conforme as figuras 17 e 18, pode ser observado que
a fração alcaloídica foi efetiva em reduzir o processo ulcerativo já na concentração de 5
mg/kg, enquanto os dois alcalóides só foram efetivos na concentração de 20 mg/kg.
65
Índ.Ulceração
25
20
18 %
15
10
5
35 %
Controle
Fr. Alc.
Cantin
76 %
***
4-MeO-Can
0
Figura 17: Atividade antiúlcera da fração alcaloídica de Simaba ferruginea e dos alcalóides
cantin-6-ona e 4-metoxicantin-6-ona na dose de 5 mg/kg administrados via intraperitoneal em
relação à ulceração induzida por etanol 50% (10 mL/kg) em camundongos. Cada grupo
representa a média de 5 a 7 animais, e as barras verticais, os EPM. Difere significativamente
do controle, *p < 0,05, ** p < 0,01, p*** < 0,001.
Índ. Ulceração
25
20
Controle
15
10
5
83 %
***
53 %
*
Fr. Alc.
76 %
***
Cantin
4-MeO-Cant
0
Figura 18: Atividade antiúlcera da fração alcaloídica de Simaba ferruginea e dos alcalóides
cantin-6-ona e 4-metoxicantin-6-ona na dose de 20 mg/kg administrados via intraperitoneal
em relação à ulceração induzida por etanol 50% (10 mL/kg) em camundongos. Cada grupo
representa a média de 5 a 7 animais, e as barras verticais, os EPM. Difere significativamente
do controle, *p < 0,05, ** p < 0,01, p* ** < 0,001.
Provavelmente, a maior efetividade da ação antiúlcera encontrada na fração
alcaloídica deve-se ao sinergismo dos dois alcalóides, ou ainda, à interação sinérgica com os
demais alcalóides presentes na mesma fração, potencializando o efeito terapêutico. Este
66
resultado alerta para o fato de que em estudos químico-biológicos os efeitos esperados não
devem concentrar-se somente nos compostos isolados.
Daí a importância de testes com frações semi-purificadas, que por conterem vários
compostos podem apresentar ação sinérgica, seja pela potencialização do efeito de
determinado composto ou por agir através de outros mecanismos, cujo advento final, é uma
resposta terapêutica eficaz e potente, valorizando assim a utilização de fitoterápicos para o
tratamento de muitas enfermidades, e não somente o consumo de fármacos e fitofármacos
(BUTLER, 2005).
A utilização de fitofármacos apresentam-se mais atraentes à indústria farmacêutica e
aos prescritores porque geralmente apresentam propriedades químicas, farmacodinâmicas e
farmacocinéticas amplamente conhecidas e comprovadas, visto que, tais informações nem
sempre podem ser esclarecidas quando há uma mistura de substâncias (fitoterápicos), as quais
podem agir em diversos alvos farmacológicos (MORAES et al., 2003) .
Em decorrência dos diferentes resultados obtidos entre a fração alcaloídica e os
alcalóides, procurou-se avaliar o efeito antiulcerogênico (em camundongos no modelo de
indução por etanol) da associação dos dois alcalóides cantin-6-ona (C) e 4-metoxicantin-6ona (D) administrados por diferentes vias (intraperitoneal e oral) a fim de verificar possível
ação sinérgica destes compostos.
O tratamento que associou 2,5 mg/kg de cada alcalóide via intraperitoneal (Fig. 19),
apresentou significativa inibição da ulceração (62 %) quando comparado com o tratamento de
5 mg/kg de cada alcalóide administrado separadamente pela mesma via (C 35 % e D 18 %).
Estes dados demonstram que ocorreu sinergismo, isto é, houve uma potenciação do efeito
antiulcerogênico, já que a inibição da ulceração ocasionada pela interação dos dois alcalóides
foi maior que a soma dos efeitos de cada um, podendo ou não agir pelo mesmo mecanismo de
ação (BARBOSA, YOEM, 2001).
Ainda, na mesma figura (19), observa-se que a outra associação de C + D na dose de
10 mg/kg cada, apresentou uma inibição de 69 % no processo ulcerogênico, não diferindo
muito do tratamento com menor dose (62 %).
67
16
14
Índ. Ulceração
12
10
8
6
61,2 %
**
Controle
69,2 %
**
Cpto C + D (2,5 mg/kg)
Cpto C + D (10 mg/kg)
4
2
0
Figura 19: Atividade antiúlcera dos alcalóides cantin-6-ona + 4-metoxicantin-6-ona nas doses
de 2,5 mg/kg cada e 10 mg/kg cada, administradas via intraperitoneal em relação à ulceração
induzida por etanol 50% (10 mL/kg) em camundongos. Cada grupo representa a média de 5 a
7 animais, e as barras verticais, os EPM. Difere significativamente do controle, *p < 0,05, **
p < 0,01, p* ** < 0,001.
Ainda, ao comparar-se os dados da figura acima com as figuras 16,17 e 18, pode-se
constatar que nas duas diferentes vias de tratamento e dose, a fração alcaloídica demonstrouse mais efetiva do que os tratamentos com os alcalóides isolados administrados tanto de forma
individual como associados. A provável explicação para o melhor desempenho
antiulcerogênico da fração alcaloídica, deve-se provavelmente a ação sinérgica entre os
demais compostos presentes na fração, mesmo que estes se encontrem em baixíssima
concentração.
Foi avaliada ainda, a atividade antiulcerogênica do tratamento associando os dois
alcalóides (10 mg/kg cada) administrados por vias diferentes (Fig. 20), onde a via oral
demonstrou ser mais efetiva, inibindo 76,9 % da ulceração, sendo somente um pouco menos
efetiva que a fração alcaloídica 20 mg/kg v.o. que inibiu 80%.
68
16
Índ. Ulceração
14
12
10
8
6
Controle
69,2 %
**
4
Cpto C + D (10 mg/kg i.p)
76,9 %
**
Cpto C + D (10 mg/Kg v.o)
2
0
Figura 20: Atividade antiúlcera dos alcalóides cantin-6-ona + 4-metoxicantin-6-ona nas doses
de 10 mg/kg cada administradas via intraperitoneal e oral em relação à ulceração induzida por
etanol 50% (10 mL/kg) em camundongos. Cada grupo representa a média de 5 a 7 animais, e
as barras verticais, os EPM. Difere significativamente do controle, *p < 0,05, ** p < 0,01, p*
** < 0,001.
Os resultados obtidos no modelo de úlcera induzida por etanol, indicam que a fração
alcaloídica, na dose de 20 mg/kg, administrada via oral ou intraperitoneal, é a mais efetiva, e
seu perfil farmacológico assemelha-se ao perfil exibido pela associação dos alcalóides cantin6-ona e 4-metoxicantin-6-ona na dose 10 mg/kg cada.
Em um estudo citado em literatura, a atividade antiulcerogênica do extrato etanólico e
das frações hexano e DCM de Quassia amara, são atribuídas aos alcalóides indólicos e βcarbolinas e aos quassinóides, ambos presentes nos extratos e frações, que inibiram entre 50 à
90 % o processo ulcerogênico induzido por etanol e indometacina (TOMA et al., 2002).
Em outro estudo, Toma e colaboradores (2004), testaram a atividade antiulcerogênica
de um extrato rico em alcalóides pirrolizidínicos administrados via oral frente ao etanol,
indometacina e betanecol, e hipotermia. O extrato alcaloídico apresentou resultados
significativos em todos os testes, sendo que os autores sugeriram que tais efeitos devem-se a
uma cito-proteção e também por outros mecanismos ainda não elucidados.
Deve-se ressaltar que somente os relatos citados acima referiam-se a atividade
antiulcerogênica dos alcalóides. Entretanto, atividades analgésicas, anticolinesterásicas,
colinérgicas, antimaláricas, antineoplásicas e outras, encontram-se amplamente citadas em
literatura (RASKIN et al., 2002).
69
Especificamente da classe indólica, tal como o cantin-6-ona e 4-metoxicantin-6-ona,
são relatadas atividades como antitumoral, anti-microbiana, anti-hipertensiva e estimulante do
sistema nervoso central (MEDEIROS et al., 2001).
Ainda, ao idealizar-se a comercialização da S. ferruginea para o tratamento de
gastrites e úlceras, a viabilidade econômica da produção da fração alcaloídica em relação ao
isolamento dos compostos é disparadamente mais favorável, além da rapidez do processo de
obtenção, e garantia de uma boa purificação da amostra (metodologia para extração de
alcalóides). Desponta então, a possibilidade da produção de um fitoterápico com uma espécie
vegetal endêmica do Cerrado brasileiro, para tratamento de uma das afecções que mais vem
acometendo pessoas no mundo, principalmente por causa do estresse e má alimentação, cujo
tratamento convencional é relativamente caro e geralmente não é fornecido pelo Sistema
Único de Saúde (RATES, 2001a; MORAES et al., 2003).
Confirmando essa tendência pela busca de extratos e frações semi-purificadas, Cox e
Heinrich (2001), afirmam que a fitoterapia moderna vai se voltar para o “screening” de
extratos vegetais, os quais geralmente são efetivos devido a mistura de compostos presentes
nestes extratos, ao invés de pesquisar uma única substância, que necessita de mais processos
para obtenção, com conseqüente aumento de custo, além dos baixos rendimentos.
Também foi avaliado o perfil antiulcerogênico do extrato metanólico, da fração
alcaloídica e dos alcalóides administrados via intraperitoneal no modelo de úlcera induzida
por indometacina 30 mg/kg via oral em ratos (Quadro 03), cujos resultados obtidos não foram
significativos, ainda que houvesse ocorrido a redução da ulceração nos animais.
70
Quadro 03: Avaliação da atividade antiulcerogênica do extrato metanólico, fração alcaloídica
e alcalóides isolados da S. ferruginea nas doses 5 e 20 mg/kg via intraperitoneal no modelo de
úlcera induzida por indometacina (30 mg/kg via oral) em ratos.
Tratamento
Dose (i.p.)
Mediana
Q1 – Q3
Significância
Controle
-
31
21-64
-
Ext. MeOH
5 mg/kg
38
35-44
ns
Ext. MeOH
20 mg/kg
46
41-52
ns
Fr. Alcaloídia
5 mg/kg
50
44-58
ns
Fr. Alcaloídica
20 mg/kg
41
38-48
ns
Cantin-6-ona
5 mg/kg
43
40-53
ns
Cantin-6-ona
20 mg/kg
48
45-58
ns
4-MeO-cantin-6-ona
5 mg/kg
40
38-43
ns
4-MeO-cantin-6-ona
20 mg/kg
37
33-45
ns
Num estudo anterior, o extrato hidroalcoólico de rizomas de S. ferruginea demonstrou
ser efetivo contra ulcerações no modelo citado acima, a partir de 20 mg/kg. Segundo o autor,
esta proteção gástrica contra lesões induzida por indometacina sugere um possível
envolvimento do extrato da planta em interferir na síntese de prostaglandinas e assim
desempenhar atividade citoprotetora/antiúlcera (MARCELLO, 2001).
Ainda, segundo Marcello (2001), o extrato hidroalcoólico de S. ferruginea, foi efetivo
contra ulcerações nos modelos induzidos por etanol v.o. em ratos e também, em animais
submetidos a estresse por frio e por ácido acético, demonstrando também efeito significativo
na redução da secreção gástrica e antimucolítica. Foi também sugerido que o possível efeito
gastroprotetor do extrato da planta deve-se a uma combinação de efeitos antioxidantes,
varredor de radicais livres, interferência com a síntese de PGE2 ou PGI2, através de efeitos
sistêmicos e locais, observados pela redução da secreção e acidez total no estômago dos
animais avaliados.
O quadro 04 apresenta os resultados dos tratamentos com o extrato metanólico e as
várias frações do rizoma de S. ferruginea administrados nas doses de 5 mg/kg e 20 mg/kg via
oral em ratos, onde as frações DCM e DCM-RA foram os únicos tratamentos que
apresentaram inibição significativa
da ulceração induzida por indometacina. O extrato
metanólico e a fração alcaloídica apresentaram atividade, mas não de forma estatisticamente
significativas.
71
A composição da fração DCM-RA pouco difere da fração alcaloídica, que constituise praticamente só de alcalóides, pois esta fração derivou da extração seletiva para alcalóides,
enquanto na fração DCM detectou-se apenas os alcalóides C e D e alguns compostos
esteroidais/ terpenóides. Isto indica que a atividade encontrada provavelmente se deve a
presença dos alcalóides, o que não justifica os resultados obtidos para a fração alcaloídica,
que também deveria ter apresentado resultado significativo neste modelo.
A inibição da ulceração no modelo induzido por indometacina através do tratamento
com as frações DCM e DCM-RA, devem-se provavelmente por suas ações sobre a secreção
do muco gástrico, conforme prevê o próprio modelo.
Quadro 04: Avaliação da atividade antiulcerogênica do extrato metanólico e frações da S.
ferruginea nas doses 5 e 20 mg/kg via oral no modelo de úlcera induzida por indometacina
(30 mg/kg via oral) em ratos.
Tratamento
Dose (v.o.)
Mediana
Q1 – Q3
Significância
Veículo
-
20
9 – 23
-
Ext. metanólico
5 mg/kg
10
10 – 15
ns
Ext. metanólico
20 mg/kg
7
02 – 22
ns
Fr. Hexano
5 mg/kg
18
15 – 22
ns
Fr. Hexano
20 mg/kg
29
23 – 35
ns
Fr. DCM
5 mg/kg
11
8 – 13
ns
Fr. DCM
20 mg/kg
1
0–2
**
FR. AE
5 mg/kg
22
17 – 24
ns
Fr. AE
20 mg/kg
21
07 – 26
ns
Fr. Aquosa
5 mg/kg
21
13 – 22
ns
Fr. Aquosa
20 mg/kg
18
4 – 21
ns
Fr. Alcaloídica
5 mg/kg
07
6 – 17
ns
Fr. Alcaloídica
20 mg/kg
08
2 – 16
ns
Fr. DCM-RA
5 mg/kg
4
2–7
*
Fr. DCM-RA
20 mg/kg
1
0-2
**
72
5.2.2 Atividade antinociceptiva dos rizomas de S. ferruginea.
A fim de verificar outras propriedades terapêuticas da S. ferruginea, o extrato, as
frações e compostos isolados foram avaliados em modelo de dor para verificar a atividade
antinociceptiva administrados via intraperitoneal nas doses de 5 mg/kg e 20 mg/kg.
Os tratamentos produziram inibição do processo doloroso induzido pelo ácido
acético, sobretudo na dose de 20 mg/kg (Fig. 21 e 22). A ordem de efetividade desses
tratamentos foi: cantin-6-ona (71 %) > 4-metoxicantin-6-ona (63 %) > fração alcaloídica (47
%) > extrato metanólico (27 %) quando comparados com o grupo controle (Fig. 22).
50
45
Nro contorções
40
35
30
19 %
32 %
*
20 %
Controle
Ext. MeOH
25
Fr. Alc.
20
Cantin
15
4-OMe-Cantin
10
5
0
Figura 21: Atividade antinociceptiva do extrato metanólico, da fração alcaloídica de Simaba
ferruginea e dos alcalóides cantin-6-ona e 4-metoxicantin-6-ona na dose de 5 mg/kg
administrada via intraperitoneal em relação a nocicepção induzida por ácido acético 0,6% em
camundongos. Cada grupo representa a média de 8 animais, e as barras verticais, os EPM.
Difere significativamente do controle, *p < 0,05, ** p < 0,01, p***< 0,001.
73
45
40
Nro contorções
35
30
25
20
15
27 %
Controle
47 %
***
Ext. MeOH
63 %
***
71 %
***
Fr.Alc.
Cantin
4-OMe-Cantin
10
5
0
Figura 22: Atividade antinociceptiva do extrato metanólico, da fração alcaloídica de Simaba
ferruginea e dos alcalóides cantin-6-ona e 4-metoxicantin-6-ona na dose de 20 mg/kg
administrada via intraperitoneal em relação a nocicepção induzida por ácido acético 0,6% em
camundongos. Cada grupo representa a média de 8 animais, e as barras verticais, os EPM.
Difere significativamente do controle, *p < 0,05, ** p < 0,01, p*** < 0,001.
5.2.3 Atividade antiúlcera das folhas de S. ferruginea
O extrato metanólico bruto das folhas de S. ferruginea também foi avaliado no
modelo de úlcera induzido por etanol via oral em camundongos, sendo que apresentou
atividade significativa nas duas concentrações (5 mg/kg e 20 mg/kg), uma vez que inibiu 80%
a formação de úlcera nos animais tratados (Fig. 23). Tal resultado exibe muita relevância pois
a composição química das folhas, consiste principalmente de flavonóides, sendo a quercitrina
o composto majoritário e diferindo da composição dos rizomas que também foram efetivos
neste modelo.
74
20
18
Índ. Ulceração
16
14
12
Controle
10
MeOH 5 mg/kg
8
MeOH 20 mg/kg
6
4
80 %
**
80 %
**
2
0
Figura 23: Atividade antiúlcera do extrato metanólico bruto das folhas de Simaba ferruginea
nas doses de 5 mg/kg e 20 mg/kg administrada via oral em relação à ulceração induzida por
etanol 50% (10 mL/kg) em camundongos. Cada grupo representa a média de 5 a 7 animais, e
as barras verticais, os EPM. Difere significativamente do controle, *p < 0,05, ** p < 0,01.
As frações das folhas de S. ferruginea foram testadas neste mesmo modelo de
ulceração, porém não apresentaram resultados significativos, inclusive a fração AE, cujo
constituinte majoritário é o flavonóide quercitrina. Entretanto, este composto quando testado
isoladamente (Fig. 24), apresentou uma inibição significativa da ulceração de 66,7% na dose
de 20 mg/kg quando administrado via oral.
75
16
14
Índ. Ulceração
12
10
8
6
41,6 %
Controle
66 %
**
Quercitrina 5 mg/kg
Quercitrina 20 mg/kg
4
2
0
Figura 24: Atividade antiúlcera da quercitrina nas doses de 5 mg/kg e 20 mg/kg administrada
via oral em relação à ulceração induzida por etanol 50% (10 mL/kg) em camundongos. Cada
grupo representa a média de 5 a 7 animais, e as barras verticais, os EPM. Difere
significativamente do controle, *p < 0,05, ** p < 0,01.
O modelo de ulceração por etanol é caracterizado pela produção de espécies reativas
do oxigênio (radicais livres) que promovem lesão celular, exercendo papel importante na
injúria isquêmica do estômago. Talvez isso justifique o efeito protetor do extrato metanólico,
rico em quercitrina, um dos flavonóides com maior poder antioxidante, exercendo então,
papel importantíssimo de seqüestrar os radicais livres envolvidos na injúria induzida pelo
etanol, e por isso, prevenindo a formação de úlcera nos animais tratados (LA CASA et al.,
2000; MARCELLO, 2001; REPETTO; LLESUY, 2002; MARTINEZ- FLOREZ et al.,
2002).
Em um estudo com uma fração rica e outra deficiente em flavonóides, foi avaliado o
perfil antiulcerogênico frente aos agentes etanol e indometacina, cujos resultados
apresentados indicam que os flavonóides exercem atividades antisecretoras e citoprotetoras,
combatendo efetivamente o processo ulceroso (BATISTA et al., 2004).
Segundo Repetto e Llesuy (2002) as possíveis ações antioxidantes dos flavonóides
que conferem ação protetora da mucosa gástrica, devem-se a quelação de metais de transição,
a inibição de enzimas oxidativas ou produção de radicais livres pelas células e ao seqüestro
dos radicais livres.
São relatados três prováveis mecanismos de ação dos flavonóides, os quais talvez
expliquem essa ação gastroprotetora: aumento intracelular de glutationa que é responsável
por diminuir os níveis de espécies reativas de oxigênio durante o processo de metabolização;
extinção de espécies reativas de oxigênio e prevenção do influxo de cálcio que sinaliza o
76
último passo da morte celular induzida pela cascata do glutamato (ISHIGE et al., 2001;
REPETTO, LLESUY, 2002).
Estudos com flavonóides isolados como rutina, quercetina e kaempferol,
demonstraram a inibição dose-dependente dos danos na mucosa gástrica induzida por etanol,
demonstrando o significativo efeito protetor destes compostos sobre a mucosa gástrica
(NARAYANA et al., 2001).
Segundo Sannomiya e colaboradores (2005), num estudo com as folhas de Byrsonima
crassa, os flavonóides presentes no extrato metanólico são os compostos responsáveis pela
inibição de até 93 % da ulceração induzida por etanol para a dose 500 mg/kg. Ainda, deve-se
ressaltar, que os flavonóides isolados neste estudo são todos derivados da quercetina, além da
amentoflavona, catequina e epicatequina.
No modelo de úlcera induzida por indometacina, o extrato, as frações e o composto
quercitrina das folhas, foram administrados via oral, não inibiram a ulceração nas duas doses
testadas. Houve redução dos índices de ulceração, mas não foram significativos
estatisticamente (Quadro 5). Provavelmente, a atividade antiúlcera da quercitrina deve-se
principalmente ao efeito antioxidante, seqüestrando os radicais livres do oxigênio, não sendo
tão efetiva sobre a secreção de muco gástrico, não apresentando atividade neste modelo
(NARAYANA et al., 2001).
Quadro 05: Avaliação da atividade antiulcerogênica da quercitrina isolada da fração AE das
folhas de S. ferruginea nas doses 5 e 20 mg/kg via oral no modelo de úlcera induzida por
indometacina (30 mg/kg via oral) em ratos.
Tratamento
Dose (mg/kg)
Mediana
Q1 – Q3
Significância
Veículo
-
30
9-36
-
Quercitrina
5
22
20- 25
ns
Quercitrina
20
10
3 - 42
ns
Mesmo a composição química das folhas diferindo dos rizomas, observou-se neste
trabalho, que ambas as partes estudadas apresentaram atividade antiúlcera, sendo os alcalóides
isolados dos rizomas mais eficazes e potentes que a quercitrina isolada das folhas, assim como
as respectivas frações dos rizomas e folhas.
Evidencia-se por este estudo, que mais uma vez, são confirmadas as indicações
populares (etnofarmacologia), que apontaram a parte da planta e utilização terapêutica de
77
forma correta, isto é, as informações da medicina popular sobre a S. ferruginea foram em
parte evidenciadas por este trabalho.
Possíveis modificações estruturais nos alcalóides, de forma que aumentem sua
lipossolubilidade, podem torná-los mais efetivos, tal como a adição de grupamentos metilas
ou metoxilas, que favoreceriam sua absorção e conseqüentemente sua ação biológica.
78
6 CONSIDERAÇÕES FINAIS
Através dos testes fitoquímicos e farmacológicos realizados com os rizomas e folhas
da S. ferruginea, pode-se relatar alguma considerações:
- a constituição química dos rizomas e folhas da Simaba ferruginea é distinta,
prevalecendo nos rizomas compostos graxos e alcalóides, enquanto nas folhas, compostos
fenólicos (flavonóides).
- os compostos isolados dos rizomas foram os alcalóides: cantin-6-ona e 4metoxicantin-6-ona (constituintes majoritários nesta parte da planta).
- os compostos isolados das folhas foram: β-sitosterol e quercitrina (composto
majoritário das folhas).
- a fração alcaloídica mostrou-se efetiva na inibição da ulceração induzida por etanol
em camundongos, administrada nas vias oral e intraperitoneal, e também nas concentrações
de 5 e 20 mg/kg.
- os alcalóides apresentaram atividade antiúlcera no modelo de úlcera por etanol,
sendo mais efetivos na dose de 20 mg/kg cada um.
- a associação dos alcalóides mostrou-se efetiva na dose de 2,5 mg/kg de cada
alcalóide, demonstrando possível ação sinérgica entre estes dois compostos.
- na ulceração induzida por indometacina a fração DCM-RA foi efetiva nas
concentrações de 5 mg/kg e 20 mg/kg via oral em ratos.
- na atividade antinociceptiva os alcalóides apresentaram maior atividade que a fração
alcaloídica no modelo de nocicepção induzida por ácido acético em camundongos.
- o flavonóide quercitrina apresentou atividade antiúlcera no modelo de ulceração por
etanol somente na dose de 20 mg/kg, e não foi efetivo na úlcera induzida por indometacina.
79
7 REFERÊNCIAS BIBLIOGRÁFICAS
ABOUTABL, E. A.; NASSAR, M. I.; ELSAKHAMY, F. M.; MAKLAD, Y. A.; OSNAN, A. F., EL-KHBISY,
E. A. Phytochemical and pharmacological studies on Sideritis taurica Stephan ex Wild., J Ethnopharmacol., v.
82, n. 2-3, p. 177-184, 2002.
ANDERSON, L. A.; HARRIS, A.; PHILLIPSON, J. D. Production of cytotoxic canthin-6-one alkaloids by
Ailanthus altissima plant cell cultures. J. Nat. Prod., v. 46, n. 3, p. 374-378, 1983.
ANG, H. H.; HITOTSUYANAGI, Y.; FUKAYA, H.; TAKEYA, K. Quassinoids from Eurycoma longifolia.
Phytochemistry, v. 59, n. 8, p. 833-837, 2002.
ANVISA 2004. Disponível em: http://www.anvisa.gov.br.
ARISAWA, M.; KINGHORN, A. D.; CORDELL, G. A.; FARNSWORTH, N. R. Plant anticancer agents.
XXIII. 6 alpha-senecioyloxychaparrin, a new antileukemic quassinoid from Simaba multiflora. J. Nat. Prod., v.
46, n. 2, p. 218-221, 1983 a.
ARISAWA, M.; KINGHORN, A. D.; CORDELL, G. A.; FARNSWORTH, N. R . Plant anticancer agents.
XXIV. Alkaloid constituients of Simaba multiflora. J. Nat. Prod., v. 46, n. 2, p. 222-225, 1983 b.
BARBOSA, S. F.; YOEM, R. H. C. Interações medicamentosas. Caderno UniABC de Farmácia, n. 11, p. 5071, 2001.
BATISTA, L. M.; ALMEIDA, A. B. A.; MAGRI, L. P.; TOMA, W.; CALVO, T. R.; VILEGAS, W.; SOUZA
BRITO, A. R. M. Gastric antiulcer activity of Syngonanthus arthrotrichus Silveira. Biol. Pharm. Bull., v. 27, n.
3, p. 328-332, 2004.
BUTLER, M. S. The role of natural product chemistry in drug discovery. J. Nat. Prod., v. 67, p. 2141-2153,
2004.
BUTLER, M. S. Natural products to drugs: natural product derived compounds in clinical trials. Nat. Prod.
Rep., v. 22, p. 162-195, 2005.
CABRAL, J. A.; McCHESNEY, J. D.; MILHOUS, W. K.
guianensis. J. Nat. Prod., v. 56, n. 11, p. 1954-1961, 1993.
A new antimalarial quassinoid from Simaba
CALIXTO, J. B. Biopirataria: A diversidade biológica na mira da indústria farmacêutica. Ciência Hoje, v. 28, n.
167, p. 36-43, 2000.
CAMUESCO, D.; COMALADA, M.; RODRIGUEZ-CABEZAS, M. E.; NIETO, A.; LORENTE, M. D.;
CONCHA, A.; ZARZUELO, A.; GALVEZ, J. The intestinal anti-inflamatory effect of quercitrin is associated
with an inhibition in iNOS expression. Br. J. Phharmacol., v. 143, n. 7, p. 908-918, 2004.
CAÑIGUERAL, S. La fitoterapia: uma terapêutica para el tercer milênio? Rev. Fitoterapia, v. 2, n. 2, p.101121, 2002.
CECHINEL FILHO, V. Pesquisas com plantas medicinais na UNIVALI: principais avanços e perspectivas.
Alcance, Itajaí, n. 4, p. 59-64, 1995.
CECHINEL FILHO, V.; YUNES, R. A. Estratégias para obtenção de compostos farmacologicamente ativos a
partir de plantas medicinais. Conceitos sobre modificação estrutural para otimização da atividade. Quim. Nova,
v. 21, n.1, p. 99-105, 1998.
CECHINEL FILHO, Valdir. Principais avanços e perspectivas na área de produtos naturais ativos: estudos
desenvolvidos no NIQFAR/UNIVALI. Quim. Nova, v. 23, n. 5, p. 680-685, 2000.
CECHINEL FILHO, V.; YUNES, R. A. Breve análise histórica da química de plantas medicinais: sua
importância na atual concepção de fármaco segundo os paradigmas ocidental e oriental. In: YUNES, R. A;
80
CALIXTO, J. B. Plantas medicinais sob a ótica da química medicinal moderna, Chapecó: Universitária,
2001.
CHAN, K. L.; CHOO, C. Y.; ABDULLAH, N. R.; ISMAIL, Z. Antiplasmodial studies of Eurycoma longifolia
Jack using the lactate dehydrogenase assay of Plasmodium falciparum. J. Ethnopharmacol., v. 92, n. 2-3, p.
223-227, 2004.
CHOO, C. Y.; CHAN, K. L. High performance liquid chromatography analysis of canthinone from Eurycoma
longifolia. Planta Med., v. 68, n. 4, p. 382-384, 2002.
CICERO, A. F.; MINARDI, M.; MIREMBE, S.; PEDRO, E.; GADDI, A. Effects of a new low dose soy
protein/beta-sitosterol association on plasma lipid levels and oxidation. Eur. J. Nutr., v. 26, p. 1-4, 2004.
COLLIER, H. O.J.; DINNEN, L. C.; JOHNSON, C. A.; SCHNEIDER, C. Braz. J. Pharmacol., v. 32, p. 295,
1968.
COMALADA, M.; CAMUESCO, D.; SIERRA, S.; BALLESTER, I.; XAUS, J.; GALVEZ, J.; ZARZUELO, A.
In vivo quercitrin anti-inflammatory effect involves release of quercetin, which inhibits inflammation through
down-regulation of the NF-kappaB pathway. Eur. J. Immunol., v. 35, n. 2, p. 584-592, 2005.
COX, P. A.; HEINRICH, M. Ethnobotanical drug discovery: uncertainty or promise? Pharm. News, v. 8, n. 3, p.
55-59, 2001.
DE SOUSA, R. P.; BARBOSA, L. F.; DE OLIVEIRA, A. F.; MATHIAS, L.; BRAZ-FILHO, R.; VIEIRA, I. J.
Cymosanine, a novel C19-quassinoid from Simaba subcymosa. Nat. Prod. Res., v. 19, n. 2, p. 151-155, 2005.
DEWICK, P. M. Medicinal natural products: A biosynthetic approach. 2 ed. Londres: British Library
Cataloguing in Publication Data, p. 347-350, 2002.
DJANANGUIRI, B. The production of acute ulceration by indomethacin in rat. Scand. J. Gastroent., v. 4, p.
265-267, 1969.
FACUNDO, V. A.; MORAIS, S. M. de; SOUZA, R. T.; BRAZ-FILHO, R. Chemical constituents from
Zanthoxylum rugosum A. St. Hill & Tul from northeastern Brazil. Rev. Latinoamer. Quím., V. 32, n. 2, p. 6167, 2002.
FERREIRA, M. E.; ARIAS, R.; ORTIZ, T.; INCHAUSTI, A.; NAKAYAMA, H. THOUVNEL, C.;
HOCQUEMILLER, R.; FOURNET, A. Leishmanicidal activity of two canthin-6-one alkaloids, two major
constituents of Zanthoxylum chiloperone var. angustifolium. J. Ethnopharmacol., v. 80, p. 199-202, 2002.
FARKAS, E.; SCHUBERT, R.; ZELKO, R. Effect of beta-sitosterol on the characteristics of vesicular gels
containing chlorhexidine. Int. J. Pharm., v. 278, n. 1, p. 63-70, 2004.
FUKAMIYA, N.; OKANO, M.; ARATANI, T.; NEGORO, K.; McPHAIL, A. T.; JU-ICHI, M.; LEE, K. H.
Antitumor agents, 79. Cytotoxic antileukemic alkaloids from Brucea antidysenterica. J. Nat. Prod., v. 49, n. 3,
p. 428-434, 1986.
GALVEZ, J.; SANCHEZ, M. F.; JIMENEZ, J.; TORRES, M. I.; FERNANDEZ, M. I.; NUNEZ, M. C.; RIOS,
A.; GIL, A.; ZARZUELO, A. Effect of quercitrin on lactose-induced chronic diarrhoea in rats. Planta Med., v.
61, n. 4, p. 302-306, 1995.
GUARIM NETO, G.; MORAIS, R. G. Medicinal plants resources in the Cerrado of Mato Grosso state Brazil: a
review. Acta Bot. Bras., v. 17, n. 4, p. 561-584, 2003.
GUPTA, M. P. Plantas Medicinales Iberoamericanas. Santafé de Bogotá: Andres Bello, p.515-516, 1995.
GUSMAN, F.; CAIN, M.; LARSCHEID, P.; HAGEN, T.; COOK, J, M.; SCHWERI, M.; SKOLNICK, P.;
PAUL, S. M. Biomimetic approach to potential benzodiazepine receptor agonists and antagonists. J. Med.
Chem., v. 27, n. 5, p. 564-570, 1984.
81
HE, W.; VAN PUYVELDE, L.; DE KIMPE, N.; VERBRUGGEN, L.; ANTHONISSEN, K.; VAN DER
FLAAS, M.; BOSSELAERS, J.; MATHENGE, S. G.; MUDIDA, F. P. Chemical constituents and biological
activities of Zanthoxylum usambarense. Phytother Res., v. 16, n.1, p. 66-70, 2002.
HITOTSUYANAGI, Y.; OZEKI, A,; ITOKAWA, H.; MELLO ALVES de, S.; TAKEYA, K. Cedronolactone E,
a novel C(19) quassinoid from Simaba cedron. J. Nat. Prot., v. 64, n. 2, p. 1583-1584, 2001.
HOSTETTMANN, K.; QUEIROZ, E. F.; VIEIRA, P. C. Princípios ativos de plantas superiores. São Carlos:
EdUFSCar, 2003. 152p.
ISHIGE, K.; SCHUBERT, D.; SAGARA, Y. Flavonoids protect neuronal cells from oxidative stress by three
distinct mechanisms. Free Radic Biol. Med., v. 30, n. 4, p. 433-446, 2001.
JEONG, C. H.; SHIM, K. H. Tyrosinase inhibitor isolated from the leaves of Zanthoxylum piperitum. Biosci.
Biotechnol. Biochem., v. 68, n. 9, p. 1984-1987, 2004.
JIWAJINDA, S.; SANTISOPASRI, V.; MURAKAMI, A.; SUGIYAMA, H.; GASQUET, M.; RIAD, E.;
BALANSARD, G.; OHIGASHI, H. In vitro anti-tumor promoting and anti-parasitic activities of the quassinoids
from Eurycoma longifolia, a medicinal plant in Southeast Ásia. J. Ethnopharmacol., v. 82, n. 1, p. 55-58, 2002.
JOLY, A .B. Botânica introdução à taxonomia vegetal. 12 ed. São Paulo: Nacional. 1998. 777 p.
JU, Y. H.; CLAUSEN, L. M.; ALLRED, K. F.; ALMADA, A. L.; HELFERICH, W. G. Beta-sitosterol, betasitosterol glucoside, and a mixture of beta-sitosterol and beta-sitosterol glucoside modulate the growth of
estrogen-responsive breast cancer cells in vitro and in ovariectomized mice. J. Nutr., v. 134, n. 5, p. 1145-1151,
2004.
KARDONO, L. B.; ANGERHOFER, C. K.; TSAURI, S.; PADMAWINATA, K.; PEZZUTO, J. M.;
KINGHORN, A. D. Cytotoxic and antimalarial constituents of the roots of Eurycoma longifólia. J. Nat. Prod.,
v. 54, n. 5, p. 1360-1367, 1991.
KATO, M. J. Global phytochemistry: the Brazilian approach. Phytochemistry, v. 57, p. 621-623, 2001.
KINGHORN, A. D. The role of pharmacognosy in modern medicine. Expert Opin. Pharmacother., v. 3, n. 2,
2002.
KOEHN, F. E.; CARTER, G. T. The evolving role of natural products in drug discovery. Drug Discovery, v. 4,
p. 206-220, 2005.
KOIKE, K.; OHMOTO, T. Carbon-13 nuclear magnetic resonance study of canthin-6-one alkaloids. Chem.
Pharm. Bull., v. 33, p.5239-5243, 1985.
KUO, P. C.; SHI, L. S.; DAMU, A. G.; SU, C. R.; HUANH, C. H.; KE, C. H.; WU, J. B.; LIN, A. J.; BASTOW,
K. F.; LEE, K. H.; WU, T. S. Cytotoxic and antimalarial beta-carbonile alkaloids from the roots of Eurycoma
longifolia. J. Nat. Prod., v. 66, n. 10, p. 1324-1327, 2003.
LA CASA, C.; VILLEGAS, I.; ALARCON de la LASTRA, C.; MOTILVA, V.; MARTIN CALERO, M. J.
Evidence for protective and antioxidant of rutin, a natural flavone, against ethanol induced gastric lesions. J.
Ethnopharmacol., v. 71, n. 1-2, p. 45-53, 2000.
LAPA, A. J. et al. Métodos de avaliação da atividade farmacológica de plantas medicinais. CYTED/CNPq:
Programa Iberoamericano de Ciências e Tecnologia para o Desenvolvimento, 2002.
LEITZKE. R. de C. Z.; GUARIM NETO, G. Utilização de plantas medicinais do cerrado: Simaba ferruginea St.
Hill. (Calunga). In: SIMPÓSIO BRASILEIRO DE PLANTAS MEDICINAIS, 17, 2002, Cuiabá. Anais...
Cuiabá- MT/ UFMT, 2002. Disponível em compact disk.
LORENZI, H.; MATOS, A. F. J. Plantas medicinais no Brasil: nativas e exóticas. São Paulo: Instituto
Plantarum de estudos da flora LTDA, 2002.
82
MACIEL, M. A.; PINTO, A. C.; VEIGA JUNIOR, V. F.; GRYNBERG, N. F.; ECHEVARRIA, A. Plantas
medicinais: a necessidade de estudos multidisciplinares. Quim. Nova, v.25, n. 3, p. 429-438, 2002.
MARCELLO, C. M. Triagem antiúlcera de plantas medicinais usadas popularmente em Mato Grosso para
afecções gastrintestinais e validação pré-clínica de Simba ferruginea St. Hil (calunga) como antiúlcera. Cuiabá,
2001. Tese de Doutorado em Saúde e Ambiente da UFMT, Cuiabá, 2001, p.149.
MARCELLO, C. M. et al. Efeito do extrato hidroetanólico de Simaba ferruginea ST.Hil. (Simaroubaceae) sobre
o tempo de sono barbitúrico e sobre o trânsito intestinal. In: SIMPOSIO BRASILEIRO DE PLANTAS
MEDICINAIS, 17, 2002, Cuiabá. Anais.... Cuiabá- MT/UFMT, 2002. Disponível em compact disk, a.
MARCELLO, C. M. et al. Avaliação da atividade antiúlcera de frações de Simaba ferruginea ST. Hil.
(Simaroubaceae). In: SIMPÓSIO BRASILEIRO DE PLANTAS MEDICINAIS, 17, 2002, Cuiabá. Anais...
Cuiabá- MT/ UFMT, 2002. Disponível em compact disk, b.
MARQUES, C. L. O mercado de
produtos fitoterápicos: cenário atual e tendências. Fármacos
&Medicamentos. São Paulo, n.1, p.43-46, 1999.
MARTINS, S. Remédios da natureza: Respaldos pela biodiversidade brasileira e por séculos de tradição, os
fitoterápicos crescem no Brasil e no mundo. Anfarmg, n.44, p.34-37, 2003.
MARTINEZ-FLOREZ, S.; GONZÁLEZ-GALLEGO, J.; CULEBRAS, J. M.; TUNÓN, M. J. Los flavonóides:
propiedades Y acciones antioxidantes. Nutr. Hosp., v. 17, n. 6, p. 271-278, 2002.
MEDEIROS, W. L. B.; VIEIRA, I. J. C.; MATHIAS, L.; BRAZ-FILHO, R.; SCHRIPSEMA, J. A new natural
quaternary índole alkaloid isolated from Tabernaemontana laeta Mart. (Apocynaceae). J. Braz. Chem. Soc., v.
12, n. 3, p. 368-372, 2001.
MERCK INDEX: The Merck Index: An encyclopedia of chemicals, drugs and biologicals. 12 ed.USA:
Library of Congress Catalog, p.8697-8698, 1996.
MORAES, M. O.; BEZERRA, F. A. F.; LOTUFO, L. V. C.; PESSOA, C.; MORAES, M. E. A. Avaliação
clínica da eficácia e segurança de fitoterápicos no Brasil. Arquivos Brasileiros de Fitomedicina Científica, v.
1, p. 30-38, 2003.
MORETTI, C.; BHATNAGAR, S.; BELOEIL, J. C.; POLONSKY, J. Two new quassinoids from Simaba
multiflora fruits. J. Nat. Prod., v. 49, n. 3, p. 440-444, 1986
MORETTI, C.; DEHARO, E.; SAUVAIN, M.; JARDEL, C.; DAVID, P. T.; GASQUET, M. Antimalarial
activity of cedronon. J. Ethnopharmacol., v. 43, n. 1, p. 57-61, 1994.
MORETTO, L. D. Fitoterápicos: O Brasil se alinha com a legislação internacional. Pharmaceutical
Technollogy, v. 4., n. 2., p. 46-47, 2000.
MUHAMMAD I,; BEDIR, E.; KHAN, S. I.; TEKWANI, B. L.; KHAN, I. A.; TAKAMATSU, S.; PELLETIER,
J.; WALKER, L. A. A new antimalarial quassinoid from Simaba orinocensis. J. Nat. Prod., v. 67, n. 5, p. 772777, 2004.
MURAKAMI, C.; FUKAMIYA, N.; TAMURA, S.; OKANO, M.; BASTOW, K. F.; TOKUDA, H.;
MUKAINAKA, T.; NISHINO, H.; LEE, K. H. Multidrug-resistant cancer cell susceptibility to cytotoxic
quassinoids, and cancer chemopreventive effects of quassinoids and canthin alkaloids. Bioorg. Med. Chem., v.
12, n. 18, p. 4963-4968, 2004.
NARAYANA, R. K.; SRIPAL REDDY, M.; CHALUVADI, M. R; KRISHNA, D. R. Bioflavonoids
classification, pharmacological, biochemical effects and therapeutic potential. Indian J. Pharmacol., n. 33, p. 216, 2001.
NASH, R. Plant extracts as medicines and sources of new therapeutic agents. Phar. Manufacuting P. Sourcer,
2004. Disponível em: <http://www.samedanltd.com>.
83
NGUYEN, A. T.; MALONNE, H.; DUEZ, P.; VANHAELE-FASTRE, R.; VANHAELEN, M.; FONTAINE, J.
Cytotoxic constituents from Plumbago zeylanica. Fitoterapia, v. 75, n. 5, p. 500-504, 2004.
NJAR, V. C.; ALAO, T. O.; OKOGUN, J. I.; RAJI, Y.; BOLARINWA, A. F.; NDUKA, E. U. Antifertility
activity of Quassia amara: quassin inhibits the stereidogenesis in rat Leydig cells in vitro. Planta Med., v. 61, n.
2., p. 180-182, 1995.
NIERO, R.; MALHEIROS, A.; BITTENCOURT, C. M. S.; BIAVATTI, M. W.; LEITE, S. N.; CECHINEL
FILHO, V. Aspectos químicos e biológicos de plantas medicinais e considerações sobre fitoterápicos. p. 11-56,
2003. In: CECHINEL FILHO, V; BRESOLIN, T. M. B. Ciências Farmacêuticas: contribuição ao
desenvolvimento de novos fármacos e medicamentos. Itajaí: UNIVALI, 2003.
OZEKI, A.; HITOTSUYANAGI, Y.; HASHIMOTO, E.; ITOKAWA, H.; TAKEYA, K.; MELLO ALVES de,
S. Cytotoxic quassinoids from Simaba cedron. J. Nat. Prod., v. 61, n. 6, p. 776-780, 1998.
OVESNA, Z.; VACHALKOVA, A.; HORVATHOVA, K. Taraxasterol and beta-sitosterol: new naturally
compounds with chemoprotective/chemopreventive effects. Neoplasma, v. 51, n. 6, p. 407-414, 2004.
PHILLIPSON, J. D. Phytochemistry and medicinal plants. Phytochemistry, v. 56, p. 237-243, 2001.
PINTO, A. C.; SILVA, D. H. S.; BOLZANI, V. S.; LOPES, N. P.; EPIFANIO, R. A. Produtos naturais:
atualidade, desafios e perspectivas. Quim. Nova, v. 25, p. 45-61, 2002.
PLOTKIN, M. J. Global phytochemistry: the ethnobotanist view. Phytochemistry, v. 56, p. 117-120, 2001.
POLONSKY, J.; VARON, Z.; MORETTI, C.; PETTIT, G. R.; HERALD, C. L.; RIDEOUT, J. A.; SAHA, S. B.;
KHASTGIR, H. N. The antineoplastic quassinoids of Simaba cuspidate Spruce and Ailanthus grandis Prain. J.
Nat. Produt.; v. 43, n. 4, p. 503-509, 1980.
RAJI, Y.; BOLARINWA, A. F. Antifertility activity of Quassia amara in male rats – in vivo study. Life Sci., v.
61, n. 11, p. 1067-1074, 1997.
RAMESH N.; VISWANATHAN, M. B.; SARASWATHY, A.; BALAKRISHNA, K.; BRINDHA, P.;
LAKSHMANAPERUMALSAMY, P. Phytochemical and antimicrobial studies on Drynaria quercifolia.
Fitoterapia, v. 72, n. 8, p. 934-936, 2001.
RASKIN, I.; RIBNICKY, D. M.; KOMAMYTSKY, S.; ILIC. N.; POULEV, A.; BORISJUK, N.; BRINKER,
A.; MORENO, D. A.; RIPOLL, C.; YAKOBY, N.; O’NEAL, J. M.; COMWELL, T.; PASTOR, I.;
FRIDLENDER, B. Plants and human health in the twenty-first century. Trends Biotechnol., v. 20, n. 12, p.
522-531, 2002.
RATES, S. M. K. Promoção do uso racional de fitoterápicos: uma abordagem no ensino de Farmacognosia. Rev.
Brasileira de Farmacognosia, v. 11, n. 2. p. 57-69, 2001. a
RATES, S. M. K. Plants as source of drugs. Toxicon, v. 39, p. 603-613, 2001.b
REPETTO, M. G.; LLESUY, S. F. Antioxidant properties of natural compounds used in popular medicine for
gastric ulcers. Braz. J. Med. Biol. Res., v. 35, n. 5, p. 523-534, 2002.
ROBERT, A.; NEZAMIS, J. E.; LANCASTER, C.; HAUCHAR, A. J. Cytoprotection by protaglandins in rats.
Prevetion of gastric necrosis produced by alcohol, HCl, NaOH, hypertonic NaCl and thermal injury.
Gastroenterology, v.77, p. 433-443, 1979.
RYOKKYNEN, A.; KAYHKO, U. R.; MUSTONEN, A. M.; KUKKONEN, J. V.; NIEMINEN, P.
Multigenerational exposure to phytosterols in the mouse. Reprod Toxicol., v. 19, n. 4, p. 535-540, 2005.
SANTOS, A. R.; NIERO, R.; CECHINEL FILHO, V.; YUNES, R. A.; PIZZOLATTI, M. G.; DELLE
MONACHE, F.; CALIXTO, J. B. Antinociceptive properties of steroids from Phyllanthus corcovadensis in
mice. Planta Med., v. 61, n. 4, p. 329-332, 1995.
84
SANTOS, P. M. L.; KUSTER, R. M.; SCHRIPSMA, J.; BARRETO, E. O.; MARTINS, M. A. Identificação de
flavonóides antialérgicos de Croton campestris (Euphorbiaceae). In: Congresso Latinoamericano de Química /
Reunião Anual da Sociedade Brasileira de Química. 18 /27, Salvador, 2004. Anais... Salvador, 2004.
SANCHEZ, M. F; VERA, B.; GALVEZ, J.; ZARZUELO, A. Effect of quercitrin on the early stages of hapten
induced colonic inflammation in the rat. Life Sci., v. 70, n. 26, p. 3097-3108, 2002.
SANNOMIYA, M.; FONSECA, V. B.; da SILVA, M. A.; ROCHA, L. R.; Dos SANTOS, L. C.; HIRUMALIMA, C. A.; SOUZA BRITO, A. R.; VILEGAS, W. Flavonoids and antiulcerogenic activity from Bryrsonuima
crassa leaves extracts. J. Ethnopharmacol., v. 97, n. 1, p. 1-6, 2005.
SARAIVA, R. C. G.; NUMOMURA, S. M.; POHLIT, A. M.; PINTO, A. C. Triterpenos e alcalóide isolados de
Simaba polyphylla Cavalc. (Simaroubaceae). In: Congresso Latinoamericano de Química / Reunião Anual da
Sociedade Brasileira de Química. 18 /27, Salvador, 2004. Anais... Salvador, 2004.
SARDESAI, V. Herbal medicines: Poisons or potions? J. Lab. Clin. Med., v. 139, p. 343-348, 2002.
SENAY, S. E.; LEVINE, R. J. Synergism between cold and restraint for rapid production of stress ulcer in rats.
Proc. Soc. Exp. Biol. Med., v. 124, p. 1221-1223, 1967.
SILVA-MEYRE, C.; YUNES, R. A.; DELLE MONACHE, F.; SANTOS, A. R. S.; SCHMELING, L. O.;
GADOTI, V. M.; LIZ, F.; CECHINEL FILHO, V. Phytochemical and pharmacological analysis of Bauhinia
microstachya (Raddi) Macbr. (Leguminosae). Z. Natuforsch., v. 56, p. 939-942, 2001.
SIMÕES, C. M. O.; SCHNKEL, E. P. A pesquisa e a produção brasileira de medicamentos a partir de plantas
medicinais. Nexus, 2001.
SIMÕES, C. M. O. et al. Farmacognosia: da planta ao medicamento. 4. ed. Porto Alegre/Florianópolis:
UFRGS. 2002, 833 p.
SOUZA, M. M.; BELLA CRUZ, A.; SCHUHMACHER, M. B.; KREUGER, M. R. O.; FREITAS, R. A.;
BELLA CRUZ, R. Cé. Métodos de avaliação de atividade biológica de produtos naturais e sintéticos. p. 109166, 2003. In: CECHINEL FILHO, V; BRESOLIN, T. M. B. Ciências Farmacêuticas: contribuição ao
desenvolvimento de novos fármacos e medicamentos. Itajaí: UNIVALI, 2003.
TAMURA, S.; FUKAMIYA, N.; OKANO, M.; KOYAMA, J.; KOIKE, K. Three new quassinoids, ailantinol E,
F, and G, from Ailanthus altissima. Chem. Pharm. Bull., v. 51, n. 4, p. 385-389, 2003.
TAN, S.; YUEN, K. H.; CHAN, K. L. HPLC analysis of plasma 9-methoxycanthin-6-one from Eurycoma
longifolia and its application in a bioavailability/pharmacokinetic study. Planta Med., v. 68, n. 4, p. 355-358,
2002.
THOUVENEL, C.; GANTIER, J. C.; DURET, P.; FOURNET, A; HOCQUEMILLER, R; FERREIRA, M. E.;
ARIAS, R.; FOURNET, A. Antifungal compounds from Zanthoxylum chiloperone var angustifolium.
Phytother Res., v. 17, n. 6, p. 678-680, 2003.
TOMA, W. et al. Antiulcerogenic activity of four extracts obtained the bark wood of Quassia amara L.
(Simaroubaceae). Biol. Pharm. Bull., v. 25, n. 9, p. 1151-1155, 2002.
TOMA, W.; TRIGO, J. R.; de PAULA, A. C.; BRITO, A R. Preventive activity of pyrrolizidine alkaloids from
Senecio brasiliensis (Asteraceae) on gastric and duodenal induced ulcer on mice and rats. J. Ethnopharmacol.,
v. 95, n. 2-3, p. 345-351, 2004.
TOMOYORY, H.; KAWATA, Y.; HIGUCHI, T.; ICHI, I.; SATO, M.; IKEDA, I.; IMAIZUMI, K. Phytosterol
oxidation products are absorbed in the intestinal lymphatics in rats but do not accelerate atherosclerosis in
apolipoprotein E-deficient mice. J. Nutr., v. 134, n. 7, p. 1690-1696, 2004.
TRUEBA, G. P. Los flavonóides: antioxidantes o prooxidantes. Rev. Cubana Invest. Biomed., v. 22, n. 1, p.
38-48, 2003.
85
TULP, M.; BOHLIN, L. Functional versus chemical diversity: is biodiversity important for drug discovery?
Trends Pharmacol. Sci., v. 23, n. 5, 2002.
TULP, M.; BOHLIN, L. Unconventional natural sources for future drug discovery. Drug Discov. Today, v. 9, n.
10, p. 450-458, 2004.
UGAZ, O L. Investigación fitoquímica. 2.ed. Lima: Pontifícia Universidad Catolica del Peru - fondo Editorial.
1994, p. 300.
VEIGA JUNIOR, V. F.; PINTO, A. C.; MACIEL, M. A. M. Plantas medicinais: cura segura? Quim. Nova, v.
28, n. 3, p. 519-528, 2005.
VIEIRA, R. F. Conservation of medicinal and aromatic plants in Brazil. In: JANICK, J. (Ed.). Perspectives on
new crops and new uses. Alexandria: ASHS Press, p. 152-159, 1999.
VIEIRA, R. F.; MARTINS, R. C. Estratégias para conservação e manejo de recursos genéticos de plantas
medicinais e aromáticas. Resultados da primeira reunião técnica. Brasília: EMBRAPA Recursos Genéticos e
Biotecnologia / Instituto Brasileiro de Meio Ambiente e dos Recursos Naturais Renováveis (Ibama)/ Conselho
Nacional de Desenvolvimento Científico e Tecnológico (CNPq), p. 54, 2002.
XI-NING, Z.; OTSUKA, H.; IDE, T.; HIRATA, E.; TAKUSHI, A.; TAKEDA, Y. Three flavonol glycosides
leaves of Myrsine seguini. Phytochemistry, v. 46, n. 5, p.943-946, 1997.
WANI, M. C.; TAYLOR, H. L.; THOMPSON, J. B.; WALL, M. E. Plant antitumor agents. XVI. 6alphaSenecioyloxy-chaparrinone, a new antileukemic quassinoid from Simaba multiflora. Lloydia, v. 41, n. 6, p. 578583, 1978.
YUNES, R. A.; PEDROSA, R. C.; CECHINEL FILHO, V. Fármacos e fitoterápicos: a necessidade do
desenvolvimento da indústria de fitoterápicos e fitofármacos no Brasil. Quím. Nova, São Paulo, v.24, n.1,
p.147-152, 2001.
86
8 ANEXOS
8.1 Artigo
87
88
89
90
91