Apostila de Química 04 – Compostos
Orgânicos
1.0 Introdução
Composto orgânico – Todo elemento que possui carbono na sua composição.
Existem exceções – grafite, monóxido de carbono, carboidratos...
Química orgânica é a parte da Química que estuda os compostos do elemento
carbono com propriedades características.
Elementos principais além do carbono – Hidrogênio (H), oxigênio (O),
nitrogênio (N) e enxofre (S).
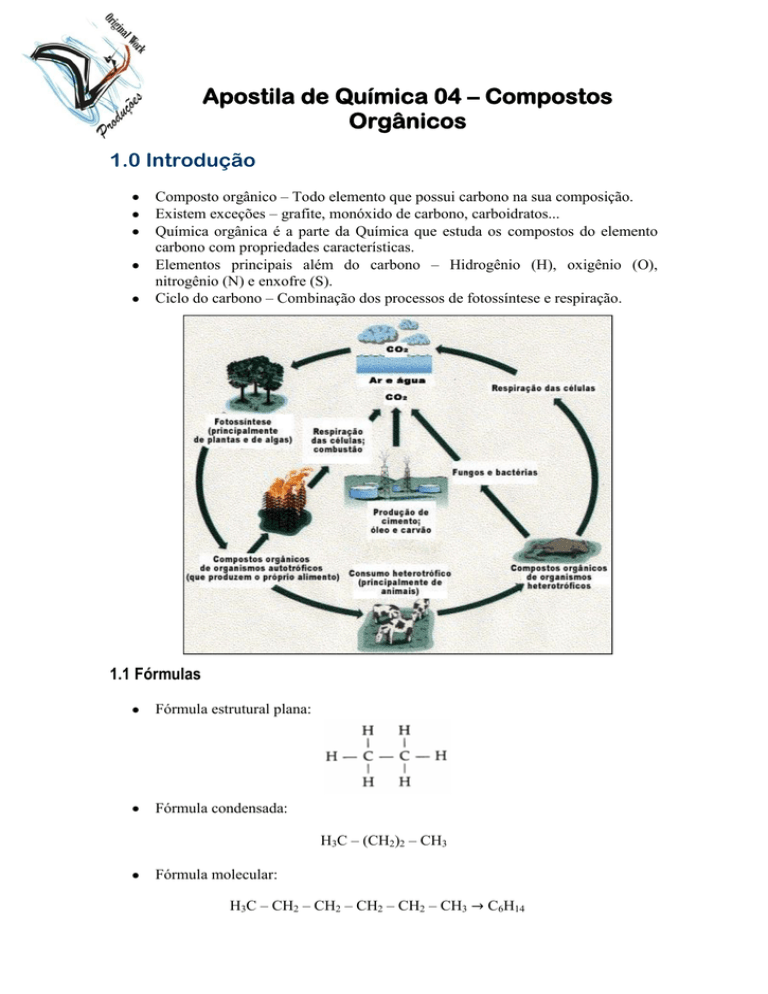
Ciclo do carbono – Combinação dos processos de fotossíntese e respiração.
1.1 Fórmulas
Fórmula estrutural plana:
Fórmula condensada:
H3C – (CH2)2 – CH3
Fórmula molecular:
H3C – CH2 – CH2 – CH2 – CH2 – CH3
C6H14
2.0 História
Teoria da força vital:
Berzelius.
Compostos orgânicos só podem ser produzidos por organismos vivos.
Queda da teoria:
Friedrich Wöhler.
Conseguiu produzir uréia (orgânico) a partir do cianato de amônio
(inorgânico)
3.0 Características Gerais
Ligação predominante – Covalente.
Ligações mais freqüentes – Carbono com carbono ou carbono com hidrogênio.
Compostos feitos somente de carbono e hidrogênio - Compostos apolares.
Se houver outro elemento químico além do carbono e do hidrogênio –
Compostos polares.
Temperatura de fusão e ebulição:
Menor que os compostos inorgânicos – Ligações intermoleculares mais fracas.
A temperatura ambiente, os compostos orgânicos são encontrados nos
três estados físicos.
Solubilidade:
Praticamente insolúveis em água.
Dissolvem-se em outros compostos orgânicos, sejam eles apolares ou
polares.
Combustibilidade.
3.1 Temperatura de Ebulição
Fatores que influenciam nas temperaturas de fusão e ebulição – Tamanho das
moléculas e tipos de interação molecular.
Quanto maior o tamanho da molécula, maior será sua temperatura de ebulição.
Quanto maior for a intensidade das forças intermoleculares, maior será a sua
temperatura de ebulição.
Ordem crescente da intensidade das interações:
Dipolo induzido – Dipolo induzido
<
Dipolo-Dipolo
<
Pontes de Hidrogênio
Série homóloga – Substâncias que pertencem a uma mesma função e diferem
entre si pela quantidade de grupos CH2.
Série heteróloga – Substâncias que pertencem a diferentes funções e que
apresentam o mesmo número de carbonos.
Série isóloga – Substâncias que apresentam o mesmo número de átomos de
carbono e diferem na insaturação (quantidade de H2).
3.2 Solubilidade
Líquidos apolares tendem a se dissolver em líquidos apolares.
Líquidos polares tendem a se dissolver em líquidos polares.
Solvente polar mais importante – Água (solvente universal).
Solvente orgânico mais utilizado:
Etanol.
Considerado um solvente polar, mas apresenta uma parte polar e outra
apolar - Dissolve-se tanto em solventes polares quanto em solventes
apolares.
A medida que aumenta a cadeia carbônica, sua solubilidade em água diminui,
ocorrendo um aumenta de sua solubilidade em solventes apolares.
Identificação de substâncias polares/apolares:
Se a substância for simples ou binária com as substâncias Be, B ou C –
Substância apolar.
O resto – Apolar.
3.3 Capacidade de Formar Cadeias
Átomos de carbono têm a propriedade de se unirem – Cadeias carbônicas:
Responsável pela existência de milhões de compostos orgânicos.
São chamados também de cadeia principal.
Pode apresentar outros elementos, desde que estejam entre os átomos de
carbono:
Esses átomos recebem o nome de heteroátomos:
São elementos bivalentes ou trivalentes.
Elementos mais usados: oxigênio, nitrogênio, enxofre e fosfato.
4.0 Classificação do Carbono
Classificação de acordo com o número de outros átomos do carbono a ele
ligados:
Primário – Ligado diretamente a 1 carbono.
Secundário – Ligado diretamente a 2 carbonos.
Terciário – Ligado diretamente a 3 carbonos.
Quaternário – Ligado diretamente a 4 carbonos.
A presença de dupla ou tripla ligação não influencia na classificação do
carbono.
Classificação de acordo com o tipo de ligação existente em cada carbono:
Saturado – Apresenta 4 ligações simples (sigma).
Insaturado – Apresenta pelo menos 1 ligação dupla ou tripla.
5.0 Classificação das Cadeias Carbônicas
5.1 Disposição dos Átomos de Carbono
5.1.1 Cadeia Aberta, Acíclica ou Alifática
Há pelo menos 2 extremidades e nenhum ciclo.
Cadeia normal, reta ou linear- Apresentam 2 extremidades, dispostos numa
única sequência.
Cadeia ramificada – Apresenta mais de 2 extremidades.
5.1.2 Cadeia Fechada ou Cíclica
Não apresenta extremidades e há 1 ou mais ciclos.
Cadeias aromáticas:
Apresenta pelo menos 1 anel benzênico.
Ressonância – Deslocalização das ligações π ao longo de todo o anel,
formando nuvens eletrônicas.
Mononuclear – 1 anel.
Polinuclear – Mais de 1 anel.
Cadeias alicíclicas, não aromáticas ou cicloalifáticas – Não apresentam o núcleo
aromático ou benzênico.
Cadeias mistas – Cadeias cuja estrutura apresenta extremidades livres e ciclos.
5.2 Tipo de Ligação entre Átomos de Carbono
Cadeia saturada – Apresenta somente ligações simples entre os átomos de
carbono.
Cadeia insaturada – Apresenta pelo menos 1 ligação dupla ou tripla entre os
átomos de carbono.
5.3 Natureza dos Átomos
Cadeia homogênea – Constituída apenas por átomos de carbono.
Cadeia heterogênea – Existe pelo menos 1 heteroátomo entre os átomos de
carbono.