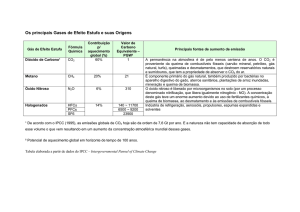
1. Observe a imagem, que apresenta uma situação de intensa poluição do ar que danifica
veículos, edifícios, monumentos, vegetação e acarreta transtornos ainda maiores para a
população. Trata-se de chuvas com poluentes ácidos ou corrosivos produzidos por reações
químicas na atmosfera.
Com base na figura e em seus conhecimentos,
a) identifique, em A, dois óxidos que se destacam e, em B, os ácidos que geram a chuva ácida,
originados na transformação química desses óxidos. Responda no quadro abaixo.
A
B
b) explique duas medidas adotadas pelo poder público para minimizar o problema da poluição
atmosférica na cidade de São Paulo.
2. Para preparar uma massa básica de pão, deve-se misturar apenas farinha, água, sal e
fermento. Parte do trabalho deixa-se para o fungo presente no fermento: ele utiliza amido e
açúcares da farinha em reações químicas que resultam na produção de alguns outros
compostos importantes no processo de crescimento da massa. Antes de assar, é importante
que a massa seja deixada num recipiente por algumas horas para que o processo de
fermentação
ocorra.
Esse período de espera é importante para que a massa cresça, pois é quando ocorre a
a) reprodução do fungo na massa.
b) formação de dióxido de carbono.
c) liberação de energia pelos fungos.
d) transformação da água líquida em vapor d‘água.
e) evaporação do álcool formado na decomposição dos açúcares.
3. O sal faz uma grande viagem até chegar à nossa mesa.
No Brasil, as principais salinas produtoras de sal marinho estão localizadas nos estados do Rio
Grande do Norte, Rio de Janeiro, Ceará e Piauí; ficando os estados de Alagoas e Bahia
responsáveis pela extração de sal-gema de minas.
Acredite, essa substância que hoje temos fartamente à disposição foi um dos bens mais
desejados da história humana. Apesar de encher os oceanos, brotar de nascentes e rechear
camadas subterrâneas, o sal já foi motivo de verdadeira obsessão e de guerras entre povos e
nações.
Quimicamente, a definição de sal é bem simples: trata-se de uma substância produzida pela
reação de um ácido com uma base. Como há muitos ácidos e bases, há vários tipos diferentes
de substâncias que podem ser chamadas de sal.
O que chamamos popularmente de sal de cozinha, ou simplesmente sal, é o cloreto de sódio,
que pode ser formado a partir da reação do ácido clorídrico com a soda cáustica (hidróxido de
sódio).
A água do mar é a principal fonte desse sal, porém ele também pode ser encontrado em
jazidas subterrâneas, fontes e lagos salgados.
(super.abril.com.br/ciencia/imperio-sal-443351.shtml
Acesso
em:
dnpm.gov.br/assets/galeriaDocumento/SumarioMineral2008/salmarinho.pdf
22.08.2013. Adaptados)
16.08.2013
Acesso
e
em:
A análise do texto permite concluir, corretamente, que o sal
a) é denominado cloreto de sódio, quando produto da reação entre ácido clorídrico e hidróxido
de sódio.
b) pode ser encontrado somente em jazidas subterrâneas, fontes e lagos.
c) tem, como principal fonte, uma reação entre um ácido e uma base.
d) vem de salinas presentes em todos os estados do país.
e) é obtido por uma reação química entre dois ácidos.
4. O dióxido de enxofre é um dos diversos gases tóxicos poluentes, liberados no ambiente por fornos de
usinas e de indústrias. Uma das maneiras de reduzir a emissăo deste gás tóxico é a injeçăo de carbonato
de cálcio no interior dos fornos industriais. O carbonato de cálcio injetado nos fornos das usinas se
decompőe formando óxido de cálcio e dióxido de carbono. O óxido de cálcio, entăo, reage com o dióxido
de enxofre para formar o sulfito de cálcio no estado sólido, menos poluente.
Assinale a alternativa que apresenta, na sequęncia em que aparecem no texto (desconsiderando-se as
repetiçőes), as fórmulas químicas dos compostos, grifados e em itálico, mencionados no processo.
a) SO2 ; CaCO2 ; CaO2 ; CaSO2
b) SO2 ; CaCO3 ; CaO ; CO2 ; CaSO4
c) SO2 ; Ca2CO3 ; Ca2O ; CO2 ; CaSO3
d) SO2 ; CaCO3 ; CaO ; CO2 ; CaSO3
e) SO3 ; CaCO4 ; CaO ; CO ; CaSO4
5. Os combustíveis fósseis, que têm papel de destaque na matriz energética brasileira, são
formados, dentre outros componentes, por hidrocarbonetos.
A combustão completa dos hidrocarbonetos acarreta a formação de um óxido ácido que vem
sendo considerado o principal responsável pelo efeito estufa.
A fórmula química desse óxido corresponde a
a) CO2
b) SO3
c) H2O
d) Na2O
6. Associe as substâncias químicas às suas respectivas características.
SUBSTÂNCIAS
CARACTERÍSTICAS
I. HC
II. SO2
III. KOH
IV. CaO
V. NaC
VI. H2 SO4
(
(
(
(
(
A sequência correta encontrada é
a) II, III, I, VI, IV.
) óxido de perfil ácido
) base usada na fabricação de sabão
) ácido componente do suco gástrico
) ácido presente nas baterias de automóveis
) óxido usado na correção da acidez do solo
b) II, IV, I, III, V.
c) III, IV, II, V, VI.
d) IV, II, VI, I, III.
7. Uma das maiores emissoras de CO2 do país, a Petrobrás anuncia que planeja deixar de
lançar na atmosfera milhões de toneladas de carbono presentes nos reservatórios de petróleo
e gás da camada pré-sal. As concentrações de carbono no local são muito maiores do que em
outros campos petrolíferos. Estimativas apontam que somente nas duas áreas com reservas
delimitadas – os campos de Tupi e Iara, onde há um acúmulo de até 12 bilhões de barris de
óleo e gás – existam 3,1 bilhões de toneladas de CO2 , um dos gases que contribuem para o
aquecimento do planeta.
Folha de São Paulo, 31 de maio de 2009.
Caso todo gás produzido na exploração do pré-sal seja lançado na atmosfera, poderá acarretar
aumento
a) do efeito estufa e, consequentemente, maior dispersão dos raios solares para o espaço,
gerando aquecimento global.
b) considerável do pH das águas dos mares e, consequentemente, destruição dos corais
formados por carbonatos.
c) da temperatura nos mares, ocasionando o desvio de curso de correntes marítimas e, até
mesmo, a extinção de animais marinhos.
d) da sensação térmica, sem, contudo provocar alterações climáticas consideráveis, pois o
efeito estufa é um fenômeno natural.
8. As chuvas ácidas são provocadas devido à grande quantidade de poluentes gasosos
lançados na atmosfera por alguns tipos de indústria e pela queima de combustíveis fósseis por
automóveis. Uma das substâncias liberadas é o dióxido de enxofre que, ao entrar em contato
com o ar atmosférico, transforma-se em trióxido de enxofre. O trióxido de enxofre em contato
com a água das nuvens transforma-se em ácido sulfúrico. As chuvas ácidas provocam a
deterioração de monumentos históricos, principalmente os constituídos de carbonato de cálcio,
cuja reação com o ácido sulfúrico resulta na formação de sulfato de cálcio, dióxido de carbono
e água.
Assinale a alternativa que apresenta a fórmula CORRETA das seguintes substâncias químicas
citadas no texto: ácido sulfúrico, sulfato de cálcio, dióxido de carbono e água, respectivamente.
a) H2SO3 , CaSO4 , CO2 e H2O
b) H2SO3 , CaSO4 , CO2 e HO2
c) H2SO4 , CaSO4 , CO2 e H2O
d) H2SO4 , CaSO3 , CO e HO2
9. Os óxidos de metais de transição podem ter caráter ácido, básico ou anfótero. Assinale a
opção que apresenta o caráter dos seguintes óxidos: CrO, Cr2O3 e CrO3.
a) Ácido, anfótero, básico
b) Ácido, básico, anfótero
c) Anfótero, ácido, básico
d) Básico, ácido, anfótero
e) Básico, anfótero, ácido
10. Na BR-381, na região central de Minas Gerais, houve um acidente com uma carreta que
transportava H2 SO4 .
Devido ao acidente, ocorreu o vazamento do material transportado atingindo o Rio Piracicaba.
<http://tinyurl.com/lo3qquc> Acesso em: 20.03.2015. Adaptado.
A água desse rio, na região do acidente, apresentou-se
a) neutra, pela ionização do ácido na água.
b) ácida, pela ionização do ácido na água.
c) ácida, pela neutralização da água.
d) básica, pela neutralização da água.
e) básica, pela dissociação da base na água.
11. Azia é uma sensação de ardor (queimação) e pode ser sintoma de algumas doenças
como refluxo gastroesofágico ou indicação de processos irritativos ou inflamatórios no esôfago.
Esse ardor é provocado pela ação do ácido gástrico fora do ambiente estomacal.
A substância, representada por sua fórmula, que pode ser utilizada, paliativamente, para
combater os efeitos da azia é
a) CO2
b) NaC
c) H2 CO3
d) NaHCO3
12.
Em uma aula prática, um béquer com uma solução concentrada de ácido nítrico foi
deixado próximo a outro contendo hidróxido de amônio. Entre os béqueres, foi observada a
formação de uma fumaça branca que se depositou sobre a bancada. Sobre o sólido branco
obtido, afirma-se, corretamente, que
a) é insolúvel em água.
b) possui caráter básico.
c) apresenta N com número de oxidação 3 e 5.
d) tem temperatura de ebulição menor que o HNO3.
e) resulta da condensação do NH4OH e evaporação do HNO3.
13.
Na fabricação de papel, as indústrias de celulose geram resíduos com alto teor de
hidróxido de sódio. Durante o processo de clarificação do resíduo líquido, são separadas, por
sedimentação, as impurezas, tais como: carbono não queimado, ferro, sílica, cálcio, alumina e
magnésio. Agricultores situados próximos a essas indústrias utilizam esse resíduo para
correção da acidez do solo. Embora não exista critério definido para dosagem dessas
aplicações, estudos apontam que, em alguns casos, o uso é benéfico, mas, em determinados
tipos de solo, o uso desse resíduo influencia na estabilidade da argila, provocando erosão.
Em relação à fabricação de papel, é CORRETO afirmar:
a) A sedimentação é um processo químico para extrair a celulose da madeira.
b) Os resíduos gerados na fabricação de papel apresentam caráter alcalino.
c) O resíduo pode ser aplicado em qualquer solo para melhorar suas propriedades.
d) A celulose é um polipeptídio natural que apresenta alto teor de toxicidade.
14. Para determinar se uma solução ou uma substância pura tem caráter ácido ou básico
pode-se utilizar uma solução contendo extrato de repolho roxo, em substituição à fenolftaleína.
A tabela seguinte mostra a relação entre a solução/substância analisada e a cor da solução
indicadora.
Solução/ substância
limão (aq)
água
cal virgem (aq)
Cores
rosa
roxo
verde
O indicador contendo extrato de repolho roxo torna-se verde na presença de
a) ácido sulfúrico.
b) cloreto de sódio.
c) dióxido de carbono.
d) hidróxido de cálcio.
15.
Um óxido básico é um óxido iônico que reage com água tendo um hidróxido como
produto.
São óxidos básicos todas as seguintes substâncias:
a) CO2, SO3 , TiO2.
b) CaO, Na2O, K 2O.
c) CaSO4 , MgO, CO.
d) Li2O, Mg(OH)2, SiO2.
e) KHO3 , CaO, BaSO4 .
16. A Petrobrás lançou no mercado o combustível diesel S 10 com baixo teor de enxofre
para reduzir a poluição ambiental. Quanto maior a porcentagem de derivados de enxofre
presentes no diesel, maiores serão as quantidades de óxidos de enxofre (anidridos sulfuroso e
sulfúrico) gerados em sua combustão. No que diz respeito ao anidrido sulfuroso, afirma-se
corretamente que
a) é classificado como óxido iônico.
b) é responsável pelo efeito estufa.
c) forma um diácido, ao reagir com água.
d) é obtido pela reação entre o anidrido sulfúrico e o oxigênio.
e) forma um sal insolúvel em água, ao ser neutralizado com hidróxido de sódio.
17. O carbonato de sódio, Na2CO3, conhecido comercialmente como barrilha, tem grande uso
no tratamento de águas de piscinas e de abastecimento público. Tal substância é classificada
como um
a) óxido básico.
b) óxido ácido.
c) hidróxido.
d) ácido.
e) sal.
18. Em um laboratório químico, um estudante encontrou quatro frascos (1, 2, 3 e 4) contendo
soluções aquosas incolores de sacarose, KC, HC e NaOH, não necessariamente nessa
ordem. Para identificar essas soluções, fez alguns experimentos simples, cujos resultados são
apresentados na tabela a seguir:
Frasco
1
2
3
4
Cor da solução
após a
adição de
fenolftaleína
incolor
rosa
incolor
incolor
Condutibilidade
elétrica
Reação
com
Mg(OH)2
conduz
conduz
conduz
não conduz
não
não
sim
não
Dado: Soluções aquosas contendo o indicador fenolftaleína são incolores em pH menor do que
8,5 e têm coloração rosa em pH igual a ou maior do que 8,5.
As soluções aquosas contidas nos frascos 1, 2, 3 e 4 são, respectivamente, de
a) HC, NaOH, KC e sacarose.
b) KC, NaOH, HC e sacarose.
c) HC , sacarose, NaOH e KC.
d) KC, sacarose, HC e NaOH.
e) NaOH, HC, sacarose e KC.
19. Considere fórmulas químicas a seguir.
I. H2Cr2O7
II. CrO3
III. NH4OH
IV. BaO
V. NaHSO3
VI. ZnO
Acerca dessas fórmulas é correto afirmar que, quando dissolvidas pequenas quantidades em
água destilada, as substâncias:
a) I e VI formam soluções alcalinas.
b) II e VI formam soluções ácidas.
c) I e III formam soluηυes αcidas.
d) III e IV formam soluções alcalinas.
e) IV e V formam soluções ácidas.
20. O cientista Wim L Noorduin, da Escola de Engenharia e Ciências Aplicadas (SEAS, na
sigla em inglês) em Harvard, nos EUA, aprendeu a manipular gradientes químicos para criar
estruturas microscópicas semelhantes a flores. Nas suas experiências, Noorduin aprendeu a
controlar minúsculos cristais, em placas de vidro e lâminas de metal, para criar estruturas
específicas. Noorduin e a sua equipe dissolveram cloreto de bário e silicato de sódio numa
solução de água. O dióxido de carbono do ar naturalmente dissolve-se na água, dando início a
uma reação que deriva em cristais de carbonato de bário. O processo químico também baixa o
pH da solução ao redor dos cristais, os quais, por sua vez, reagem com o silicato de sódio
dissolvido. Com o pH ácido é adicionada uma camada de sílica às estruturas, usando o ácido
da solução, permitindo a continuidade da formação de cristais de carbonato de bário. ―Ao longo
de pelo menos 200 anos, as pessoas têm questionado como formas complexas conseguem
evoluir na natureza‖, declara Noorduin. ―Este trabalho ajuda a demonstrar o que é possível
(fazer) apenas com mudanças químicas e ambientais.‖
http://diariodigital.sapo.pt/news.asp?id_news=641134
A respeito das substâncias inorgânicas sublinhadas no texto, pode-se afirmar que suas
fórmulas químicas são, respectivamente,
Dados: números atômicos (Z): C = 6, O = 8, Na = 11, Si = 14, C 17 e Ba = 56
a) BaC 2 , Na2SiO3 , CO2 e BaCO3 .
b) BaC, Na2SiO3 , CO2 e BaCO3 .
c) BaC 2 , Na2SiO, CO2 e Ba2CO3 .
d) BaC, Na2SiO, CO e Ba2CO3 .
e) BaC, Na2SiO3 , CO e Ba2CO3 .
TEXTO PARA A PRÓXIMA QUESTÃO:
Baseado no texto a seguir, responda a(s) questão(ões)
―... Por mais surpreendente que pareça, a desintegração do exército napoleônico pode
ser atribuída a algo tão pequeno quanto um botão — um botão de estanho, para sermos mais
exatos, do tipo que fechava todas as roupas no exército, dos sobretudos dos oficiais às calças
e paletós dos soldados de infantaria.
Quando a temperatura cai, o reluzente estanho metálico exposto ao oxigênio do ar
começa a se tornar friável e a se esboroar (desfazer) num pó acinzentado e não metálico —
continua sendo estanho, mas com forma estrutural diferente‖.
(Adaptado de Os Botões de Napoleão — Penny Le Couteur e Jay Burreson — p. 8).
21. O texto acima faz alusão a uma reação química, cujo produto é um pó acinzentado e não
metálico. A alternativa que apresenta corretamente o nome e fórmula química dessa
substância
a) cloreto de estanho de fórmula SnC 2 .
b) estanho metálico de fórmula Sno .
c) óxido de estanho VI de fórmula Sn2O3 .
d) peróxido de estanho de fórmula Sn3O2 .
e) óxido de estanho II de fórmula SnO.
22. Íons bário em solução aquosa são muito tóxicos para o ser humano, assim, todos os sais
solúveis de bário podem ser fatais se ingeridos, como o BaC 2 . Há, também, sais de bário
praticamente insolúveis em água, como o BaSO4 e o BaCO3 : o primeiro é utilizado como
contraste em determinados exames radiográficos e sua ingestão não causa problemas; já o
segundo, se ingerido, pode causar a morte.
a) Escreva a configuração eletrônica em camadas do íon bário.
b) Sabendo que o suco gástrico contém ácido clorídrico, explique por que o sal utilizado como
contraste pode ser ingerido sem causar danos, desde que puro, e por que o carbonato de
bário, mesmo sendo insolúvel em água, pode ser fatal se ingerido.
23. Dadas as distribuições da camada de valência de alguns elementos,
A 3s2 3p5
C 2s2 2p3
B 3s2
D 3s2 3p1
E 2s2 2p4
são feitas as seguintes afirmativas:
I. A ligação entre os elementos A e C forma uma substância com geometria trigonal plana.
II. Os elementos B e E formam um composto que apresenta caráter básico na presença de
água.
III. O composto resultante da ligação entre A e B conduz corrente elétrica em solução aquosa.
IV. Quando C se liga a E, forma uma substância que reage com ácido, produzindo sal e água.
V. Uma substância de fórmula química D2E3 pertence à função hidróxido.
São corretas as proposições
a) I e V.
b) I e II.
c) II e III.
d) III e IV.
e) IV e V.
24.
A decomposição térmica do calcário, CaCO3, produz CO2 e CaO, ou seja, nessa
transformação, um
a) sal produz um óxido ácido e um óxido básico.
b) sal produz dois óxidos ácidos.
c) sal produz dois óxidos básicos.
d) ácido produz dois óxidos ácidos.
e) ácido produz um óxido ácido e um óxido básico.
25. O hipoclorito de sódio é um sal utilizado frequentemente em soluções aquosas como
desinfetante e/ou agente alvejante. Esse sal pode ser preparado pela absorção do gás cloro
em solução de hidróxido de sódio mantida sob resfriamento, de modo a prevenir a formação de
clorato de sódio. As soluções comerciais de hipoclorito de sódio sempre contêm quantidade
significativa de cloreto de sódio, obtido como subproduto durante a formação do hipoclorito.
Assim, é correto afirmar que as fórmulas químicas do hipoclorito de sódio, clorato de sódio e
cloreto de sódio são, respectivamente,
a) NaCO, NaCO3 e NaC.
b) NaCO2 , NaCO4 e NaC.
c) NaCO, NaCO2 e NaC.
d) NaCO, NaCO4 e NaCO2.
e) NaCO2 , NaCO3 e NaC.
26.
Em junho de 2012 ocorreu na cidade do Rio de Janeiro a Conferência Rio+20. Os
principais focos de discussão dessa conferência diziam respeito à sustentabilidade do planeta
e à poluição da água e do ar. Em relação a esse último aspecto, sabemos que alguns gases
são importantes para a vida no planeta. A preocupação com esses gases é justificada, pois, de
um modo geral, pode-se afirmar que
a) o CH4 e o CO2 estão relacionados à radiação ultravioleta, o O 3, à chuva ácida e os NO x, ao
efeito estufa.
b) o CH4 está relacionado à radiação ultravioleta, o O 3 e o CO2, ao efeito estufa e os NOx, à
chuva ácida.
c) os NOx estão relacionados ao efeito estufa, o CH4 e o CO2, à radiação ultravioleta e o O3, à
chuva ácida.
d) o O3 está relacionado à radiação ultravioleta, o CH4 e o CO2, ao efeito estufa e os NOx, à
chuva ácida.
27. O mármore é um material empregado para revestimento de pisos e um de seus principais
constituintes é o carbonato de cálcio. Na limpeza desses pisos com solução ácida, ocorre
efervescência. Nessa efervescência o gás liberado é o
a) oxigênio.
b) hidrogênio.
c) cloro.
d) dióxido de carbono.
e) monóxido de carbono.
28. Assinale a alternativa CORRETA para o par de substâncias cujas soluções aquosas, ao
serem misturadas, produz um precipitado amarelo.
a) AC 3 e KOH
b) Ba NO3 2 e Na2SO4
c) Cu NO3 2 e NaCO4
d) Pb C2H3O2 2 e KI
e) AgNO3 e NH4OH
29. Considere os seguintes óxidos:
I. MgO
II. CO
III. CO2
IV. CrO3
V. Na2O
Os óxidos que, quando dissolvidos em água pura, reagem produzindo bases são
a) apenas II e III.
b) apenas I e V.
c) apenas III e IV.
d) apenas IV e V.
e) apenas I e II.
30. O uso dos combustíveis fósseis, gasolina e diesel, para fins veiculares resulta em emissão
de gases para a atmosfera, que geram os seguintes prejuízos ambientais: aquecimento global
e chuva ácida. Como resultado da combustão, detecta-se na atmosfera aumento da
concentração dos gases CO2 , NO2 e SO2 .
Sobre as moléculas desses gases, é correto afirmar que
a) CO2 é apolar e NO2 e SO2 são polares.
b) CO2 é polar e NO2 e SO2 são apolares.
c) CO2 e NO2 são apolares e SO2 é polar.
d) CO2 e NO2 são polares e SO2 é apolar.
e) CO2 e SO2 são apolares e NO2 é polar.
31.
O movimento revolucionário intensificado por Lavoisier, no século XVIII, provocou
alterações significativas no campo da química daquela época. A esse respeito, Simmons
(2003) afirma que ―Lavoisier chegou ao oxigênio em 1778, depois de mais de quatro anos de
experiência e com a ajuda dos trabalhos de Joseph Priestley, que havia reconhecido as
propriedades especiais do ‗ar deflogisticado‘, produzido pelo aquecimento contínuo de óxido de
mercúrio‖. Enquanto Priestley não abandonava a teoria do flogístico, Lavoisier conseguiu ―a
parte mais saudável e pura do ar‖, chamando-a de oxigênio. O contexto do trabalho de
Lavoisier colaborou para o entendimento das propriedades dos ácidos.
A partir da análise do texto, faça o que se pede.
a) Explique, por meio do equacionamento balanceado da decomposição do óxido de mercúrio
(HgO2) utilizado por Lavoisier, se o processo de obtenção do oxigênio é endotérmico ou
exotérmico.
b) Considerando a importância dos ácidos no trabalho de Lavoisier, apresente: o nome, a
fórmula molecular e a fórmula eletrônica de Lewis de um ácido que possua, em sua
estrutura, o elemento oxigênio.
c) Enumere duas propriedades químicas dos ácidos.
32.
Bicarbonato de sódio e carbonato de sódio são duas substâncias químicas muito
presentes no cotidiano. Entre várias aplicações, o bicarbonato de sódio é utilizado como
antiácido estomacal e fermento de pães e bolos, e o carbonato de sódio, conhecido como
barrilha ou soda, tem sua principal aplicação na fabricação de vidro comum.
As fórmulas químicas do bicarbonato de sódio e do carbonato de sódio estão corretas e
respectivamente representadas em
a) NaHCO3 e NaOH.
b) Na(CO3)2 e NaHCO3.
c) NaHCO3 e Na2CO3.
d) Na(HCO3)2 e NaOH.
e) Na2HCO3 e Na2CO3.
33. Observa-se que uma solução aquosa saturada de HC libera uma substância gasosa.
Uma estudante de química procurou representar, por meio de uma figura, os tipos de partículas
que predominam nas fases aquosa e gasosa desse sistema – sem representar as partículas de
água. A figura com a representação mais adequada seria
a)
b)
c)
d)
e)
34. A ferrugem é uma mistura de óxidos de ferro resultantes da corrosão desse metal. Outros
óxidos metálicos, entretanto, ao contrário dos presentes na ferrugem, formam uma camada
protetora sobre a superfície do metal. Um deles é o óxido formado pelo elemento químico do
grupo 13, pertencente ao terceiro período da Classificação Periódica dos Elementos.
Escreva a fórmula química desse óxido protetor e classifique-o quanto ao tipo de óxido.
35. Em uma aula prática-demonstrativa uma professora adicionou, em um recipiente, água e
gotas de fenolftaleína. Em seguida, acrescentou óxido de cálcio e a mistura, antes incolor, ficou
rosa. Logo depois, soprou a solução com auxílio de um tubo de vidro o que levou ao
desaparecimento da cor rosa e à formação de um precipitado branco.
Com relação ao experimento, é INCORRETO afirmar que a(o):
a) solução fica incolor apenas em meio neutro ou ácido.
b) gás carbônico soprado reage com o hidróxido de cálcio.
c) óxido de cálcio é um óxido molecular com caráter básico.
d) precipitado é o carbonato de cálcio formado na reação de neutralização.
36. O magma que sai dos vulcões durante as erupções é constituído por rochas fundidas e
vários tipos de gases e vapores, tais como CO , CO2 , SO2 , SO3 , HC e H2O . A respeito
dessas substâncias, são feitas as seguintes afirmações:
I. Quando dissolvidos em água, os gases CO2 , SO2 , SO3 e HC geram soluções eletrolíticas
cujo pH é menor que 7.
II. As moléculas de CO2 , SO2 e H2O apresentam geometria linear.
III. No estado sólido, as moléculas de CO2 encontram-se atraídas entre si por ligações de
hidrogênio muito intensas.
É correto o que se afirma em:
a) I, apenas.
b) II, apenas.
c) I e II, apenas.
d) II e III, apenas.
e) I, II e III.
37. Ácido muriático (ou ácido clorídrico comercial) é bastante utilizado na limpeza pesada de
pisos para remoção de resíduos de cimento, por exemplo. Sua aplicação em resíduos
contendo quantidades apreciáveis de CaCO3 resulta na liberação de um gás. Considerando a
ampla utilização desse ácido por profissionais da área de limpeza, torna-se importante
conhecer os produtos formados durante seu uso.
A fórmula do gás citado no texto e um teste que pode ser realizado para confirmar sua
presença são, respectivamente:
a) CO2 e borbulhá-lo em solução de KC
b) CO2 e borbulhá-lo em solução de HNO3
c) H2 e borbulhá-lo em solução de NaOH
d) H2 e borbulhá-lo em solução de H2SO4
e) CO2 e borbulhá-lo em solução de Ba(OH)2
38. Na agricultura, é comum a preparação do solo com a adição de produtos químicos, tais
como carbonato de cálcio (CaCO3) e nitrato de amônio (NH4NO3). A calagem, que é a correção
da acidez de solos ácidos com CaCO3, pode ser representada pela equação:
CaCO3 (s) 2 H (aq) Ca 2 (aq) H2O ( ) CO 2 (g)
a) Explique como se dá a disponibilidade de íons cálcio para o solo durante a calagem,
considerando solos ácidos e solos básicos. Justifique.
+
b) Qual o efeito da aplicação do nitrato de amônio na concentração de íons H do solo?
39. Com o aumento da demanda por alimentos e a abertura de novas fronteiras agrícolas no
Brasil, faz- se cada vez mais necessária a correção da acidez e a fertilização do solo para
determinados cultivos. No intuito de diminuir a acidez do solo de sua plantação (aumentar
o pH), um fazendeiro foi a uma loja especializada para comprar conhecidos insumos agrícolas,
indicados para essa correção. Ao chegar à loja, ele foi informado de que esses produtos
estavam em falta. Como só havia disponíveis alguns tipos de sais, o fazendeiro consultou um
engenheiro agrônomo procurando saber qual comprar.
O engenheiro, após verificar as propriedades desses sais, indicou ao fazendeiro o
a) KC
b) CaCO3
c) NH4C
d) Na2SO4
e) Ba(NO3 )2
40. Em uma bancada de laboratório, estão quatro balões volumétricos (frascos de vidro com
calibrações únicas) utilizados para o preparo de soluções de concentração conhecida,
rotulados com as seguintes fórmulas, conforme mostra a figura abaixo.
Em relação às substâncias contidas nos frascos, analise as afirmativas a seguir.
I. Os balões P e R indicam, respectivamente, as funções ácido e sal.
II. Os balões Q e S indicam, respectivamente, as funções ácido e sal.
III. Os balões P e Q correspondem, respectivamente, a ácido sulfúrico e ácido nitroso.
IV. Os balões R e S indicam, respectivamente, as funções base e sal.
V. Os balões R e S correspondem, respectivamente, a hidróxido de alumínio e permanganato
de potássio.
São corretas apenas as afirmativas
a) I e II.
b) II e III.
c) I, II e III.
d) II, III e IV.
e) II, IV e V.
41. Em 31 de julho de 2010, um acidente envolvendo um carro e uma carreta, carregada de
amônia, interditou a BR-381, próxima a Caeté, região metropolitana de Belo Horizonte. Com
relação a esse gás, afirma-se, corretamente, que
a) é solúvel em solventes apolares.
b) apresenta geometria trigonal plana.
c) forma o hidróxido de amônio ao reagir com a água.
d) é uma molécula apolar formada por ligações polares.
42. Dado: Os compostos iônicos de metais alcalinos são solúveis em água.
Um técnico de laboratório distraído preparou soluções de carbonato de potássio
K 2CO3 ,
hidróxido de sódio (NaOH) e de hidróxido de cálcio Ca OH , colocando-as em três frascos
2
não rotulados (frascos X, Y e Z).
Para identificar as soluções, um aluno misturou, em três tubos de ensaio distintos, amostras de
cada frasco com solução aquosa de ácido clorídrico. Nada foi observado nas soluções dos
frascos X e Y, mas ocorreu uma efervescência no tubo que continha a solução do frasco Y.
Em seguida, o aluno combinou, dois a dois, os conteúdos de cada frasco (frascos X, Y e Z) em
tubos de ensaio limpos. Observou que só houve formação de precipitado quando misturou as
soluções dos frascos X e Y.
Assinale a alternativa que identifica corretamente o conteúdo dos frascos X, Y e Z.
a) Frasco X - Ca OH ; Frasco Y – NaOH; Frasco Z - K 2CO3 .
2
b) Frasco X – NaOH; Frasco Y – Ca OH ; Frasco Z - K 2CO3 .
2
c) Frasco X – NaOH; Frasco Y – K 2CO3 ; Frasco Z - Ca OH .
2
d) Frasco X – Ca OH ; Frasco Y – K 2CO3 ; Frasco Z – NaOH.
2
e) Frasco X - K 2CO3 ; Frasco Y - Ca OH ; Frasco Z – NaOH.
2
43. A Química está intrinsecamente ligada ao desenvolvimento do homem, já que abarca
todas as transformações de matérias e teorias correspondentes. No Império Romano, usava-se
chumbo em utensílios de cozinha, encanamentos de água e recipientes para guardar bebidas
como o vinho. Esse elemento químico na sua forma metálica não é venenoso, tanto que muitas
pessoas conseguem viver anos com bala de chumbo alojada no corpo. Já outras, que aspiram
ou ingerem compostos de chumbo, podem até morrer de plumbismo.
Crianças, em especial as que moram em casas cujas paredes foram pintadas com tinta à base
de chumbo, correm o risco de, ao colocar farelos de tinta na boca, contrair plumbismo.
Um dos compostos do chumbo é o Pb3O4. Em relação a esse composto, pode-se afirmar que
a) o Pb3O4 é um óxido misto ou duplo.
b) o Pb3O4 é um óxido neutro.
c) o Pb3O4 reage com o HBr produzindo brometo de etila,Br2 e água.
d) no Pb3O4 o nox do chumbo é +4.
e) o Pb3O4 é um oxido anfótero e, em razão disso, só reage com as bases fortes.
44.
Lamentavelmente, vem ocorrendo, com frequência maior do que a desejável, o
tombamento de caminhões que transportam produtos químicos tanto em vias urbanas quanto
em rodovias. Nesses acidentes, geralmente há vazamento do produto transportado, o que
requer ações imediatas dos órgãos competentes para evitar que haja contaminação do ar, do
solo e de cursos de água.
Assim, a imediata utilização de cal (CaO) ou de calcário CaCO3 em quantidades adequadas
é recomendada quando o produto transportado pelo caminhão que sofreu o acidente for
a) amônia, NH3 .
b) ácido clorídrico, HCℓ.
c) etanol, C2H5OH .
d) oxigênio, O 2 .
e) hidrogênio, H2 .
45.
Para identificar quatro soluções aquosas, A, B, C e D, que podem ser soluções de
hidróxido de sódio, sulfato de potássio, ácido sulfúrico e cloreto de bário, não necessariamente
nessa ordem, foram efetuados três ensaios, descritos a seguir, com as respectivas
observações.
I. A adição de algumas gotas de fenolftaleína a amostras de cada solução fez com que apenas
a amostra de B se tornasse rosada.
II. A solução rosada, obtida no ensaio I, tornou-se incolor pela adição de amostra de A.
III. Amostras de A e C produziram precipitados brancos quando misturadas, em separado, com
amostras de D.
Com base nessas observações e sabendo que sulfatos de metais alcalino-terrosos são pouco
solúveis em água, pode-se concluir que A, B, C e D são, respectivamente, soluções aquosas
de
a) H2SO4, NaOH, BaCℓ2 e K2SO4.
b) BaCℓ2, NaOH, K2SO4 e H2SO4.
c) NaOH, H2SO4, K2SO4 e BaCℓ2.
d) K2SO4, H2SO4, BaCℓ2 e NaOH.
e) H2SO4, NaOH, K2SO4 e BaCℓ2.
46. Uma carreta carregada com ácido sulfúrico tombou no município de Fortaleza de Minas,
em 12 de outubro de 2010, derramando parte da carga. Sobre essa substância, é incorreto
afirmar que
a) é neutralizado com adição de cal virgem.
b) é utilizado para diminuir a acidez dos solos.
c) forma solução incolor na presença de fenolftaleína.
d) está presente nas soluções usadas em baterias automotivas.
47. Um teste simples para detectar a presença de gás oxigênio dissolvido na água envolve a
2+
2+
adição de Mn em meio básico, seguida pela adição de I em meio ácido. Sabe-se que o Mn
4+
reage com o oxigênio dissolvido na água, formando o Mn que é reduzido, posteriormente,
2+
pelo I , originando Mn e I2. Em meio aquoso, as espécies adicionadas ou formadas
2+
4+
apresentam as seguintes cores: incolor (I ), rosa claro (Mn ), preto (Mn ) e marrom escuro (I2).
Se a amostra de água analisada apresenta oxigênio dissolvido, a cor final do teste será
a) incolor, devido ao I .
2+
b) rosa claro, devido ao Mn .
4+
c) escura, devido ao Mn .
d) escura, devido ao I2.
48. Em relação às Ligações e Funções Químicas, assinale a opção incorreta.
a) Ligações iônicas resultam da atração entre íons de cargas elétricas contrárias.
b) Os gases nobres não formam substâncias compostas porque todas as suas camadas
eletrônicas
estão completas.
c) Nas ligas metálicas, os elétrons fluem ao longo de um conjunto formado pelos núcleos dos
átomos
presentes.
d) A valência de uma espécie está associada à sua capacidade de perder ou ganhar certa
quantidade
de elétrons.
e) Todos os sais são substâncias de caráter iônico.
49. Nas condições ambientes, assinale a opção que contém apenas óxidos neutros.
a) NO2, CO e Aℓ2O3
b) N2O, NO e CO
c) N2O, NO e NO2
d) SiO2, CO2 e Aℓ2O3
e) SiO2, CO2 e CO
50. O quadro a seguir relaciona algumas substâncias químicas e sua(s) aplicação(ões) ou
característica(s) frequentes no cotidiano.
Ordem
I
II
III
IV
Substâncias
Hipoclorito de sódio
Ácido nítrico
Hidróxido de amônio
Óxido de cálcio
Aplicação(ões)/Característica(s)
Alvejante, agente antisséptico
Indústria de explosivos
Produção de fertilizantes e produtos de limpeza
Controle de acidez do solo e caiação
As fórmulas químicas das substâncias citadas nesse quadro são, na ordem, respectivamente:
a) I. NaCO ; II. HNO3 ; III. NH4OH ; IV. CaO .
b) I. NaCO4 ; II. HNO3 ; III. NH3OH ; IV. CaO .
c) I. NaCO ; II. HNO3 ; III. NH3OH ; IV. CaO .
d) I. NaCO ; II. HNO2 ; III. NH4OH ; IV. CaO2 .
e) I. NaCO4 ; II. HNO2 ; III. NH3OH ; IV. CaO2 .
51. A chuva ácida é um tipo de poluição causada por contaminantes gerados em processos
industriais que, na atmosfera, reagem com o vapor d‘água.
Dentre os contaminantes produzidos em uma região industrial, coletaram-se os óxidos SO3,
CO,
Na2O e MgO.
Nessa região, a chuva ácida pode ser acarretada pelo seguinte óxido:
a) SO3
b) CO
c) Na2O
d) MgO
52.
O óxido nítrico, NO, é um poluente nocivo que sai dos canos de escapamento de
automóveis e caminhões. Na presença de água, o óxido nítrico forma, na atmosfera, ácidos
responsáveis pelo fenômeno da chuva ácida. As equações a seguir mostram as reações.
4NO g 3O2 2H2O 4HNO3 aq
4NO g O2 2H2O 4HNO2 aq
Levando-se em conta as propriedades dos ácidos formados e os efeitos produzidos por eles no
meio ambiente, é incorreto afirmar que
a) a água da chuva tem seu pH diminuído na presença desses ácidos.
b) os dois ácidos produzidos apresentam a mesma força de acidez.
c) o ácido nitroso pode corroer estruturas contendo sais de carbonato.
d) o ácido nítrico é um ácido forte e pode danificar estruturas metálicas.
53. O fluxograma a seguir representa um processo para a produção de magnésio metálico a
2+
partir dos íons Mg dissolvidos na água do mar.
a) Preencha a tabela da página a seguir com as fórmulas químicas das substâncias que foram
representadas, no fluxograma, pelas letras A, B, C e D.
Substância
Fórmula
Química
A
B
C
D
b) Escreva as duas semirreações que representam a eletrólise ígnea do MgCl 2, identificando
qual é a de oxidação e qual é a de redução.
c) Escreva a equação química que representa um método, economicamente viável, de produzir
a substância A.
54. O prefeito de uma determinada cidade consultou a população, que tem forte
consciência ecológica e pratica princípios de sustentabilidade, para autorizar a instalação de
uma nova indústria na região.
Para tanto, a comunidade pesquisou e decidiu que, tendo em vista o fato de a cidade
ficar em uma região chuvosa, é importante, para evitar problemas decorrentes da chuva ácida,
que a indústria a ser instalada tenha um rígido controle nas suas emissões de gás
a) N2
b) O2
c) CO2
d) SO2
e) H2
55. Numa aula prática de Química, um aluno colocou em um tubo de ensaio um pouco de
água, 2 gotas de fenolftaleína e uma pequena porção de cinza de cigarro, rica em óxido de
potássio e constatou que a mistura ficou rosa. Tal fato aconteceu, porque o óxido de potássio é
.................... e reage com a água originando um(a) .................... .
As palavras que completam corretamente as lacunas são
a) ácido e sal.
b) básico e sal.
c) neutro e ácido.
d) básico e base.
56. Uma estudante de química realizou quatro experimentos, que consistiram em misturar
soluções aquosas de sais inorgânicos e observar os resultados. As observações foram
anotadas em uma tabela:
Experimento
1
2
3
4
Solutos contidos
inicialmente nas soluções
que foram misturadas
Ba(CℓO3)2
Mg(IO3)2
Mg(IO3)2
Pb(CℓO3)2
MgCrO4
Pb(CℓO3)2
MgCrO4
Ca(CℓO3)2
Observações
formação de precipitado branco
formação de precipitado branco
formação de precipitado amarelo
nenhuma transformação observada
A partir desses experimentos, conclui-se que são pouco solúveis em água somente os
compostos
a) Ba(IO3)2 e Mg(CℓO3)2.
b) PbCrO4 e Mg(CℓO3)2.
c) Pb(IO3)2 e CaCrO4.
d) Ba(IO3)2, Pb(IO3)2 e PbCrO4.
e) Pb(IO3)2, PbCrO4 e CaCrO4.
57. Proponha um método de obtenção de sulfato de cobre anidro a partir de uma reação de
neutralização. Expresse as etapas para a sua obtenção por meio de equações químicas,
indicando as condições necessárias para que cada etapa seja realizada.
58. As figuras a seguir representam, de maneira simplificada, as soluções aquosas de três
ácidos, HA, HB e HC, de mesmas concentrações. As moléculas de água não estão
representadas.
Considerando essas representações, foram feitas as seguintes afirmações sobre os ácidos:
I. HB é um ácido mais forte do que HA e HC.
II. Uma solução aquosa de HA deve apresentar maior condutibilidade elétrica do que uma
solução aquosa de mesma concentração de HC.
III. Uma solução aquosa de HC deve apresentar pH maior do que uma solução aquosa de
mesma concentração de HB.
Está correto o que se afirma em
a) I, apenas.
b) I e II, apenas.
c) II e III, apenas.
d) I e III, apenas.
e) I, II e III.
59. Monóxido de Carbono – perigo à vista
O monóxido de carbono é um gás incolor e inodoro presente na queima de combustíveis,
fumaça de cigarros etc. Quando inalado, compete com o gás oxigênio ao combinar-se com a
hemoglobina do sangue muito mais facilmente que esse. Assim, as células do corpo vão
receber quantidade de oxigênio bem menor do que o necessário, pois a hemoglobina
disponível para o transporte de oxigênio diminui, causando danos à saúde, podendo, até
mesmo, levar à morte. Em recintos fechados, onde o fumo é liberado, tanto fumantes quanto
não fumantes sofrem a ação desse gás no organismo. Considere que um fumante, em um
recinto fechado, tenha ficado exposto das 22h às 6h do dia seguinte, a 450 ppm de monóxido
de carbono proveniente da fumaça de cigarros.
(ppm – partes do monóxido por milhão de partes de ar)
Quantidade de CO necessária para
desativar a hemoglobina (ppm)
Tempo de
exposição: 1h
Tempo de
exposição: 8h
Porcentagem
de hemoglobina
desativada
Efeitos na saúde
55 – 80
15 – 18
3%
Diminuição
da
cardíaca, alteração
sanguíneo
atividade
no fluxo
110 – 170
30 – 45
6%
Problemas de visão, diminuição
da capacidade de trabalho
280 – 575
75 – 155
10 a 20 %
Pequenas dores de cabeça,
problemas psicomotores
575 – 860
155 – 235
20 a 30 %
Dores de cabeça intensas e
náuseas
860 – 1155
235 – 310
30 a 40 %
Náuseas, vômitos e diminuição
da visão
1430 – 1710
390 – 470
40 a 60 %
Convulsão, coma
1710 – 2000
470 – 550
60 a 70%
Coma, diminuição da atividade
cardíaca e respiratória
2000 – 2280
550 – 630
70 a 80%
Morte
Consultando a tabela acima, percebe-se que o efeito desse gás nessa pessoa será
a) a diminuição da atividade cardíaca.
b) pequena dor de cabeça.
c) convulsão.
d) dor de cabeça intensa e náuseas.
e) a morte.
60.
O processo de industrialização tem gerado sérios problemas de ordem ambiental,
econômica e social, entre os quais se pode citar a chuva ácida. Os ácidos usualmente
presentes em maiores proporções na água da chuva são o H 2CO3, formado pela reação do
CO2 atmosférico com a água, o HNO3, o HNO2, o H2SO4 e o H2SO3. Esses quatro últimos são
formados principalmente a partir da reação da água com os óxidos de nitrogênio e de enxofre
gerados pela queima de combustíveis fósseis.
A formação de chuva mais ou menos ácida depende não só da concentração do ácido
formado, como também do tipo de ácido. Essa pode ser uma informação útil na elaboração de
estratégias para minimizar esse problema ambiental. Se consideradas concentrações idênticas,
quais dos ácidos citados no texto conferem maior acidez às águas das chuvas?
a) HNO3 e HNO2.
b) H2SO4 e H2SO3.
c) H2SO3 e HNO2.
d) H2SO4 e HNO3.
e) H2CO3 e H2SO3.
Gabarito:
Resposta da questão 1:
[Resposta do ponto de vista da disciplina de Biologia]
b) Melhoramento das emissões dos gases geradores da chuva ácida emitidos pelas chaminés
das indústrias e usinas termoelétricas.
[Resposta do ponto de vista da disciplina de Química]
a) Em A se destacam: CO2 , SO3 e NO2 .
Os óxidos que geram ácidos (chuva ácida):
SO3 H2O H2 SO 4
2NO2 H2O HNO2 HNO3
Preenchendo o quadro fornecido no enunciado, teremos:
A
B
SO3 e NO2
H2SO4 e HNO3
b) O rodízio municipal de veículos, que visa diminuir a emissão de poluentes emitidos pelos
motores, e a inspeção veicular anual, que colabora no controle de regulagem dos motores a
combustão interna.
Resposta da questão 2:
[B]
A produção de dióxido de carbono (CO2 ), durante a fermentação alcoólica realizada por microorganismos do gênero Saccharomyces, resulta no crescimento da massa do pão.
Resposta da questão 3:
[A]
[Resposta do ponto de vista da disciplina de Geografia]
Como mencionado corretamente na alternativa [A], o texto faz referencia literal ao sal como
cloreto de sódio resultante da reação entre ácido clorídrico e hidróxido de sódio. Estão
incorretas as alternativas: [B], porque pode também ser encontrado no oceano; [C], porque a
reação entre um ácido e uma base é o processo de formação do sal e não sua fonte; [D],
porque as salinas não estão em todos os estados do Brasil; [E], porque a reação química
ocorre entre um ácido e uma base.
[Resposta do ponto de vista da disciplina de Química]
O cloreto de sódio pode ser obtido a partir da reação entre ácido clorídrico e hidróxido de sódio.
HC
NaOH
H2O NaC
ácido
clorídrico
hidróxido
de sódio
Resposta da questão 4:
[D]
cloreto
de
sódio
O dióxido de enxofre (SO2 ) é um dos diversos gases tóxicos poluentes, liberados no ambiente
por fornos de usinas e de indústrias. Uma das maneiras de reduzir a emissão deste gás tóxico
é a injeção de carbonato de cálcio (CaCO3 ) no interior dos fornos industriais. O carbonato de
cálcio injetado nos fornos das usinas se decompõe formando óxido de cálcio (CaO) e dióxido
de carbono (CO2 ). O óxido de cálcio, então, reage com o dióxido de enxofre para formar o
sulfito de cálcio (CaSO3 ) no estado sólido, menos poluente.
Resposta da questão 5:
[A]
A reação de combustão completa dos hidrocarbonetos formam dióxido de carbono (CO 2) um
óxido ácido e água, conforme a reação:
CxHy O2 CO2 H2O
Resposta da questão 6:
[A]
[I] O ácido clorídrico (HC ) está presente no suco gástrico;
[II] O dióxido de enxofre (SO2 ) é um óxido de caráter ácido, que ao reagir com a água forma o
ácido sulfúrico (H2SO4 ).
[III] O hidróxido de potássio (KOH) é uma base, utilizada para fabricar sabão;
[IV] O óxido de cálcio (CaO) é um óxido básico, usado para corrigir a acidez do solo.
[V] O cloreto de sódio (NaC ) é um sal neutro usado como tempero na culinária.
[VI] O ácido sulfúrico (H2SO4 ) é um ácido presente em baterias de automóvel.
Resposta da questão 7:
[C]
Caso todo gás produzido na exploração do pré-sal seja lançado na atmosfera, poderá acarretar
aumento da temperatura nos mares, devido à elevação da concentração e do grau de agitação
das moléculas de CO2 , ocasionando o desvio de curso de correntes marítimas e, até mesmo,
a extinção de animais marinhos.
Resposta da questão 8:
[C]
Ácido sulfúrico: H2SO4 .
Sulfato de cálcio: CaSO4 .
Dióxido de carbono: CO2 .
Água: H2O.
Resposta da questão 9:
[E]
A acidez aumenta com a elevação do número de oxidação do cromo:
Cr O
Cr Cr O O O
2 2 3 3 2 2 2
CrO Cr2O3 CrO3
2
3
Cr O O O
6 222
6
elevação do Nox
Conclusão :
CrO : caráter básico
Cr2O3 : caráter anfótero
CrO3 : caráter ácido
Resposta da questão 10:
[B]
O ácido sulfúrico em água sofre ionização, em duas etapas:
H2SO4 H HSO4
HSO4 H SO42
Como ocorre a liberação de H irá acidificar o meio.
Resposta da questão 11:
[D]
O NaHCO3 é o único entre as alternativas que ao reagir com ácido, formará um sal, água e
gás carbônico, o que combateria a sensação de azia.
NaHCO3 (s) HC(aq) NaC(s) H2O() CO2 (g)
Resposta da questão 12:
[C]
HNO3(aq) NH4OH(aq) NH4NO3(aq) H2O( )
[A] Incorreta. O nitrato de amônio, formado na reação é solúvel (todos os nitratos são solúveis
em água);
[B] Incorreta. Como o sal formado é derivado de um ácido forte e uma base fraca, o sal
formado, possui caráter ácido;
[C] Correta.
NH4
x 1(4) 1
x 3
NO3
x 6 1
x 5
[D] Incorreta. O ácido nítrico é um ácido volátil, formado por ligações covalentes, portanto,
possui temperatura de ebulição menor que o nitrato de amônio, que é um composto iônico.
[E] Incorreta. O sólido formado é resultado da reação entre o NH4OH e o HNO3 .
Resposta da questão 13:
[B]
[A] Incorreta. A sedimentação é um processo físico de separação de misturas.
[B] Correta. Pois são utilizadas para corrigir a acidez do solo, apresentam, portanto, caráter
alcalino.
[C] Incorreta. Por apresentar propriedades alcalinas, não pode ser usada em qualquer tipo de
solo, somente aqueles que são ácidos.
[D] Incorreta. A celulose é um polissacarídeo, que possui baixo teor de toxicidade.
Resposta da questão 14:
[D]
Pela tabela dada, o repolho roxo torna-se verde ao ser colocado em contato com a cal virgem,
ou seja, um composto básico. Dentre os listados, apenas o hidróxido de cálcio apresentará
essa característica.
Resposta da questão 15:
[B]
São óxidos básicos (possuem metais das famílias IA e IIA) e reagem com água produzindo
bases, as seguintes substâncias: CaO, Na2O, K 2O.
Resposta da questão 16:
[C]
O anidrido sulfuroso (SO2 ) é o dióxido de enxofre derivado do ácido sulfuroso pela saída de
água: H2SO3 H2O SO2 . Ao reagir com água forma o ácido sulfuroso, ou seja:
H2O SO2 H2SO3 .
Resposta da questão 17:
[E]
O carbonato de sódio, Na2CO3, é classificado como sal, sal comum ou sal normal.
Resposta da questão 18:
[B]
O frasco 2 é o único que apresenta pH igual ou maior do que 8,5 (rosa), logo contém uma base
forte (NaOH).
No frasco 4 não ocorre condução de eletricidade, conclui-se que a solução é formada por
moléculas, ou seja, sacarose.
No frasco 3 ocorre reação com Mg(OH)2 , conclui-se que apresenta um ácido, ou seja, HC .
No frasco 1 ocorre condução de eletricidade, não ocorre reação com hidróxido de magnésio e a
hidrólise é neutra, ou seja, a solução é de cloreto de potássio (KC).
Frasco
1 (KC)
2 (NaOH)
3 (HC )
4 (sacarose)
Cor da solução
após a
adição de
fenolftaleína
incolor
rosa
incolor
incolor
Condutibilidade
elétrica
Reação
com
Mg(OH)2
conduz
conduz
conduz
não conduz
não
não
sim
não
Resposta da questão 19:
[D]
Os compostos [III] e [IV] formam soluções alcalinas:
NH4 OH NH4(aq)
OH(aq)
BaO H2O Ba(OH)2
Resposta da questão 20:
[A]
Teremos:
Cloreto de bário: BaC 2 .
Silicato de sódio: Na2SiO3 .
Dióxido de carbono: CO2 .
Carbonato de bário: BaCO3 .
Resposta da questão 21:
[E]
―Quando a temperatura cai, o reluzente estanho metálico exposto ao oxigênio do ar começa a
se tornar friável e a se esboroar (desfazer) num pó acinzentado e não metálico – continua
sendo estanho, mas com forma estrutural diferente‖.
De acordo com o texto conclui-se que ocorre uma reação química com o oxigênio presente no
ar:
Snx O2 Sn2 O2 SnO (óxido de es tanho II).
Resposta da questão 22:
a) Teremos:
56 Ba
56 Ba
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2
2
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
K 1s2 2
L 2s2 2p6 8
M 3s2 3p6 3d10 18
N 4s2 4p6 4d10 18
O 5s2 5p6 8
b) O carbonato de bário (BaCO3 ) reage com o ácido clorídrico (HC ) presente no suco
gástrico e é rapidamente dissolvido.
BaCO3 (aq) HC(aq) H2O() CO2 (g) BaC 2 (aq)
2
BaC 2 (aq) Ba
(aq)
2C (aq)
íons tóxicos
2+
Consequentemente, os cátions bário (Ba ), que são tóxicos ao corpo humano, chegam ao
sangue.
O sulfato de bário (BaSO4 ) é, praticamente, insolúvel no suco gástrico e não ataca o sistema
digestivo, logo os cátions bário (Ba2 ), que são tóxicos ao corpo humano, não chegam ao
sangue.
Resposta da questão 23:
[C]
Análise das afirmativas:
[I] Falsa. A ligação entre os elementos A e C forma uma substância com geometria piramidal.
A 3s2 3p5 (família 7A)
Geometria piramidal:
C 2s2 2p3 (família 5A)
[II] Verdadeira. Os elementos B e E formam um composto que apresenta caráter básico na
presença de água.
B 3s2 (família 2A)
E 2s2 2p4 (família 6A; oxigênio)
Ocorre a formação de um óxido básico (família 2A).
[III] Verdadeira. O composto resultante da ligação entre A e B conduz corrente elétrica em
solução aquosa.
A 3s2 3p5 (família 7A)
B 3s2 (família 2A)
Ocorre a formação de um composto iônico (BA2), que conduz corrente elétrica em solução
aquosa.
[IV] Falsa. Quando C se liga a E, ocorre a formação de um óxido ácido que reage com base,
produzindo sal e água.
C 2s2 2p3 (família 5A)
E 2s2 2p4 (família 6A; oxigênio)
[V] Falsa. Uma substância de fórmula química D2E3 pertence à função óxido.
D 3s2 3p1 (família 3A)
D2O3 (óxido).
E 2s2 2p4 (família 6A; oxigênio)
Resposta da questão 24:
[A]
CaCO3 é um sal.
CO2 é um óxido de caráter ácido, pois em água reage originando um ácido (H 2CO3).
CaO é um óxido básico, pois, em água, reage originando uma base (Ca(OH)2).
Resposta da questão 25:
[A]
Hipoclorito de sódio: NaCO.
Clorato de sódio: NaCO3 .
Cloreto de sódio: NaC.
Resposta da questão 26:
[D]
O gás ozônio (O3 ) contribui na retenção da radiação ultravioleta que penetra na atmosfera do
Planeta Terra.
O metano (CH4 ) e o gás carbônico (CO2 ) contribuem para o efeito estufa, ou seja, para a
reflexão de radiações solares na atmosfera.
Os óxidos de nitrogênio (NOx ) , formados principalmente pela reação do gás nitrogênio e do
gás oxigênio no interior dos motores a combustão interna, podem reagir com a água formando
a chuva ácida.
Resposta da questão 27:
[D]
Teremos a seguinte reação:
CaCO3 (s) 2H (aq) H2O( )
CO2 (g)
Ca2 (aq)
efervescência
(dióxido de carbono)
Resposta da questão 28:
[D]
O precipitado amarelo citado no texto do enunciado é o PbI2 .
Pb C2H3O2 2 KI
PbI2 2K 2C2H3O2
precipitado
amarelo
Resposta da questão 29:
[B]
Teremos:
I. MgO + H2O Mg(OH)2 (base)
II. CO+ H2O não ocorre
III. CO2 + H2O H2CO3
(ácido)
IV. CrO3 + H2O H2CrO4 (ácido)
V. Na2O + H2O 2NaOH (base)
Resposta da questão 30:
[A]
Teremos:
1.
Resposta da questão 31:
A equação citada no texto é a seguinte: 2HgO(s) calor 2Hg() O2 (g).
O texto também relata a necessidade de aquecimento para a ocorrência do processo,
sugerindo o caráter endotérmico da reação.
2.
Ácido Sulfúrico. H2SO4
+
Os ácidos são substâncias que, em água, sofrem ionização, liberando cátions H . Em função
dessa ionização, são substâncias que apresentam condutividade elétrica em água e por isso
são chamados de eletrólitos. Podem reagir com bases produzindo sais na chamada
neutralização. È também uma característica típica dos ácidos a capacidade de reagirem com
certos metais provocando sua corrosão. Esta reação é uma óxido-redução, também chamada
de deslocamento.
Resposta da questão 32:
[C]
Fórmulas:
Ânion bicarbonato: HCO3 .
Cátion sódio: Na .
Ânion carbonato: CO32 .
Então,
Bicarbonato de sódio: [Na+ ][HCO3- ]; NaHCO3 .
Carbonato de sódio: [Na+ ]2 [CO32- ]; Na2CO3 .
Resposta da questão 33:
[C]
Na fase gasosa predominam as moléculas de HC e na fase líquida, como o HC sofre
+
ionização ( HC H C ) predominam os íons H e C .
Resposta da questão 34:
O elemento químico do grupo 13, pertencente ao terceiro período da Classificação Periódica
dos Elementos, é o alumínio: [A3 ]2 [O2 ]3 A 2O3 (Óxido anfótero).
Resposta da questão 35:
[C]
CaO H2O Ca(OH)2
Ca(OH)2 CO2 CaCO3 H2O
Óxidos básicos são formados por oxigênio e um metal da família dos metais alcalinos (IA) ou
metais alcalinos terrosos (IIA). O tipo de ligação é iônica. Portanto, o óxido de cálcio é um óxido
iônico com caráter básico.
Resposta da questão 36:
[A]
Quando dissolvidos em água, os gases CO2 , SO2 , SO3 e HC geram soluções eletrolíticas
cujo pH é menor que 7, pois CO2 , SO2 , SO3 são óxidos ácidos (reagem com água formando
ácidos) e HC é um ácido forte.
Resposta da questão 37:
[E]
A aplicação do ácido muriático em resíduos contendo quantidades apreciáveis de CaCO 3
resulta na liberação de gás carbônico:
2HC(aq) CaCO3 (s) H2O() CO2 (g) CaC 2 (aq)
O teste deve ser feito com uma base que produza um sal insolúvel:
CO2 (g) Ba(OH)2 (aq) BaCO3 H2O( )
Resposta da questão 38:
a) De acordo com o equilíbrio fornecido:
CaCO3 (s) 2 H (aq) Ca2 (aq) H2O () CO2 (g)
Em solos ácidos (presença do cátion H ) o equilíbrio acima é deslocado para a direita e
consequentemente a disponibilidade de cátions cálcio (Ca2 ) aumenta.
Em solos básicos ocorre a diminuição do cátion H o equilíbrio acima é deslocado para a
esquerda e consequentemente a disponibilidade de cátions cálcio (Ca2 ) diminui.
b) A aplicação do nitrato de amônio implica na seguinte reação de hidrólise:
NH4NO3 NH4 NO3
NH4 NO3 H2O H NO3 NH4OH
NH4 NO3 H2O H NO3 NH3 H2O
NH4 H NH3
O meio fica ácido, consequentemente a concentração de íons H aumenta.
Resposta da questão 39:
[B]
Para diminuir a acidez o sal deve deixar o meio básico:
CaCO3 2 H2O Ca2 2OH H2O CO2
CaCO3 H2O Ca2 2OH
CO2
meio
básico
Resposta da questão 40:
[E]
Teremos:
Resposta da questão 41:
[C]
Teremos:
NH3(g) H2O() NH4OH(aq)
Resposta da questão 42:
[D]
A solução do frasco Y (K 2CO3 ) reage com HC. A efervescência observada decorre da
liberação de gás carbônico (CO2 ): K2CO3 (aq) 2HC(aq) CO2 (g) H2O() 2KC(aq).
A solução do frasco X (Ca(OH)2 ) reage com a solução do frasco Y (K 2CO3 ). A formação de
precipitado se deve à formação de carbonato de cálcio (CaCO3 ):
Ca(OH)2 (aq) K 2CO3 (aq) CaCO3 (s) 2KOH(aq)
precipitado
A solução do frasco Z é de hidróxido de sódio (NaOH).
Resposta da questão 43:
[A]
O Pb3O4 é um óxido misto ou duplo (o Nox do chumbo varia): PbO2.2PbO .
Resposta da questão 44:
[B]
A imediata utilização de cal (CaO) ou de calcário CaCO3 em quantidades adequadas é
recomendada quando o produto transportado pelo caminhão que sofreu o acidente tiver caráter
ácido:
2HC CaO CaC 2 H2O
ou
2HC CaCO3 CaC 2 H2O CO2
Resposta da questão 45:
[E]
I. A adição de algumas gotas de fenolftaleína a amostras de cada solução fez com que apenas
a amostra de B (NaOH; base forte) se tornasse rosada.
II. A solução rosada (básica), obtida no ensaio I, tornou-se incolor pela adição de amostra de A
(H2SO4 - solução ácida); temos uma neutralização.
III. Amostras de A e C produziram precipitados brancos quando misturadas, em separado, com
amostras de D.
H2SO4(aq) (A) + BaCℓ2 (D) BaSO4 + 2HCℓ(aq)
K2SO4(aq) (C) + BaCℓ2 (D) BaSO4 + 2KCℓ(aq)
Resposta da questão 46:
[B]
Compostos básicos são utilizados para diminuir a acidez dos solos.
Resposta da questão 47:
[D]
Mn (rosa claro) + O2(aq) Mn (preto) + O
4+
2+
Mn (preto) + 2I (incolor) Mn (rosa claro) + I2 (marrom escuro)
2+
4+
2-
Na presença de oxigênio, a cor final do teste será escura devido à presença do I2, que
predominará sobre o rosa claro.
Resposta da questão 48:
[B]
Os gases nobres são estáveis nas condições padrão. As camadas não precisam estar
completas.
Resposta da questão 49:
[B]
Óxidos neutros são formados por ametais e na temperatura ambiente são gasosos. Os mais
comuns são o monóxido de carbono (CO), óxido nítrico (NO) e o óxido nitroso (N 2O).
Eles não reagem com água, nem com ácidos, nem com bases. Mas podem participar de outras
reações.
Resposta da questão 50:
[A]
Teremos:
Ordem
I
II
Substâncias
Hipoclorito de sódio
Ácido nítrico
Fórmula química
NaCO
HNO3
III
IV
Hidróxido de amônio
Óxido de cálcio
NH4OH
CaO
Resposta da questão 51:
[A]
Teremos:
SO3(g) + H2O(l) H2SO4(aq)
Resposta da questão 52:
[B]
[A] Correta. A presença dos ácidos nítrico e nitroso abaixam o pH da chuva, deixando ácida.
[B] Incorreta. O HNO3 , pela regra (nº de O – nº de H), 3 1 2, mais forte que o HNO2 ,
2 1 1.
[C] Correta.
HNO2 CO32 H2CO3 NO2
[D] Correta. Por ser um ácido forte ele ataca (reage) com o ferro, que compõe as estruturas
metálicas. Conforme a reação: HNO3(aq) Fe(s) Fe(NO3 )2(aq) H2(g)
Resposta da questão 53:
a) No fluxograma:
Teremos:
A + H2O Ca(OH)2
A = CaO, então:
CaO + H2O Ca(OH)2
Mg (aq) + Ca(OH)2 Ca (aq) + B (precipitado)
B = Mg(OH)2, então:
2+
2+
Mg (aq) + Ca(OH)2 Ca (aq) + Mg(OH)2
2+
2+
B + D água + MgCl2
B = Mg(OH)2 e D = HCl, então:
Mg(OH)2 + 2HCl 2H2O + MgCl2
MgCl2
C = Cl2, então:
Mg(s) + C + subprodutos
MgCl2
Mg(s) + Cl2 + subprodutos
H2 + C D
C = Cl2 e D = HCl
H2 + Cl2 2HCl
A tabela será preenchida da seguinte maneira:
Substância
A
B
C
Fórmula
CaO
Mg (OH)2
CI2
química
b) Eletrólise ígnea do MgCl2(s):
(+) 2Cl (l) 2e + Cl2(g) (oxidação/ânodo)
2+
(–) Mg (l) + 2e Mg(s) (redução/cátodo)
D
HCI
c) Um método economicamente viável para produzir a substância A é a calcinação do CaCO3:
CaCO3(s)
CaO(s) + CO2(g)
Resposta da questão 54:
[D]
O SO2 (dióxido de enxofre) é um óxido ácido, logo: SO 2(g) + H2O(ℓ) H2SO4(aq).
Resposta da questão 55:
[D]
Teremos:
K2O + H2O 2KOH
Resposta da questão 56:
[D]
Experimento
1
2
3
4
Solutos contidos
inicialmente nas soluções
que foram misturadas
Ba(CℓO3)2
Mg(IO3)2
Mg(IO3)2
Pb(CℓO3)2
MgCrO4
Pb(CℓO3)2
MgCrO4
Ca(CℓO3)2
Observações
formação de precipitado branco
formação de precipitado branco
formação de precipitado amarelo
nenhuma transformação observada
Equacionando os experimentos fornecidos na tabela, teremos:
1) Ba(ClO3)2 + Mg(IO3)2 Mg(ClO3)2 + Ba(IO3)2
2) Mg(IO3)2 + Pb(ClO3)2 Pb(IO3)2 + Mg(ClO3)2
3) MgCrO4 + Pb(ClO3)2 PbCrO4 + Mg(ClO3)2
4) MgCrO4 + Ca(ClO3)2 CaCrO4 + Mg(ClO3)2
Como a tabela nos informa que na reação 4 não ocorre a formação de um precipitado,
concluímos que o sal Mg(ClO3)2 é solúvel em água e assim:
1) Ba(ClO3)2 + Mg(IO3)2 Mg(ClO3)2 + Ba(IO3)2
Solúvel
Branco
2) Mg(IO3)2 + Pb(ClO3)2 Pb(IO3)2 + Mg(ClO3)2
Branco
Solúvel
3) MgCrO4 + Pb(ClO3)2 PbCrO4 + Mg(ClO3)2
Amarelo Solúvel
4) MgCrO4 + Ca(ClO3)2 CaCrO4 + Mg(ClO3)2
Solúvel Solúvel
A partir desses experimentos, conclui-se que são pouco solúveis em água somente os
compostos Ba(IO3)2, Pb(IO3)2 e PbCrO4.
Resposta da questão 57:
Sulfato de cobre pentahidratado (CuSO4.5H2O) são cristais de cor azul, obtidos pela
cristalização da solução resultante da ação de ácido sulfúrico quente e concentrado sobre
cobre, ou pela ação de ácido sulfúrico diluído sobre hidróxido ou carbonato de cobre. Então:
H2SO4(diluído) + Cu(OH)2(s) + 3H2O(l) CuSO4.5H2O(s)
CuSO4.5H2O(s)
CuSO4(s) + 5H2O(g)
Resposta da questão 58:
[E]
Analisando a figura dada, teremos:
Força ácida: HB > HA> HC.
Podemos perceber que HB é o ácido mais forte seguido de HA, que é o segundo.
Como HA é mais forte do que HC, Uma solução aquosa de HA deve apresentar maior
condutibilidade elétrica do que uma solução aquosa de mesma concentração de HC.
Uma solução aquosa de HC deve apresentar pH maior do que uma solução aquosa de mesma
concentração de HB, pois HC é um ácido mais fraco do que HB.
Concluímos que está correto o que se afirma em I, II e III.
Resposta da questão 59:
[C]
O fumante ficou exposto das 22 h às 6 h do dia seguinte a 450 ppm de CO. O tempo de
exposição foi de 8 horas. Pela tabela a porcentagem de hemoglobina desativada (de acordo
com a quinta linha) foi de 40 a 60 % e os efeitos na saúde forma convulsão e coma.
Resposta da questão 60:
[D]
Os ácidos citados no texto e conferem maior acidez às águas das chuvas são os ácidos
sulfúrico e nítrico, pois são ácidos fortes.
Uma maneira de saber que estes ácidos são fortes é lembrando que:
D = quantidade de átomos de oxigênio – quantidade de átomos de hidrogênios ionizáveis.
Conforme o valor de D encontrado, teremos a seguinte classificação:
Oxiácidos
Valor de D
Fracos
0
Semifortes ou
moderados
1
Fortes
2 ou 3
Assim:
H2SO4 4 – 2 = 2 (ácido forte)
HNO3 3 – 1 = 2 (ácido forte)