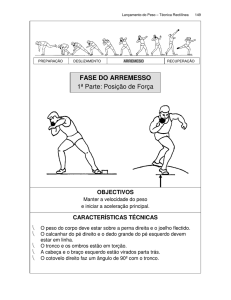
TÍTULO: AVALIAÇÃO DA PLURIPOTENCIA DAS CÉLULAS PLURIPOTENTES-SIMILES ISOLADAS A
PARTIR DE TECIDOS FETAIS
CATEGORIA: CONCLUÍDO
ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE
SUBÁREA: CIÊNCIAS BIOLÓGICAS
INSTITUIÇÃO: CENTRO UNIVERSITÁRIO DAS FACULDADES METROPOLITANAS UNIDAS
AUTOR(ES): DAMIANA PEDRO DE OLIVEIRA
ORIENTADOR(ES): CRISTIANE VALVERDE WENCELAU
COLABORADOR(ES): INSTITUTO BUTANTAN, IRINA KERKIS
RESUMO
As células tronco pluripotentes (CTP) podem ser isoladas in vitro a partir das fases
iniciais do desenvolvimento embrionário (massa celular interna do blastocisto e
epiblasto do embrião pré-implantado). Nesta fase do desenvolvimento várias
moléculas sinalizadoras controlam a expressão de genes como oct/4 e nanog, que
são responsáveis pelas características de pluripotência e auto-renovação celular das
células tronco embrionárias (CTE) e células tronco do epiblasto. Resultados obtidos
pelo nosso grupo demonstrou que a expressão destes marcadores de pluripotência
se mantêm em fases posteriores do desenvolvimento embrionário, no encéfalo fetal
de camundongos. No encéfalo fetal com idades de desenvolvimento 12, 15 e 18
dias, células imunopositivas para oct/4, nanog, sox2 e Fragilis foram identificadas.
Com base nestes resultados, o projeto objetivou isolar células tronco embrionáriassímiles in vitro e avaliar a expressão das células isoladas para marcadores de
pluripotência (oct/4 e nanog. Estes resultados parciais demonstram que é possível
isolar colônias que apresentam similaridades com as CTE quanto a morfologia e
expressão de marcadores de pluripotência, quando cultivadas sob as mesmas
condições das CTE de camundongo de fetos com 12 dias de desenvovimento.
INTRODUÇÃO
Células-tronco (CT) com diferentes graus de plasticidade residem em todos os tipos
de tecidos do organismo. Estas células surgem a partir da fertilização do óvulo pelo
espermatozoide, os quais derivam o zigoto. O zigoto inicia o processo divisão celular
resultando na mórula, blastocisto e consequentemente todo o feto. O zigoto é
considerado fonte de CT primordiais , e suas células são capazes de originar todo
um organismo e os anexos embrionários, sendo classificadas como células tronco
totipotentes . A mórula é composta por 16 blastômeros, consiste de uma massa
embrionária esférica rodeada por uma zona pelúcida, que posteriormente se torna o
blastocisto. O blastocisto é uma estrutura esférica rodeada por uma camada de
células
trofoblásticas
que
contém
uma
massa
celular
interna,
que
consequentemente origina o embrião. Ambas células isoladas a partir desta fase do
embrião são classificadas como células tronco embrionárias e são pluripotentes
(AVILON et al., 2003; NICHOLS et al., 1998). Durante o desenvolvimento
embrionário inicial, o período entre a implantação e a gastrulação é marcado por
intensa
proliferação
e
migração
celular,
resultando
na
determinação
e
posicionamento do endoderma, ectoderma e mesoderma para que ocorraa
organogênese. A execução coordenada destes processos depende de uma cascata
gênica complexa no embrião, cuja hierarquia ainda é pouco conhecida (GILBERT,
2010). Até o presente sabe-se que é controlado por várias moléculas sinalizadoras
que as mantém pluripotentes e regula todo o mecanismo de comprometimento e
diferenciação celular embrião-feto durante a ontogênese. As
moléculas mais
conhecidas são as citocinas, como por exemplo: “leucemia inhibitory fator” (LIF),
“bone morphogenic protein” (BMP), “fibroblast growth fator” (FGF) e Wnt. Embora os
fatores de transcrição reguladores, incluindo Sox2, Oct4, Nanog, e FoxD3 são
expressos durante as fases iniciais de desenvolvimento do embrião , estudos têm
demonstrado que muitos genes tornam-se ativos em diversos tecidos em fases
posteriores do desenvolvimento (BOYER et al 2005). Um exemplo é a crista neural
de camundongos que expressa níveis de Oct/4 e Nanog (LE DOUARIN et al., 2008).
A expressão de fatores de transcrição e consequentemente a manutenção da
pluripotência in vitro é mantida por diversas células como: células tronco
embrionárias, células germinativas, células tronco pluripotentes ind uzidas e até mesmo
por alguns tipos de células fetais de diversos tecidos (BELTRÃO BRAGA et al., 2011;
WENCESLAU et al., 2011, TESAR et al., 2005; KUCIA et al., 2007; LAWSON et al.,
1991). Porém, há muitas moléculas específicas que podem afetar a pluripotência e
auto-renovação das células tronco pluripotentes. Neste sentido, a identificação,
caracterização e classificação destas moléculas proporcionará ferramentas úteis
para a identificação e isolamento de CTP. Além disso, a compreensão dos
mecanismos que regulam a pluripotência das CTP continua a ser um grande desafio
para os pesquisadores desta área. Mais conhecimento destes marcadores é
criticamente necessário para os usos adequado das CTP e elucidação dos
mecanismos que regem a pluripotência e auto-renovação destas células.
OBJETIVOS
Avaliar a expressão de marcadores de pluripotência nas CTPS isoladas in vitro a
partir de encéfalos de fetos de camundongos em cultura com ou sem monocamada
de fibroblastos murinos. Avaliar a imunoreatividade de oct3/4 e nanog através da
técnica de imunocitofluorescência e a expressão através da técnica de PCR.
Comparar as imunopositividade e expressão do oct3/4 e nanog nas células isoladas
entre as diferentes idades fetais.
METODOLOGIA
As células isoladas in vitro neste trabalho foram provenientes de fetos de
camundongos em diferentes idades de desenvolvimento (10, 12 e 15 e 18 dias),
(Figura 1). Os animais adultos utilizados na pesquisa pertenciam à linhagem balb C
proveniente do biotério do Setor de Reprodução animal da Faculdade de Medicina
Veterinária e Zoocténica do Estado de São Paulo- FMVZ-USP, com idades variando
entre dois e seis meses de vida. Após, confirmado o coito, as fêmeas de
camundongo foram divididas em três grupos, sendo eutanasiadas nas seguintes
idades gestacionais: 10, 12 e 15 dias. A eutanásia ocorreu em câmara de CO 2 de
acordo com as práticas laboratoriais da COBEA/CEUIAB (Colégio Brasileiro de
Experimentação Animal/ Comissão de Ética no Uso de Animais do Instituto
Butantan), que autorizou os procedimentos de coleta dos tecidos encefálicos, os
quais foram utilizados para o isolamento das células in vitro.
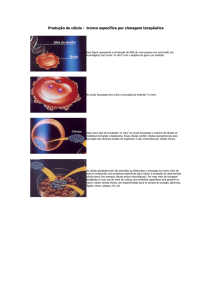
Figura 1: Embriões
e fetos utilizados na pesquisa
para a coleta e isolamento das células tronco do tecido neuronal. A – saco gestacional com embriões de 10
dias de gestação; B – feto com dias de gestação; C - feto com 15 dias de gestação.
Para demonstrar a presença de células imunopositivas para marcadores de
pluripotência foram utilizados métodos de imunohistoquímica e citometria de
fluorescência, eletroforese de amostras de RNA, RT-PCR relativa quantitativa e o
cultivo das CTP em monocamada de matrigel.
Isolamento de CTP in vitro
Após a coleta dos encéfalos fetais os mesmos foram lavados três vezes em solução
de PBS com 1% de antibiótico (penicilina/estreptomicina –LGC) para a retirada dos
possíveis contaminantes. Em seguida do tecido foi fragmentado em uma placa de
petri de 33mm de diâmetro com auxilio de uma lamina de bisturi. Os fragmentos
então foram transferidos para placas de petri de 33mm de diâmetro com meio de
cultivo composto por: DMEM-F12, 10% soro fetal bovino -HYCLONE, 2% de
glutamina, 1% amninoácidos não essenciais, 200ul Beta-mercaptoetanol , 1% LIF
(recombinant murine leukemia inhibitory factor) e 1% de estreptomicina/penicilina.
Após 4 dias as colônias com morfologia de CTE foram transferidas para placas de
cultivo de 33mm de diâmetro como monocamada de matrigel. A coleta deu-se
mecanicamente com auxilio de pipetas de vidros e microscópio invertido de luz. As
culturas celulares foram mantidas em estufa de CO2 com 5% de oxigênio e
umidade.
DESENVOLVIMENTO
As CTP são naturalmente derivadas in vitro do embrião em sua fase precoce do
desenvolvimento, como o estágio de mórula e blastocisto pré-implantado e até
mesmo da crista gonadal de fetos. Outra fonte de obtenção de CTP é a partir dos
métodos de de-diferenciação celular utilizando uma célula adulta. Os métodos de
diferenciação incluem:
transferência nuclear de célula somática, fusão celular e
produção de células tronco pluripotentes induzidas através da ativação de genes de
manutenção de pluripotência em células adultas. (EVANS and KAUFMAN 1981;
ANDREWS
et al 2005; BELTRAO BRAGA et al 2011). A auto-renovação,
diferenciação e a pluripotência das de CTE é regulada por vários sinais durante o
desenvolvimento embrionário. Estas moléculas sinalizadoras através ligações
extracelulares específicas desencadeia uma sequência de eventos de fosforilação
envolvendo diversas outras proteínas, resultando finalmente na ativação ou inibição
de fatores de transcrição. Dentre os fatores de transcrição comumente expressos
em células tronco pluripotentes destacam-se o Oct/4, nanog e Sox2, os quais
desempenham papeis cruciais na manutenção da pluripotência auto-renovação,
sendo expressos nas fases inicias do desenvolvimento embrionário (MARUYAMA et
al., 2005).
Células tronco neuronais
Células tronco neuronais possuem as mesmas propriedades das células tronco
isoladas dos tecidos convencionais como medula óssea e tecido adiposo. Os
marcadores das células tronco neuronais são relativos e sua importância depende
em particular, do ambiente celular e do estado. Foram primeiramente encontradas
no sistema nervoso central de animais adultos e seres humanos, em regiões do
cérebro reconhecidas por sua atividade neurogênica ao longo da vida a : zona
subventricular (SVZ) dos ventrículos laterais e no giro dentado (DG) na formação do
hipocampo. As atividades proliferativas das células tronco neurais nos nichos
celulares foi relatado a muito tempo (ALTMAN, 1969). No entanto, a capacidade
regenerativa desta região em derivar astrócitos e neurônios foi demonstrada
posteriormente somente na década de 90 (LABOSKY et al., 1994; LUSKIN, 1993).
As CT e os progenitores da ZSV são derivados durante o desenvolvimento
embrionário, a partir das células neuroepiteliais que formam a parede do tubo
neural.No cérebro adulto, as células tronco estão localizadas em nichos particulares,
com elementos estruturais do microambiente o que permite que as células tronco
mantenham a
sua identidade, module sua proliferação e destino (WATT and
HOGAN, 2000). Estas células liberam fatores mitogênicos e sinais de diferenciação
neuronais como :o fator básico de crescimento de fibroblastos (bFGF), o fator de
crescimento semelhante á insulina (IGF-1), o fator de crescimento endotelial
vascular (VEGF) de plaquetas, o fator de crescimento de plaquetas (PDGF),
interleucina-8 e fator neurotrófico derivado de cérebro (LEVENTHAL et al., 1999;
GROTHE et al., 2001), o qual desempenham papel importante no destino das
células neurais ( GRITTI et al., 1999). As CT neurais estão no topo da cadeia
evolutiva da linhagem neuronal, e possuem um alto grau de multipotencialidade
sendo comparadas com as CTH, devido sua capacidade de originar todas a
diversidade celular do SNC. Além disso, as CT neuronais fetais possuem uma
grande capacidade de enxertia no SNC após o transplante, contribuindo com a
neurogênese em encéfalos de roedores adultos (TABAR et al., 2005).
RESULTADOS
Para o isolamento de células tronco embrionárias-símiles foram utilizados
fragmentos de tecidos do sistema nervoso central do embrião com 10 dias de
desenvolviemnto e de fetos com 12, 14, 15 e 18 dias de desenvolvimento foram
utilizados dois métodos: “explante” e digestão enzimática. No método “explante” os
tecidos foram fragmentados com auxílio de uma lâmina de bisturi e posteriormente
transferidos para placas de cultivo com e sem monocamada de matrigel (este
método foi realizado nas amostras de 10, 12 dias com matrigel e 15 e 18 dias sem
monocamada de matrigel). Para realizar a digestão enzimática o tecidos após serem
fragmentados com auxílio de lamina de bisturi foram submetidos a digestão
enzimática com triple a 0,025% por 30 minutos a 37°C . Após este período a enzima
foi inativada com meio de cultivo contendo SFB, seguido da centrifugação por 5 min
a 1000rpm. As células derivadas da digestão enzimática foram transferidas para
placas para o meio de cultivo 3 (este método foi utilizado para as amostras de 12
dias de desenvolvimento) (ver figura 1).
Com base na análise de todas as
metodologias que lançamos mão, podemos demonstrar que os tecidos fetais
abrigam nichos de células tronco pluripotentes, multipotentes e progenitores no
início do desenvolvimento embrionário/fetal (10-12 dias de desenvolvimento) com
predominância de células imunopositivas para marcadores relacionados à
pluripotência (oct/4, nanog, sox2 e Fragilis) (ver figura 2) e células tronco neuronais
multipotente (nestina) (ver figura3). Nesta fase, as CTP e germinativa, mulitpotentes
e progenitores foram encontradas em regiões adjacentes a zona subventricular,
como por exemplo nas três vesículas cerebrais (mesencéfalo, rombencéfalo e
prosencéfalo) em desenvolvimento. Com o avanço do desenvolvimento a presença
de células pluripotentes e germinativas está preferencialmente localizada na zona
subventricular, que é o nicho do encéfalo adulto.
Figura 1: Colônias isoladas a partir
do encéfalo de feto com 12 dias de
desenvolvimento em monocamada
de matrigel com meio de cultivo 2.
Demonstramos
as
diferentes
morfologias das colônias isoladas
mecanicamente do encéfalo fetal:
epitelial-símile (A), embrionária –
símile, neuronal–símile
Figura 2: Imunocitofluorescência das colônias isoladas com
12 dias de desenvolvimento em meio de cultivo para o fator de
transcrição Oct/4 (a) Sox2 (c) e nanog (b). Em C colônias de
células fibroblastoídes com imunolocalização perinuclear
(seta).
Figura 7: Imunocitofluorescência das colônias isoladas com 12 dias de desenvolvimento em
meio de cultivo para o fator de transcrição Oct/4 (a) Sox2 (c) e nanog (b). Em C colônias de
células fibroblastoídes com imunolocalização perinuclear (seta).
CONSIDERAÇÕES FINAIS
Com base na análise de todas as metodologias que lançamos mão, podemos
demonstrar que os tecidos fetais abrigam nichos de células tronco pluripotentes,
multipotentes e progenitores no início do desenvolvimento embrionário/fetal (10-12
dias de desenvolvimento) com predominância de células imunopositivas para
marcadores relacionados à pluripotência (oct/4, nanog, sox2 e Fragilis) e células
tronco neuronais multipotente (nestina).
Nesta fase, as CTP e germinativa,
mulitpotentes e progenitores foram encontradas em regiões adjacentes a zona
subventricular, como por exemplo nas três vesículas cerebrais (mesencéfalo,
rombencéfalo
e
prosencéfalo)
em
desenvolvimento.
Com
o
avanço
do
desenvolvimento a presença de células pluripotentes e germinativas está
preferencialmente localizada na zona subventricular, que é o nicho do encéfalo
adulto.
REFERENCIAS BIBLIOGRÁFICAS
ALTMAN J. Autoradiographic and histological studies of postnatal neurogenesis. IV.
Cell proliferation and migration in the anterior forebrain, with special reference to
persisting neurogenesis in the olfactory bulb.J Comp Neurol. 1969 ;137, 4:433-57.
ANDREWS, P. W; MATIN, M. M; BAHRAMI, A. R; DAMJANOV, I.; GOKHALE, P;
DRAPER, J. S. Embryonic stem (ES) cells and embryonal carcinoma (EC) cells:
opposite sides of the same coin. Biochem. Soc. Trans. 2005; 33: 1526–1530.
AVILION AA, NICOLIS SK, PEVNY LH, PEREZ L, VIVIAN N, LOVELL-BADGE R.
Multipotent cell lineages in early mouse development depend on SOX2 function.
Genes Dev; 2003; 17:126 – 14.
BELTRÃO-BRAGA. P.I; PIGNATARI, G.C; MAIORKA, P.C; OLIVEIRA, N.A; LIZIER,
N.F; WENCESLAU, C.V; MIGLINO M.A; MUOTRI, A.R, KERKIS. I. Feeder-free
derivation of induced pluripotent stem cells from human immature dental pulp stem
cells. Cell Transplant. 2011; Apr 1.
BOYER, L.A.; LEE, T.I.; COLE, M.F.; JOHNSTONE, S.E.; LEVINE, S.S.; ZUCKER,
J.R.; GUENTHER, M.G.; KUMAR, R.M.; MURRAY, H.L.; JENNER, R.G.; et al. Core
transcriptional regulatory circuitry in human embryonic stem cells. Cell. 2005; 122,
947–956.56
EVANS MJ; KAUFMAN M H. Establishment in culture of pluripotential cells from
mouse embryos. Nature 1981; 292: 154-156.
GILBERT, S.F. VI ed.
Associates.2010; 711p.
Developmental biology.
Sunderland
(MA): Sinauer
GRITTI A, FRÖLICHSTHAL-SCHOELLER P; GALLI R; PARATI EA; COVA L;
PAGANO SF; BJOMSON CR; VESCOVI AL; DOETSCH F; GARCIA-VERDUGO JM;
ALVAREZ-BUYLLA A. Epidermal and fibroblast growth factors behave as mitogenic
regulators for a single multipotent stem cell-like population from the subventricular
region of the adult mouse forebrain. J Neurosci. 1999 May 1;19(9):3287-97.
GROTHE C.; MEISINGER C.; CLAUS P. In vivo expression and localization of the
fibroblast growth factor system in the intact and lesioned rat peripheral nerve and
spinal ganglia. J Comp Neurol. 2001 Jun. 4;434(3):342-57.
LABOSKY, P.A; BARLOW, D.P; HOGAN, B.L. Mouse embryonic germ (EG) cell
lines: transmission through the germ-line and differences in the methylation imprint of
insulin-like growth factor 2 receptor (Igf2r) gene compared with embryonic stem (ES)
cell lines. Development 1994;120: 3197–204.
LEVENLTHAL C.; RAFII S.; SHAHAR A.; GOLDMAN SA. Endothelial trophic support
of neuronal production and recruitment from the adult mammalian subependyma. Mol
Cell Neurosci. 1999 Jun;13(6):450-64
LE DOUARIN, N.M. CALLONI, G.W and DUPIN, E. The stem cells of the neural
crest. Cell Cycle. (2008)7, 1013–1019.
LUSKIN MB. Restricted proliferation and migration of postnatally generated neurons
derived from the forebrain subventricular zone. Neuron. 1993 Jul;11(1):173-89.
MARUYAMA , M., ICHISAKA, T., NAKAGAWA, M., and YAMANAKA, S. Differential
roles for sox15 and sox2 in transcriptional control in mouse embryonic stem cells
2005.
NICHOLS J.; ZEVNIK, B.; ANASTASSIADIS, K.; NIWA, H.; KLEWE-NEBENIUS, D.;
CHAMBERS, I.; SCHÖLER, H.; SMITH, A. Formation of pluripotent stem cells in the
mammalian embryo depend on the POU transcription factor oct-4. Cell 1998;
95:379:391.
KUCIA, M. et al. Morphological and molecular characterization of novel population of
CXCR4þ SSEA-4þ Oct-4þ very small embryonic-like cells purified from human
cordblood: preliminary report. Leukemia. 2007; 21: 297–303.
LAWSON, K.A; MENESES, J.J;PEDERSEN, R.A. Clonal analysis of epiblast fate
during germ layer formation in the mouse embryo. Development 1991;113: 891–911.
TABAR, V; PANAGIOTAKOS, G; GREENBERG, E.D; CHAN, B.K; SADELAIN, M;
GUTIN, P.H; STUDER, L. Migration and differentiation of neural precursors derived
from human embryonic stem cells in the rat brain. Nat. Biotechnol. 2005; 23: 601–
606.
TESAR, P.J. Derivation of germ-line-competent embryonic stem cell lines from
preblastocyst mouse embryos. Proc. Natl. Acad. Sci. USA. 2005; 102: 8239–8244.
WENCESLAU CV, MIGLINO MA, MARTINS DS, AMBRÓSIO CE, LIZIER NF,
PIGNATARI GC, KERKIS I. Mesenchymal progenitor cells from canine fetal tissues:
yolk sac, liver and bone marrow. Tissue Eng Part A. 2011.
WATT, FM.; HOGAN, B.L of Eden: stem cells and their niches. Science. 2000 Feb
25;287(5457):1427-30.