QUÍMICA
Material nº 1
Prof. SPERANDIO
37
Prezado estudante:
B.5) Sínteses Orgânicas:
B.5.1) Friedel-Crafts
B.5.2) Wurtz
B.5.3) Kolbe
b.5.4) de Álcoois
Para sua orientação, cada questão consta os
assuntos abordados pela mesma. A ordem dos
assuntos vistos é:
I – Histórico
II – Classificação dos Carbonos;
III – Classificação das Cadeias Carbônicas
IV – Nomenclatura dos Radicais
V – Funções Orgânicas e sua nomenclatura
VI – Séries: a) Homóloga
b) Isóloga
c) Heteróloga
VII – Ligações Carbono-Carbono e Hibridação
VIII – Isomeria plana:
a) De Cadeia
b) De Posição
c) Metameria
d) Função
e) Tautomeria
IX – Isomeria Espacial:
a) Geométrica
b) Óptica
X – Efeitos Eletrônicos
a) Efeito Indutivo
b) Efeito Mesomérico
c) Determinação da aromaticidade
segundo Huckel
XI – Propriedades
Físicas
dos
Compostos
Orgânicos:
a) Interações intermoleculares
a.1) Por cargas e dipolos
a.2) Por Van-der-Walls
XII – Reações Orgânicas:
A) Clássicas:
A..1) Adição;
A.1.1) Eletrofílica
A.1.2) Nucleofílica
A.1.3) Radicalar
A.1.4) Adição 1,4
A.2) Substituição:
A.2.1) Eletrofílica
A.2.1) Nucleofílica
A.2.3) Radicalar
A.3) Eliminação
B) Especiais:
B.1) Esterificação:
B.1.1) de Fischer
B.1.2) Transesterificação
B.2) Saponificação e Hidrólise Alcalina
B.3) Oxidação
B.3.1)
De
compostos
insaturados
B.3.2) De Alcoóis e Aldeídos
B.4)
Redução
ou
Hidrogenação
Catalítica
B.4.1)
De
compostos
insaturados
B.4.2) De compostos contendo
carbonila (ácidos, aldeídos e
cetona)
B.4.3) De nitrocompostos
B.6) Polímeros:
B.6.1) Classificação
B.6.2) Polímeros e Copolímeros
de Adição
B.6.3) Polímeros e Copolímeros
de Condensação
B.6.4)
Copolímeros
de
rearranjo.
Sugerimos que resolva as questões de vestibular
por ASSUNTO, ou seja, inicie resolvendo todas as
alternativas que envolvam nomenclatura, depois de
séries, ligações Carbono-Carbono e hibridações e assim
sucessivamente.
VESTIBULARES DA UEM
01/2005
(Nomenclatura, Classificação de carbonos e de
cadeia, nomenclatura e hibridação)
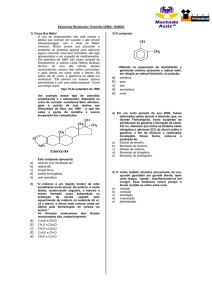
01) Supondo a união dos radicais sec-propil, etileno
(duas valências em carbonos distintos) e sec-butil,
assinale o que for correto.
01) Essa união poderá formar um composto com
fórmula molecular C9H20.
02) O composto poderá apresentar 4 carbonos
primários e 2 terciários.
04) O composto poderá apresentar duplas e triplas
ligações.
08) O composto poderá apresentar todos os
3
átomos de carbono com hibridação sp .
16) O composto poderá apresentar uma cadeia
ramificada.
32) O composto poderá ser o 2,5-dimetil-heptano.
1
Valério – Química – 2010
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
(Nomenclatura, polímeros, biomoléculas, petróleo,
hidrogenação catalítica)
04) O composto 3-metil-2-pentanol pertence à
função álcool e apresenta 4 isômeros ópticos
ativos.
08) O composto 1,2-dimetilciclopropano não
apresenta isomeria cis-trans.
16) Os compostos metóxi-propano e etóxi-etano
apresentam isomeria de compensação ou
metameria.
02) Assinale o que for correto.
01) Poliuretanos são copolímeros formados na
polimerização de poliésteres e poliéteres com
o isocianato de parafenileno.
02) Os lipídios são compostos insolúveis em água,
que formam ácidos graxos por hidrólise.
04) Um ácido graxo poliinsaturado submetido à
hidrogenação catalítica completa transformase em um ácido graxo saturado.
08) A polianilina pode conduzir eletricidade e é
formada por unidades repetitivas de eritreno.
16) A gasolina é vendida por litro, mas, em sua
utilização como combustível (queima), a
massa é o que importa, pois um aumento de
temperatura do ambiente leva a um aumento
no volume da gasolina.
32) A sacarose sofre hidrólise e cada molécula
produz 1 molécula de glicose e 1 molécula de
frutose.
(Nomenclatura, cadeias
propriedades físicas)
carbônicas,
radicais,
05) Assinale o que for correto.
01) Em uma cadeia carbônica saturada, só
existem ligações simples entre os átomos de
carbono.
02) Os compostos de fórmula molecular C3H6,
C4H8 e C5H10 podem ser hidrocarbonetos
cíclicos contendo apenas ligações simples.
04) Haletos orgânicos são compostos que podem
ser derivados dos hidrocarbonetos pela
substituição de hidrogênio(s) por halogênio(s).
08) Aminas podem ser compostos derivados
teoricamente da amônia, pela substituição de
átomo(s) de hidrogênio(s) por radical (is)
alquila(s).
16) As espécies metanoíla (formila) e etanoila
(acetila) são denominadas de radicais acilas.
32) Em geral, os aminoácidos apresentam função
mista, isto é, a função amida e ácido
carboxílico.
64) Em Maringá, o benzeno é um hidrocarboneto
aromático insolúvel em água.
(Nomenclatura, séries, propriedades físicas,
reações de redução, reações de oxidação,
interações intermoleculares)
03) Assinale o que for correto.
01) Série homóloga é uma seqüência de
compostos pertencentes à mesma função
orgânica e que diferem entre si por um ou por
mais grupos CH2.
02) Uma substância polar tende a se dissolver em
um solvente polar e uma substância apolar em
um solvente apolar.
04) Reações de redução em moléculas orgânicas
são, em geral, reações de eliminação de
oxigênio ou de adição de hidrogênio.
08) A reação do etanal com oxigênio gasoso,
transformando-se em um ácido carboxílico, é
uma reação de oxidação.
16) Ligações de hidrogênio (pontes de hidrogênio)
ocorrem quando o hidrogênio se encontra
ligado
a
um
elemento
fortemente
eletronegativo (flúor, oxigênio e nitrogênio).
Pode-se verificar a existência dessa ligação
entre duas moléculas de etanal.
32) O metano apresenta geometria molecular
tetraédrica e, pela cisão homolítica (quebra da
ligação), pode formar o radical metil.
02/2005
(Nomenclatura, propriedades físicas, biocompostos
e biopolímeros, compostos do dia-a-dia)
06) Assinale o que for correto.
01) Os sabões são sais de ácidos graxos e
apresentam boa solubilidade em água que
apresente elevada concentração de sais de
cálcio e magnésio.
02) O sulfato de alumínio Al2(SO4)3 pode ser
usado no tratamento da água para remoção de
partículas em suspensão.
04) As proteínas são polímeros de aminoácidos e
resultam das ligações entre moléculas de
aminoácidos, denominadas de ligações
peptídicas.
08) A sacarina, o ciclamato de sódio e o
aspartame são adoçantes artificiais.
16) A celulase é uma enzima, ou seja, um
catalisador de processos biológicos. Os seres
humanos não digerem celulose porque não
possuem celulase.
32) A função éster está presente nos triacilgliceróis.
(Nomenclatura, isomerias plana e espacial)
04) Assinale o que for correto.
01) A mistura racêmica é formada por 50% de
dextrógiro e 50% de levógiro; portanto não
desvia a luz polarizada.
02) O 1,2-diclorobenzeno e o 1,4-diclorobenzeno
possuem isomeria de posição.
2
Valério – Química – 2010
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
09) Assinale o que for correto.
(Nomenclatura, propriedades físicas, hibridação,
reações de substituição eletrofílica e de
hidrogenação catalítica)
01) A substância de fórmula molecular C3H9N
pode ser uma amina terciária.
02) O etanal é menos solúvel em água do que o
o
propanal, na temperatura de 25 C.
04) O butanal pode ser reduzido e formar o
butanol-1.
o
08) O ácido acético apresenta k a (a 25 C) maior do
que o ácido cloroacético.
16) No 2-metil-3-etil-hexano, os carbonos são
3
híbridos sp e dispõem-se segundo os vértices
de um tetraedro, originando ângulos de
0
aproximadamente 109 .
32) O gás metano pode dar origem às seguintes
espécies: íon carbônio, íon carbânion, radical
metil e radical metileno.
07) Assinale o que for correto, dadas as seguintes
substâncias:
A – Benzeno;
B – Ciclopentano;
C – Cicloexano;
D – 2-etil-penteno-1.
01) A substância A é insolúvel em octano.
02) Nas substâncias A e B, os átomos de carbono
2
apresentam hibridização sp .
04) A substância C apresenta maior ponto de
ebulição do que a substância B.
08) A remoção de um átomo de hidrogênio da
substância C forma o cicloexil.
16) A substância C pode adquirir duas
conformações interconvertíveis, denominadas
de conformação cadeira e barco.
32) A reação entre a substância A com HNO3 e
H2SO4 concentrados formará a fenilamina
(anilina).
64) A hidrogenação catalítica da substância D
formará um hidrocarboneto opticamente ativo.
(Nomenclatura, classificação dos carbonos, reação
de esterificação)
10) Sabendo-se que a substância responsável pelo
aroma característico da maçã verde é o etanoato
de etila, assinale o que for correto.
01) A substância apresenta fórmula molecular
C4H8O2.
02) A substância apresenta 4 carbonos primários.
04) A substância pode ser obtida através da
reação entre um ácido carboxílico e um álcool.
08) A substância pertence à função éter.
16) A substância pode sofrer hidrólise na presença
de água.
32) A
substância
apresenta
caráter
aromático.
(Nomenclatura, reações de combustão, isomerias
plana
e
espacial,
séries,
interações
intermoleculares)
08) Assinale o que for correto.
01) Na combustão completa de um mol de etanol,
23
são produzidas aproximadamente 18,06 x 10
moléculas de água.
02) Os pares de funções álcool e éter, aldeído e
cetona, ácido carboxílico e éster podem
apresentar isomeria funcional.
04) A isomeria óptica ocorre com moléculas
simétricas.
08) O 1,2-dicloro-ciclobutano apresenta isomeria
de Baeyer (baeyeriana).
16) Os alcenos eteno, propeno e buteno-1 podem
ser representados pela fórmula geral C nH2n e
constituem uma série homóloga.
32) As moléculas de álcoois formam ligações de
hidrogênio (ponte de hidrogênio) com as
moléculas de água, portanto todos os álcoois
apresentam boa solubilidade em água.
01/2006
(Nomenclatura,
séries,
isomeria
polímeros, reações de oxidação e
tratamento de águas e esgotos)
espacial,
redução,
11) Assinale o que for correto.
a) Uma espécie com fórmula H35C17COOH é um
ácido graxo insaturado.
−
b) O cloro (Cl2), o hipoclorito (OCl ) e o ozônio
(O3) podem ser utilizados em tratamentos de
águas residuais.
c) O ácido α-amino-acético é um aminoácido que
apresenta isomeria óptica.
d) O metil-acrilato de etila na presença de
catalisador forma o polimetacrilato de metila, um
plástico transparente parecido com o vidro.
e) Os automóveis a álcool (etanol) podem emitir
aldeídos por meio dos escapamentos, devido à
redução parcial do álcool.
(Nomenclatura, radicais, propriedades físicas,
reações de redução, acidez dos compostos
orgânicos, hibridação)
3
Valério – Química – 2010
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
(Funções orgânicas e interações intermoleculares)
(Nomenclatura)
12) Pode-se verificar a existência de ponte de
hidrogênio (ligação de hidrogênio) entre duas
moléculas de
a)
b)
c)
d)
e)
16
C2H6.
H3C-O-CH3.
H3C-CH2-OH.
H3C-CHO.
C6H6.
(DISCURSIVA) Desenhe as fórmulas estruturais
dos compostos abaixo, indicando todos os átomos
envolvidos e os tipos de ligações entre os átomos
(simples, duplas ou triplas ligações).
a) 3-metil-butanal
b) Ácido 4-metil-pentanóico
c) Metanoato de n-butila
(Nomenclatura, isomeria plana, reação de redução)
(Nomenclatura, radicais, reação de combustão,
acidez dos compostos orgânicos, isomeria
espacial, aromaticidade)
17) (DISCURSIVA) Dados os compostos abaixo,
responda as alternativas, indicando todos os
átomos envolvidos e os tipos de ligações entre os
átomos (simples, duplas ou triplas ligações).
13) Assinale o que for correto.
a) A combustão de 2 moléculas de acetileno com
excesso de oxigênio produz 2 moléculas de
água.
b) Ao perder um átomo de hidrogênio, o benzeno
forma o radical benzil.
c) Nas mesmas condições, o valor de k a do ácido
2-cloro-etanóico é menor do que o do ácido
etanóico.
d) O composto 4-cloro-1-butanol apresenta um
carbono assimétrico.
e) O benzeno e o ciclohexeno são hidrocarbonetos
aromáticos.
I.
II.
III.
IV.
Propanoato de metila
Butano
Etanoato de etila
Butanal
a)
Forme um par de compostos que apresente
algum tipo de isomeria – de cadeia, de
posição, tautomeria (ou dinâmica), de
compensação (ou metameria) ou de função –
e dê o nome desse tipo de isomeria.
Escreva a reação de formação do butano a
partir da hidrogenação catalítica de um
composto de fórmula molecular C4H8.
b)
(Nomenclatura, hibridação)
02/2006
(Nomenclatura, efeitos eletrônicos,
Huckle, isomerias plana e espacial)
14) Sobre a molécula do 1-butino (ou but-1-ino),
assinale o que for correto.
3
de
18) Assinale a alternativa incorreta.
a) A hibridização do carbono 2 é do tipo sp .
b) A hibridização do carbono 1 é do tipo sp.
c) Entre os carbonos 1 e 2, existem duas ligações
sigma.
d) Entre os carbonos 3 e 4, o tipo de ligação é
2
2
covalente do tipo sp -sp .
e) A ligação σ (sigma) H-C do carbono 1 é do tipo
2
s-sp .
(Nomenclatura, séries, propriedades
isomeria espacial, reação de oxidação)
15) Assinale o que for correto.
regra
a) Efeito indutivo é a atração, ou a repulsão de
pares eletrônicos formadores de ligações
simples (ligações σ), decorrente da diferença de
eletronegatividade dos átomos formadores da
ligação.
b) Têm caráter aromático todos os compostos
cíclicos de anéis planos contendo 4n + 2
elétrons π, sendo n um número inteiro.
c) Tautomeria é o caso particular de isomeria
funcional em que os dois isômeros ficam em
equilíbrio dinâmico.
d) A isomeria de posição ocorre quando os
isômeros têm a mesma cadeia carbônica, mas
diferem pela posição de ramificações ou de
ligações duplas ou triplas.
e) Os compostos cis-1,2-dicloro-eteno e o trans1,2-dicloro-eteno são isômeros cis-trans e
apresentam o mesmo ponto de fusão.
físicas,
a) Os alcenos apresentam fórmula geral CnH2n+2.
b) O propeno apresenta maior ponto de ebulição
do que 1-penteno.
c) O composto 3,3-dimetil-1-pentino apresenta
fórmula molecular C7H11.
d) O 2-buteno não apresenta isomeria geométrica
ou cis-trans.
e) Os álcoois primários podem ser oxidados a
ácidos carboxílicos.
(História da Química Orgânica, Nomenclatura,
interações intermoleculares)
19) Assinale a alternativa correta.
4
Valério – Química – 2010
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
a) O cianato de amônio, sob aquecimento, não
forma uréia.
b) A substituição dos hidrogênios da água por dois
grupos alquila ou arila formará compostos
pertencentes à função éter.
c) A denominação 2-etil-2-metil-hexano para um
alcano é correta segundo as normas da IUPAC.
d) A substância 1,5-diamino-pentano (cadaverina),
produzida na decomposição de cadáveres, é
uma amina terciária.
e) O aldeído fórmico ou metanal forma ligações de
hidrogênio (pontes de hidrogênio) entre si.
(Nomenclatura e Hibridação)
22) (DISCURSIVA) Escreva apenas uma das possíveis
estruturas para cada fórmula molecular abaixo e
atribua o nome (usual ou IUPAC) ao composto.
Indique todos os átomos envolvidos e os tipos de
ligações entre os átomos (ligações simples,
ligações duplas ou ligações triplas).
a) C7H6O2
b) C3H5ON
(Nomenclatura e reações de oxidação)
(Nomenclatura, biocompostos, séries, classificação
de cadeias, petróleo)
23) (DISCURSIVA)
Um composto orgânico de
fórmula molecular C3H8O (composto A) é oxidado
pelo KMnO4 em meio ácido, formando o composto
B, que, por sua vez, é novamente oxidado,
formando o composto C. Escreva as estruturas dos
compostos A, B e C, sabendo que o composto C é
o ácido propanóico. Indique todos os átomos
envolvidos e os tipos de ligações entre os átomos
(ligações simples, ligações duplas ou ligações
triplas) e dê o nome (usual ou IUPAC) aos
compostos A e B.
20) Assinale a alternativa correta.
a) Glicerídeos ou glicéridos são ésteres da glicina
com ácidos graxos.
b) O composto de fórmula molecular C18H36O2
pode ser um ácido graxo poliinsaturado.
c) Alcanos (ou hidrocarbonetos parafínicos) são
hidrocarbonetos acíclicos e saturados, isto é,
que têm cadeias abertas e apresentam apenas
ligações simples entre os átomos de carbono.
d) A parafina, muito utilizada na fabricação de
velas, é constituída basicamente de uma
mistura de alcanos de massa molar menor que
90 g/mol.
e) O 2-metil-buta-1,3-dieno, na presença de
catalisadores, de pressão e de temperatura,
pode formar o polibutadieno.
INVERNO 2006
(Nomenclatura, reações de substituição eletrofílica
e redução, acidez e basicidade dos compostos
orgânicos)
24) Assinale a alternativa correta.
(Nomenclatura, reação de substituição eletrofílica,
reação de substituição nucleofílica, reações de
oxidação e de redução)
a) A reação entre tolueno e H2SO4 na presença de
HNO3
formará
somente
o
composto
m-nitrotolueno (meta-nitrotolueno).
b) Na presença de calor e de platina como
catalisador, um alcano pode formar um alceno e
água.
c) O ácido tricloroacético apresenta maior valor de
Ka do que o ácido etanóico. Isso ocorre devido
ao efeito indutivo do tipo elétron-receptor ou
efeito indutivo negativo do cloro.
d) O anel do fenol pode sofrer oxidação e formar o
ciclo-hexanol.
e) Na reação entre os compostos A (metil amina) e
B (cloreto de alumínio), o composto A atua
como ácido de Lewis enquanto o composto B
atua como base de Lewis.
21) Assinale a alternativa incorreta.
a) O benzeno reage com o ácido nítrico, na
presença de ácido sulfúrico concentrado,
formando um nitrocomposto.
b) A reatividade da reação de substituição do
grupo OH de um álcool terciário é normalmente
maior do que a reatividade de substituição do
grupo OH de um álcool primário.
c) O etano pode ser reduzido a um álcool e, após a
redução, todos os carbonos apresentarão Nox
+3.
d) Um aldeído pode ser transformado em um ácido
carboxílico por uma reação de oxidação.
e) O ácido acético, na presença de um redutor com
o LiAlH4, pode ser reduzido para etanol
5
Valério – Química – 2010
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
(Nomenclatura, isomerias plana e espacial)
(Nomenclatura,
reações
de
hidrogenação,
substituição radicalar e eliminação, propriedades
físicas)
25) Assinale a alternativa correta.
29) Assinale a alternativa incorreta.
a) O cloreto de etanoila é uma substância que
apresenta isomeria óptica.
b) O 1,2-dicloro-ciclo-propano não apresenta
isomeria cis-trans.
c) Um composto de fórmula molecular C4H11N
apresenta isomeria de compensação e pode ser
uma amina.
d) Um aldeído e um enol em equilíbrio químico
dinâmico não apresentam tautomeria.
e) Álcoois aromáticos e éteres aromáticos não
apresentam isomeria funcional.
a) Por meio de uma reação de eliminação, o 2bromo-3-metil-butano pode formar o 2-metilbut2-eno e ácido bromídrico.
b) A hidrogenação do propeno formando o
propano é um exemplo de uma reação de
redução.
c) O cis-but-2-eno apresenta maior ponto de
ebulição do que o hept-1-eno.
d) Os compostos: água, ânion cloreto e amônia
podem ser reagentes nucleófilos.
e) A reação de etano com cloro gasoso, na
presença de luz, formando cloreto de etila e
ácido clorídrico, é um exemplo de uma reação
de substituição.
(Nomenclatura e isomeria espacial)
26) (DISCURSIVA) Considere um composto com
fórmula molecular C4H8. Desenhe as fórmulas
estruturais dos isômeros geométricos, indicando os
átomos envolvidos e os tipos de ligações entre os
átomos (simples, duplas ou triplas) e dê os nomes
dos compostos.
(Nomenclatura, regra de Huckel, séries)
30) Assinale a alternativa correta.
a) Um composto de fórmula molecular C8H13ClO
pode ser o composto 3-cloro-1-fenil-2hidróxibutano.
b) A função amina está presente na trimetilamina e
na anilina.
c) O nome de um suposto composto orgânico pode
ser o 6-metil-heptano.
d) Um composto com fórmula molecular C6H6 não
pode ter caráter aromático, pois não atende à
regra de Hückel.
e) Os compostos com fórmula molecular CH4O,
C2H6O, C3H8O e C4H10O podem pertencer à
função álcool e constituem uma série
heteróloga.
(Nomenclatura e radicais orgânicos)
27) (DISCURSIVA) Dê o nome (conforme a
nomenclatura IUPAC) e desenhe as fórmulas
estruturais dos reagentes e do produto, indicando
os átomos envolvidos e os tipos de ligações entre
os átomos (simples, duplas ou triplas) da reação
entre o radical isopropil e o radical terciobutil (ou
terc-butil).
VERÃO 2006
(Nomenclatura, isomerias plana e espacial)
28) Assinale a alternativa incorreta.
(Nomenclatura, isomeria espacial)
31) Assinale a alternativa correta.
a) Os compostos n-hexano, 2,3-dimetil-butano e 2metil-pentano são isômeros de cadeia e
representam um caso de isomeria plana.
b) Metil n-propilamina e dietilamina são isômeros
de compensação.
c) Isomeria espacial é aquela em que os
compostos têm a mesma fórmula plana, mas
estruturas espaciais diferentes.
d) Um ácido carboxílico e um éster podem ser
isômeros de função.
e) O metóxi-benzeno e orto-etil-fenol são isômeros
funcionais.
a) Uma molécula assimétrica é aquela que
apresenta plano de simetria.
b) A isomeria óptica ocorre com moléculas
simétricas.
c) Carbono assimétrico é o carbono ligado a
quaisquer átomos ou grupos atômicos.
d) O
composto
3-cloro-butanol-2
apresenta
isomeria óptica.
e) Ao se analisar com um polarímetro uma mistura
racêmica, isto é, com igual número de
moléculas dextrógiras e levógiras, o aparelho
registrará desvios no plano da luz polarizada.
(Nomenclatura e reação de adição eletrofílica)
32) (DISCURSIVA) Desenhe as fórmulas estruturais
dos reagentes e dos possíveis produtos da reação
entre propeno e ácido iodídrico. Indique o(s)
nome(s) de todos os átomos envolvidos e os tipos
de ligações (simples, duplas ou triplas) entre os
átomos.
6
Valério – Química – 2010
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
(Nomenclatura e isomeria espacial)
(Funções, classificação de cadeia e de carbonos)
QUESTÃO 33 (DISCURSIVA)
Desenhe as fórmulas estruturais e dê o nome aos
compostos abaixo, indicando os átomos envolvidos
e os tipos de ligações (simples, duplas ou triplas)
entre os átomos.
36) Assinale a alternativa incorreta.
a) O átomo de carbono é tetravalente devido à sua
possibilidade de hibridização.
b) De acordo com sua distribuição eletrônica,
existem, para o átomo de carbono, dois orbitais
com elétrons desemparelhados e, por isso, ele
forma apenas duas ligações covalentes.
c) Uma cadeia carbônica de um alcano linear não
pode apresentar carbonos terciários ou
quaternários.
d) A cadeia carbônica de um alceno linear ou
cíclico possui, ao menos, uma ligação dupla.
e) Um alcino ramificado com 5 átomos de carbono
tem o nome de metilbutino.
a) Um ácido opticamente ativo com fórmula
molecular C5H10O2.
b) Isômeros geométricos de um hidrocarboneto
alifático com 4 átomos de carbono.
INVERNO 2007
(Nomenclatura, reação de substituição eletrofílica)
34) Em um reator, colocam-se 1,0 mol de
metoxibenzeno, 1,0 mol de benzoato de metila, 1,0
mol de Cl2 e 0,05 mol de catalisador. Esse reator é
colocado sob condições energéticas de modo que
ocorra a reação (substituição eletrofílica aromática).
Ao final da reação, é encontrado no reator, como
produto, 1,0 mol de uma mistura contendo oclorometoxibenzeno e p-clorometoxibenzeno. A
partir dessas informações, assinale a alternativa
correta.
(Nomenclatura, reações de oxidação, redução e de
neutralização)
37) Dados os compostos abaixo, assinale a alternativa
incorreta.
I.
CH3-CH2-OH
II. CH3-CHO
III. CH3-COOH
IV. CH3-COONa
a) O cloro reage preferencialmente com o
metoxibenzeno devido ao efeito indutivo
ativante do grupo metóxi.
b) Será também encontrado, no reator, 0,05 mol de
p-clorobenzoato de metila.
c) O cloro reage preferencialmente com o
metoxibenzeno devido ao efeito ativante (por
ressonância) do grupo metóxi.
d) Será também encontrado, no reator, 1,0 mol de
m-clorobenzoato de metila.
e) A reação de benzoato de metila com cloro é
mais rápida do que a reação do metoxibenzeno
com cloro.
a) Os nomes dos compostos I, II, III e IV são,
respectivamente, etanol, etanal, ácido etanóico
e etanoato de sódio.
b) A oxidação do composto I leva ao composto II, e
a oxidação do composto II leva ao composto III.
c) O etanol pode ser reduzido a ácido acético e
esse procedimento é utilizado na produção do
vinagre.
d) O composto IV pode ser obtido por meio da
reação do composto III com NaOH.
e) O composto I só possui ligações simples e os
demais possuem uma ligação dupla cada.
(Nomenclatura e isomeria plana)
35) Considere os pares de compostos abaixo.
• Propanal e prop-1-en-1-ol
• Etóxi-etano e metóxi-propano
• 1-hidróxi-2-etil-benzeno e 1-hidróxi-3-etilbenzeno
• 1-hidróxi-2-n-propil-benzeno e 3-fenil-propan-1-ol
• Cicloexano e metilciclopentano
Nesses compostos, encontramos, respectivamente,
as isomerias:
a) de função, tautomeria, de compensação, de
posição e de cadeia.
b) de função, de compensação, de posição, de
cadeia e tautomeria.
c) tautomeria, de compensação, de posição, de
cadeia e de função.
d) de função, de posição, de compensação,
tautomeria e de cadeia.
e) tautomeria, de compensação, de posição, de
função e de cadeia.
7
Valério – Química – 2010
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
VERÃO 2007
(Nomenclatura, acidez e basicidade dos compostos
orgânicos, propriedades físicas)
(Nomenclatura, hibridação dos carbonos)
38) (DISCURSIVA) Certo rejeito orgânico industrial é
−10
composto de fenol (Ka = 10 ), 2,4-dinitrofenol (Ka
−4
−18
= 10 ) e álcool benzílico (Ka = 10 ) solubilizados
em solvente orgânico de baixa polaridade.
Considerando que esse rejeito é submetido aos
tratamentos descritos abaixo,
Tratamento 1
1.a) Adição de solução aquosa de NaHCO3;
1.b) Separação de fases;
1.c) Adição de HCl em excesso à fase aquosa até
nova formação de fases.
Tratamento 2
2.a) Adição de solução aquosa de NaOH à fase
orgânica obtida ao final do tratamento 1.b;
2.b) Separação de fases;
2.c) Adição de HCl em excesso à fase aquosa até
nova formação de fases.
Tratamento 3
A fase orgânica obtida ao final do tratamento 2.b é
submetida a um processo de destilação.
40) Considerando os compostos I e II, assinale a
alternativa correta.
CH3
CH2
I (metilbenzeno)
II (feniletileno)
a) O composto II não é aromático, pois possui 8
elétrons pi.
b) O composto I não é aromático, pois possui um
3
carbono sp com quatro ligações simples.
c) O composto II tem anel planar, pois todos os
2
carbonos do anel são sp .
d) No composto I, todas as ligações C-C e C-H
o
fazem ângulos de 120 entre si.
e) No composto II, existem sete carbonos com
2
hibridização sp e um com hibridização sp.
a) desenhe a fórmula estrutural do componente do
rejeito (que é o ácido mais forte) e da sua forma
solúvel em água que é obtida após o tratamento
1.a e dê os seus respectivos nomes;
b) desenhe a fórmula estrutural do componente do
rejeito e da sua forma solúvel em água que é
obtida após o tratamento 2.a e dê os seus
respectivos nomes;
c) desenhe a fórmula estrutural do componente do
rejeito que é obtido após o tratamento 3 e dê o
seu nome.
(Nomenclatura, isomeria plana, classificação dos
carbonos, ligações carbono-carbono)
41) Considerando a fórmula estrutural do composto
abaixo, assinale a alternativa incorreta.
H3C
HO
(Nomenclatura, acidez e basicidade dos compostos
orgânicos, reação de neutralização)
CH3
(hex-4-en-2-ol)
39) (DISCURSIVA) Em um recipiente, são colocados
−5
1,0 mol de ácido acético (Ka ≈ 10 ), 1 mol de ácido
−3
cloroacético (Ka ≈ 10 ) e 0,5 mol de KOH.
Considerando o sistema após atingido o equilíbrio,
responda:
a) O composto possui a função enol que
tautomeriza com a função cetona.
b) O composto possui uma função álcool.
c) O composto possui 2 carbonos primários.
d) O composto possui 4 dos seus átomos de
carbono formando somente ligações simples e
apenas 2 átomos de carbono que formam
ligação dupla entre eles.
e) O composto tem fórmula molecular C6H12O.
a) Quais substâncias serão encontradas no
recipiente? E em que quantidades?
b) O KOH reage preferencialmente com um dos
componentes presentes no recipiente. Qual é o
efeito responsável por essa preferência?
Escreva a fórmula estrutural dos dois ácidos
orgânicos e mostre, por meio de setas, a
atuação desse efeito.
8
Valério – Química – 2010
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
(Nomenclatura, reação de substituição eletrofílica,
efeitos eletrônicos)
a ___________ enquanto no produto de sua
reação existem quatro carbonos com número de
oxidação igual a -2 e dois carbonos com número
de oxidação igual a _________ . Dessa forma,
conclui-se que o reagente II deve ser um
__________forte.
42) Considerando a equação química abaixo, assinale
a alternativa incorreta.
O
CH3
O
CH3
O
CH3
UEM 2008 INVERNO
Br
FeBr3
+ HBr
(Nomenclatura, classificação de carbonos e de
cadeia, interações intermoleculares, hibridação e
reação de neutralização)
a) FeBr3 não é consumido neste processo.
b) O produto orgânico formado, uma mistura de 2bromo-metoxi-benzeno
e
4-bromometoxibenzeno, é uma conseqüência do maior
efeito indutivo ativante do grupo metóxi,
comparado ao seu pequeno efeito de
ressonância desativante.
c) O grupo metóxi é orto para dirigente.
d) Substâncias com anéis benzênicos em suas
estruturas podem sofrer reações de substituição
eletrofílica.
+
e) O eletrófilo da reação acima é o Br (formado
pela interação do catalisador FeBr3 com Br2)
que substitui um hidrogênio aromático.
45) Sobre o ácido propanodióico (estrutura abaixo),
assinale o que for correto.
+
Br2
+
Br
H
H
OH
43) (DISCURSIVA) Desenhe a fórmula estrutural e dê
o nome do composto orgânico de cadeia aberta,
saturada,
ramificada,
com
dois
carbonos
quaternários, seis carbonos primários, com fórmula
molecular C8H18O e de função orgânica álcool.
(Nomenclatura, isomeria plana, regra de Huckel,
efeitos eletrônicos, reação de substituição
eletrofílica)
(Nomenclatura, reações de oxidação e redução)
46) Assinale o que for correto.
44) (DISCURSIVA) Considerando as equações de oxiredução, que acontecem nos reatores A e B,
complete as afirmativas.
CH3CHO
CH3COCH3
(I)
(I)
CH3CH=C(CH3)2
REATOR B
cicloexanona
01) O benzoato de metila e o acetato de fenila são
ésteres que têm as estruturas formadas,
respectivamente, pela troca do hidrogênio
presente na carboxila do ácido benzóico pelo
grupo metila e pela troca do hidrogênio
presente na carboxila do ácido acético pelo
grupo fenila.
02) O benzoato de metila e o acetato de fenila são
isômeros de função com fórmulas moleculares
C8H8O2.
04) O benzoato de metila é um composto
aromático segundo a regra de Hückel, porque
possui todos os carbonos da unidade cíclica
2
hibridados em sp , formando um anel plano
com seis elétrons π.
08) O efeito de ressonância desativa o anel do
benzoato de metila para uma reação de
substituição eletrofílica aromática, orientando o
ataque do eletrófilo na posição meta.
16) O grupamento NO2, no nitrobenzeno, tem
efeito indutivo e de ressonância doadores de
elétrons.
CH3CH2OH
CH3CHOHCH 3
(II)
(II)
OH
01) Ele apresenta cadeia carbônica saturada,
homogênea e normal.
02) Ele não forma ligações de hidrogênio e, por
isso, não é solúvel em água.
04) Para neutralizar 1 mol desse ácido, são
necessários 2 mols de hidróxido de sódio.
08) Ele é apolar.
16) Os três átomos de carbono apresentam
2
hibridação sp .
(Nomenclatura, classificação de carbonos)
REATOR A
O
O
CH3COOH + CH 3COCH3
HOOC(CH 2)4COOH
a) No reator A, o número de oxidação do carbono
1 no etanal é +1 que, após a reação, passa ao
número de oxidação _________ no etanol,
enquanto que o número de oxidação do carbono
2 na propanona é +2 e passa a __________ no
2-propanol. Dessa forma, chega-se à conclusão
de que o reagente I deve ser um
_________________.
b) No reator B, o número de oxidação dos
carbonos 2 e 3 no alceno são ___________ e
0, respectivamente. Na cicloexanona, existem
cinco carbonos com número de oxidação igual a
-2 e um carbono com número de oxidação igual
9
Valério – Química – 2010
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
(Nomenclatura, reações de oxidação e redução,
hibridação dos carbonos)
(Nomenclatura, propriedades físicas, hibridação
dos carbonos)
47) Assinale o que for correto.
49) Assinale o que for correto.
01) Os números de oxidação do carbono 1 no
ácido etanóico (ácido acético) e no etanal
(aldeído acético) são, respectivamente, +3 e
+1.
02) Na reação de um alceno com KMnO4 diluído e
a frio, forma-se diol como produto orgânico e
MnO2 como produto inorgânico.
04) O número de oxidação do Mn no
permanganato de potássio é +9 e, no MnO2, é
+10.
2
08) O número de oxidação dos carbonos sp de
um alceno qualquer é maior do que o número
de oxidação dos carbonos de um diol formado
a partir do mesmo alceno.
2+
3+
–
16) Na equação 2Fe + Cl2 ==> 2Fe + 2Cl ,
ocorre mudança do número de oxidação do
–
cloro de 0 (Cl2) para –1 (Cl ).
01) O etano possui ponto de ebulição maior que o
metanol, porque possui maior cadeia
carbônica.
02) O metanol possui geometria planar e as suas
interações intermoleculares são do tipo força
de Van de Waals.
04) O cicloexanol é aromático e apolar.
08) O hexan-1-ol é insolúvel em água.
16) O cloreto de etila (cloroetano) tem dois
3
carbonos sp
e apresenta interações
intermoleculares do tipo dipolo-dipolo.
UEM 2008 VERÃO
(Nomenclatura,
hibridação
classificação de cadeias)
48) Dadas as substâncias abaixo, assinale o que for
correto.
A. CH3-CH3
B. CH2=CHCl
C.
01) Todos os compostos possuem cadeias cíclicas
normais.
02) Os compostos A, B e D são hidrocarbonetos.
04) O composto C é um fenol.
08) O composto B possui quatro carbonos
3
2
hibridizados em sp e dois em sp .
16) Os compostos A, B e C possuem,
respectivamente, cadeia heterogênea fechada
normal saturada, cadeia heterogênea fechada
normal insaturada, cadeia heterogênea
fechada normal saturada.
CH2
O
HO
OH
carbonos,
50) Com relação aos compostos abaixo, assinale o que
for correto.
A) cicloexano
B) cicloexeno
C) cicloexanol
D) metilcicloexano
(Nomenclatura, reações de polimerização)
D.
O
dos
E. HO-CH2-CH2-OH
F.
O
H3C
CH3
O
01) A substância F, um éster, é o monômero que
dá origem a um poliéster.
02) A substância C, quando polimerizada, forma o
poliestireno.
04) Tanto A quanto B são usados pela indústria
para produção do polímero polietileno.
08) A baquelite é um polímero termofixo que é
obtido através das reações das substâncias D
e E.
16) A substância A é o monômero adequado para
formar o polietileno em condições de catálise
ácida.
10
Valério – Química – 2010
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
(Nomenclatura e isomeria plana)
04) A anilina, uma base mais forte que a água,
reage com HCl para formar o cloreto de
anilinium (ou cloreto de anilônio).
08) O grupo –NH2, quando ligado ao anel
aromático, é um poderoso ativador orto/paradirigente em reações de substituição
aromática eletrofílica.
16) A anilina reage com Br2/H2O em uma
velocidade bem maior do que o benzeno reage
com Br2/H2O.
51) Dadas as fórmulas abaixo, assinale o que for
correto.
O
A)
CH3
H3C
CH3
CH3
CH3
O
B)
(Nomenclatura, interações
propriedades físicas)
CH3
H
CH3
C)
CH3
H
01) Ao se cozinhar feijão em uma panela de
pressão, a temperatura de início da fervura
depende da quantidade de calor fornecida.
02) Moléculas de metanol formam ligações de
hidrogênio tanto entre si como com moléculas
de água.
04) Moléculas do éter metóxi metano não formam
ligações de hidrogênio entre si, mas formamnas com moléculas de água.
08) Todos os alcoóis são solúveis em água devido
à formação de ligações de hidrogênio.
16) A adição de ácido octanóico em água leva à
formação de um sistema bifásico, pois o ácido
octanóico não tem polaridade suficiente para
ser solúvel em água.
CH3
OH H3C
D)
H2C
CH3
CH3
OH H3C
E)
H3C
CH3
CH3
01)
02)
04)
08)
A é isômero funcional de B.
A possui dois isômeros ópticos.
B e C são tautômeros.
A tem como tautômeros D e E, sendo E mais
estável que D.
16) O composto A recebe o nome oficial de 2,3dimetilpentanona-4.
(Nomenclatura, efeitos eletrônicos, regra
Huckel, reação de substituição eletrofílica)
(Nomenclatura,
reações
de
substituição
nucleofílica, reações de eliminação, redução e
oxidação)
54) Assinale o que for correto.
01) Acetato de etila reage com cloreto de etil
magnésio, dando um intermediário que,
hidrolisado, forma a butanona e o etanol.
02) Metanal reage com cloreto de metil magnésio
dando um intermediário que, hidrolisado,
forma etano.
−
+
04) 3-etil-pentanol-3 reage com MnO4 /H e
aquecimento, em um sistema fechado,
produzindo ácido etanóico (ácido acético) e
pentanona-3.
08) Tendo em um reator uma mistura de aldeído e
cetona em concentrações idênticas, ao se
−
iniciar uma reação com adição de MnO4
diluído e a frio, inicia-se a formação de um
álcool secundário.
16) Cloreto de etanoíla reage com metilamina para
formar etanamida.
de
52) Considerando as formas de ressonância da anilina,
assinale o que for correto.
H
H
:N
H
+
N
H
e
53) Assinale o que for correto.
CH3
OH
intermoleculares
H
+
N
-
H
H
+
H
N
-
01) Segundo a regra de Hückel, a anilina (I) é um
composto aromático, pois possui anel plano
com elétrons π deslocalizados, formando uma
nuvem π acima e abaixo do plano em um total
de 6 elétrons π (portanto 4n + 2 elétrons π,
onde n=1).
02) As estruturas de (I) a (IV) representam
adequadamente o efeito indutivo na anilina.
11
Valério – Química – 2010
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
UEM 2009 INVERNO
(Nomenclatura, reações de esterificação e
transesterificação, desidratação intramolecular,
oxidação, redução)
(Nomenclatura, reações de oxidação, neutralização
de aminoácidos e polimerização, hibridação dos
carbonos)
58) Assinale o que for correto.
55) Assinale o que for correto.
01) Se acetato de sódio reage com cloroetano
para produzir acetato de etila, então, pelo
mesmo método, para se obter formiato de
isopropila, os reagentes devem ser formiato de
sódio e 2-cloropropano.
02) A desidratação de 2-hidróxi-3-metilbutano
produz dois alcenos: o 2-metil-2-buteno em
menor proporção e o produto mais estável 3metil-1-buteno em maior proporção.
04) A oxidação energética do metil propeno forma
CO2 e ácido propanóico.
08) A redução de ácido carboxílico forma aldeído
que, reduzido, produz álcool primário.
16) A transesterificação de óleos e de gorduras
consome glicerina como reagente e forma
etanol ou metanol como produto secundário e
biodiesel como produto principal.
01) Um oxidante fraco reage com cetonas e não
consegue oxidar aldeídos.
02) Em soluções ácidas, os aminoácidos estão
protonados e, em soluções básicas, são
encontrados na forma de íons negativos.
04) No etileno, os átomos de carbono estão
2
3
hibridizados em sp e, no polietileno, em sp .
08) Com diamina e ácido dicarboxílico como
matéria-prima e condições adequadas,
produz-se o polímero poliéster.
16) Sabão possui grande cadeia apolar e
extremidade polar, enquanto detergente tem
pequena cadeia apolar e grande parte polar.
(Nomenclatura, interações
propriedades físicas)
intermoleculares
e
(Nomenclatura, reações de substituição radicalar e
adição eletrofílica)
56) Assinale o que for correto.
59) Assinale o que for correto.
01) O 2-metil-3-etil pentano tem maior ponto de
ebulição que o 2,3-dimetil hexano que, por sua
vez, tem maior ponto de ebulição que o
n-octano.
02) Metanol é solúvel em água e o octan-1-ol
(octanol-1) não o é.
04) O ponto de ebulição do ácido propanóico é
maior que o do propan-1-ol (propanol-1).
08) O ponto de ebulição do hexan-2-ol (hexanol-2)
é maior que o do heptano.
16) Água
e
cicloexano
formam
mistura
homogênea.
01) A monocloração do 2,3-dimetilbutano forma
apenas dois produtos.
02) A monocloração do 2,2,4-trimetilpentano forma
quatro produtos diferentes.
04) A adição de HCl gasoso a 2,4,4-trimetil-2penteno produz 2-cloro-2,4,4-trimetilpentano.
08) A adição de eteno a uma solução aquosa de
HCl produz cloroetano como produto principal.
16) Br2 em CCl4 reage com alceno, adicionando Br
e CCl3 aos carbonos insaturados.
(Nomenclatura, reações de substituição eletrofílica,
efeitos eletrônicos e hibridação dos carbonos)
(Nomenclatura, isomerias plana e espacial)
60) Assinale o que for correto.
57) Dadas as reações I e II, assinale a(s) alternativa(s)
correta(s).
I) Benzeno + Br
II) Fenol + 3Br
2
FeBr3
2
FeBr3
01) 2-metil-pentanal e 2-etil-butanal são exemplos
de isomeria de compensação.
02) Ácido-2-etil-butanoico apresenta-se como dois
isômeros óticos: um dextrógiro e outro
levógiro.
04) Hexeno-3 e 2-metil-2-penteno são exemplos
de isomeria de posição.
08) Butanona e butanal são exemplos de isomeria
de função.
16) 2,3-diclorobutano apresenta um isômero
meso, um dextrógiro, um levógiro e ainda pode
apresentar mistura racêmica com 50% do
dextrógiro e 50% do levógiro.
A + HBr
B + 3 HBr
01) A é o 1,2-dibromo benzeno.
02) B é o 2,4,6-tribromofenol.
04) O grupamento –OH do fenol, por efeito de
ressonância, ativa o anel aromático em
reações de substituição eletrofílica aromática.
08) A velocidade da reação I é bem maior que a
da reação II.
16) Todos os carbonos dos compostos A e B
2
estão hibridizados em sp .
12
Valério – Química – 2010
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
(Nomenclatura, hibridação e ligações carbonocarbono e séries)
(Funções, séries, reação de esterificação)
63) A hidrólise total de dois óleos vegetais, A e B,
fornece a relação percentual em mol de ácidos
graxos abaixo.
61) Assinale
a(s)
alternativa(s)
correta(s),
considerando os compostos com as seguintes
fórmulas estruturais:
O
OH
I)
H3C
Óleo
VI)
H
VII)
HC
II)
III)
A
B
O
OH
VIII) H3C
O
IV)
H3C
IX) H
CH3
CH3
O
O
X) H3C
V)
H3C
OH
20
35
Ácido
Linoléic
o
C17H31CO2H
M
=
280
-1
g.mol
65
55
01) O óleo A, quando hidrolisado, gera maior
percentagem de ácido graxo saturado que o
óleo B.
02) O óleo B tem maior percentagem de
insaturações que o óleo A.
04) O óleo B, quando hidrolisado, fornece maior
número de mols de ácidos graxos insaturados.
08) Um mol de óleo A, quando hidrolisado, produz
massa idêntica de ácido palmítico obtido pela
hidrólise de 1,5 mol de óleo B.
16) Quando hidrolisado, um óleo vegetal qualquer
fornece sempre uma relação percentual em
mols de ácidos graxos idêntica à relação
percentual em massa de ácidos graxos.
CH3
OH
Ácido Oléico
C17H33CO2H
M
=
282
-1
g,mol
Assinale o que for correto.
OH
H3C
Ácido
Palmític
o
C15H31CO2H
M
=
256
-1
g.mol
15
10
CH3
UEM 2009 VERÃO
01) Os compostos I, IV, V, VIII e X são
constituintes de uma série heteróloga.
2
02) O composto IX tem dois carbonos sp e um sp.
04) Os carbonos do composto VII estão contidos
em uma reta (estão alinhados).
08) Os compostos II, III e VI são constituintes de
uma série homóloga.
16) Os compostos I, VII e IX são, respectivamente,
propanal, ácido propinóico e metanoato de
etila.
(Nomenclatura, reação de polimerização)
64) Assinale o que for correto.
01) O náilon é um polímero de adição.
02) Um polímero acrílico tem seu monômero
derivado do ácido acrílico.
04) O Teflon® é um polímero que contém átomos
de cloro em sua estrutura.
08) Os termoplásticos são polímeros que podem
ser amolecidos ou endurecidos pela variação
da temperatura.
16) A matéria prima para a produção do cloreto de
polivinila (PVC) é o cloroetileno.
(Nomenclatura, classificação de carbonos e de
cadeias)
62) Assinale o que for correto.
01) Heteroátomo é o átomo diferente de carbono
que está inserido entre átomos de carbono de
uma cadeia carbônica.
02) No etanol, o átomo de oxigênio não pertence à
cadeia carbônica.
04) Em proteína, não se encontra heteroátomo.
08) A cadeia carbônica da hexilamina é
heterocíclica.
16) O propanol tem cadeia carbônica acíclica
heterogênea insaturada.
13
Valério – Química – 2010
(Nomenclatura, reação
transesterificação)
de
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
esterificação
e
(Funções, isomeria espacial, biomoléculas)
67) A equação química abaixo representa a obtenção
de moléculas de glicose por meio do processo de
fotossíntese.
65) Considere a reação representada abaixo para
obtenção do flavorizante de abacaxi (I) e assinale o
que for correto.
6CO2(g) + 6H2O(l) 1C6H12O6(s) + 6O2(g)
O
O
H3C
+
OH
+
H
CH3CH2OH
O
H3C
CH3
+
OH
H2O
OH
I
01) De acordo com a nomenclatura IUPAC, a
substância I é o butanoato de etila.
02) A reação para obtenção do composto I é
chamada de transesterificação.
04) A adição de água à reação favorece a
produção do composto I.
08) O composto I também pode ser obtido pela
reação entre butanoato de sódio e brometo de
etila.
16) Se, em uma reação semelhante, a mistura de
ácido butanóico e etanol for substituída pelo
ácido 4- hidroxibutanoico, os produtos da
reação serão água e um éster cíclico.
HO
H
De acordo com as informações acima, assinale o
que for correto.
01) A molécula de glicose apresenta quatro
átomos de carbono quirais diferentes.
02) A molécula de glicose apresenta isômeros
geométricos.
04) A molécula de glicose possui um átomo de
carbono quaternário.
08) A glicose é um lipídio encontrado em vegetais.
16) No processo de fotossíntese, ocorre
transformação de energia luminosa em
energia química.
66) De acordo com as reações fornecidas no esquema
abaixo, assinale a(s) alternativa(s) correta(s).
(Nomenclatura,
interações
propriedades físicas)
H2
Ni(cat)
intermoleculares,
68) Os frascos de quatro substâncias foram numerados
de 1 a 4 e seus pontos de ebulição são dados na
tabela abaixo.
NO 2
H2
FRASCOS
1
2
3
4
NH2
Pt(cat)
CO2H
CH3
CH3Cl
AlCl 3
HO
Glicose
(Nomenclatura, reações de substituição eletrofílica
e radicalar, oxidação e redução, efeitos eletrônicos)
HNO 3
H2SO4
O
HO
KMnO 4
+
P.E. (o. C)
36
69
117
142
Sabendo que as substâncias desconhecidas são
ácido propanóico, pentano, butanol e hexano,
assinale o que for correto.
H
CH2Br
Br2
01) Os frascos de 1 a 4 contêm, respectivamente,
pentano, butanol, ácido propanóico e hexano.
02) O pentano tem o menor ponto de ebulição,
pois suas moléculas se unem por forças de
van de Waals, que são pouco intensas.
04) O ácido propanóico apresenta maior ponto de
ebulição que o butanol, pois suas moléculas
unem-se por duas ligações de hidrogênio,
dando origem a dímeros.
08) O ponto de ebulição dos alcanos de cadeia
linear aumenta gradativamente com o
aumento de suas massas moleculares.
16) A quantidade de energia necessária para
romper
uma
ligação
de
hidrogênio
intermolecular entre dois átomos é maior que a
energia necessária para romper uma ligação
covalente entre os mesmos átomos.
UV
01) A reação de nitração do benzeno é uma
reação de adição.
02) O ciclo-hexano pode ser obtido por oxidação
do benzeno.
04) A halogenação do tolueno é uma reação de
substituição.
08) O permanganato de potássio é o agente
oxidante na reação de conversão do tolueno
em ácido benzóico.
16) Devido ao efeito de ressonância do anel
aromático, o produto obtido pela redução
catalítica do nitrobenzeno é uma base mais
fraca que a metilamina.
14
Valério – Química – 2010
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
(Nomenclatura, hibridação dos carbonos, isomeria
plana, propriedades físicas)
08) Uma mistura equivalente de seus isômeros S
e R é descrita como uma mistura racêmica.
2
16) Apresenta carbonos com hibridização sp, sp e
3
sp .
69) Dadas as fórmulas moleculares dos compostos I e
II, assinale o que for correto.
I.
C3H6O
(Nomenclatura, reações de desidratação, oxidação
e redução, efeitos eletrônicos na substituição
eletrofílica)
II) C3H8O
72) A equação química abaixo representa o processo
de síntese do luminol a partir do ácido 3-nitroftálico
e da hidrazina. O luminol é um composto que, sob
condições
adequadas,
apresenta
quimioluminescência e por isso é utilizado em
química forense (investigação de crimes) para a
detecção de sangue. A respeito dessa reação,
assinale o que for correto.
01) O composto I pode ser um ácido carboxílico e
o composto II, um álcool.
02) O composto I possui um carbono com
2
hibridização sp .
04) Os compostos I e II são isômeros de função.
08) O composto II pode ser o propanol ou o
metóxietano.
16) Os compostos I e II são insolúveis em água.
NO 2
(Nomenclatura,
séries,
classificação de cadeias)
radicais
orgânicos,
NO 2
NH2
O
COOH
+
COOH
70) Assinale o que for correto.
NH2
NH
NH2
NH
ácido 3 -nitroftálico
O
Na 2S2O 3
NH
NH
O
luminol
O
01) Os compostos que se obtêm pela substituição
de um átomo de hidrogênio do metano pelos
radicais –CH3, –OH, –NH2 e –COOH são,
respectivamente: etano, metanol, metilamina e
ácido metanóico.
02) Metano, etano, propano e 2-metilpropano são
constituintes de uma série homóloga de
hidrocarbonetos alifáticos.
04) O composto formado pela união dos radicais
etil e terc-butil é o 2,2-dimetilbutano.
08) A substância dietilamina tem cadeia carbônica
acíclica, saturada e homogênea.
16) O composto 1,2-dimetilcicloexeno é aromático.
01) A formação da 5-nitroftalhidrazina ocorre com
eliminação de uma molécula de água.
02) O Na2S2O4 atua como agente oxidante.
04) Em solução aquosa, o ácido 3-nitroftálico
apresenta caráter ácido, enquanto o luminol
apresenta caráter básico.
08) Em reações de substituição eletrofílica
aromática, o grupo nitro atua como grupo
metadirigente, enquanto o grupo amina atua
como ortoparadirigente.
16) A desidratação do ácido 3-nitroftálico puro
gera o anidrido 3-nitroftálico.
UEM INVERNO 2010
(Nomenclatura,
polimerização)
(Funções orgânicas, classificação de cadeias,
isomeria espacial, hibridação)
O
de
01) A hidrólise de proteínas causa a diminuição do
seu tamanho de cadeia, sendo os
polipeptídeos
as
menores
unidades
formadoras das proteínas, obtidos a partir da
sua hidrólise.
02) A resina fenol-formaldeido é um exemplo de
um polímero termoplástico.
04) O poliisopreno tem a mesma estrutura química
da borracha natural.
08) Recentemente a melamina foi utilizada de
maneira criminosa na China para a
adulteração do leite, pois a adição desse
composto ao leite fazia aumentar o seu teor de
nitrogênio.
16) A seguinte equação descreve a reação de
formação do poliestireno a partir do estireno:
CH=CH2
O
NH
N
reação
73) Assinale o que for correto.
71) A talidomida é uma substância usualmente utilizada
como medicamento sedativo. Devido aos efeitos
teratogênicos de um de seus isômeros óticos, esse
medicamento não deve ser prescrito a mulheres
em idade fértil, pois causa malformação ou
ausência de membros em fetos. A respeito da
molécula da talidomida abaixo, assinale o que for
correto.
O
biomoléculas,
O
01) Os três anéis são aromáticos.
02) Possui um único centro quiral e apresenta dois
isômeros oticamente ativos.
04) Possui duas aminas secundárias.
n
CH2CH2
n
15
Valério – Química – 2010
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
(Nomenclatura, isomeria espacial, interações
intermoleculares e propriedades físicas)
(Funções orgânicas, propriedades físicas)
76) A vitamina C apresenta a estrutura química
mostrada a seguir.
74) Considere alcoóis de fórmula C nH2n+1OH e aminas
de fórmula (CnH2n+1)3-xNHx e assinale a(s)
alternativa(s) correta(s).
01) O álcool que contém o menor número de
átomos de carbono, sendo um deles
assimétrico, é o 2-butanol.
02) O álcool será mais solúvel em água quanto
maior for o valor de n.
04) De acordo com o valor de x, podemos
classificar a amina em x=1: amina primária e
x=2: amina secundária.
08) Aminas são compostos que apresentam
valores de x iguais a 0, 1 ou 2 e, para x igual a
3, tem-se o composto amônia.
16) Tanto em alcoóis como em aminas primárias,
as interações intermoleculares mais fortes são
as forças de van der Waals.
(Nomenclatura, interações intermoleculares
propriedades físicas, classificação de cadeias)
OH
HO
OH
O
O
OH
Linus Pauling, ganhador dos prêmios Nobel de
Química e da Paz, ingeria diariamente entre 4 e 6
gramas dessa vitamina, por acreditar nos seus
efeitos terapêuticos. No entanto, recomenda-se
-4
somente a ingestão diária de 3,5 x 10 mol dessa
vitamina. Sobre essas informações, assinale o que
for correto.
01) A vitamina C é lipossolúvel.
02) Em um mol de moléculas de vitamina C,
encontramos 6 mols de átomos de carbono.
04) A molécula de vitamina C pode ser hidrolisada
em meio ácido, convertendo sua função
lactona para ácido carboxílico e álcool.
08) A ingestão diária de vitamina C feita por Linus
Pauling aproximava-se a 1.000 vezes do valor
recomendado.
16) A fórmula mínima da vitamina C é C3H4O3.
e
75) Em um posto de gasolina, a determinação do
volume de etanol adicionado à gasolina pode ser
feito por um teste simples, em que se adicionam,
em um frasco graduado de 100 ml, os volumes de
50 ml da gasolina e 50 ml de água, seguidos de
forte agitação. Sobre esse teste, assinale o que for
correto.
(Nomenclatura, reação de nitração/esterificação)
01) A mistura final obtida é heterogênea e
apresenta 3 fases distintas.
02) As interações intermoleculares de ligação de
hidrogênio entre as moléculas de água e
etanol são muito mais fortes que as interações
intermoleculares entre etanol e gasolina.
04) Se a mistura for deixada em repouso após sua
agitação e for observada uma separação em
duas fases, com volume de 60 ml na fase
aquosa e 40 ml na fase orgânica, a gasolina
possui 10% de etanol.
08) O teste pode também ser usado para
identificar
a
presença
de
solventes
adulterantes da gasolina, como o tolueno.
16) Um dos hidrocarbonetos componentes da
gasolina, o 2,2,4-trimetilpentano, pode ser
classificado
com
um
hidrocarboneto
ramificado, saturado e alifático.
77) A duas equações abaixo representam as reações
de síntese e de decomposição explosiva da
nitroglicerina. A respeito dessas reações e dos
compostos envolvidos, assinale o que for correto.
OH
HO
OH
O
NO 2
O
NO 2
O
NO 2
+
3 HNO 3
H2SO4
O
NO 2
O
NO 2
O
NO 2
+
3H2O
3N2(g) + 6CO 2(g) + 5H 2O(v) + 1/2O 2(g)
01) A glicerina pode ser também denominada
propeno-1,2,3-triol.
02) O processo de explosão da nitroglicerina se dá
pela conversão quase que instantânea de um
pequeno volume desse líquido em um grande
volume de gases, numa reação extremamente
exotérmica.
04) O ácido sulfúrico é utilizado como um
catalisador da reação de nitração e facilita a
saída de moléculas de água.
08) A explosão da nitroglicerina pode matar uma
pessoa tanto pela expansão dos gases de
forma violenta como pela alta toxicidade dos
gases gerados.
16) A alta liberação de calor em um explosivo se
deve a ligações químicas fortes presentes no
explosivo, contrariamente às ligações fracas
presentes nos produtos gasosos.
16
Valério – Química – 2010
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
QUESTÃO 16
a) 3-metil-butanal
(Nomenclatura, reações de hidrogenação catalítica,
adição eletrofílica, adição 1,4)
CH3
78) A respeito de reações químicas de adição, assinale
o que for correto.
O
H3C
H
b) Ácido 4-metil-pentanóico
01) A hidrogenação de alcenos é usada para a
produção de margarinas a partir de óleos
vegetais.
02) O produto principal da reação de adição entre
o propeno e o ácido clorídrico, na ausência de
peróxidos, é o 1-cloropropano.
04) A reação entre o acetileno e o Cl2, em
proporções equimolares, gera o cloreto de
vinila, utilizado na produção do poli(cloreto de
vinila), o PVC.
08) A reação do 1,3-butadieno em proporção
equimolar com o Cl2 gera como produto
principal o 1,4-dicloro- 2-buteno.
16) Através da hidratação do acetileno, é possível
produzir o acetaldeído.
O
H3C
OH
H3C
c) Metanoato de n-butila
O
H
CH3
O
QUESTÃO 17
a) Forme um par de compostos que apresente algum tipo de
isomeria – de cadeia, de posição, tautomeria (ou dinâmica), de
compensação (ou metameria) ou de função – e dê o nome
desse tipo de isomeria.
(Funções orgânicas, biomoléculas, biopolímeros)
O
O
79) Assinale o que for correto.
H3C
H3C
01) A sacarose é um polissacarídeo de fórmula
(C12H22O11)n encontrado em frutas, como a
uva.
02) O amido é um dissacarídeo formado pela
condensação de 2 moléculas de α−glicose,
entre os carbonos 1 e 4.
04) Devido à grande presença de grupos OH em
sua estrutura, tanto o amido quanto a celulose
são solúveis em água.
08) A lactose é encontrada no leite e resulta da
condensação de uma molécula de α−glicose
com uma de β-galactose.
16) O glicogênio é um polissacarídeo de reserva
alimentar nos animais e é formado pela
condensação de moléculas de glicose.
O
CH3
O
CH3
Propanoato de metila
etanoato de etila
de compensação ou metâmeros)
(isômeros
b) Escreva a reação de formação do butano a partir da
hidrogenação catalítica de um composto de fórmula molecular
C4H8.
CH3-CH=CH-CH3 + H2
CH3-CH2-CH2-CH3
Obs. A mesma reação poderia ser feita a partir do but-1-eno.
QUESTÃO 22
a) C7H6O2
O
OH
GABARITO
Q
S
T
01
02
03
04
05
06
07
08
09
10
11
12
13
14
G
A
B
59
55
47
23
95
62
92
27
53
23
B
C
A
B
Q
S
T
15
16
17
18
19
20
21
22
23
24
25
26
27
28
G
A
B
E
*
*
E
B
C
C
*
*
C
C
*
*
E
Q
S
T
29
30
31
32
33
34
35
36
37
38
39
40
41
42
G
A
B
C
B
D
*
*
C
E
D
C
*
*
C
A
B
Q
S
T
43
44
45
46
47
48
49
50
51
52
53
54
55
56
G
A
B
*
*
05
13
27
02
24
10
15
29
22
05
06
14
Q
S
T
57
58
59
60
61
62
63
64
65
66
67
68
69
70
G
A
B
22
09
07
24
20
03
13
26
25
28
17
14
10
06
Q
S
T
71
72
73
74
75
76
77
78
79
*
*
*
*
*
G
A
B
10
28
12
09
18
30
22
25
24
*
*
*
*
*
Ácido benzóico ou ácido fenilmetanóico
b) C3H5ON
O
H2C
NH2
Propenamida
QUESTÃO 23
H3C
OH
Propan-1-ol
17
O
Ox. Branda
H3C
Ox. Enérg.
O
H3C
OH
H
propanal
ácido propanóico
Valério – Química – 2010
QUÍMICA
Material nº 1
Prof. SPERANDIO
37
QUESTÃO 26
H
H
H
c) desenhe a fórmula estrutural do componente do rejeito que
é obtido após o tratamento 3 e dê o seu nome.
CH3
OH
H3C
CH3
H3C
cis-but-2-eno
H2C
H
trans-but-2-eno
QUESTÃO 27
CH3
+
H3C
H3C
H3C
CH3
CH3
Isopropil
H3C
tercbutil
H3C
CH3
Álcool benzílico (fenilmetanol)
H3C
QUESTÃO 39
a) Quais substâncias serão encontradas no recipiente? E em
que quantidades?
Resolução:
2,2,3-trimetilbutano
Obs. Repare que não há necessidade de indicar as posições
dos radicais no produto.
CH3-COOH
ác. acetico
CH2Cl-COOH
KOH⟶CH3COOH
ác. cloroacético
ác. acético
CH2ClCOONa
cloroacetato de sódio
QUESTÃO 32
Inicio
I
H2C
+
I
HI
CH2
CH3
CH3
propeno
1-iodopropano
H3C
Final
CH3
H
H3C
OH
H3C
CH3
cis-but-2-eno
H3C
0
0,50mol
0,50mol
0
0
1,00mol
0,50mol
0
1,00mol
0,50mol
0
H2C
H3C
b) Isômeros geométricos de um hidrocarboneto alifático com 4
átomos de carbono.
H
0
b) O KOH reage preferencialmente com um dos componentes
presentes no recipiente. Qual é o efeito responsável por essa
preferência? Escreva a fórmula estrutural dos dois ácidos
orgânicos e mostre, por meio de setas, a atuação desse efeito.
O efeito causado pelo cloro é denominado de efeito indutivo
ou elétron-atraente.
O
O
O
H
0,50mol
Portanto, no final da reação teremos 1,00mol de ácido acético,
0,50mol de ácido cloroacético e 0,50mol de cloroacetato de
sódio.
Ácido 2-metilbutanóico (repare que o carbono alfa é quiral)
H
1,00mol
2-iodopropano
QUESTÃO 33
a) Um ácido opticamente ativo com fórmula molecular
C5H10O2.
H3C
1,00mol
Reage
O
O H
Cl
ácido cloroacético
H
ácido acético
CH3
QUESTÃO 43
H
CH3
trans-but-2-eno
CH3
CH2
H3C
QUESTÃO 38
a) desenhe a fórmula estrutural do componente do rejeito (que
é o ácido mais forte) e da sua forma solúvel em água que é
obtida após o tratamento 1.a e dê os seus respectivos nomes;
CH3 H3C
OH
2,2,3,3-tetrametilbutan-1-ol
ONa
QUESTÃO 44
a) No reator A, o número de oxidação do carbono 1 no etanal
é +1 que, após a reação, passa ao número de oxidação -1
no etanol, enquanto que o número de oxidação do carbono 2
na propanona é +2 e passa a 0 (zero) no 2-propanol. Dessa
forma, chega-se à conclusão de que o reagente I deve ser um
agente redutor .
b) No reator B, o número de oxidação dos carbonos 2 e 3 no
alceno são
-1
e 0, respectivamente. Na cicloexanona,
existem cinco carbonos com número de oxidação igual a -2 e
um carbono com número de oxidação igual a + 2 enquanto
no produto de sua reação existem quatro carbonos com
número de oxidação igual a -2 e dois carbonos com número
de oxidação igual a
+3
. Dessa forma, conclui-se que o
reagente II deve ser um agente oxidante forte.
NO 2
NO 2
2,4-dinitrofenóxido de sódio
b) desenhe a fórmula estrutural do componente do rejeito e da
sua forma solúvel em água que é obtida após o tratamento 2.a
e dê os seus respectivos nomes;
ONa
fenóxido de sódio
18
Valério – Química – 2010