Aula: 21.
Temática: Reações de deslocamento ou simples troca.
Após a polêmica sobre a reação de combustão, vamos explorar um
pouco mais o tema da reatividade.
Reações que ocorrem entre uma substância simples e uma composta
produzindo novas substâncias: uma simples e uma composta.
Cl2
+
2NaBr
2NaCl
+
Br2
(O cloro está deslocando o bromo)
3Al
+
6HCl
2AlCl3 +
3H2
(O alumínio está deslocando o hidrogênio)
Algumas reações químicas de deslocamento.
Vamos enfocar algumas reações de deslocamento entre metais e não metais
com sais e ácidos.
REAÇÃO DE METAIS COM ÁCIDOS E SAIS.
O elemento mais reativo desloca o menos reativo dos compostos.
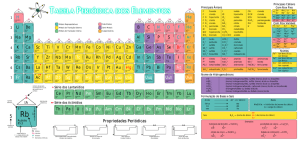
Fila de reatividade dos metais
Li Cs Rb K Ba Sr Ca Na Mg Al Mn Be Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi As Cu Hg Ag Pt Au
Ordem crescente de reatividade
Ser um metal mais reativo significa reagir com mais facilidade, possibilitando
deslocar o outro metal, menos reativo, pertencente à substância composta.
Exemplos:
1.. Zn
+
metal
CuSO4
ZnSO4
+
Cu
sal
O zinco (Zn) é mais reativo que o cobre (Cu), portanto desloca o cobre da
substância composta.
2. Ag
+ CuSO4
metal
não ocorre reação
sal
A prata (Ag) é menos reativa que o cobre (Cu), portanto não desloca o cobre
da substância composta.
3. Zn
metal
+
2HCl
ZnCl2
+
H2
ácido
O zinco é mais reativo que o hidrogênio (H).
4. Ag +
HCl
não ocorre reação
A prata é menos reativa que o hidrogênio. O mesmo comportamento é
observado com todos os metais que estão após o H na fila de reatividade.
REAÇÃO DE NÃO-METAIS COM SAIS.
O não-metal desloca o ânion do sal quando é mais reativo que este.
Fila de reatividade dos não metais.
F
O
Cl
Br
I
S
N
P
C
Ordem crescente de reatividade.
1.Cl2
+
2NaBr
2NaCl
+
Br2
O cloro (Cl) é mais reativo que o bromo (Br).
I2
+
NaCl
não ocorre reação
O iodo (I2) é menos reativo que o cloro.
Nesta aula estudamos as reações químicas por deslocamento. O
assunto ficou claro para você? Espero que sim, mas se necessitar de maiores
esclarecimentos escreva. Até a próxima aula.