ÁLCOOIS, FENÓIS,
ÉTERES,ALDEÍDOS E CETONAS
Karla Gomes
Diamantina-MG
ÁLCOOIS
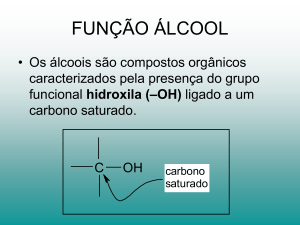
• Grupo funcional –OH, hidroxila, ligada
diretamente a um carbono saturado.
• Classificação quanto ao número de hidroxilas:
monoálcool, diálcool, triálcool e poliálcool.
• Quanto ao tipo de carbono a que a hidroxila
encontra-se ligada: Primários, secundários e
terciários.
ÁLCOOIS- IUPAC
• H3C — OH: met + an + ol = metanol
• H3C — CH2 — OH: et + an + ol = etanol
• H3C — CH2 — CH2 — OH: propan-1-ol
ÁLCOOIS- IUPAC
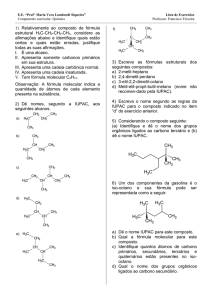
• Exemplos de nomenclatura para monoálcoois
não ramificados:
•
OH
|
H3C — CH —CH3: propan-2-ol
•
OH
|
H3C — CH — CH2 — CH3: butan-2-ol
•
OH
|
H3C — CH2 — CH2 — CH —CH2 — CH3: hexan-3-ol
ÁLCOOIS- IUPAC
• Exemplos de nomenclatura para monoálcoois
ramificados:
OH
|
H3C — CH = CH — CH — CH2 — CH3
hex-4-en-3-ol
ÁLCOOIS- IUPAC
• Poliálcoois são aqueles compostos que
apresentam mais de um grupo OH em sua
estrutura. Nesses casos, basta acrescentar os
sufixos que indicam a quantidade, como: di,
tri, tetra, etc.
• Exemplo de nomenclatura para poliálcoois:
OH OH
| |
H2C — CH2: etanodiol
ÁLCOOIS- USUAL
• Para monoálcoois inicia-se com a palavra
álcool seguida do nome do radical ligado à
hidroxila com terminação –ico.
• Exemplos:
• H3C- OH -Álcool metílico
•
OH
|
H3C— HC — CH3 – Álcool isopropílico
ÁLCOOIS- PROPRIEDADES FÍSICOQUÍMICAS
• O grupo hidroxila é bastante polar e as
moléculas dos álcoois podem realizar ligações
de hidrogênio.
• Possuem P.F e P.E muito maiores que os
hidrocarbonetos.
FENÓIS
• Compostos que possuem o grupo –OH ligada
diretamente ao carbono de anel aromático.
• Apresentam P.F, P.E, densidade e solubilidade
semelhante aos álcoois.
• Os fenóis são mais ácidos do que os álcoois,
seguindo uma ordem crescente de acidez:
ÁLCOOIS< FENÓIS< ÁCIDOS CARBOXÍLICOS
FENÓIS- IUPAC E USUAL
• Fenol mais simples é o hidroxibenzeno, que é
chamado simplesmente de FENOL.
• Grande parte dos fenóis são nomeados
utilizando a palavra FENOL seguido dos
substituintes (radicais).
FENÓIS-IUPAC E USUAL
FENÓIS-IUPAC E USUAL
ÉTERES
• Compostos que possuem o oxigênio (-óxi),
entre carbonos. (-O-)
• Interações do tipo dipolo-dipolo ou dipolo
instantâneo- dipolo induzido.
ÉTERES – IUPAC E USUAL
• Inicia-se com o nome do radical (cadeia com
menor número de carbonos) com terminação
–óxi, adicionando-se o nome da cadeia com
maior número de carbonos.
• Inicia-se com a palavra éter, seguida dos
nomes dos radicais (em ordem de
complexidade), colocando-se no radical mais
complexo a terminação –ílico.
ÉTERES – IUPAC E USUAL
H3C— O —CH2 — CH3
Nomenclatura oficial IUPAC: metoxietano
Nomenclatura usual: éter metil-etílico
H3C—CH2 — O —CH2 — CH3
Nomenclatura oficial IUPAC: etoxietano
Nomenclatura usual: éter dietílico
EPÓXIDOS
• São éteres cíclicos com anéis de três
membros. Na nomenclatura da IUPAC, os
epóxidos são chamados de OXIRANOS.
• O epóxido mais simples é nomeado como
óxido de etileno.
EPÓXIDOS
ALDEÍDOS
• Compostos que possuem o grupo carbonila
(C=O) em um carbono primário, ou seja,ligada
a pelo menos um hidrogênio. Aldo-carbonila.
• Este grupo funcional aparecerá nas
extremidades das cadeias.
ALDEÍDOS- IUPAC
• Deve-se substituir a terminação –o dos
hidrocarbonetos por –al. Para enumerar a
cadeia principal, deve-se começar pelo
carbono da carbonila.
ALDEÍDOS- IUPAC
• H2C ═ O: met + an + al = Metanal
• H3C ─ HC ═ O: et + an + al = etanal
• H3C ─ CH ─ CH2 ─HC ═ O: but + an + al =
butanal
• O ═ CH ─ CH2 ─ HC ═ O : propandial
ALDEÍDOS- IUPAC
ALDEÍDOS- USUAL
• Inicia-se com a palavra aldeído precedida da
cadeia carbônica com terminação –óico.
Exemplos:
• H2C ═ O: Aldeído fórmico ou formaldeído
• H3C ─ HC ═ O: Aldeído acético
ALDEÍDOS- USUAL
CETONAS
• Compostos que possuem a carbonila em um
carbono secundário, ou seja, ligada a dois
átomos de carbono. Ceto-carbonila.
• O carbono vizinho à carbonila e denominado
carbono α,o vizinho a esse, carbono β,
que,por sua vez, temo como vizinho o carbono
γ, e assim por diante.
CETONAS- IUPAC
• Substitui-se a terminação –o dos
hidrocarbonetos por –ona. Deve-se enumerar
a cadeia principal com ou mais carbonos,
começando pela extremidade mais próxima da
carbonila.
• Em caso de mais uma carbonila usa-se a
terminação diona,triona, etc.
CETONAS- IUPAC
•
O
║
H3C ─ C ─ CH3→ propanona
•
O
║
H3C ─ C ─ CH2 ─ CH3: butanona
CETONAS-USUAL
• Citam-se os nomes em ordem alfabética ou de
complexidade, dos radicais ligados à carbonila
e, em seguida, adiciona-se o termo cetona.
• Alguns exemplos seguem a seguir:
CETONAS
PROPRIEDADES FÍSICAS E QUÍMICAS
DOS ALDEÍDOS E CETONAS
• Semelhantes em suas propriedades físicas e
muito diferentes nas propriedades químicas.
• A carbonila é bastante polar, mas não realiza
ligações de hidrogênio entre si.
• Interações dipolo-dipolo.
PROPRIEDADES FÍSICAS E QUÍMICAS
DOS ALDEÍDOS E CETONAS
• Aldeídos e cetonas podem fazer ligações de
hidrogênio com outras moléculas em que há
hidrogênio núcleo exposto. Água e etanol.
• P.F e P.E menor que os álcoois e maiores que
os éteres.
• Solubilidade considerável para compostos de
cadeias menores.
PROPRIEDADES FÍSICAS E QUÍMICAS
DOS ALDEÍDOS E CETONAS
• Aldeídos são bons redutores,ou seja,grande
facilidade de sofrer oxidação.
• A oxidação pode ocorrer através do oxigênio
atmosférico ou por oxidantes fracos.
• As cetonas dificilmente reagem nessas
condições.