Universidade de Ribeirão Preto
Prospecção Molecular de genes codificadores de enzimas da via de fenilpropanóides em
Dipteryx odorata (Aubl) Willd e Eclipta alba (L.) Hassk.
Eldo Sá Corrêa Filho
Ribeirão Preto – SP
2008
Eldo Sá Corrêa Filho
Prospecção Molecular de genes codificadores de enzimas da via de fenilpropanóides em
Dipteryx odorata (Aubl) Willd e Eclipta alba (L.) Hassk.
Dissertação apresentada a Universidade de
Ribeirão Preto – UNAERP, para a obtenção
do grau de mestre em Biotecnologia de
Plantas Medicinais e Microrganismos.
Orientadora: Profª. Drª. Sonia Marli
Zingaretti.
Co-orientador: Prof. Dr. Mozart Azevedo
Marins.
Ribeirão Preto – SP
2008
Ficha catalográfica preparada pelo Centro de Processamento Técnico da
Biblioteca Central da UNAERP
- Universidade de Ribeirão Preto -
Corrêa Filho, Eldo Sá.
C817p
Prospecção molecular de genes codificadores de enzimas
da via de fenilpropanóides em Dipteryx odorata (Aubl) Willd
e Eclipta Alba (L.) Hassk. / Eldo Sá Corrêa Filho. - Ribeirão Preto, 2008.
89 f. : il. + anexos.
Orientadora: Profª. Drª. Sonia Marli Zingarette, coorientador: Prof. Dr. Mozart Azevedo Marins.
Dissertação (mestrado) – Departamento de Pós-Graduação
em Biotecnologia, área de concentração: Plantas Medicinais
e de Microorganismo da Universidade de Ribeirão Preto,
Ribeirão Preto, 2008.
1. Enzimas. 2. Plantas medicinais. 3. Metabolismo
secundário. I. Título.
CDD: 660.634
Dedico
Ao meu pai, Eldo Sá Corrêa, por saber que, onde ele estiver, vai estar sempre ao meu lado.
À minha mãe, Maria José da Costa, pelo apoio incondicional, pelo carinho e confiança.
À minha avó Alexandra Pinto de Barros da Costa.
Aos meus irmãos Eldimar Costa Corrêa e Marcelo Alexandre Costa pelos momentos alegres
de minha vida.
À minha família, por tudo que eu aprendi com eles, amor e respeito com os outros.
Aos amigos de Cuiabá, Ribeirão Preto e do Mundo que, como minha família, sempre me
apoiaram.
À música, que me fez mais feliz e às minhas orações que me elevaram a um equilíbrio espiritual.
Agradecimentos
À Universidade de Ribeirão Preto, ao Departamento de Biotecnologia de plantas medicinais, pela
oportunidade.
Aos Professores Doutores Sonia Marli Zingaretti e Mozart Marins, pelo apoio, orientação,
conhecimento e confiança. Muito Obrigado!
Aos professores do Departamento de Biotecnologia, pela atenção e pelos ensinamentos. Ana
Lúcia Fachin, Ana Maria Soares Pereira, Suzelei de Castro França, Milton Faria Junior, Renê
Beleboni, Mirian Lourenço, Bianca Waleria Bertoni, Paulo Sergio Pereira.
Ás técnicas Simone Cristina Zampollo Torres, Patrícia Garnica Roberto, pela importante amizade
conquistada e pelo apoio de todos os dias no laboratório de biologia molecular desta instituição.
Aos amigos, Diogo Ferreira Guimarães, Maria Fernanda de Arruda Palma, Luana Pietro, Douglas
Catanante, Lívia Mendonça, Rosany, Lianara Barbosa, Georgeo Ribeiro, João Paulo Vinha Pittar,
Erica Costa Aguiar, Alexandra Costa Aguiar, Gilberto Costa Aguiar, Vanessa Colnaghi
Fernandes, Paula Matrangulo, Rosana Caetano, Antonio Coutinho, Alessandra Garnica,
Adilvania Costa, Cristiane Baiana, André Araújo Pereira, Juliana Coppede, Teresa Cofre,
Giovana Pirolla, Vanessa Zissou, Ana Clara Bou Castelo, Fernanda Suzano, pela amizade,
incentivo, apoio e pelos momentos de descontração.
À estagiária Viviane Fátima da Silva, por toda ajuda e amizade.
Ao amigo Carlos Ono, muito obrigado.
À CAPES pela bolsa de mestrado.
À FAPESP pelo suporte financeiro.
SUMÁRIO
CONTEÚDO
Página
LISTA DE ABREVIATURAS
I
LISTA DE FIGURAS
V
LISTA DE TABELAS
VIII
RESUMO
IX
ABSTRACT
X
1 INTRODUÇÃO
1
1.1 Plantas Medicinais
1
1.1.2 Dipteryx odorata (Aubl) Willd
3
1.1.3 Eclipta alba (L.) Hassk
4
1.2 Metabolismo da planta
6
1.2.1 Via dos fenilpropanóides
9
1.2.2 Flavonóides
11
1.2.3 Isoflavonóides
12
1.2.4 Enzimas chave da regulação do eixo principal e ramificação da via de
fenilpropanóide
13
1.2.5 Isoflavona Sintase
14
1.2.6 Isoflavona Redutase
14
1.2.7 Chalconas
15
1.2.7.1 Chalcona sintase
15
1.3 Biotecnologia
19
2 OBJETIVO
20
3 MATERIAL E MÉTODOS
22
3.1 Busca pela seqüência das enzimas
22
3.2 Análise da seqüência de nucleotídeos
22
3.3 Alinhamento das seqüências
22
3.4 Material Vegetal
22
3.5 Extração de DNA
23
3.6 Extração de RNA Total
24
3.7 Preparo do cDNA
25
3.7.1 Tratamento das amostras de RNA com DNase
25
3.7.2 Síntese do cDNA
25
3.8 Amplificação dos fragmentos
26
3.9 Purificação do produto gerado por PCR
26
3.10. Preparo de células competentes
27
3.11 Reação de ligação
27
3.12 Transformação Bacteriana
27
3.13 Extração do plasmídeo
28
3.14 Seqüenciamento
29
3.15 Análise in silico, programas computacionais utilizados
29
4 RESULTADOS E DISCUSSÃO
32
4.1 Construção dos iniciadores específicos
32
4.2 Amplificação por PCR
38
4.3 Amplificação do cDNA
41
4.4 Seqüência de nucleotídeos obtida
42
5 CONCLUSÃO
53
6 BIBLIOGRAFIA
55
ANEXOS
64
I
LISTA DE ABREVIATURAS
µg
microgramas
µl
microlitros
ºC
graus celsius
cDNA
DNA complementar
CHI
enzima chalcona isomerase
CHS
enzima chalcona sintase
CHS 41
iniciador específico para amplificação do gene CHS
CHS 42
iniciador específico para amplificação do gene CHS
cm
centímetros
DEPC
dimetil pirocarbonato
DH10B
linhagem
de
E.
coli,
F-mcrAD(mrr-hsdRMS-mcrBC)f80dlac
ZDM15DlacX74deoR recA1 endA1 araD139 D(ara, leu)7697 galU galK l-rpsL nupG
DL
dose letal
DNA
ácido desoxirribonucléico
DNA ZOL
mistura contendo fenol, usada para extração de DNA.
dNTP
desoxinucleotídeos
DTT
dietiltreitol
DWL
demetil wedelo lactona
EDTA
ácido etileno diamino tetracético
EtOH
etanol
F3H
flavanóide 3-Hidroxlase
g
gramas
H2O
água
II
H-BOH
hiosciamina 6β-hidroxilase
IFR
enzima isoflavona redutase
ISFR 1
iniciador específico para amplificação do gene IFR
ISFR 2
iniciador específico para amplificação do gene IFR
IFS
enzima isoflavona sintase
ISFS 1
iniciador específico para amplificação do gene IFS
ISFS 2
iniciador específico para amplificação do gene IFS
kb
kilobase
l
litros
LB
meio de cultura Luria Bertani
M
molar
M13F
iniciador universal direto
M13R
iniciador universal reverso
MER
unidade de tamanho dos iniciadores
MeOH
metanol
mg
miligramas
MgCl2
cloreto de magnésio
Min
minutos
ml
mililitros
mM
milimolar
mm
milímetros
MOPS
ácido 3- (N - morfolino) propanosufônico
MS
meio de cultura Murashige & Skoog
ng
nanograma
NADPH
nicotinamida adenina dinucleotídeo fosfato na forma reduzida
III
NCBI
national center for biotechnology information
OD
densidade óptica
OMS
organização mundial da saúde
PAL
enzima fenilalanima amonialiase
pb
pares de base
PBS
tampão salina-fosfato
PCR
reação em cadeia da polimerase
pGEM
vetor plasmidial
pH
potencial hidrogeniônico
pmols
picomoles
RNA
ácido ribonucléico
Rnase H
Ribonuclease H enzima que degrada fitas de RNA/DNA hibridas
rpm
rotações por minuto
RT-PCR
reação em cadeia da polimerase com transcriptase reversa
SDS
duodecil sulfato de sódio
seg
segundos
S.N.A.P
“a simple nucleic acid prep” (invitrogen)
SS
enzima estrictosidina-sintase
TEB
tampão de eletroforese (Tris/Ácido bórico/EDTA)
TE
solução de Tris 10mM e EDTA 1mM, pH 8,0
TEMP
temperatura
TRIS
hidroxmetilaminometano
T4 DNA
enzima de modificadora ligase
TDC
enzima triptofano-descarboxilase
U
unidades
IV
UV
ultra violeta
V
volts
WL
wedelolactona
V
LISTA DE FIGURAS
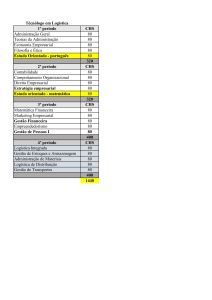
Figura 1: Dipteryx odorata (Aubl) Willd; (A) porte da árvore; (B) folhas e flores; (C) fruto; (D)
semente; (E) casca; (F) Apresentação visual da madeira extraída da planta.
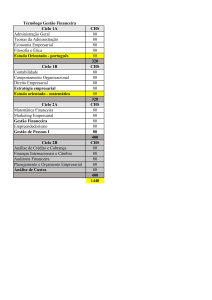
Figura 2: Eclipta alba. (A) folhas e flor; (B) caule com flores e folhas; (C) aspecto natural
característica de plantas rasteiras; Arquivo pessoal.
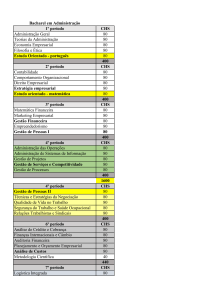
Figura 3: Ciclo biossintético dos metabólicos secundários.
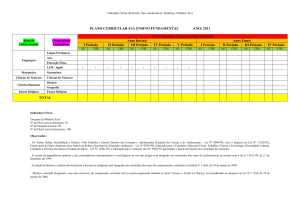
Figura 4: Biossíntese do ácido chiquímico.
Figura 5: Formação de composto fenilpropanóides.
Figura 6: Biossíntese de derivados cumarínicos.
Figura 7: Núcleo fundamental dos flavonoides e sua numeração (a). Núcleo fundamental da
chalcona (b).
Figura 8: Representação esquemática da via de biossíntese do fenilpropanóide em Glycine max
(soja).
Figura 9: Alinhamento de seqüências de nucleotídeos para o gene que codifica a enzima
Chalcona Sintase CHS (EC 2.3.1.74). Os quadros em azul representam as regiões conservadas
utilizadas para a construção dos iniciadores CHS41 e CHS 42. Os iniciadores encontram-se
destacados na figura.
VI
Figura 10: Alinhamento de seqüências de nucleotídeos para o gene que codifica a enzima
Isoflavona Redutase IFR (EC 1.3.1.45). Os quadros em azul representam as regiões conservadas
utilizadas para a construção dos iniciadores ISFR 1 e ISFR 2. Os iniciadores encontram-se
destacados na figura.
Figura 11: Alinhamento de seqüências de nucleotídeos já conhecidas em plantas para o gene que
codifica a enzima Isoflavona Sintase IFS (EC 2.1.1.44). Os quadros em azul representam as
regiões conservadas utilizadas para a construção dos iniciadores ISFS 1 e ISFS 2. Os iniciadores
encontram-se destacados na figura.
Figura 12: Eletrofotograma do gel de agarose a 0,8% Tampão TEB 1X. Fragmentos
amplificados por PCR dos genes CHS, IFR e IFS utilizando DNA genômico das plantas D.
odorata (d, g & j) e E. alba (c, f & i); (a) Padrão de Peso molecular 1Kb Plus Invitrogen; (b, e &
h) Branco; (c & d) fragmento do gene da CHS; (f & g) fragmentos do gene IFR; (i & j)
fragmentos do gene IFS obtidos para as plantas E. alba e D. odorata respectivamente. Utilizou-se
10 pmoles dos iniciadores em cada uma das reações.
Figura 13: Eletroforograma do gel de agarose a 0,8%; Tampão TEB 1X. Fragmentos
amplificados por PCR dos genes CHS, IFR e IFS utilizando DNA genômico da planta E. alba;
(a) Padrão de Peso molecular 1Kb Plus Invitrogen; (b, f & j) Branco; (c, d & e) utilizando o
primer CHS41 e CHS42, fragmento do gene da CHS; (g, h & i) utilizando o primer ISFR1 e
ISFR2, fragmento do gene da IFR; (k, l & m) utilizando o primer ISFS1 e ISFS2, fragmento do
gene da IFS. Utilizou-se 10 pmoles dos iniciadores em cada uma das reações.
Figura 14: Eletroforese em gel de agarose 1% Tampão TEB 1X dos fragmentos amplificados por
PCR do gene CHS. A. utilizando cDNA da planta D. odorata; (a) Padrão de Peso molecular 1Kb
Plus Invitrogen; (b) hipocótilo; (c) cotilédone; (d) folhas; (e) calos. B. utilizando cDNA da
planta E. alba. (a) Padrão de peso molecular 1Kb GE; (b) Clone 19; (c) Raiz; (d) Folha; (e) Parte
aérea, usando os iniciadores CHS 41 e CHS 42.
Usando os iniciadores CHS 41 e CHS 42.
VII
Figura 15: Seqüência consenso de nucleotídeos determinada para um fragmento do cDNA do
gene da CHS expressos em folhas de Dipteryx odorata..
Figura 16: Gráfico do alinhamento da seqüência de nucleotídeos para o cDNA do gene de
Chalcona sintase de folha de D odorata, obtido no programa BLAST contra o banco de dados
Genbank (http://www.ncbi.nlm.nih.gov/). Traços vermelhos significam alinhamento de seqüência
maior ou igual a 200 nucleotídeos.
Figura 17: Alinhamento realizado com o programa Clustal X (1.83) foi usado a seqüência
consenso (folha Dipteryx odorata) mais as 13 seqüências usadas no desenho do iniciador CHS 41
e CHS 42.
Figura 18: Dendograma construído a partir do alinhamento realizado com o programa Clustal X
(1.83); foi usado a seqüência consenso (folha CHS Dipteryx odorata) mais as 13 seqüências
usadas no desenho do iniciador CHS 41 e CHS 42. O quadro em azul coloca em destaque as
seqüências de RNA de Calos e de folha da planta D. odorata.
Figura 19: Alinhamento, utilizando o programa BLASTN, das seqüências de D. odorata de calos
(gi|148954096|) “subject” e de folha “query”, verifica-se que as duas seqüências apresentam
diferenças na seqüência de nucleotídeos.
Figura 20: Seqüência protéica Folha CHS Dipteryx odorata. Gerada no programa ORF Finder.
Figura 21 Alinhamento das seqüências de aminoácidos deduzidas das seqüências de nucleotídeos
de CHS de calos (gi|148954096|) e CHS expresso em folhas de D. odorata.
VIII
LISTA DE TABELAS
Tabela 01 Número de identificação das seqüências de nucleotídeos recuperadas do GenBank
referentes a genes da enzima IFR.
Tabela 02: Número de identificação das seqüências de nucleotídeos recuperadas do GenBank
referentes a genes da enzima CHS.
Tabela 03: Número de identificação de nucleotídeos recuperadas do GenBank referentes a genes
da enzima IFS.
Tabela 04: Seqüências de nucleotídeos dos iniciadores gerados a partir de regiões conservadas
dos genes das enzimas CHS, IFR e IFS e suas principais características
Tabela 05: Relação das seqüências de nucleotídeos que apresentaram similaridade com a
seqüência de nucleotídeos submetida. Tabela gerada pelo programa blastn Programa da
ferramenta BLAST (http://www.ncbi.nlm.nih.gov/).
IX
Resumo
As plantas medicinais são ricas em metabólitos secundários, a biossíntese destes
compostos muitas vezes é decorrente da adaptação das espécies às condições de estresse físico e
biológico a que são submetidas. A grande importância dos metabólitos secundários reside na sua
eficácia no tratamento da saúde humana e animal. O estudo da regulação das vias de síntese
destes compostos fitoquímicos desperta o interesse dos pesquisadores e da indústria farmacêutica,
pois possibilita a manipulação genética das espécies podendo garantir uma maior produção
dessas biomoléculas. A caracterização molecular da enzima chalcona sintase (CHS), enzima
chave dentre as enzimas da via de síntese dos fenilpropanóides poderá ser de grande valia no
processo de entendimento da regulação da biossíntese dos fenilpropanóides. Nesta prospecção
foram utilizadas as plantas Dipteryx odorata (Aubl) Willd e Eclipta alba (L.) Hassk, sendo a
primeira de suma importância por acumular altos níveis de cumarinas nas sementes e isoflavonas
bioativas e triterpenos os quais são compostos metabólitos secundários com alta atividade
fitoquímica; a espécie Eclipta alba (L.) Hassk por produzir cumestanos, um subproduto da via de
síntese dos fenilpropanóide. Para atender aos objetivos foram produzidos iniciadores para os
genes da chalcona sintase (CHS), isoflavona redutase (IFR) e isoflavona sintase (IFS) baseados
no alinhamento de seqüências de nucleotídeos de diferentes espécies vegetais. A seqüência de
nucleotídeos dos fragmentos amplificados apresentou alta similaridade com outras seqüência já
depositadas no GenBank, confirmando a eficiência na elaboração dos iniciadores. O alinhamento
da seqüência de nucleotídeos obtida para folha de D. odorata foi comparada à seqüência de CHS
obtida para calus da mesma planta e as diferenças encontradas podem sugerir a existência de
isoformas.
Palavras Chaves: Metabólito secundário, Enzimas, Plantas Medicinais.
X
Abstract
Medicinal plants are rich in secondary metabolites, whose biosynthesis is frequently due
to the species adaptation to physical and biological stress conditions to which they are submitted.
Secondary metabolites are of such great importance mainly because of their effectiveness in
human and animal health treatments. Studies on the regulations of biosynthesis pathways of these
phytochemical compounds arouse the interest of researchers and of the pharmaceutical industry,
for it allows the genetic manipulation of species, which may warrant greater production levels of
these biomolecules. The molecular characterization of the chalcone synthase enzyme (CHS) is of
great value to understanding the phenylpropanoid biosynthesis regulation process. For this
prospection, Dipteryx odorata (Aubl) Willd and Eclipta alba (L.) Hassk plants were used.
Dipteryx odorata (Aubl) Willd is of utmost importance due to its capacity to accumulate high
levels of cumarines in its seeds, as well as bioactive isoflavones and triterpenes, which are
secondary metabolite compounds of high phytochemical activity; and Eclipta alba (L.) Hassk, for
its ability to produce cumestanes, which are phenylpropanoid biosynthesis pathway sub-products.
In order to fulfill the requirements of this research, initiators for chalcone synthase (CHS),
isoflavone reductase (IFR) and isoflavone synthase (IFS) genes were produced based on the
alignment of nucleotide sequences from different vegetal species. The amplified nucleotide
fragment sequence presented high similarity to other sequences on GenBank, confirming the
effectiveness of the initiator production. The alignment of nucleotide fragment sequences
obtained for D. odorata leaves was compared to the CHS sequence obtained for the callus of the
same plant and the differences found may suggest the existence of isoforms.
Key words: Secondary metabolites, Enzymes, Medicinal Plants.
"Para o triunfo do mal basta que os bons fiquem de braços cruzados"
Edmund Burke.
INTRODUÇÃO
1 INTRODUÇÃO
1.1 Plantas medicinais
Desde os primórdios das civilizações as plantas já eram utilizadas como fonte de
medicamentos para o tratamento das enfermidades. Os Suméricos, população que residia às
margens do rio Tigre e Eufrates por volta de 4000 a.C., através de escrita cuneiforme em placas
de barro, registraram o uso de plantas como remédios, incluindo o tomilho, ópio, alcaçuz e
mostarda (BALBACH, 1980). Na civilização egípcia surgem os primeiros textos médicos,
destacando o Papiro de Ébers, onde são encontradas cerca de oitocentas receitas e referências a
mais de setecentas variações como a babosa, absinto, hortelã, mirra, dentre outras
(ALMEIDA, 1993).
As plantas medicinais podem ser usadas em preparações diversas para serem ingeridas
(uso interno ou sistêmico) ou para uso na pele, nas mucosas das cavidades naturais (uso externo
ou tópico). Apesar da diferença entre as duas formas de uso, o homem percebeu, de alguma
forma, a presença na planta, de substâncias que, quando administradas, teriam a propriedade de
provocar reações benéficas no organismo, capazes de resultar na recuperação da saúde. Esses
compostos atuantes denominados princípios ativos, podem ser constituídos de uma única ou de
um conjunto de substâncias existentes na planta que atuam sinergicamente (chamado de
complexo fitoterápico ou fitocomplexo).
Com base nesses conceitos, a Organização Mundial de Saúde (OMS), recomenda aos
órgãos responsáveis pela saúde pública de cada país, que procedam a levantamentos regionais das
plantas usadas na medicina popular tradicional, identificando-as botanicamente, estimulando e
recomendando o uso daquelas que tiverem comprovadas sua eficácia e segurança. Atuam também
desenvolvendo programas que permitam cultivar e utilizar as plantas selecionadas na forma de
preparações dotada de eficácia, segurança e qualidade (AKELERE, 1993).
A literatura relata novas biomoléculas, algumas de relevante ação farmacológica, como
por exemplo, o taxol, isolado da planta Taxus brevifolia, essa biomolécula apresenta atividade
clínica excelente contra câncer de ovário e de pulmões apresentando-se como uma promessa de
boa atividade no tratamento de outras neoplasias (CHAUDHARY et al., 1994), e a artemisinina
presente
na
espécie
Artemísia
annua,
que
exerce
potente
atividade
antimalárica
(CECHINEL – FILHO e YUNES, 1998). É importante mencionar que as plantas, além de seu
uso na medicina popular com finalidades terapêuticas, têm contribuído ao longo dos anos para a
obtenção de vários fármacos, até hoje utilizados, como por exemplo, a morfina (anestésico), a
vincristina (antitumoral), além da rutina (vasodilatadora), (CECHINEL – FILHO e YUNES,
1998; NODARI e GUERRA, 1999). Ainda, segundo os autores, no final da década de 90, cerca
de 75% dos compostos puros naturais empregados na indústria farmacêutica, foram isolados
seguindo recomendações da medicina popular (CECHINEL – FILHO e YUNES, 1998).
No Brasil, apenas 8% das espécies vegetais foram estudados em busca de compostos
bioativos e 1.100 espécies vegetais foram avaliadas em suas propriedades medicinais
(GARCIA, 1995). O estudo de plantas medicinais justifica-se pela importância que assume na
descoberta de várias substâncias com aplicação na medicina, agricultura e outras áreas.
1.1.2 Dipteryx odorata (Aubl) Willd
Dipteryx odorata (Aubl) Willd é uma planta medicinal da família Fabaceae, conhecida na
medicina popular como Cumaru, em virtude do acúmulo de cumarinas nas suas sementes.
Segundo Kuster et al., (2004) as cumarinas são encontradas nas sementes numa concentração de
1 a 3%, são biomoléculas com grande potencial de uso em perfumarias e cosméticos
(MENDES e SILVEIRA, 1994) o que lhe atribui um grande valor comercial.
É uma árvore nativa da região da Amazônica, presente desde o estado do Acre até o
Maranhão, apresenta porte elevado, com até 30 m de altura na mata primária, mas de menor
altura quando cultivada, (Figura 1) (LORENZIN, 1998; DUCKE, 1948; MORS et al., 2000). A
casca de seu tronco é lisa, de cor amarela com cheiro muito agradável. O fruto é uma drupa de
cor verde amarelo, com pericarpo de cheiro agradável e sabor amargo. Suas flores aromáticas,
dispostas em panículas longas, exalam um perfume forte e agradável. As sementes têm a cor
pardo avermelhada quando verdes tornado-se preta quando madura, possuem forte odor de
cumarina e fornece, por extração um óleo, fixo também aromático que, facilmente se rancifica
(SOUSA, 1991).
A
C
D
B
E
F
Figura 1: Dipteryx odorata (Aubl) Willd; (A) porte da árvore; (B) folhas e flores; (C) fruto; (D) semente; (E) casca;
(F) Apresentação visual da madeira extraída da planta. Fonte: LORENZI; SOUZA 1998, p. 198.
Estudos fitoquímicos baseados nas análises de extratos brutos desta planta demonstraram
a presença de isoflavonas bioativas como a 7-hidroxi-4’, 6-dimetoxisoflavona e 3’, 7dimetoxisoflavona acumuladas em culturas in vitro de calos de Dipteryx odorata (Aubl) Willd
(JANUÁRIO et al., 2005), além destes, outros compostos como os triterpenos, lupeol e betulina
também foram encontrados (VIEIRA JÚNIOR, 2007).
1.1.3 Eclipta alba (L.) Hassk.
Eclipta alba (L.) Hassk. pertencente a família Asteraceae é conhecida popularmente como
agrião-do-brejo ou erva-botão. Trata-se de uma erva silvestre, comum nos terrenos úmidos e
sombreados de todo o mundo tropical, sendo considerada planta daninha em todo o Brasil
(LORENZI, et al., 2002).
É uma erva ereta, de ramos finos e lenhosos, com folhas sésseis, oblongo-lanceoladas,
cartáceas de 3-5 cm de comprimento. Possui inflorescências em capítulos de bordo
esbranquiçados, axilares e terminais. Seus frutos são do tipo aquênio, com cerca de 2 mm de
comprimento, de cor preta e muito numerosos (SOUSA, et al., 1991), (Figura 2).
A
B
C
Figura 2: Eclipta alba (L.) Hassk. (A) folhas e flor; (B) caule com flores e folhas; (C) aspecto natural característica
de plantas rasteiras; (Arquivo pessoal).
Segundo Wagner et al., (1986), na Índia a E. alba (L.) Hassk é uma das plantas principais
da medicina tradicional Ayuverdica, usada como medicação hepatoprotetora no tratamento de
hepatite a vírus ou tóxicas. No Brasil a literatura etnofarmacológica registra seu uso no combate a
tosse, bronquite, asma, diarréia e sífilis, bem como no emprego do suco extraído das folhas, ao
qual se atribui a propriedade de diminuir os sintomas provocados pela ferroada de escorpião e
picada de serpentes; registra ainda, propriedades colagoga, tônica, emética, purgativa,
desobstruente e antiinflamatória, especialmente para os males do fígado (SOUSA, et al., 1991). É
importante ressaltar que a eficácia e a segurança desta planta, já foi comprovada cientificamente,
como antiinflamatória, proteção hepática e neutralizadora do veneno de serpentes
(MATOS, 2000).
O estudo químico da planta mostra que os seus constituintes mais importantes são os
flavonóides do tipo cumestano, wedelolactona (WL) e demetilwedelolactona (DWL), por sua
atividade hepatoprotetora e imunoestimulante (WAGNER, et al., 1986; CHANDRA, et al., 1987;
SAXENA, et al., 1993; SYED, et al., 2003; JAYATHIRTHA, et al., 2004). Em modelos
experimentais foi possível comprovar que o extrato dessa planta apresenta ação protetora do
fígado, inibindo a ação necrosante sobre as células hepáticas provocadas pela administração do
tetracloreto de carbono (CHANDRA, et al., 1987). Estudos comprovam que o extrato bruto dessa
planta inibiu os efeitos hepatotóxicos provocados pelo veneno de Bothrops jararacussu (jararaca)
e de Crotalus durissus terrificus (cascavel) em ratos que resistiram até o triplo da DL 50,
deixando os animais do experimento imunizados (MORS, et al., 2000).
O crescente emprego que se faz desta planta no Brasil, bem como sua comprovada
atividade hepatoprotetora e imunomoduladora se constituem em motivo suficiente para sua
escolha como tema de estudos químicos, farmacológicos, bioquímicos, genéticos e clínicos
visando sua validação como medicamento eficaz e seguro (LORENZI, et al., 2002).
1.2 Metabolismo das Plantas
Define–se metabolismo como o conjunto de reações químicas que continuamente estão
ocorrendo em cada célula. Estas são divididas em catabolismo (reações de degradação),
anabolismo (reações de síntese) e biotransformação (SANTOS, 2004).
O metabolismo primário corresponde às vias metabólicas ligadas diretamente às funções
básicas e essenciais para a sobrevivência da planta (como a fotossíntese e as trocas gasosas),
enquanto que, o metabolismo secundário, corresponde às vias metabólicas ativadas como uma
das principais respostas das plantas às alterações do ambiente ao seu redor, como por exemplo, o
estresse
hídrico,
intensa
exposição
à
radiação
UV
e
ataques
microbianos
(MANN, 1987; VERPOORTE, et al., 2000). Os metabólitos secundários estão associados a
várias funções biológicas e possuem importante papel na interação entre a planta e o seu meio
ambiente (FRANÇA, et al., 2001).
Existem diferentes rotas biossintéticas dos metabólitos secundários no reino vegetal,
destacando-se neste estudo a via do Chiquimato (Figura 3), onde são produzidos os aminoácidos
aromáticos precursores dos fenilpropanóides, derivados do ácido chiquímico (DEWICK, 1997).
Figura 3: Ciclo biossintético dos metabólicos secundários. Fonte: SIMÕES, et al., 2004, p. 411.
O ácido chiquímico é formado pela condensação aldólica de dois metabólitos da glicose:
o fosfoenolpiruvato e a eritrose-4-fosfato. Uma vez formado, o ácido chiquímico pode ser
metabolizado em ácido corísmico ou ácido gálico. Como o pH prevalente na planta torna os
ácidos ionizados, tem-se, de fato, chiquimato, corismato e galato, respectivamente
(SANTOS, 2004).
Sabe-se que a rota do ácido chiquímico, decorrente da conversão de precursores de
carboidratos, derivados da glicose e da rota da pentose fosfato, em aminoácidos aromáticos,
presente em plantas, fungos e bactérias, não ocorre em animais. Em conseqüência, os mesmos
não podem sintetizar três aminoácidos aromáticos – fenilalanina, tirosina e triptofano – que são,
portanto, nutrientes essenciais a serem incorporados na dieta, (Figura 4).
Figura 4: Biossíntese do ácido chiquímico. Fonte: SIMÕES, et al., 2004, p. 413.
A formação de muitos compostos fenólicos vegetais, incluindo fenilpropanóides simples,
cumarinas, derivados do ácido benzóico, lignina, antocianinas, isoflavonas, taninos condensados
e outros flavonóides, inicia-se com a fenilalanina (YAMADA, 2004).
1.2.1 Via dos fenilpropanóides
Dentre as vias de biossíntese de compostos secundários em plantas, destaca-se a via de
síntese dos fenilpropanóides, com a produção de chalconas, composto responsável pela síntese de
isoflavonas, com comprovada atividade antifúngica (RIVERA – VARGAS, et al., 1993), bem
como precursores da síntese de fitoalexinas (DIXON, 1986; DIXON e HARRIS, 1990;
BLOUNT, et al., 1992) cujo consumo tem sido associado a decréscimos no risco de ataques
cardíacos (DAVIS, et al., 1999).
Os fenilpropanóides se formam a partir do ácido chiquímico (1), que formam as unidades
básicas dos ácidos cinâmicos (2) e p-cumárico (3), onde esses últimos, por meio de reduções
enzimáticas produzem propenilbenzenos (4) e/ou alilbenzenos (6) e, por meio de oxidação com
degradação das cadeias laterais, geram aldeídos aromáticos (5); ciclizações enzimáticas
intramoleculares produzem cumarinas (7), (Figura 5). (SIMÕES, et al., 2004).
Figura 5: Formação de composto fenilpropanóides. Fonte: SIMÕES, et al., 2004, p. 469.
Santos (2004) em um estudo sobre o metabolismo básico e origem dos metabólitos
secundários mostrou que a fenilalanina, pela ação da enzima fenilalanima amonialiase (PAL),
perde uma molécula de amônia, originando o ácido cianâmico e que a regulação dessa enzima é
um fator crítico na produção dos metabólitos do chiquímico. Segundo o autor, nas plantas, a
atividade da PAL está sob controle de vários fatores internos e externos, tais como: as taxas
hormonais, os níveis de nutrientes, luz, infecção por fungos e lesões. Os ácidos cinâmicos são os
precursores da maioria dos compostos classificados como fenilpropanóides (ArC3), que se
definem como compostos aromáticos com uma cadeia lateral de três carbonos, ligada ao anel
aromático. Muitos compostos fenólicos simples desempenham um papel importante na defesa do
vegetal contra insetos, herbívoros e fungos. (SANTOS, 2004).
Compostos fenólicos mais complexos são biossintetizados a partir de unidades
formadoras dos fenilpropanóides, como as cumarinas que são amplamente distribuídas nos
vegetais e podem também ser encontradas em fungos e bactérias. Estruturalmente, são lactonas
do ácido ο-hidróxi-cinâmico (2H-1-benzopiran–2–onas), sendo o representante mais simples da
cumarina o 1,2-benzopirona (KUSTER, et al., 2004).
As cumarinas são derivadas da 5,6-benzo-2pirona (α-cromona), originam-se do ácido
trans-cinâmico que, por oxidação, resultam no ácido ο-cumárico, cuja hidroxila fenólica
condensa com uma unidade de glicose (Figura 6). Esse composto transforma-se no seu isomero
cis, o qual por ciclização forma a cumarina. (SANTOS, 2004).
1.2.2 Flavonóides
Os flavonóides representam um dos grupos fenólicos mais importantes e diversificados
entre os produtos de origem natural, com ampla distribuição no reino vegetal. Os flavonóides
podem ser encontrados em diversas formas estruturais, entretanto, a maioria dos representantes
dessa classe possui 15 átomos de carbono em seu núcleo fundamental, constituído de duas fenilas
ligadas por uma cadeia de três carbonos entre elas. Nos compostos tricíclicos, as unidades são
chamadas de núcleos A, B e C e os átomos de carbono recebem a numeração com números
ordinários para os núcleos A e C e os mesmos números seguidos de uma linha (`) para o núcleo B
7(a). As chalconas possuem uma numeração diferente, 1(b). Até o presente momento, são
conhecidos mais de 4.200 flavonóides diferentes, sendo que o número de novas estruturas
identificadas praticamente dobrou nos últimos 20 anos (ZUANAZZI, et al., 2004).
Figura 6: Biossíntese de derivados cumarínicos. Fonte: SIMÕES, et al., 2004, p. 420.
Os flavonóides possuem funções diversificadas, entre elas a proteção dos vegetais contra
a incidência de raios ultravioleta, visível e contra patógenos; constitui-se também em um atrativo
de animais e insetos com finalidade da polinização; participa também do controle da ação de
hormônios vegetais, como agentes alelopáticos e inibidores de enzimas (HARBORNE, 1989;
HARBORNE e WILLIAMS, 2000).
a
b
Figura 7: Esqueleto fundamental dos flavonoides e sua numeração (a). Estrutura fundamental da chalcona (b),
Fonte: SIMÕES, et al., 2004, p. 579 (a), 585 (b).
1.2.3 Isoflavonóides
Os isoflavonóides são caracterizados, como flavonóides, por uma cadeia arila-C3-arila,
mas do tipo difenil-1,2-propano. Ao contrário das outras classes de flavonóides, sua distribuição
taxonômica
é
restrita
e
são
de
ocorrência
quase
exclusiva
em
Fabaceae
(ZUANAZZI, et al., 2004).
Estes compostos são produzidos quase que exclusivamente em leguminosas, tendo papel
importante na defesa da planta e na nodulação da raiz (LUCZKIEWICZ e GLOD, 2003). Estas
biomoléculas possuem importâncias farmacológica devido as suas propriedades terapêuticas
multidirecionais como antioxidante, antifúngico, contraceptivo, anti-inflamatório, fitoestrógeno e
na prevenção contra o câncer (LUCZKIEWICZ e GLOD, 2003.; DASTIDAR, et al., 2004;
JANG, et al., 2003).
Como todo flavonóide, os isoflavonóides são produzidos a partir da combinação ,de
produtos das vias do chiquimato e do acetato, onde todos os flavonóides são formados a partir de
um precursor chalcona, o produto da condensação do 4-coumaroyl CoA (produto central da via
dos fenilpropanóides) e três moléculas de malonyl CoA pela ação da enzima chalcona sintase. A
chalcona sofre ação da enzima isomerase para produzir uma flavona, que por sua vez sofre ação
da enzima isoflavona sintase (DIXON e STEELE, 1999).
1.2.4 Enzimas chaves na regulação do eixo principal e ramificação da via de
fenilpropanóide
O completo entendimento da regulação catalítica de fluxo das vias de biossíntese dos
metabólitos secundários é de grande interesse da indústria farmacêutica, pois propicia a
manipulação bioquímica e genética em processos biotecnológicos garantindo uma maior
produção economicamente viável e continua dos metabólitos ativos.
1.2.5 Isoflavona Sintase
A isoflavona sintase (IFS) é uma enzima que catalisa o passo decisivo para a biossíntese
dos isoflavonóides (Figura 8) (ZABALA, et al., 2006), em pelo menos duas reações incomuns
para uma proteína, sendo uma reação de hidroxilação e uma reação de migração de um grupo
arila. A reação envolve a conversão de uma 2S-flavanona a 2-hidróxisoflavanona, seguida pela
sua conversão em isoflavonóide (STEELE, et al., 1999). A função das enzimas envolvidas nos
metabolismo secundário como as chaconas e isoflavonas têm sido estudas em experimentos de
transgênia visando a determinação exata de sua função. Tian e Dixon, (2006) utilizaram os genes
da isoflavona sintase (IFS), chalcona isomerase (CHI) e a fusão gênica entre IFS/CHI, isolados
de soja e alfafa, respectivamente, em estudos de metabolismo. Os genes foram utilizados para a
transformação de tabaco numa construção utilizando o promotor 35S. Folhas jovens e pétalas de
tabaco contendo a fusão gênica IFS/CHI produziram altos níveis de genesteína e glicosídeo
genesteína quando comparadas com as plantas onde foi introduzido o gene da IFS.
Sreevidya, et al., (2006) verificaram a produção de flavonóides em rizoma de arroz após a
inserção do gene da IFS. Em soja, o polimorfismo e a expressão do gene IFS foi estudado em 18
cultivares, sendo 16 Glycine max e 2 Glycine soya. O estudo foi realizado por RT-PCR e
iniciadores específicos para os genes da CHI, Flavanon, 3-Hidroxlase (F3H) e IFS. Os resultados
encontrados comprovam que a expressão dos três genes IFS, CHI e F3H estava sobre controle
circadiano, ou seja, a expressão genética aumentava de acordo com o desenvolvimento do ciclo
de vida da planta (KIM, et al., 2004).
1.2.6 Isoflavona Redutase
A isoflavona redutase (IFR) é uma enzima especifica da via de biossíntese dos
isoflavonóides (Figura 8) (ZABALA, et al., 2006), encontrada tipicamente em leguminosas. Ela
catalisa uma redução NADPH – dependente, envolvida na biossíntese de compostos derivados da
via dos fenilpropanóides, e teve sua importância relacionada ao sistema de defesa das plantas
(FRANÇA, et al., 2001). Pesquisadores realizaram um estudo relacionando a expressão do gene
IFR com o crescimento dos estames de pólen da espécie Solanum tuberosum (batata), eles
chegaram a mostrar, que a expressão do gene da IFR, ocorre na primeira hora da polinização e
mais tarde com 72 horas de polinização (VAN ELDIK, et al., 1997).
1.2.7 Chalconas
O termo chalcona é utilizado para caracterizar uma família de compostos possuindo como
esqueleto fundamental o 1,3-diarilpropano, modificado pela presença de uma ligação olefínica,
de um grupamento cetona e/ou de um grupo hidroxila (ZUANAZZI, et al., 2004).
As chalconas apresentam uma grande variedade de atividades biológicas, sendo as mais
comuns edulcorantes ou protetores contra o calor e luz. Esses compostos são encontrados em
diferentes órgãos vegetais, sobretudo nas flores. Em alguns membros das famílias Asteraceae,
Oxalidaceae, Scrophulariaceae, Gesneriaceae, Acanthaceae e Liliceae, a presença das chalconas
contribui significativamente para a pigmentação amarela da corola. Grande parte da cor amarela
das plantas se deve à presença de carotenos, isso faz com que tenham um papel importante em
sistemas ecológicos em função das cores que produzem nos vegetais, com implicação direta no
processo de polinização agindo como atraentes para insetos e pássaros (ZUANAZZI,
et al., 2004).
1.2.7.1 Chalcona sintase
Genes da chalcona sintase (CHS) codificam a primeira enzima da via de síntese dos
flavonóides. A enzima atua catalisando a condensação de três resíduos de acetato do malonylCoA com p-coumaroyl-CoA, formando a naringenim chalcona, na primeira etapa da via de
síntese dos fenilpropanóides e precursora de compostos como os flavonóides, isoflavonóides e
antocianina em plantas (HELLER e HAHLBROCK, 1980), (Figura 8), (ZABALA, et al., 2006).
Campos et al., (2003), avaliando a atividade das enzimas chalcona sintase (CHS) e
Fenilalanina amônia-liase (PAL), em resposta a ação de indutores, como o ácido salicílico e
fungo o Colletotrichum lindemuthianum em extratos de folhas de quatro cultivares de feijão,
verificaram alterações significativas nas atividades enzimáticas depois de três dias de exposição
aos tratamentos indutivos quando foram comparados com o controle não induzido.
Outros estudos, envolvendo compostos intermediários da via de síntese dos
fenilpropanóides, suportam a hipótese de que o promotor do gene de chalcona sintase é regulado
por compostos intermediários da via, como o ácido trans anâmico, primeiro composto
intermediário da via. Esse intermediário em baixas concentrações age como indutor estimulando
a expressão enquanto concentrações muito altas causam uma regulação negativa, reprimindo a
expressão, (LOAKE, et al., 1991).
A elucidação completa da via do metabolismo dos flavonóides tem possibilitado a
determinação de possíveis funções de seus compostos intermediários em diferentes tecidos, tais
como a proteção UV, resistência aos patógenos e insetos.
Figura 8: Representação esquemática da via de biossíntese do fenilpropanóide em Glycine max (soja).
Fonte: Zabala, et al., 2006, p. 3.
Os produtos da via permitem que as plantas possam se adaptar melhor ao ambiente com
alto grau de estresse. Além disso, o estudo da evolução dos genes envolvidos no caminho
biossintético dos flavonóides, com destaque para o gene da CHS dos mais bem documentados, é
essencial a uma compreensão mais aprofundada do processo que determina a evolução adaptável
das espécies.
Neste sentido, França, et al., (2001) mostraram, em um estudo comparativo da biossíntese
de metabólitos secundários presentes na cana-de-açúcar, o perfil de genes expressos relacionados
ao metabolismo dos isoprenóides e dos fenilpropanóides e apontaram as ramificações do
metabolismo secundário ativado durante o estágio do desenvolvimento tecido-específicos e da
resposta adaptativa da cana-de-açúcar aos agentes indutores de estresses biológico e químico. Os
resultados obtidos se baseiam em ESTs cuja função putativa foi atribuída, sendo que a
funcionalidade dos produtos desses genes necessita ser confirmada por evidência bioquímica e
genética.
Vários autores reportam a clonagem e caracterização dos genes da enzima CHS para
diferentes espécies vegetais, como Zea mays (FRANKEN, et al., 1991), Sorghum bicolor
(LO e COOLBAUGH, 2002); Ginkgo biloba (PANG, et al., 2005) e Arabidopsis
(SASLOWSKY, et al., 2000). Pela comparação de suas seqüências é possível verificar que as
CHS apresentam estruturas conservadas (os genes chs possuem na maioria um intron e dois
exons) e parecem formar uma pequena família multigênica, muito embora a sequência genômica
e de cDNA da CHS seja conhecida para algumas plantas não o é totalmente conhecida para as
plantas medicinais (PANG, et al., 2005).
Akashi et al., (1999), clonaram de Glycyrrhiza echinata, o gene codificador de isoflavona
sintase, uma das enzimas chaves da via envolvida na síntese de genisteína e daidzeina. Em soja,
dois genes codificadores da enzima foram identificados e usados para estudos de expressão em
Arabidopsis e também no isolamento de genes homólogos em outras leguminosas (JUNG et al.,
2000). No entanto, a maioria dos genes da via de síntese de fenilpropanóides já caracterizados
pertence às monocotiledôneas sendo então necessária a caracterização desses genes em espécies
dicotiledôneas.
1.3 Biotecnologia
Apesar dos estudos com plantas medicinais terem aumentado nas últimas décadas a
maioria dos trabalhos concentra-se nos estudos fitoquímicos e ensaios de bioatividade ou ainda
no isolamento dos princípios ativos das plantas. As técnicas de biologia molecular, aliadas ao
estabelecimento de cultivo in vitro de D. odorata e E. alba, poderão permitir a manipulação
direcionada de genes importantes na tentativa de agregar valor econômico e expandir o potencial
biotecnológico de espécies nativas.
As primeiras etapas nessa direção, incluem a purificação e caracterização de enzimas
chaves das vias biossintéticas, o isolamento de micromoléculas biossintetizadas, clones de cDNA
e a superexpressão ou supressão de enzimas que regulam a biossíntese de metabólitos
secundários em tecidos específicos (FRANÇA, et al., 2004). A lista de genes que estão sendo
caracterizados vem crescendo continuamente; dentre eles os que codificam as enzimas
fenilalanina amonialiase (PAL), chalcona sintase (CHS) (KREUZALER et al., 1983), triptofanodescarboxilase (TDC) (DE LUCA, et al., 1989), estrictosidina-sintase (SS) (KUTCHAN, et al.,
1995) e hiosciamina 6β-hidroxilase (H-BOH) (HASHIMOTO, et al., 1991).
A expressão de um transgene em uma planta medicinal pode alterar o perfil de
metabólitos produzidos, de tal modo que o fluxo da via seja direcionado e que uma maior
quantidade de um composto ativo útil seja acumulada. A manipulação genética do metabolismo
de plantas pode ser realizada no sentido de produzir quantidades significativas de metabólitos de
alto valor farmacêutico (FRANÇA, et al., 2004).
OBJETIVO
2 OBJETIVO
Este trabalho teve por objetivo a prospecção molecular dos genes que codificam as
enzimas chalcona sintase (CHS), isoflavona sintase (IFS) e isoflavona redutase (IFR) em
Dipteryx odorata (Aubl) Willd e Eclipta alba (L.) Hassk, as quais regulam o fluxo da via de
biossíntese de metabólitos secundários da classe dos fenilpropanóides.
Específicos:
1- Busca em bancos de dados de seqüências de nucleotídeos de genes que codificam as
enzimas chalcona sintase, isoflavona sintase e isoflavona redutase, previamente conhecidos e já
disponíveis.
2- Identificação de regiões conservadas em seqüências de DNA dos genes CHS, IFS e IFR
de diferentes espécies vegetais e a geração de iniciadores específicos que possibilitem o
rastreamento destes genes em outras espécies de planta.
3-Amplificação dos fragmentos dos genes utilizando os iniciadores gerados.
4-Obtenção das seqüências de nucleotídeos dos fragmentos amplificados.
5-Análise estrutural “in sílico” das seqüências obtidas.
MATERIAL E MÉTODOS
3 MATERIAL E MÉTODOS
3.1 Busca pelas seqüências das enzimas
A busca foi feita a partir de combinações com palavras chaves em bancos de dados de
seqüências (GenBank) e foram selecionadas várias seqüências com alta similaridade.
3.2 Análise da seqüência de nucleotídeos
Para as análises das seqüências de nucleotídeos, foram utilizadas as ferramentas de
bioinformática disponíveis no NCBI “National Center For Biotechnology Information”
(http://www.ncbi.nlm.nih.gov/).
Blastn e Blastx (ALTSCHUL, et al., 1990) que possibilitam as
comparações de seqüência e apontam as similaridades entre elas.
3.3 Alinhamento das seqüências
O alinhamento das seqüências selecionadas foi realizado utilizando o programa Clustal X
(THOMPSON, et al., 1997), que permite o alinhamento de seqüências de nucleotídeos a partir de
suas seqüências FASTA e, assim, possibilita a visualização das regiões conservadas entre os
genes alinhados. Estas regiões conservadas foram selecionadas e novamente utilizando o
programa Blastn, foram comparadas com outras seqüências no GenBank para a confirmação de
sua identidade e categorização. A partir destas seqüências, foram desenhados um conjunto de
iniciadores para a amplificação de fragmentos de DNA genômico e cDNA de plantas medicinais.
3.4 Material Vegetal
Dentre as diferentes plantas medicinais tradicionalmente usadas pela população brasileira,
foram escolhidas a Dipteryx odorata (Aubl) Willd e Eclipta alba (L.) Hassk, que tem sido objeto
de estudos de metaboloma pelo grupo de Química de Produtos Naturais (QPN) da Unidade de
Biotecnologia da Universidade de Ribeirão Preto, tendo sido isolados metabólitos secundários
com esqueleto fenilpropanoídico correlacionados a atividades biofarmacológicas. Ambas as
espécies são micropropagadas in vitro pela Unidade de Biotecnologia da UNAERP, constituindose em fonte de material para estudos diversos.
Assim, amostras de folhas; hipocótilo e calos de D. Odorata (Aubl) Willd e amostras de
folha, raiz, parte aérea de E. Alba (L.) Hassk, bem como amostras de cultura de raízes em
suspensão de E. alba transformada com Agrobacterium rhizogenes (DIOGO, et al., 2005), foram
coletadas e utilizadas para extração de DNA e RNA, seguindo-se protocolos convencionais.
3.5 Extração de DNA
Amostras constituídas de 100 mg de material vegetal, das plantas selecionadas, foram
congeladas em nitrogênio líquido e maceradas com um bastão de vidro em um microtubo de
2 ml. A esse tubo foram adicionados 300 µl de DNAZOL (GIBCO BRL) e a mistura foi agitada
gentilmente por inversão e, em seguida, incubada a temperatura ambiente por 5 min. Ao tubo,
foram adicionados 300 µl de clorofórmio, seguidos de vigorosa agitação e incubação por 5 min. a
temperatura ambiente. Os tubos foram centrifugados por 10 min a 12.000Xg e 4ºC e após a
centrifugação, a fase aquosa foi retirada e transferida para um novo microtubo de 1,5 ml onde
foram adicionados 225 µl de etanol absoluto, a mistura foi incubada a temperatura ambiente por
5 min. e posteriormente centrifugada por 5 min a 5.000Xg e 4ºC. Após a centrifugação, o
sobrenadante foi descartado e ao “pellet” foram adicionados 300 µl da solução de lavagem
DNAzol/EtOH, constituída de uma mistura de DNAzol e etanol absoluto (1:0,75 ml/ml), e
novamente centrifugado por 5 min a 5000 X g a 4ºC. Em seguida, o sobrenadante foi descartado
lavado com 300 µl de etanol 70%, sendo novamente centrifugado por 5 min a 5000 X g e 4ºC.
Após a centrifugação, o etanol foi removido, o “pellet” seco na bancada a temperatura ambiente e
depois ressuspendido em 30 µl de TE (Tris 10mM e EDTA 1mM, pH 8,0). A qualidade do DNA
extraído foi sempre analisada por eletroforese em gel de agarose de 1% em tampão 1X TBE (Tris
1 mM; acido bórico 0,83 mM e EDTA 10 mM, pH 8,0) acrescido de brometo de etídio
(0,5 µg/ml) em voltagem constante.
3.6 Extração de RNA total
Aproximadamente 1 grama de material vegetal das plantas selecionadas, foi utilizado para
extração de RNA total. O material foi coletado, pesado e imediatamente congelado em nitrogênio
líquido, sendo em seguida macerado utilizando-se cadinho de porcelana e pistilo, os dois
previamente tratados para serem livres de RNase. Ao material macerado foram adicionados
3,75 ml de trizol e 1,25 ml de tampão PBS. A mistura foi coletada e transferida do cadinho de
porcelana para tubos de 2 ml e centrifugada a 10.000 rpm por 5 min., a temperatura de 4ºC, em
centrifuga de mesa “eppendorf” 5417R. Após a centrifugação, o sobrenadante foi transferido para
um novo tubo de 2 ml, aos quais foram adicionados 200 µl de clorofórmio e 10 µl de glicogênio
(20 mg/ml). Os tubos foram gentilmente invertidos por aproximadamente 15 segundos, sendo a
seguir, incubados a temperatura ambiente por 5 min. e centrifugados a 14.000 rpm por 15 min e
4ºC. O sobrenadante foi transferido para um novo microtubo, ao qual, foi adicionado o mesmo
volume de trizol e misturado por inversão. Em seguida foram novamente adicionados ao tubo
200 µl de clorofórmio, os tubos foram agitados manualmente por 6 seg., sendo incubados a
temperatura ambiente por 5 min. e centrifugados a 14.000 rpm por 15 min e 4ºC. Após a
centrifugação o sobrenadante foi transferido para um novo tubo onde foi adicionado 1 volume de
isopropanol 100%, gelado, misturando por inversão e incubado por um período de 12 a 18 horas
a – 20ºC. Depois da incubação os tubos foram centrifugados a 14.000 rpm por 15 min a 4ºC, o
isopropanol foi removido e o “pellet” lavado com 1 ml de etanol 70% gelado. Novamente os
tubos foram centrifugados a 14.000 rpm por 15 min a 4ºC e o sobrenadante descartado.
O sedimento foi ressuspendido em 20 µl de H2O tratada com DEPC e incubado a 60ºC por 10
min para dissolução.
Uma alíquota de 2 µl do RNA extraído foi utilizada para quantificação em
espectrofotômetro nas densidades óticas de 230, 260 e 280. A qualidade do RNA extraído foi
também verificada por eletroforese em gel de agarose 1,5% em condições desnaturantes
(0,02 M de MOPS, 5 mM de acetato de sódio e 0,5 mM de EDTA pH 8,0 mais 37% de
formaldeido), a voltagem constante de 60 V. Após a corrida o gel foi visualizado em UV e
fotografado.
3.7 Preparo do cDNA
3.7.1 Tratamento das amostras de RNA com DNAse
Inicialmente amostras contendo 1 µg do RNA total foram tratadas com 1 µl da enzima
DNase I (1U/µl) seguindo o procedimento recomendando pelo fabricante (Invitrogen), numa
reação com volume final de 10 µl. A reação foi incubada a temperatura ambiente por 15 min.
sendo em seguida interrompida pela adição de 1 µl de EDTA (0,5 M), a reação foi incubada por
10 min a 65ºC para inativação da DNAse.
3.7.2 Síntese do cDNA
Para a síntese do cDNA foi utilizado o kit Invitrogen - SuperScript™ II Reverse
Transcriptase (Invitrogen), seguindo-se o procedimento recomendado pelo fabricante. A reação
ocorreu um volume final de 20 µl e utilizou-se para isso um volume variável por amostra
equivalente a 1 µg.
A um tubo de 200 µl, foram adicionados: 1 µl de Oligo dT 12 – 18 (500 ηg/µl), 1 µg de
RNA total, 1 µl de dNTPs mix (10mM), água Milli-Q e estéril suficiente para completar o
volume de 12 µl. Essa mistura foi previamente aquecida a 65 °C por 5 min., sendo transferida
imediatamente para um recipiente contendo gelo. Ao tubo foram adicionados na ordem: 4 µl de
5x tampão (First Strand Buffer) e 2 µl de DTT (0,2 M). A mistura foi homogeneizada
gentilmente e incubada a 42 °C por 2 min., após o período de incubação adicionou-se 1µl da
enzima SuperScript II RT (200 U/µl), e novamente a reação foi colocada à 42 °C por 50 min.,
após esse período a temperatura foi elevada a 70°C por 15 min. para inativação da enzima.
3.8 Amplificação dos fragmentos via PCR
Os iniciadores construídos para os genes da CHS, IFS e IFR foram utilizados em
experimentos de PCR utilizando inicialmente DNA genômico extraído de plantas medicinais D.
odorata e E. alba. Posteriormente foram utilizados cDNAs obtidos de folhas de plântulas de D.
odorata e E. Alba; tecidos modificados de E. alba (raízes em suspensão) e D. odorata (Calos).
Para as reações de amplificação a partir de DNA genômico a concentração utilizada foi de 1ng/µl
enquanto que 2 µl foram utilizados quando partia-se de cDNA.
Nas reações de amplificação foram utilizados 10 pmoles de cada iniciador, 1 µl de dNTP
(10 mM), 0,75 µl de MgCl2 (50 mM), 2,5 µl de tampão 10X sem MgCl2, 0,2 µl de Taq DNA
polimerase (5U/µl) e H2O Milli-Q autoclavada para completar o volume para 25 µl.
As reações foram estabelecidas para se determinar a melhor temperatura de anelamento,
partindo-se da temperatura previamente calculada em função da seqüência de bases dos oligos,
seguindo os procedimentos recomendados na literatura (VALLETTE, et al., 1989) em
Termociclador PTC-100TM (MJ Research, Inc). As reações se processaram seguindo um
programa básico de amplificação composto por um período de desnaturação inicial 95°C por 5
min, um segundo passo de desnaturação a 95°C por 30 seg. e um período de anelamento por 30
seg. com temperatura adequada a cada iniciador, seguido de um período de extensão a 72°C por 1
min, o ciclo de desnaturação, anelamento e extensão foi repetido 39 vezes e as reações foram
refrigeradas a 10°C ao final da ciclagem. Os produtos gerados foram analisados em gel de
agarose, 1,5% em tampão TBE 1X.
3.9 Purificação do produto gerado por PCR
Com vistas ao seqüenciamento dos fragmentos amplificados, os mesmos foram
purificados de gel de agarose e posteriormente clonados em vetor especial que permitisse a
transformação de bactérias e sua obtenção em quantidades suficientes. Assim, os produtos
obtidos da PCR foram purificados com o Kit Concert Rapid PCR Purification System
(Invitrogen), que garante um grau de pureza suficiente seguindo-se as instruções do fabricante.
Os fragmentos purificados foram dissolvidos em 30 µl TE e armazenados em freezer -20°C.
3.10 Preparo de células competentes
Uma colônia da bactéria E. coli da linhagem DH10B foi inoculada em 10 ml de meio LB
líquido contendo estreptomicina 30 µg/ml e incubada por um período de 12 a 16 horas a 37ºC sob
agitação de 250 rpm. Utilizou-se 5 ml da cultura como inóculo em 5 ml de meio LB e colocou-se
para agitar a 250 rpm a temperatura de 37ºC até que atingisse a DO600 de 0,4 a 0,6. O frasco foi
então transferido para o gelo por 30 min. e a seguir a cultura foi centrifugada por 15 min a
5.000 rpm a 4ºC em garrafas estéreis e geladas. O sobrenadante foi descartado e a massa de
células ressuspendida em 500 ml de glicerol 10% gelado. Esse processo foi repetido duas vezes e
novamente as células foram centrifugadas e finalmente ressuspendidas em 500 a 600 µl de GYT
gelado (10% glicerol; 0,125% extrato de levedura; 0,25% triptona) e transferidas para um tubo
tipo eppendorf. Alíquotas de 40 µl foram transferidas para tubos individuais e armazenadas em
freezer -80 ºC até sua utilização.
3.11 Reação de ligação
A reação de ligação teve como volume final 10 µl, do produto de PCR foi utilizado 4 µl,
tampão de ligação 10X 1 µl, 2 µl do vetor pGEM (PROMEGA) (25 ng/µl), 1 µl de T4 DNA
Ligase (4.0 Weiss units) e 2 µl água milli-Q. A reação de ligação foi incubada a 14ºC por
16 horas.
3.12 Transformação Bacteriana
Em um fluxo laminar, tubos de 1,5 ml contendo 40 µl de células competentes de E. coli
DH10B receberam 2 µl da reação de ligação, permanecendo no gelo por 5 min. As células foram
então transferidas para cubetas, previamente geladas, 0.2 cm (Bio-Rad), e submetidas a um pulso
elétrico de 2.5 V. Imediatamente as células foram transferidas para 1 ml de meio SOC (Triptona
2 %; Extrato de levedura 0,5%; NaCl 10mM) e incubadas a 37ºC por 1 hora sob agitação. Após a
incubação as células transformadas foram plaqueadas em meio LB sólido contendo ampicilina
(100 mg/ml; Calbio Chem). Para o controle do processo de ligação foi usado pUC18 como
controle positivo e células competentes não transformadas foram usadas como controle negativo
da transformação. As placas foram incubadas a 37ºC por um período de 12 a 14 horas. Dessas
placas foram isoladas colônias brancas para cada fragmento clonado. Para a verificação da
inserção foram realizadas reações de PCR a partir de 2 µl da diluição da colônia branca em 10 µl
de água e 1,5 µl de tampão 10X; 1,5 µl de dNTPs (1,25 mM); 1,3 µl de oligonucleotídeos M13F
e reverso (5pmol/µl); 0,15 µl de Taq DNA polimerase (5 U/µl); 0,25 µl de MgCl2 (25 µM) e água
Milli-Q 8,25 µl; perfazendo 15 µl. A amplificação foi feita em Termociclador PTC-100TM (MJ
Research, Inc) utilizando a seguinte ciclagem: 95ºC por 2 min, seguido de 35 ciclos de 95ºC
40 seg, 55ºC 40 seg e 72ºC 55 seg, com uma extensão final a 72ºC por 10 min.
3.13 Extração do DNA plasmídial
O plasmideo das bactérias transformadas foi extraído utilizando-se o kit “S.N.A.P.TM
Miniprep Kit Version F” (Invitrogen). 3ml da cultura de bactérias foram centrifugados em
centrifuga de mesa a 14.000Xg por 3 min. O sobrenadante foi descartado e ao “pellet” foram
adicionados 150 µl de tampão de ressuspensão e em seguida 150 µl do tampão de lise. O
microtubo foi gentilmente invertido por 5 – 6 vezes e incubado a temperatura ambiente por 3
min. Após o período de incubação, adicionou–se 150 µl da solução de precipitação, gelada, e o
tubo foi novamente invertido por 6 – 8 vezes. A mistura foi centrifugada a 14.000Xg em
temperatura ambiente por 5 min e ao sobrenadante foram adicionados 600 µl de “Binding
Buffer”, o tubo foi invertido 5 – 6 vezes e transferido para a coluna, S.N.A.P.TM Miniprep
Column. O sistema foi centrifugado a temperatura ambiente a 3000Xg por 30 segundos. O eluido
foi descartado e à coluna foram adicionados 500 µl de tampão de lavagem, “Wash Buffer”, o
sistema foi novamente centrifugado por 30 segundos e na mesma velocidade. Após a
centrifugação foram adicionados novamente 900 µl do tampão de lavagem e procedeu-se nova
centrifugação, sendo o filtrado descartado. Ao tubo foram adicionados 60 µl de TE para eluição
do DNA plasmidial que continuava ligado a resina. O DNA foi eluido por centrifugação a
máxima velocidade e a temperatura ambiente por 1 minuto. A coluna foi descartada e o DNA
plasmidial eluído foi mantido a - 20ºC.
3.14 Seqüênciamento
Nas reações de seqüenciamento foi utilizado o kit DNA Sequencing Big Dye (Perkin
Elmer), onde foram colocados 2 µl de mix Big Dye, 1,2 µl de iniciadores (M13R ou M13F) e 2 µl
de DNA. As condições de amplificação foram: 96ºC 10 seg, 50ºC; 20 seg.; 60ºC 4 min, em um
total de 25 ciclos. Após a amplificação, as amostras foram precipitadas através da adição de 80 µl
de isopropanol 75% e centrifugadas por 20 min em microcentrífuga a temperatura ambiente.
Após descarte do sobrenadante, adicionou-se 180µl de etanol 70% e as amostras foram
centrifugadas novamente por 5 min.. O sobrenadante foi descartado e o precipitado seco a
temperatura ambiente. Os produtos amplificados foram mantidos a -20ºC até o momento do
seqüenciamento em um seqüênciador automático 377-ABI PRISM (Perkin Elmer).
3.15 Análise in silico, programas computacionais utilizados
Para as análises das seqüências de nucleotídeos, foram utilizadas as ferramentas de
bioinformática disponíveis no NCBI “National Center For Biotechnology Information”
(http://www.ncbi.nlm.nih.gov/).
O BLASTN e TBLASTN (ALTSCHUL, et al., 1990) possibilitaram as
comparações de seqüência e apontaram as similaridades entre as mesmas. O alinhamento das
seqüências foi realizado utilizando o programa Clustal X versão 1.83.1 (THOMPSON et al.,
1997), este programa permite o alinhamento de seqüências de nucleotídeos a partir de suas
seqüências FASTA. O programa possibilitou a visualização de regiões conservadas, entre os
genes das diferentes plantas pesquisadas. Estas regiões conservadas foram selecionadas e
novamente foi utilizado o programa Blastn, onde foram comparadas com outras seqüências no
GenBank para a confirmação de sua identidade e categorização. A partir destas seqüências, foi
desenhado um conjunto de oligonucleotídeos específicos (primers) para a amplificação de
fragmentos homólogos nas plantas Dipteryx odorata (Aubl) Willd e Eclipta alba (L.) Hassk.
RESULTADOS E DISCUSSÃO
4 RESULTADOS E DISCUSSÃO
4.1. Construção dos iniciadores específicos
Para atender os objetivos de nossa proposta, primeiramente foram pesquisadas as
seqüências de nucleotídeos dos genes CHS (EC 2.3.1.74), IFS (EC 2.1.1.44) e IFR (EC 1.3.1.45)
de outras plantas já depositadas no GenBank (http://www.ncbi.nlm.nih.gov/), o que resultou em
um total de 53 seqüências para CHS; 27 para IFS e 7 com IFR. Nas tabelas 01, 02 e 03 estão
relacionados o número de acesso no GenBank e o nome cientifico do organismo onde foram
identificadas.
O alinhamento das seqüências de nucleotídeos desses genes de plantas foi realizado com
os recursos oferecidos pelo programa Clustal X. Muito embora tenhamos encontrado várias
seqüências de nucleotídeos para cada um dos genes alvo, nem todas puderam ser utilizadas em
virtude da disparidade de tamanhos e foram eliminadas no momento do alinhamento. Quando as
seqüências diferem muito no tamanho e, ou similaridade, algumas lacunas são criados
automaticamente pelo programa Clustal X, dificultando a visualização das regiões conservadas.
Tabela 01: Número de identificação das seqüências de nucleotídeos depositadas no GenBank referentes a
genes da enzima IFR.
GenBank
AF201458
AF201184
AF277052
GMAJ3245
LAU48590
MSISREDMR
MSU174336
Espécie
Medicago sativa
Glycine max
Medicago truncatula
Glycine max
Lupinus albus
Medicago sativa
Medicago sativa
Tabela 02: Número de identificação das seqüências de nucleotídeos depositadas no GenBank referentes a
genes da enzima CHS.
GenBank
AB083126
AF026258
AF358430
AF358431
AF358432
ALFCHS1A
ALFCHS2A
ALFCHS4A
ALFCHS8A
ALFCHS9A
AM051060
AY192572
AY237728
AY268022
AY289103
AY289104
AY35111
CAR012690
CAR012822
D88260
D88261
D88262
D88263
DQ140415
DQ239901
GMACHS2
Espécie
Glycine max
Onobrychis vicifolia
Senna alata
Senna alata
Senna alata
Medicago sativa
Medicago sativa
Medicago sativa
Medicago sativa
Medicago sativa
Astragatus membranaceus
Arachis hypogaea
Glycine max
Phaseolus vulgaris
Lupinus luteus
Lupinus luteus
Arachis hypogaea
Cicer arietinum
Cicer arietinum
Pisum sativum
Pisum sativum
Pisum sativum
Pisum sativum
Astragatus membranaceus
Glycine max
Glycine max
GenBank
GMSOYCHS
MSCHSI
MSCHSII
PEACHS1
PEACHS2
PSCHSAB
PSPCHS1
PSPCHS2
PSPCHS3
PUECHS
PVCHALCSN
S46989
SOYCHS7A
SOYCHSIV
SOYCHSVI
TFRCHS1A
TFRCHS2B
TFRCHS3AAA
TFRCHS4AAA
TFRCHS5AAA
TFRCHS6A
U01018
U01019
U01020
U01021
VUCHSCH
Espécie
Glycine max
Medicago sativa
Medicago sativa
Pisum sativum
Pisum sativum
Pisum sativum
Pisum sativum
Pisum sativum
Pisum sativum
Pueraria lobata
Phaseolus vulgaris
Glycine max
Glycine max
Glycine max
Glycine max
Trifolium subterraneum
Trifolium subterraneum
Trifolium subterraneum
Trifolium subterraneum
Trifolium subterraneum
Trifolium subterraneum
Medicago sativa
Medicago sativa
Medicago sativa
Medicago sativa
V. unguiculata
Tabela 03: Número de identificação de nucleotídeos depositadas no GeneBank referentes a genes da
enzima IFS.
GenBank
Espécie
AF195798
AF195799
AF195800
AF195801
AF195802
AF195803
AF195804
AF195805
AF195806
AF195807
AF195808
AF195809
AF195810
AF195811
Glycine max
Glycine max
Medicago sativa
Medicago sativa
Medicago sativa
Vicia villosa
Lens culinares
Lens culinares
Vigna radiata
Vigna radiata
Vigna radiata
Vigna radiata
Trifolium pratense
Trifolium pratense
GenBank
AF195812
AF195813
AF195814
AF195815
AF195818
AF195819
AF462633
AF532999
AY253284
AY530096
AY552613
AY939826
DQ205408
Espécie
Pisum sativum
Lupinus albus
Trifolium repens
Trifolium repens
Glycine max
Glycine max
Pueraria montana
Pisum sativum
Trifolium pratense
Glycine max
Glycine max
Medicago truncatula
Astragatus membranaceus
Pelo alinhamento das seqüências, foi possível verificar que algumas regiões
apresentavam-se altamente conservadas, o que possibilitou seu uso na geração de iniciadores
mais específicos para o gene alvo e conservados entre as diferentes espécies, algumas posições
apresentam bases variáveis nas diferentes espécies consideradas e a escolha da base nos
iniciadores foi determinada pela composição que fornecia a melhor temperatura de anelamento
quando combinados oligos para as posições 5’e 3’. Tais iniciadores devem conter no mínimo 18
pares de bases e são utilizadas aos pares, flanqueando regiões da seqüência a serem amplificadas
(FERREIRA, 1998).
Os iniciadores gerados, bem como suas características principais como o tamanho (MER),
temperatura de anelamento e tamanho do fragmento estimado para os diferentes genes estão
apresentados na Tabela 4.
Tabela 04: Seqüências de nucleotídeos dos iniciadores gerados a partir de regiões semi conservadas dos genes das
enzimas CHS, IFR e IFS e suas principais características.
NOME
MER
TEMP
TAMANHO DO FRAGMENTO ESPERADO
CHS41- 5’ AAG GAG GCT GCA GTG AAG GC 3’
20
60.3°C
467
CHS42- 5’ CCA GCT TCA CGA AGG TGA CC 3’
20
58.9°C
ISFR1- 5’ CCT AGG ACC AAC AGG AGC TAT T 3’
22
55.9°C
ISFR2- 5’ GGT AAA GGC GTG GCA ACA AAG G 3’
22
58.8°C
ISFS1- 5’ CTG CAC TTGC GTC CCA CAC C 3’
20
61.6°C
ISFS2- 5’ GCG ATG TCT CTG ATC TCC TCA G 3’
22
56.7°C
567
697
5’ AAG GAG GCT GCA GTG AAG GC 3’
5’ CCA GCT TCA CGA AGG TGA CC 3’
Figura 9 Alinhamento de seqüências de nucleotídeos para o gene que codifica a enzima Chalcona Sintase CHS (EC 2.3.1.74). Os quadros em azul representam as regiões conservadas utilizadas
para a construção dos iniciadores CHS41 e CHS 42. Os iniciadores encontram-se destacados na figura.
5’ CCT AGG ACC AAC AGG AGC TAT T 3’
5’ GGT AAA GGC GTG GCA ACA AAG G 3’
Figura 10 Alinhamento de seqüências de nucleotídeos para o gene que codifica a enzima Isoflavona Redutase IFR (EC 1.3.1.45). Os quadros em azul representam as regiões conservadas
utilizadas para a construção dos iniciadores ISFR 1 e ISFR 2. Os iniciadores encontram-se destacados na figura.
5’ CTGCACTTGCGTCCCACACC 3’
5’ GCGATGTCTCTGATCTCCTCAG 3’
Figura 11: Alinhamento de seqüências de nucleotídeos para o gene que codifica a enzima Isoflavona Sintase IFS (EC 2.1.1.44). Os
quadros em azul representam as regiões conservadas utilizadas para a construção dos iniciadores ISFS 1 e ISFS 2. Os iniciadores
encontram-se destacados na figura.
4.2 Amplificação por PCR
Os resultados da amplificação dos fragmentos dos genes da chalcona sintase, isoflavona
redutase e isoflavona sintase, utilizando DNA genômico das duas plantas medicinais D. odorata e
E. alba e os pares de iniciadores (CHS41 e CHS42; ISFS1 e ISFS2; ISFR1 e ISFR2) são
apresentados na Figura 12. Como pode ser observado a amplificação ocorreu para os três
conjuntos de iniciadores e nas duas plantas testadas. Na coluna (d) é possível verificar a presença
de um fragmento de aproximadamente 500 bp que pode corresponder ao do gene CHS, na coluna
(g) o fragmento amplificado apresenta tamanho aproximado de 600 pb que pode corresponder ao
fragmento do gene da IFR, ambos amplificados do DNA genômico de D. odorata. Ainda na
Figura 12, coluna (j), os iniciadores IFS, quando DNA de D. odorata foi utilizado como molde,
promoveram a amplificação de três fragmentos de tamanhos variados, evidenciando a
necessidade de padronização das condições da reação de amplificação. Quando o DNA genômico
utilizado foi obtido de E. alba, a amplificação gerou fragmentos de tamanhos diferentes do
obtidos para a D. odorata, como também pode ser observado na Figura 12, colunas c, f e i. Os
iniciadores construídos para amplificar o gene da chalcona sintase gerou dois fragmentos de
tamanhos aproximados de 200 e 300 pares de base (c), para isoflavona redutase e sintase os
fragmentos obtidos foram de 600 e 400 pb respectivamente, colunas (f) e (i). As variações nos
tamanhos dos fragmentos obtidos não deve ser considerada na sua essência posto tratarem-se de
plantas diferentes e de iniciadores construídos baseados nas seqüências de bases de cDNAs e
podem promover a amplificação de regiões compreendidas entre exons de um mesmo gene.
E. alba
a
b
D. odorata
c
d
e
E. alba
D. odorata
E. alba
f
g
h
i
D. odorata
j
500pb
100pb
CHS
IFR
IFS
Figura 12: Eletrofotograma do gel de agarose a 0,8% Tampão TEB 1X. Fragmentos amplificados por PCR dos
genes CHS, IFR e IFS utilizando DNA genômico das plantas D. odorata (d, g & j) e
E. alba (c, f & i); (a) Padrão de Peso molecular 1Kb Plus Invitrogen; (b, e & h) Branco; (c & d) fragmento do gene
da CHS; (f & g) fragmentos do gene IFR; (i & j) fragmentos do gene IFS obtidos para as plantas E. alba e
D. odorata respectivamente. Utilizou-se 10 pmoles dos iniciadores em cada uma das reações.
Na tentativa de melhorar a qualidade dos resultados das amplificações foram inicialmente
realizados testes para a determinação da temperatura ideal para a amplificação dos “primers”,
utilizando um gradiente de temperatura de 55-65°C, sendo utilizadas para cada conjunto de
“primers” as seguintes temperaturas CHS41, CHS42 (58,6°C; 60,4°C e 62,2°C), ISFR1, ISFR2
(55,9°C; 57,7°C e 60,4°C), ISFS1, ISFS2 (56,4°C; 58,6°C e 60,4°C).
Observa-se na Figura 13, que a variação da temperatura de anelamento permitiu encontrar
a temperatura ideal, onde é possível verificar uma melhor amplificação dos fragmentos,
evidenciada por bandas mais intensas e menor número de bandas espúrias, que seriam resultado
de anelamento inespecífico dos iniciadores ao DNA. Assim ficou estabelecido a temperatura de
60,4°C como ideal para a amplificação utilizando os “primers” CHS41 e CHS42; ISFR1 e ISFR2
enquanto que os “primers” ISFS1 e ISFS2 responderam melhor a temperatura de 58,6°C. A
reação de amplificação foi feita utilizando DNA genômico de E. alba, na concentração de 1 ng/µl
e 10 pmoles de iniciador.
a
b
c
d
e
f
g
h
i
j
k
l
m
500pb
100pb
CHS
IFR
IFS
Figura 13: Eletroforograma do gel de agarose a 0,8%; Tampão TEB 1X. Fragmentos amplificados por PCR dos
genes CHS, IFR e IFS utilizando DNA genômico da planta E. alba; (a) Padrão de Peso molecular 1Kb Plus
Invitrogen; (b, f & j) Branco; (c, d & e) utilizando o primer CHS41 e CHS42, fragmento do gene da CHS; (g, h & i)
utilizando o primer ISFR1 e ISFR2, fragmento do gene da IFR; (k, l & m) utilizando o primer ISFS1 e ISFS2,
fragmento do gene da IFS. Utilizou-se 10 pmoles dos iniciadores em cada uma das reações.
Os fragmentos obtidos quando da amplificação do DNA genômico de E. alba apresentam
tamanhos diferentes do esperados. Os primers para chalcona sintase promoveram a amplificação
de 2 fragmentos de tamanhos aproximados de 200 e 300 pares de bases cada, o fragmento
referente a parte do gene da IFS que esperava-se ter aproximadamente 697pb apresenta tamanho
aproximado de 500pb, o único fragmento amplificado com tamanho próximo ao esperado foi o
fragmento correspondente ao gene da IFR com tamanho estimado de aproximadamente 600 pares
de bases.
Essas divergências em relação ao tamanho e confirmação da amplificação dos fragmentos
correspondentes dos genes esperados, só podem ser elucidadas através do seqüênciamento do
fragmento e análise das seqüências de nucleotídeos obtidas. Assim, novos fragmentos foram
obtidos repetindo as reações de amplificação. Estes fragmentos foram então purificados e ligados
ao vetor pGEM, e utilizados para transformar por eletroporação bactérias E. coli,
eletrocompetentes, da linhagem DH10B. Os clones selecionados (colônias brancas) foram
cultivados em meio líquido e posteriormente tiveram seus plasmídeos extraídos e foram enviados
para seqüêncimento.
4.3 Amplificação do cDNA
Utilizando-se o RNA extraído de diferentes partes da plântula de D. odorata (hipocótilo,
cotilédone, folhas e calus) e E. alba (clone 19, raiz e folhas) e os iniciadores para a enzima CHS
para amplificação, foram isolados fragmentos de cDNA do gene de chalcona sintase presentes
nas diferentes partes das plantas (Figura 14), os fragmentos gerados apresentam tamanho
aproximado de 500 pb, tamanho esse esperado para a amplificação desse gene.
A
a
b
c
d
B
e
a
b
c
d
e
600 pb
500 pb
Figura 14: Eletroforese em gel de agarose 1% Tampão TEB 1X dos fragmentos amplificados por PCR do gene
CHS. A. utilizando cDNA da planta D. odorata; (a) Padrão de Peso molecular 1Kb Plus Invitrogen; (b) hipocótilo;
(c) cotilédone; (d) folhas; (e) calos. B. utilizando cDNA da planta E. alba. (a) Padrão de peso molecular 1Kb GE; (b)
Clone 19; (c) Raiz; (d) Folha; (e) Parte aérea. Usando os iniciadores CHS 41 e CHS 42.
Os fragmentos foram purificados e ligados ao vetor pGEM e utilizados na transformação
de bactérias da linhagem DH10B. As colônias selecionadas foram crescidas em meio de cultura
líquido e tiveram seu DNA plasmidial extraído e enviado para seqüenciamento.
4.4 Seqüência de nucleotídeos obtidas
A seqüência de nucleotídeos, dos clones selecionados, para o cDNA obtido da folha da
planta D. odorata, foi editada com o programa Sequencher™ 3.1.1 (Gene Codes Corporation)
para a retirada da seqüência de bases pertencentes ao vetor, gerando uma seqüência consenso de
573 pb, ilustrada na Figura 15. A seqüência foi comparada, utilizando a ferramenta blastn, com
seqüências homólogas presente nos bancos de dados e os resultados gerados desta busca esta
apresentado nas Figuras 16 e 17.
Figura 15: Seqüência consenso de nucleotídeos determinada para um fragmento do cDNA do gene da CHS
expressos em folhas de Dipteryx odorata.
Figura 16: Gráfico do alinhamento da seqüência de nucleotídeos para o cDNA do gene de Chalcona sintase de folha
de D odorata, obtido no programa BLAST contra o banco de dados Genbank (http://www.ncbi.nlm.nih.gov/). Traços
vermelhos significam alinhamento de seqüência maior ou igual a 200 nucleotídeos.
Como pode ser observada na Figura 16 a seqüência de nucleotídeos submetida ao banco
de dados para análise in silico, mostrou similaridade com 37 seqüências já depositadas, essas
seqüências estão listadas na Tabela 05. Entre elas encontram-se a seqüência determinada de
chalcona sintase para Medicago sativa, Pissum sativum; P truncata, Arabdopsis himalaica e
Trifolium subteraneum entre outras. Com porcentagem de cobertura variando de 79 a 21%, e de
identidade entre 89 e 86%, mas com valores de e-value sempre menores que 1 e – 28, dependendo
da espécie. Verifica-se também que a seqüência apresenta similaridade com varias isoformas do
gene em diferentes organismos. Já foi demonstrado por Matsumura et al., (2005), que a CHS
apresenta-se como uma família multigênica. Segundo o autor, foram encontradas várias
isoformas do gene (CHS1 a CHS8) na cultura da soja (Glycine max). Em nossos resultados de
analise de similaridade, apresentados na Tabela 5, verifica-se que a seqüência obtida de folha
apresenta similaridade alta com diferentes isoformas do gene identificadas não em Glycine max,
mas em Medicago sativa, as isoformas CHS2, CHS4, CHS8 e CHS12 foram encontradas entre
outras.
Tabela 05: Relação das seqüências de nucleotídeos que apresentaram similaridade com a seqüência de nucleotídeos
submetida. Tabela gerada pelo programa blastn Programa da ferramenta BLAST (http://www.ncbi.nlm.nih.gov/).
Das 37 seqüências alinhadas, 12 coincidem com as seqüências utilizadas para a geração
dos iniciadores, como já era de se esperar e estão assinaladas na tabela 05 (
).
Utilizando o programa Clustal X foi realizado o alinhamento das seqüências
acrescentando-se a elas a seqüência identificada como gi|148954096|, que se refere a seqüência
de nucleotídeos obtida para o gene de CHS expresso em células obtidas de cultura de calos de D.
odorata (FRANÇA, et al., 2007), bem como a seqüência obtida do fragmento do gene de CHS
expresso em folhas de D. odorata e cujo resultado está apresentado na (Figura 17).
Este alinhamento possibilitou a visualização de regiões conservadas mostrando a
similaridade entre as seqüências de nucleotídeos. O programa possibilitou também a construção
de um dendograma dos organismos presentes nesse alinhamento (Figura 18).
Figura 17: Alinhamento realizado com o programa Clustal X (1.83) foi usado a seqüência consenso (folha Dipteryx odorata) mais as 13 seqüências usadas no desenho do
iniciador CHS 41 e CHS 42.
Figura 18: Dendongrama construído a partir do alinhamento realizado com o programa Clustal X (1.83); foi usado a
seqüência consenso (folha CHS Dipteryx odorata) mais as 13 seqüências usadas no desenho do iniciador CHS 41 e
CHS 42. O quadro em azul coloca em destaque as seqüências de RNA de Calos e de folha da planta D. odorata.
O dendograma das seqüências foi realizado pelo programa Clustal X, onde podemos
observar que a seqüência da CHS determinada neste trabalho e expressa em folhas de D. odorata,
mostrou homologia com espécies de dicotiledôneas, pertencentes da família Fabaceae. Este
dendograma resultou na formação de 3 grupos: 2 grupos pequenos com duas seqüências cada um
e 1 grupo maior composto por 10 seqüências.
Neste grande grupo, encontra-se a seqüência, Folha-CHS [Dipteryx odorata], ela esta
agrupada com seqüências de diferentes plantas e com uma da mesma espécie, a gi|148954096|,
RNA-CHS expresso em cultura de calos Dipteryx odorata isolada e identificadas
(FRANÇA, et al., 2007). Verifica-se que, muito embora bastante similares não são idênticas o
que nos levou a suspeitar da existência de isoformas assim como já determinado em Glycine max,
e Medicago sativ. Assim sendo decidimos pela comparação das duas seqüências de D. odorata,
uma de calos (gi|148954096|) e a outra de folha, utilizando o programa Blastn. O alinhamento das
seqüências encontra-se na (Figura 19).
Figura 19: Alinhamento, utilizando o programa BLASTN, das seqüências de D. odorata de calos (gi|148954096|)
“subjct” e de folha “query”, verifica-se que as duas seqüências apresentam diferenças na seqüência de nucleotídeos.
Pelo alinhamento verifica-se uma identidade de 88% entre as seqüências, evidenciada pela
identidade de 403 em 454 bases analisadas. O alinhamento das seqüências nestas condições foi
possível pela inserção de 10 gaps (intervalos) de seqüência.
A similaridade entre as seqüências também foi analisada ao nível de proteína, para tanto, a
seqüência de nucleotídeos obtida foi traduzida para proteína nos diferentes possibilidades. As
diferentes opções foram utilizadas para comparação com os bancos de dados e resultou na
seleção de um peptídeo cuja seqüência se constitui de 100 aminoácidos, (Figura 20).
Figura 20: Seqüência protéica Folha CHS Dipteryx odorata. Gerada no programa ORF Finder.
O alinhamento da seqüência de aminoácidos de folha de D. odorata, encontrada após a
tradução, foi realizado utilizando o programa blastp e resultou numa seleção de 252 seqüências
protéicas relacionadas a CHS. As seqüências os valores de e-value e o numero de identificação
no Genbank estão apresentados como anexo 1. Os valores de e-value encontrados variam de 3e30 a 1e-28 o que permite maior confiabilidade nos dados. A seqüência mostra identidade variável
de 76 a 73% com diferentes plantas incluindo Pisum.sativum, Glycine max, Citrus jambhiri e
Nicotiana tabacum entre outras.
A seqüência de 100 aa, apresentada na (Figura 20) foi também alinhada com a seqüência
de aminoacidos determinada para a enzima Chalcona sintase das espécies Pisum.sativum, Glycine
max, Citrus jambhiri, Abeis alba, Senna alata, Clitoria ternatea e Nicotiana tabacum além da
seqüência identificada em células de calos de D odorata e disponível no GenBank. Os resultados
estão apresentados na (Figura 21).
Verifica-se que as seqüências apresentam alta similaridade, com duas regiões altamente
conservadas, uma entre os aminoácidos 181 e 231 e outra de menor tamanho entre os
aminoácidos 254 e 267, que correspondem ao domínio conservado presente no gene que codifica
a enzima Chalcona sintase responsável pela reação de condensação. Entre as regiões de resíduos
conservados encontra-se uma região com baixo índice de conservação. Verifica-se que na posição
232, 50% das seqüências apresentam um resíduo de serina, 37,5% apresentam na mesma posição
um resíduo de alanina e a seqüência de folha apresenta na mesma posição um resíduo
fenilalanina. Na posição 233 todas as seqüências alinhadas apresentam um ácido aspártico um
aminoácido de características ácidas, na seqüência determinada para folhas foi detectado um
resíduo arginina de características básicas, um aminoácido com dois grupamentos NH2 na cadeia
ramificada.
Na posição 239, seis das 8 seqüências apresentam um resíduo valina, a espécie Clitoria
ternatea apresenta um resíduo isoleucina e a seqüência encontrada para folhas de D. odorata
apresenta um resíduo de leucina na mesma posição, mas como os três aminoácidos apresentam as
mesmas características de tamanho e carga essa alteração não deve interferir na função da
enzima. O mesmo tipo de troca de aminoácidos, dentro da mesma classe pode ser observada na
posição 244 onde a seqüência de folha apresenta um resíduo asparagina onde seis das outras
seqüências apresenta acido glutâmico e Nicotiana tabacum apresenta glutamina.
Figura 21 Alinhamento das seqüências de aminoácidos deduzidas das seqüências de CHS de calos (gi|148954096|) e CHS expresso em folhas de D.
odorata.
CONCLUSÃO
5 CONCLUSÃO
1- O desenho de iniciadores baseados no alinhamento das seqüências de nucleotídeos e da
identificação de domínios conservados nas seqüências das diferentes plantas, para as
enzimas CHS, IFR e IFS mostraram-se apropriados na prospecção dos genes alvo, nas
duas plantas testadas.
2- A seqüência de nucleotídeos determinada para CHS em amostras de folhas a partir dos
iniciadores construídos apresenta alta similaridade com as seqüências de nucleotídeos já
depositadas de calos de Dipteryx odorata (Aubl) Willd.
3- Similaridade com outras dicotiledôneas: 89% com CHS de Medicago sativa, 84% com
CHS de Pisum sativum, 84% com CHS de Lupinus luteus.
4- A seqüência determinada para folha de Dipteryx odorata (Aubl) Willd apresenta alta
similaridade com a seqüência já determinada para calos na porção amplificada.
BIBLIOGRAFIA
6 BIBLIOGRAFIA
AKASHI, T.; AOKI, T.; AYABE, S. Cloning and functional expression of a cytochrome P450
cDNA encoding 2-hydroxyiso.avanone synthase involved in biosynthesis of the isoflavonoid
skeleton in licorice. Plant Physiol, v.121, p. 821–828, 1999.
AKELERE, O. Sumary of who guidelines for the assessment of herbal medicines. Herbalgram,
v. 28, p. 13-19, 1993.
ALMEIDA, E. R. Plantas medicinais brasileiras: conhecimentos populares e científicos. São
Paulo: Hemus,1993.
ALTSCHUL, S. F.; GISH, W.; MILLER, W.; MYERS, E. W.; LIPMAN, D. J. Basic local
alignment search tool. J Mol Biol. v. 5, p. 403, 1990.
BALBACH, A. A flora nacional na medicina doméstica. São Paulo: A Edificação do Lar.
1980.
BLOUNT, J. W.; DIXON, R. A.; PAIVA, N. L. Stress response in alfalfa (Medicago sativa L.).
XVI. Antifungal activity of medicarpin and its biosynthetic precursors: implications for the
genetic manipulation of stress metabolites. Physiol. Mol. Plant Pathol. v. 41, p. 333–349, 1992.
CAMPOS, A. D.; FERREIRA, A. G.; HAMPE, M. M. V.; ANTUNES, I. F.; BRANCÃO, N.;
SILVEIRA, E. P.; B. DA SILVA, J.; OSÓRIO, V. A. Induction of Chalcona synthase and
phenylalanine ammonia-lyase by salicylic acid and Colletotrichum lindemuthianum in common
bean. Braz. J. Plant Physiol., v. 15, p.129-134, 2003.
CECHINEL-FILHO,
V.;
YUNES,
R.
A.
Estratégias
para
obtenção
de
compostos
farmacologicamente ativos a partir de plantas medicinais. Conceitos sobre modificação estrutural
para otimização da atividade. Química Nova, v. 21, p. 99-105, 1998.
CHAUDHARY, A. G.; GHARPURE, M. M.; RIMOLDI, J. M.; CHORDIA, M. D.; LESLIE
GUNATILAKA, A. A.; KINGSTON, D. G. I. Unexpectedly Facile Hydrolysis of the 2-Benzoate
Group
of
Taxol
and
Syntheses
of
Analogs
with
Increased
Activities.
J. Am. Chem. Soc., v. 116, p. 4097-4098, 1994.
CHANDRA, T.; SADIQUE, J.; SOMASUNDARAM, S. Effect of E. alba on inflammation and
liver injury. Fitoterapia, v. 58, n. 1, p. 23, 1987.
DASTIDAR, S. G.; MANNA, A.; KUMAR, K. A.; MAZUNDAR, K.; DUTTA, N. K.;
CHAKRABARTY, A. N.; MOTOHASHI, N.; SHIRATARKI, Y. Studies on the antibacterial
potentiality of isoflavones. International Journal of Antimicrobial Agents. v. 23, p. 99-102,
2004.
DAVIS, S. R.; DALAIS, F. S.; SIMPSON, E. R.; MURKIES, A. L. Phytoestrogens in health and
disease. Recent Prog. Horm. Res., v. 54, p.185-210, 1999.
DE LUCA, V.; MARINEAU, C.; BRISSON, N. Molucular clonig and analysis of cDNA
Encoding a plant tryptophan decarboxylase: comparison with animal DOPA decarboxylases.
Proc. Natl. Acd. Sci. USA, v.86, p. 2582-2586, 1989.
DEWICK, P. Medicinal Natural Products: A Biosynthetic Approach. Chichester, Inglaterra :
John Wiley & Sons, 1997.
DIOGO, L. C. Atividade antiofídica de extratos vegetais de Eclipta alba (Hassk) selvagem e
geneticamente modificada pelo Agrobacterium rhizogenes. 2005. Dissertação (Mestrado em
Biotecnologia) - Universidade de Ribeirão Preto - Ribeirão Preto, 2005.
DIXON, R. A. The phytoalexin response: elicitation, signaling and the control of host gene
expression. Bot. Rev., v. 61, p. 239-291, 1986.
DIXON, R. A.; HARRISON, M. J. Activation, structure and organization of genes involved in
microbial defense in plants. Adv. Gen. v. 28, p. 165-234, 1990.
DIXON, R. A.; STEELE, C. L. Flavonoids and isoflavonoids—a gold mine for metabolic
engineering. Trends Plant Sci., v. 4, p. 394-400, 1999.
DUCKE, A. As espécies brasileiras do gênero "Coumarouna" Aubl. ou "Dipteryx" Schreb. Anais
da
Academia
Brasileira
de
Ciências,
Rio
de
Janeiro,
v.
20,
n.1, p. 39-56, 1948.
FERREIRA, M. E.; GRATTAPAGLIA, D. Introdução ao uso de marcadores moleculares em
análise genética. 3. ed. Brasília: Embrapa Cenargen, p. 222, 1998.
FRANÇA, S. C.; ROBERTO, P. G.; MARINS, M. A.; PUGA, R. D.; RODRIGUES, A.;
PEREIRA, J. O. Biosynthesis of secondary metabolites in sugarcane. Genetics and Molecular
Biology, v. 24, p. 243-250, 2001.
FRANÇA, S. C. Abordagens Biotecnológicas para a obtenção de substâncias ativas. In:
SIMÕES, C. M. O. et al. (Orgs.). Farmacognosia da planta ao medicamento. 5. ed. Porto
Alegre:
Editoras
da
UFRGS;
Florianópolis:
Editora
da
UFSC,
2004.
Cap 7, p. 123 – 146.
FRANÇA, S. C.; ROBERTO, P. G.; LOURENCO, M. V.; BRAGANHOLI D. F.; VALENTE,
V.; SILVA, V. F.; MARINS, M. A. Isolation, cloning and identification of cDNAs from callus
of Dipteryx odorata coding for key enzymes of phenilpropanoid metabolism. [No prello,
2007].
FRANKEN, P.; NIESBACH-KLOSGEN, U.; WEYDEMANN, U.; MARECHAL DROUARD,
L.; SAEDLER, H; WIENAND, U. The duplicated Chalcona synthase genes C2 and Whp (white
pollen) of Zea mays are independently regulated; evidence for translational control of Whp
expression
by
the
anthocyanin
intensifying
gene.
Embo
J.
v. 10, p. 2605-2612, 1991.
GARCIA, E. S. Biodiversity, Biotechnology and Health. Cad. Saúde Públ., Rio de Janeiro, v.
11, n. 3, p. 495-500, 1995.
HARBORNE, J. B. Methods
in Plant Biochemistry., Plant Phenolics, London,
v.1, p. 29 – 73. 1989.
HARBORNE, J. B.; WILLIAMS, C.A. Advances in flavonoid research since 1992.
Phytochemistry, Amsterdam, v. 55, n. 6, p. 481-504, 2000.
HASHIMOTO, T.; HAYASHI, A.; AMANO, Y.; KOHNO, J.; IWANARI, H.; USUDA, S.;
YAMADA, Y. Hyoscyamine 6β - hydroxilase, an enzyme involved in tropane alkaloid
biosynthesis,
is
localized
at
the
pericycle
of
the
root.
J.
Biol.
Chem.,
v. 266, p. 4648-4653, 1991.
HELLER, W.; HAHLBROCK, K. Highly purified flavanone synthase from parsley catalyzes the
formation of naringenin Chalcona, Arch. Biochem. Biophys. v. 200, p. 617–619, 1980.
JANG, D. S.; PARK, E. J.; HAWTHORNE, M. E.; VIGO, J. S.; GRAHAM, J. G.; CABIESES,
F.; SANTARSIERO, B. D.; MESECAR, A. D.; FONG, H. H. S.; MEHTA, R. G.; PEZZUTO, J.
M.; KINGHORN, A. D. Potencial Cancer Chemopreventive Constituents of the Seeds of
Dipteryx odorata (Tonka Bean). Journal of Natural Products, v. 66, n 5, p 583-587, 2003.
JANUARIO A. H.; LOURENÇO M. V.; DOMÉZIO, L. A.; PIETRO, R. C. L. R.; CASTILHO,
M. S.; TOMAZELA, D. M.; DA SILVA, M. F.DAS G. F.; VIEIRA, P. C.; FERNADES, J. B.;
FRANÇA, S. C. Isolation and Structure Determination of Bioactive Isoflavones from Callus
Culture of Dipteryx odorata (Aubl) Willd. Chem. Pharm. Bull. v. 53, n. 7, p. 740-742, 2005.
JAYATHIRTHA, M. G.; MISHRA, S. H. “Preliminary immunomodulatory activities of
methanol
extracts
of
Eclipta
alba
and
Centella
asiatica.”
Phytomedicine.
v. 11, n. 4, p. 361-365, 2004.
JUNG, W.; YU, O.; LAU, S.; O’KEEFE, D. P.; ODELL, J.; FADER, G.; MCGONIGLE, B.
Identication and expression of isoflavone synthase, the key enzyme for biosynthesis of
isoflavones in legumes. Nat. Biotechnol. v.18, p. 208-212, 2000.
KIM, H. K.; JANG, Y. H.; BAEK, I. S.; LEE, J. H.; PARK, M. J.; CHUNG, Y. S.; CHUNG, J.
I.; KIM, J. K. Polymorphism and Expression of Isoflavone Synthase Genes from Soybean
Cultivars. J. Exp. Bot., v. 19, n.1, p. 67-73, 2004.
KREUZALER, F.; RAGG, H.; FAUTZ, E.; KUHN, D. N.; HAHLBROCK, K. UV-indication of
Chalcona synthase m RNA in cell suspension of Petroselinum hortense. Proc. Natl. Acd. Sci.
USA, v. 80, p. 2591-2593, 1983.
KUTCHAN, T. M. Alkaloid Biosynthesis – The basic for metabolic engineering of medicinal
plants. The Plant Cell, v. 7, p. 1059-1070, 1995.
KUSTER, R. M.; ROCHA, L. M. Cumarinas, Cromonas e Xantonas. Farmacognosia da planta ao
medicamento. In: SIMÕES, C. M. O. et al. (Orgs.).
Farmacognosia da planta ao
medicamento. 5. ed. Porto Alegre: Editoras da UFRGS; Florianópolis: Editora da UFSC, 2004.
Cap 21, p. 537 – 557.
LOAKE, G. J.; CHOUDHARY, A. D.; HARRISON M. J.; MEHRDAD MAVANDAD, C. J.;
LAMB, B.; RICHARD, A. Dixonas, Phenylpropanoid Pathway lntermediates Regulate Transient
Expression of a Chalcona Synthase Gene Promoter, The Plant Cell, v. 3, p. 829-840, 1991.
LO, C.; COOLBAUGH, R. C.; Nicholson, R. L. Molecular characterization and in silico
expression analysis of Chalcona synthase gene family in Sorghum bicolor, Physiol. Mol. Plant
Pathol. v. 61, p. 179–188, 2002.
LORENZI, H. Árvores brasileiras: manual de identificação e cultivo de plantas arbóreas do
Brasil. Nova Odessa: Plantarum, 1998. v. 2.
__________. Plantas medicinais no Brasil nativas e exóticas Nova Odessa: Plantarum, 2002.
LORENZI, H.; SOUZA, H. M. de. Plantas ornamentais no Brasil: arbustivas, herbáceas e
trepadeiras Nova Odessa: Plantarum, 1995.
LUCZKIENWICZ, M.; GOLD, D. Callus culture of Genista plant – in vitro material producing
high
amounts
of
isoflavonas
of
phytoestrogenic
activity.
Plant
Science.
v. 165, n. 5, p. 1101-1108, 2003.
MANN, J. Secondary metabolism. 2. ed. Oxford: Clarendon Press, 1987.
MATSUMURA, H.; WATANABE, S.; HARADA, K.; SENDA, M.; AKADA, S.; KAWASAKI,
S.; DUBOUZET, E. G.; MINAKA, N.; TAKAHASHI, R. Molecular linkage mapping and
phylogeny of the Chalcona synthase multigene family in soybean. Theor Appl Genet., Tsukuba,
Japan, v. 110, n. 7, p. 1203-9, 2005.
MATOS, F. J. A. Plantas medicinais : guia de seleção e emprego de plantas usadas em
fitoterapia no nordeste do Fortaleza : Universidade Federal do Estado do Ceará, 2000.
MENDES, F. N. P., SILVEIRA, E. R. Phytochemistry. Journal of the Brazilian Chemical
Society. v. 35, p. 1499 -1503, 1994.
MORS, W. B.; RIZZINI, C. T.; PEREIRA, N. A. Medicinal Plants of Brazil,: Reference
Publications Inc. Algonac, 2000.
NODARI, R.O.; GUERRA, M. P. Biodiversidade: aspectos biológicos ,geográficos, legais e
éticos. In: SIMÕES, C. M. O. et al. (Orgs.). Farmacognosia da planta ao medicamento. 5. ed.
Porto Alegre: Editoras da UFRGS; Florianópolis: Editora da UFSC, 2004. Cap 1, p.13 - 28.
PANG, Y.; SHEN, G.; WU, W.; LIU, X.; LIN, J.; TAN, F.; SUN, X.; TANG, K.
Characterization and expression of Chalcona synthase gene from Ginkgo biloba, Plant Science.
v.168, p.1525-1531, 2005.
RIVERA-VARGAS, L. I.; CSHMITTHENNER, A. F.; GRAHAM, T. L. Soybean flavonoid
effects
on
and
v. 32, p. 851–857, 1993.
metabolism
by
Phytophthora
sojae.
Phytochemistry.
SASLOWSKY, D. E.; DANA, C. D.; WINKEL-SHIRLEY, B. An allelic series for the Chalcona
synthase locus in Arabidopsis, Gene, v. 225, p.127–138, 2000.
SAMBROOK, J. Molecular Cloning: a laboratory manual. 2nd. ed., New York: Cold Spring
Harbor Laboratory Press, 1989.
SANTOS, R. I. DOS. Metabolismo básico e origem dos metabólitos secundário. Farmacognosia
da planta ao medicamento. In: SIMÕES, C. M. O. et al. (Orgs.). Farmacognosia da planta ao
medicamento. 5. ed. Porto Alegre: Editoras da UFRGS; Florianópolis: Editora da UFSC, 2004.
Cap 16, p. 537 – 557,
SAXENA, A.; SINGH, B.; ANAND, K. Hepatoprotective effects of Eclipta alba on subcellular
levels in rats. J. Ethnopharmacol., v. 40, n. 3, p.155-161, 1993.
SIMÕES, C. M. O., SPITZER, V. Óleos Volateis. In: SIMÕES, C. M. O. et al. (Orgs.).
Farmacognosia da planta ao medicamento. 5. ed.
Porto Alegre:
Editoras da UFRGS;
Florianópolis: Editora da UFSC, 2004. Cap 18, p. 467 – 496.
SOUSA, M. P. Constituintes químicos de plantas medicinais brasileiras. Fortaleza:
Universidade Federal do Estado do Ceará, 1991.
SREEVIDYA, V. S.; SRINIVASA R. A. O. C.; SULLIA, S. B.; LADHA. J. K.; REDDY, P. M.
Metalbolic engineering of rice with soybean isflavone synthase for promoting nodulation gene
expression in rhizobia. Journal of Experimental Botany.
v. 57, n. 9, pp 1957-1969, 2006.
SYED,
S.
D.;
DEEPAK,
M.;
YOGISHA,
S.;
CHANDRASHEKAR,
A.
P.;
MUDDARACHAPPA, K. A.; D'SOUZA, P.; AGARWAL, A.; VENKATARAMAN, B. V.
Trypsin
inhibitory
effect
of
wedelolactone
and
demethylwedelolactone.
Phytother Res., v. 17, n. 4, p. 420-421, 2003.
TIAN, L.; DIXON, R. A. Engineering metabolism with an artificial bifunctional enzyme. Planta,
v. 224, p. 496-507, 2006.
THOMPSON, J. D.; GIBSON, J.; PLEWNIAK, F.; JEANMOUGIN, F.; HIGGINS, D. G. The
ClustalX windows interface: flexible strategies for multiple sequence alignmet aided by quality
analysis tools. Nucleic Acids Research. v. 25, n. 24, p. 4876-4882, 1997.
VALLETTE, F.; MEGE, E.; REISS, A.; ADESNIK, M. Construction of mutant and chimeric
genes
using
the
polymerase
chain
reaction.
Nucleic
Acids
Res.,
v. 17, n. 2, p.723–733, jan. 1989.
VAN ELDIK, G. J.; RUTIER, R. K.; COLLA, P. H. W. N.; VAN HERPEN, M. M. A.;
SCHRAUWEN, J. A. M. Expression of an isoflavone reductase-like gene enhanced by pollen
tube
growth
in
pistils
of
Solanum
tuberosum.
Plant
Molecular
Biology,
v. 33, p. 923–929, 1997.
VERPOORTE, R.; HEIJDEN, R. V. D.; MEMELINK, J. Engineering the plant Cell Factory for
Secondary Metabolite Prodution. Trangenic Resarch, v. 9, p. 323-343, 2000.
VIEIRA JÚNIOR, G. M.; ROCHA E SILVA, H.; BITTENCOURT, T. C.; CHAVES, M. H.; DE
SIMONE, C. A. Terpenos e ácidos graxos de Dipteryx lacunifera Ducke. Quím. Nova, v. 30, n.7,
2007.
YAMADA, T. Resistência de plantas as pragas e doenças: pode ser afetada pelo manejo da
cultura?. Piracicaba : POTAFOS – Associação Brasileira para Pesquisa do Potassa e do Fosfato,
2004. (Informações agronômicas. n, 108).
WAGNER, H.; GEYER, B.; YOSHINOBU, K.; GOVIND, S. R. Coumestans as the Main Active
Principles of the Liver Drugs Eclipta alba and Wedelia calendulacea. Planta Medica, v. 5, n.
370, p. 2 ,1986
ZUANAZZI, J. A. S., MONTANHA, J. A. Flavonóides. Farmacognosia da planta ao
medicamento In: SIMÕES, C. M. O. et al. (Orgs.). Farmacognosia da planta ao medicamento.
5. ed. Porto Alegre: Editoras da UFRGS; Florianópolis: Editora da UFSC, 2004. Cap 23, p. 519
– 537.
ANEXOS
ANEXOS
Sequences producing significant alignments:
Score
(Bits)
dbj|BAA22045.1| chalcone synthase [Pisum sativum]
sp|P51082|CHSB_PEA Chalcone synthase 1B (Naringenin-chalcone .
gb|AAM00230.1|AF358430_1 root-specific chalcone synthase [Senna
gb|AAM00232.1|AF358432_1 root-specific chalcone synthase [Senna
gb|AAD49355.1|AF169800_1 chalcone synthase [Lilium hybrid cv.
gb|ABD24253.1| chalcone synthase [Abies alba]
sp|P51081|CHSA_PEA Chalcone synthase 1A (Naringenin-chalcone ..
gb|ABD24232.1| chalcone synthase [Abies alba] >gb|ABD24242.1|..
gb|ABD38609.1| chalcone synthase [Abies alba] >gb|ABD38615.1|..
gb|ABD24229.1| chalcone synthase [Abies alba] >gb|ABD24237.1|..
gb|ABD38607.1| chalcone synthase [Abies alba] >gb|ABD38612.1|..
gb|ABD24231.1| chalcone synthase [Abies alba]
gb|AAO67373.1| chalcone synthase [Glycine max]
gb|ABD24239.1| chalcone synthase [Abies alba]
sp|P23569|CHSY_PUELO Chalcone synthase (Naringenin-chalcone s..
sp|P51089|CHSY_VIGUN Chalcone synthase (Naringenin-chalcone s..
sp|P30081|CHS7_SOYBN Chalcone synthase 7 (Naringenin-chalcone..
gb|ABD38599.1| chalcone synthase [Abies alba]
dbj|BAF49290.1| chalcone synthase [Clitoria ternatea]
gb|ABN80439.1| chalcone synthase [Nicotiana benthamiana]
gb|AAK49457.1| chalcone synthase [Nicotiana tabacum]
sp|P48385|CHSY_CALCH Chalcone synthase (Naringenin-chalcone s..
dbj|BAA94594.1| pinocembrin chalcone synthase [Pinus densiflora]
gb|AAM00231.1|AF358431_1 root-specific chalcone synthase [Senna
gb|ABB89213.1| chalcone synthase [Sorbus aucuparia]
sp|Q9XJ57|CHS2_CITSI Chalcone synthase 2 (Naringenin-chalcone...
gb|AAM90652.1|AF400567_1 chalcone synthase 6 [Rubus idaeus]
gb|ABD24228.1| chalcone synthase [Picea abies]
sp|P48390|CHS1_GERHY Chalcone synthase 1 (Naringenin-chalcone...
gb|ABL84242.1| chalcone synthase [Aorchis cyclochila]
gb|ABL84241.1| chalcone synthase [Aorchis cyclochila]
dbj|BAB71815.1| chalcone synthase [Citrus jambhiri]
gb|ABI79305.1| chalcone synthase [Pyrus communis]
gb|ABK24876.1| unknown [Picea sitchensis]
gb|AAX16494.1| chalcone synthase [Pyrus communis]
gb|ABK23800.1| unknown [Picea sitchensis]
sp|Q9M5M0|CHS7_PICMA Chalcone synthase 7 (Naregenin-chalcone ...
gb|ABK24675.1| unknown [Picea sitchensis]
gb|ABK25340.1| unknown [Picea sitchensis]
gb|ABN79673.1| chalcone synthase [Rudbeckia hirta]
gb|ABK25158.1| unknown [Picea sitchensis]
gb|ABK27123.1| unknown [Picea sitchensis]
sp|P51075|CHSY_BETVE Chalcone synthase (Naringenin-chalcone s...
gb|ABK23777.1| unknown [Picea sitchensis] >gb|ABK25228.1| unk...
gb|ABL84236.1| chalcone synthase [Dactylorhiza sambucina]
dbj|BAB92996.1| chalcone synthase [Malus x domestica]
gb|AAX16492.1| chalcone synthase [Malus x domestica]
gb|ABL84239.1| chalcone synthase [Dactylorhiza sambucina]
dbj|BAB84112.1| chalcone synthase [Vitis vinifera]
gb|ABL84216.1| chalcone synthase [Dactylorhiza praetermissa]
emb|CAO49115.1| unnamed protein product [Vitis vinifera]
gb|AAB72091.1| chalcone synthase [Vitis vinifera]
gb|ABL84240.1| chalcone synthase [Dactylorhiza sambucina]
133
133
132
132
132
132
132
132
132
132
132
132
132
132
132
132
132
132
131
131
131
131
131
131
131
131
131
131
131
131
131
131
131
131
131
131
131
131
131
131
131
131
131
131
130
130
130
130
130
130
130
130
130
E
Value
3e-30
3e-30
5e-30
7e-30
8e-30
8e-30
8e-30
8e-30
9e-30
9e-30
9e-30
9e-30
9e-30
9e-30
9e-30
9e-30
9e-30
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
1e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
gb|ABO42616.1| putative chalcone synthase [Jacobaea maritima].
gb|ABL84237.1| chalcone synthase [Dactylorhiza sambucina]
gb|AAY45748.1| chalcone synthase [Malus x domestica]
gb|ABD14726.1| CHS7 [Kingdonia uniflora]
gb|ABL84238.1| chalcone synthase [Dactylorhiza sambucina]
gb|ABO42643.1| putative chalcone synthase [Jacobaea maritima]
gb|AAX99413.1| chalcone synthase [Fragaria x ananassa]
gb|ABO42622.1| putative chalcone synthase [Jacobaea maritima]
gb|ABM63466.1| aromatic polyketide synthase [Hypericum hookerian
sp|Q9FUB7|CHSY_HYPAN Chalcone synthase (Naringenin-chalcone s...
gb|ABO42648.1| putative chalcone synthase [Petasites fragrans]
gb|ABL84220.1| chalcone synthase [Dactylorhiza elata]
gb|ABO42649.1| putative chalcone synthase [Jacobaea maritima]
emb|CAC88858.1| chalcone synthase [Rhododendron simsii]
sp|P51085|CHS3_TRISU Chalcone synthase 3 (Naringenin-chalcone...
gb|ABL84223.1| chalcone synthase [Dactylorhiza elata]
gb|ABD24222.1| chalcone synthase [Populus alba] >gb|ABD24224....
gb|ABL84244.1| chalcone synthase [Gymnadenia borealis]
gb|ABL84234.1| chalcone synthase [Dactylorhiza iberica]
gb|AAK15174.1|AF292367_1 aromatic polyketide synthase [Rubus ida
sp|P48386|CHS1_CAMSI Chalcone synthase 1 (Naringenin-chalcone...
gb|ABL84221.1| chalcone synthase [Dactylorhiza elata]
gb|ABD24236.1| chalcone synthase [Abies alba]
gb|ABF69124.1| chalcone synthase [Chrysanthemum x morifolium]
gb|ABL84214.1| chalcone synthase [Dactylorhiza aristata]
gb|ABL84222.1| chalcone synthase [Dactylorhiza elata]
sp|P30078|CHSY_MALDO Chalcone synthase (Naregenin-chalcone sy...
dbj|BAA31259.1| chalcone synthase [Vitis vinifera]
gb|ABL84217.1| chalcone synthase [Dactylorhiza praetermissa]
dbj|BAE17124.1| chalcone synthase [Fragaria x ananassa]
gb|ABL84225.1| chalcone synthase [Dactylorhiza maculata subsp. e
gb|ABL84210.1| chalcone synthase [Dactylorhiza aristata] >gb|...
sp|P30079|CHSY_PINSY Chalcone synthase (Naringenin-chalcone s...
gb|ABO42664.1| putative chalcone synthase [Petasites fragrans]
gb|ABO42640.1| putative chalcone synthase [Emilia sonchifolia]
gb|ABL84218.1| chalcone synthase [Dactylorhiza praetermissa]
gb|ABM67586.1| chalcone synthase [Vitis vinifera] >emb|CAO491...
gb|ABL84254.1| chalcone synthase [Pseudorchis albida subsp. stra
gb|ABL84243.1| chalcone synthase [Gymnadenia borealis]
gb|ABL84224.1| chalcone synthase [Dactylorhiza elata]
gb|ABL84227.1| chalcone synthase [Dactylorhiza fuchsii]
sp|P49440|CHSY_PHAVU Chalcone synthase 17 (Naringenin-chalcon...
gb|ABL84206.1| chalcone synthase [Coeloglossum viride]
sp|Q9XGX2|CHS1_SORBI Chalcone synthase 1 (Naringenin-chalcone...
gb|ABO42645.1| putative chalcone synthase [Hertia cheirifolia]
gb|ABO42618.1| putative chalcone synthase [Emilia sonchifolia]
gb|ABL84207.1| chalcone synthase [Coeloglossum viride]
gb|ABL84247.1| chalcone synthase [Platanthera grandiflora]
gb|AAN87170.1| chalcone synthase [Pinus pinaster]
gb|ABO42612.1| putative chalcone synthase [Lactuca sativa] >g...
gb|ABL84230.1| chalcone synthase [Dactylorhiza foliosa]
gb|ABO42628.1| putative chalcone synthase [Hertia cheirifolia...
gb|ABL84231.1| chalcone synthase [Dactylorhiza foliosa]
gb|ABL84209.1| chalcone synthase [Coeloglossum viride]
gb|ABS52573.1| chalcone synthase [Gossypium hirsutum]
gb|ABO42636.1| putative chalcone synthase [Emilia sonchifolia...
gb|ABD24227.1| chalcone synthase [Pseudotsuga menziesii]
gb|ABL84229.1| chalcone synthase [Dactylorhiza fuchsii]
sp|O82144|CHSY_HYDMC Chalcone synthase (Naringenin-chalcone s..
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
130
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
2e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
3e-29
gb|AAP85249.1| chalcone synthase [Pinus pinaster]
gb|AAS21057.1| chalcone synthase [Ginkgo biloba] >gb|AAT68477..
gb|ABL84208.1| chalcone synthase [Coeloglossum viride]
gb|ABL84232.1| chalcone synthase [Dactylorhiza foliosa]
gb|ABK21072.1| unknown [Picea sitchensis]
pdb|1D6I|A Chain A, Chalcone Synthase (H303q Mutant) >pdb|1D6..
gb|AAM46975.1| chalcone synthase [Chrysanthemum vestitum]
sp|Q9XJ58|CHS1_CITSI Chalcone synthase 1 (Naringenin-chalcone...
sp|Q9SBL5|CHS4_SORBI Chalcone synthase 4 (Naringenin-chalcone...
gb|ABD38604.1| chalcone synthase [Abies alba]
gb|ABD24230.1| chalcone synthase [Abies alba] >gb|ABD24238.1|...
pdb|1CHW|A Chain A, Chalcone Synthase From Alfalfa Complexed ...
pdb|1BI5|A Chain A, Chalcone Synthase From Alfalfa
gb|ABD38610.1| chalcone synthase [Abies alba]
gb|ABL84249.1| chalcone synthase [Platanthera hyperborea]
gb|ABD38596.1| chalcone synthase [Abies alba]
emb|CAJ20138.1| chalcone synthase [Astragalus membranaceus va...
gb|ABK54351.1| chalcone synthase [Rhodiola fastigiata]
gb|AAM90651.1|AF400566_1 chalcone synthase 11 [Rubus idaeus]
gb|ABD38595.1| chalcone synthase [Abies alba]
gb|ABD24235.1| chalcone synthase [Abies alba]
gb|ABD24251.1| chalcone synthase [Abies alba] >gb|ABD38593.1|...
dbj|BAE17122.1| chalcone synthase [Fragaria x ananassa]
gb|ABD24249.1| chalcone synthase [Abies alba] >gb|ABD24255.1|...
pdb|1CML|A Chain A, Chalcone Synthase From Alfalfa Complexed ...
gb|ABL84251.1| chalcone synthase [Platanthera hyperborea] >gb...
gb|ABD38598.1| chalcone synthase [Abies alba]
gb|ABD24233.1| chalcone synthase [Abies alba]
gb|ABD24234.1| chalcone synthase [Abies alba]
sp|P51084|CHS2_TRISU Chalcone synthase 2 (Naringenin-chalcone...
sp|Q9SBL7|CHS2_SORBI Chalcone synthase 2 (Naringenin-chalcone...
gb|ABK25266.1| unknown [Picea sitchensis]
emb|CAP09644.1| chalcone synthase [Pinus pinaster]
sp|P51078|CHS5_MEDSA Chalcone synthase 4-2 (Naringenin-chalco...
sp|P51083|CHS1_TRISU Chalcone synthase 1 (Naringenin-chalcone...
dbj|BAE79201.1| chalcon synthase [Lilium speciosum]
gb|ABL84250.1| chalcone synthase [Platanthera hyperborea]
gb|ABS86876.1| putative chalcone synthase [Quercus suber]
gb|ABM73434.1| chalcone synthase [Aquilaria sinensis]
emb|CAH61575.1| chalcone synthase [Dictamnus albus]
pdb|1BQ6|A Chain A, Chalcone Synthase From Alfalfa With Coenzyme
sp|P51087|CHS5_TRISU Chalcone synthase 5 (Naringenin-chalcone...
sp|P51088|CHS6_TRISU Chalcone synthase 6 (Naringenin-chalcone...
gb|AAO43487.1| chalcone synthase [Camellia grijsii]
pdb|1D6H|A Chain A, Chalone Synthase (N336a Mutant Complexed Wit
gb|AAM46973.1| chalcone synthase [Chrysanthemum chanetii]
sp|P30074|CHS2_MEDSA Chalcone synthase 2 (Naringenin-chalcone...
gb|AAN87169.1| chalcone synthase [Pinus pinaster]
sp|Q9SBL4|CHS5_SORBI Chalcone synthase 5 (Naringenin-chalcone...
sp|P30075|CHS4_MEDSA Chalcone synthase 4 (Naringenin-chalcone...
gb|AAM46961.1| chalcone synthase [Chrysanthemum indicum]
gb|ABD14733.1| CHS5 [Grevillea robusta]
gb|ABD24226.1| chalcone synthase [Populus trichocarpa] >gb|AB...
sp|P22928|CHSJ_PETHY Chalcone synthase J (Naringenin-chalcone...
sp|P51086|CHS4_TRISU Chalcone synthase 4 (Naringenin-chalcone...
sp|Q9SBL3|CHS6_SORBI Chalcone synthase 6 (Naringenin-chalcone...
emb|CAC20725.1| putative chalcone synthase [Medicago truncatula]
sp|Q9SBL6|CHS3_SORBI Chalcone synthase 3 (Naringenin-chalcone...
gb|AAA02825.1| chalcone synthase
130
130
130
130
130
130
130
130
130
130
130
130
130
130
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
3e-29
3e-29
3e-29
3e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
4e-29
5e-29
5e-29
5e-29
5e-29
5e-29
5e-29
5e-29
5e-29
pir||S44368 naringenin-chalcone synthase (EC 2.3.1.74) - alfa...
dbj|BAB40786.2| chalcone synthase [Lilium hybrid division I]
sp|Q9FSB8|CHS2_RUTGR Chalcone synthase 2 (Naringenin-chalcone...
sp|O23883|CHS3_PEA Chalcone synthase 3 (Naregenin-chalcone sy...
dbj|BAC66467.1| chalcone synthase [Rosa hybrid cultivar 'Kardina
sp|Q9XGX1|CHS7_SORBI Chalcone synthase 7 (Naringenin-chalcone...
gb|ABR19837.1| chalcone synthase [Dipteryx odorata]
sp|P30077|CHS9_MEDSA Chalcone synthase 9 (Naringenin-chalcone...
pdb|1U0V|A Chain A, An Aldol Switch Discovered In Stilbene Sy...
dbj|BAF96941.1| chalcone synthase [Rhododendron x pulchrum]
emb|CAA10131.1| chalcone synthase [Cicer arietinum]
sp|Q9SML4|CHS1_CICAR Chalcone synthase 1 (Naringenin-chalcone...
emb|CAA32739.1| chalcone synthase [Petunia x hybrida]
emb|CAD12638.1| naringenin-chalcone synthase [Alnus glutinosa]
sp|O23884|CHS5_PEA Chalcone synthase 5 (Naregenin-chalcone sy...
gb|AAL67805.1|AF461105_1 chalcone synthase [Hypericum perforatum
gb|ABF59867.1| chalcone synthase [Lupinus luteus]
gb|AAO63021.1| chalcone synthase B [Allium cepa]
sp|Q01288|CHS6_PEA Chalcone synthase 6 (Naregenin-chalcone sy...
gb|AAQ62588.1| chalcone synthase CHS4 [Glycine max] >gb|AAQ62...
sp|Q01287|CHS2_PEA Chalcone synthase 2 (Naregenin-chalcone sy...
sp|P48406|CHS5_SOYBN Chalcone synthase 5 (Naringenin-chalcone...
sp|O23882|CHS4_PEA Chalcone synthase 4 (Naregenin-chalcone sy...
gb|ABD14724.1| CHS4 [Sargentodoxa cuneata]
sp|P17957|CHS2_SOYBN Chalcone synthase 2 (Naringenin-chalcone...
gb|AAZ79660.1| putative chalcone synthase [Fagus sylvatica]
sp|P24826|CHS1_SOYBN Chalcone synthase 1 (Naringenin-chalcone...
gb|ABO42652.1| putative chalcone synthase [Cissampelopsis vol...
sp|O04220|CHSY_CHRAE Chalcone synthase (Naringenin-chalcone s...
gb|ABF59868.1| chalcone synthase [Lupinus luteus]
sp|Q9FSB9|CHS1_RUTGR Chalcone synthase 1 (Naringenin-chalcone...
sp|P51080|CHS7_MEDSA Chalcone synthase (Naringenin-chalcone s...
gb|ABL84226.1| chalcone synthase [Dactylorhiza maculata subsp. e
gb|AAD49353.1|AF169798_1 chalcone synthase [Lilium hybrid cv. 'A
sp|Q43188|CHS2_SOLTU Chalcone synthase 2 (Naringenin-chalcone...
gb|ABO42626.1| putative chalcone synthase [Hertia cheirifolia]
gb|ABL84257.1| chalcone synthase [Traunsteinera globosa]
gb|ABD14728.1| CHS4 [Kingdonia uniflora]
dbj|BAF99252.1| chalcone synthase [Iris x hollandica]
sp|O22586|CHSY_ONOVI Chalcone synthase (Naringenin-chalcone s...
gb|ABL84215.1| chalcone synthase [Dactylorhiza praetermissa]
sp|P48387|CHS2_CAMSI Chalcone synthase 2 (Naringenin-chalcone...
emb|CAA46590.1| naregenin-chalcone synthase [Glycine max]
gb|AAQ62589.1| chalcone synthase CHS3 [Glycine max] >gb|AAQ62...
gb|ABB30178.1| chalcone synthase 1 [Glycine max]
gb|ABD14727.1| CHS5 [Kingdonia uniflora]
sp|Q9ZRR8|CHS1_CASGL Chalcone synthase (Naringenin-chalcone s...
gb|ABL84211.1| chalcone synthase [Dactylorhiza aristata]
gb|AAK15176.1|AF292369_1 aromatic polyketide synthase [Rubus ida
dbj|BAC10998.1| chalcone synthase [Nierembergia sp. NB17]
sp|P51079|CHS6_MEDSA Chalcone synthase 6-4 (Naringenin-chalco...
gb|ABL84219.1| chalcone synthase [Dactylorhiza praetermissa]
gb|AAR97605.1| chalcone synthase [Zingiber officinale]
gb|AAA96822.1| chalcone synthase
gb|ABL84246.1| chalcone synthase [Orchis anatolica]
dbj|BAB84111.1| chalcone synthase [Vitis vinifera] >emb|CAN75...
gb|ABL84245.1| chalcone synthase [Orchis anatolica]
gb|ABD24244.1| chalcone synthase [Abies alba]
gb|AAF78070.2| chalcone synthase [Allium cepa]
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
129
128
128
128
128
128
128
128
128
128
128
128
128
128
128
128
128
128
128
128
128
5e-29
5e-29
5e-29
5e-29
5e-29
5e-29
6e-29
6e-29
6e-29
6e-29
6e-29
6e-29
6e-29
6e-29
6e-29
6e-29
6e-29
6e-29
6e-29
7e-29
7e-29
7e-29
7e-29
7e-29
7e-29
7e-29
7e-29
7e-29
7e-29
8e-29
8e-29
8e-29
8e-29
8e-29
8e-29
8e-29
8e-29
8e-29
8e-29
8e-29
9e-29
9e-29
9e-29
9e-29
9e-29
9e-29
9e-29
9e-29
9e-29
9e-29
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
gb|AAO32821.1| chalcone synthase [Arachis hypogaea]
gb|AAU43217.1| chalcone synthase [Arachis hypogaea]
sp|P24825|CHS2_MAIZE Chalcone synthase C2 (Naringenin-chalcon...
sp|P23419|CHS2_LYCES Chalcone synthase 2 (Naringenin-chalcone...
gb|ABL84204.1| chalcone synthase [Chamorchis alpina] >gb|ABL8...
gb|ABL84260.1| chalcone synthase [Traunsteinera globosa]
gb|ABD14741.1| CHS1 [Buxus bodinieri]
gb|ABL84248.1| chalcone synthase [Platanthera grandiflora]
gb|ABD38606.1| chalcone synthase [Abies alba]
gb|AAW56963.1| chalcone synthase C2-Idf-III [Zea mays]
gb|ABD24245.1| chalcone synthase [Abies alba] >gb|ABD24246.1|...
gb|ABL84205.1| chalcone synthase [Chamorchis alpina]
dbj|BAC98340.1| chalcone synthase [Prunus persica]
gb|ABD14739.1| CHS5 [Buxus bodinieri]
gb|ABD24247.1| chalcone synthase [Abies alba] >gb|ABD38594.1|..
gb|ABF82594.1| chalcone synthase [Lilium hybrid cultivar]
gb|AAO43489.1| chalcone synthase [Camellia grijsii]
gb|AAM46965.1| chalcone synthase [Chrysanthemum lavandulifoli..
gb|ABD14734.1| CHS8 [Euptelea pleiosperma]
gb|AAO43485.1| chalcone synthase [Camellia yunnanensis]
128
128
128
128
128
128
128
128
128
128
128
128
128
128
128
128
128
128
128
128
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28
1e-28