QUÍMICA B – PROF PAULO CESAR (AULA 03)
TEORIAS ÁCIDO BASE
1-TEORIA DE ARRHENIUS (1887)
Ácido É toda substância molecular, que em solução aquosa, sofre ionização formando cátions H3O+ ou H+.
Ex.: HCl + H2O ↔ H3O+(aq) + Cl-(aq)
Base É toda substância iônica, que em solução aquosa, sofre dissociação iônica formando ânions OH-.
Ex.: NaOH + H2O ↔ Na+(aq) + OH-(aq)
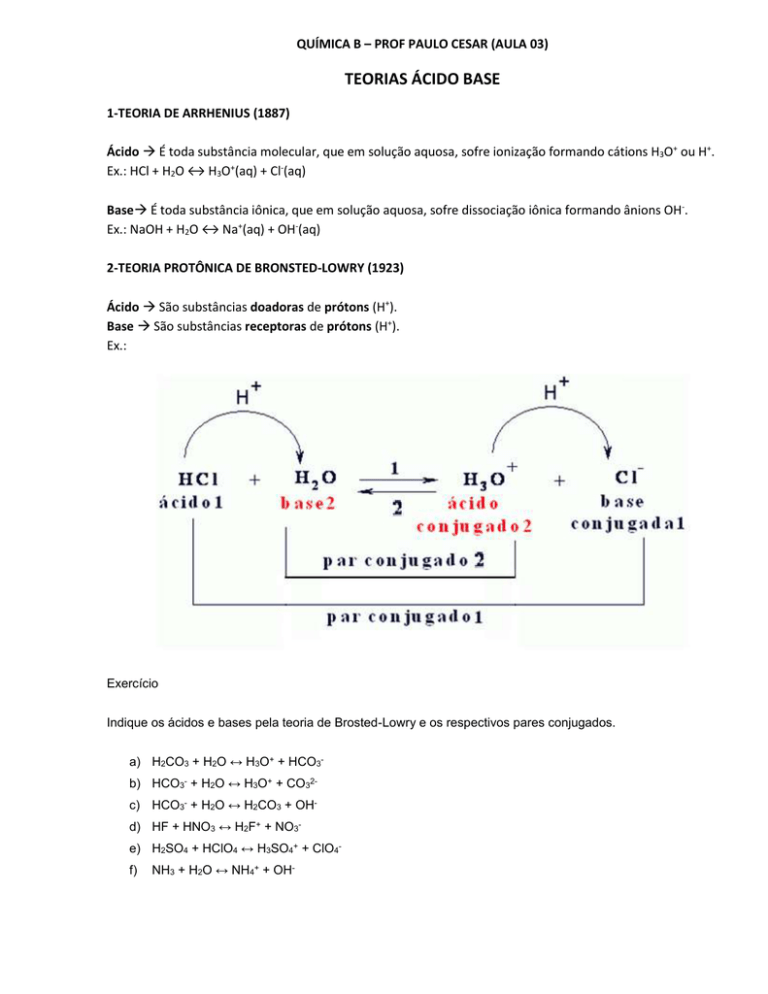
2-TEORIA PROTÔNICA DE BRONSTED-LOWRY (1923)
Ácido São substâncias doadoras de prótons (H+).
Base São substâncias receptoras de prótons (H+).
Ex.:
Exercício
Indique os ácidos e bases pela teoria de Brosted-Lowry e os respectivos pares conjugados.
a) H2CO3 + H2O ↔ H3O+ + HCO3b) HCO3- + H2O ↔ H3O+ + CO32c) HCO3- + H2O ↔ H2CO3 + OHd) HF + HNO3 ↔ H2F+ + NO3e) H2SO4 + HClO4 ↔ H3SO4+ + ClO4f)
NH3 + H2O ↔ NH4+ + OH-
3-TEORIA ELETRÔNICA DE LEWIS
ÁCIDO (reagente eletrófilo) São substâncias receptoras de pares de elétrons.
BASE (reagente nucleófilo) São substâncias doadoras de pares de elétrons.
Ex.:
Exercícios
1-Indique os ácidos e bases, pela teoria eletrônica de Lewis, nas reações abaixo:
a) H+ + :NH3 [NH4+]
b) Ag+ + 2(:NH3) [Ag(:NH3)2]+
c) Cu2+ + 4(:OH2) [Cu(:OH2)4]2+
d) Fe2+ + 6(:CN-) [Fe(:CN)6]4-
2-Faça a associação:
a)Base de Bronsted-Lowry b)Ácido de Bronsted-Lowry c)Base de Lewis
( ) Doador de próton
( ) Doador de par eletrônico
d)Ácido de Lewis
( ) Receptor de próton
( ) Reagente eletrófilo
( ) Reagente nucleófilo
3- Assinale verdadeiro (V) ou falso (F) diante das seguintes afirmações:
( )Todo ácido de Bronsted-Lowry é ácido de Lewis
( ) Todo ácido de Lewis é ácido de Bronsted-Lowry
( ) Toda base de Arrhenius é base de Bronsted-Lowry
( ) Toda base de Bronsted-Lowry é base de Arrhenius.
( ) Receptor de par eletrônico












