Questões objetivas
1) Um dos objetos do catalisador no sistema de descarga de um automóvel é o de converter os óxidos de nitrogênio
em moléculas menos danosas ao ambiente.
2NO(g) catalisador N2(g) + O2(g)
A função do catalisador na reação é a de:
a)
b)
c)
d)
e)
Impedir a formação do produto.
Fortalecer as ligações no reagente.
Diminuir a energia cinética da reação.
Diminuir a energia de ativação da reação.
Diminuir a velocidade de decomposição do NO(g).
2) A equação X + 2Y XY2 representa uma reação cuja equação da velocidade é:
V = K[X].[Y].
Assinale o valor da constante de velocidade, para a reação acima, sabendo que, quando a concentração de X é 1,0M e a
concentração de Y é 2,0M, a velocidade da reação é de 3 mol/L.m:
a) 3,00
b) 1,50
c) 1,00
d) 0,75
e) 0,50
3) Para a reação hipotética:
A (g) + B (g) C(g)
A expressão para a velocidade instantânea é V = k[A]2.[B]. Dobrando a concentração de A e mantendo a concentração de
B constante, a velocidade aumentará por um fator de:
a) 1
b) 2
c) 3
d) 4
e) 5
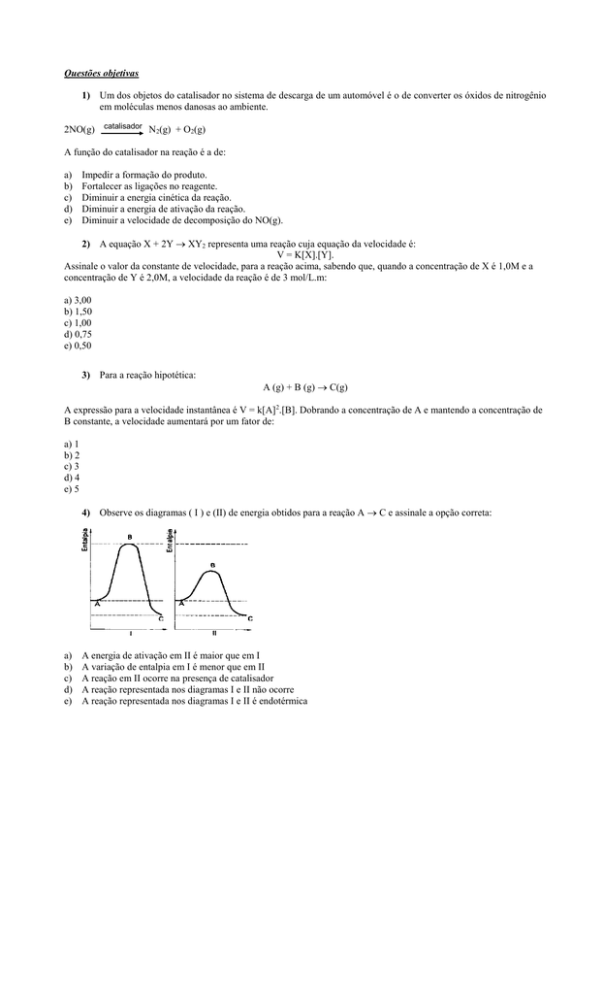
4) Observe os diagramas ( I ) e (II) de energia obtidos para a reação A C e assinale a opção correta:
a)
b)
c)
d)
e)
A energia de ativação em II é maior que em I
A variação de entalpia em I é menor que em II
A reação em II ocorre na presença de catalisador
A reação representada nos diagramas I e II não ocorre
A reação representada nos diagramas I e II é endotérmica
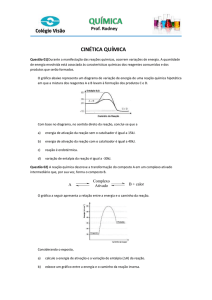
5) Considere o gráfico abaixo, referente ao diagrama de uma reação genérica: reagentes produtos, sob a ação de
um catalisador, e assinale a alternativa verdadeira.
a)
b)
c)
d)
e)
A presença do catalisador diminui a energia de ativação de a para b e manteve o H, representado por d.
A reação é exotérmica e a energia de ativação, sem a presença do catalisador, é representada por c.
A reação é endotérmica e a presença do catalisador diminui o H de a para b.
A presença do catalisador diminuiu o H da reação, representado por c.
A reação é endotérmica e a representa H com presença de catalisador.
6) Considere a reação de formação de R:
M (g) + N (g) R (g)
Observa-se, experimentalmente, que, dobrando-se a concentração de N, a velocidade de formação de R quadruplica e,
dobrando-se a concentração de M, a velocidade da reação não é afetada.
A equação da velocidade v desta reação é:
a)
b)
c)
d)
e)
V = k [M]
V = k [M]2
V = k [N]2
V = k [M][N]
V = k [M][N]2
7) A oxidação do brometo de hidrogênio pode ser descrita em 3 etapas:
I) HBr (g) + O2 (g) HOOBr (g) (etapa lenta)
II) HBr (g) + HOOBr (g) 2 HOBr (g) (etapa muito rápida)
III) HOBr(g) + HBr(g) Br2(g) + H2O(g) (etapa rápida)
A expressão da velocidade da reação de oxidação do brometo de hidrogênio esta corretamente representada em?
a)
b)
c)
d)
e)
V = K[HBr].[HOOBr]
V = K[HBr].[HOBr]
V = K[HBr]4.[O2]
V = K[HBr].[O2]
V = K[HOBr]2
8) Considere o diagrama abaixo para a seguinte reação: Br + H2
HBr + H
A entalpia da reação e a energia de ativação representada são respectivamente:
a)
b)
c)
d)
e)
3 kcal/mol e 28 kcal/mol.
25 kcal/mol e 3 kcal/mol.
28 kcal/mol e 3 kcal/mol.
28 kcal/mol e 25 kcal/mol.
25 kcal/mol e 28 kcal/mol.
9) A reação representada pela equação abaixo é realizada segundo dois procedimentos:
NaHSO4 + CH3COONa CH3COOH + Na2SO4
I) Triturando os reagentes sólidos;
II) Misturando soluções aquosas concentradas dos reagentes.
Utilizando mesma quantidade de NaHSO4 e mesma quantidade de CH3COONa nesses procedimentos, à mesma
temperatura, a formação do ácido acético:
a)
b)
c)
d)
e)
É mais rápida em I porque, no estado sólido, a concentração dos reagentes é maior.
É mais rápida em II porque, a frequência de colisões entre os reagentes é maior.
Ocorre em I e II com igual velocidade porque os reagentes são os mesmos.
É mais rápida em I porque o ácido acético é liberado na forma de vapor.
É mais rápida em II porque o ácido acético se dissolve na água.
10) Considerem-se a reação A + B C e as informações contidas no quadro abaixo
[A] mols/L
1
2
1
2
I
II
III
IV
[B] mols/L
1
1
2
2
velocidade
0,020
0,040
0,080
0,160
A expressão que melhor representa a velocidade de reação é:
a)
b)
c)
d)
e)
k [A]2
k [B]2
k [A] [B]
k [A]2[B]
k [A] [B]2
Questões discursivas
11) Dado o gráfico abaixo:
(Kcal)
689
257
-142
-246
Responda:
a)
b)
c)
d)
Indique o valor da energia de ativação com catalisador
Indique o valor da energia de ativação sem catalisador
Indique o valor da variação de entalpia da reação direta
Indique o valor da variação de entalpia da reação inversa
12) Dada à reação genérica: 2A + 3B + C Produtos, para qual são feitos 4 experimentos:
I
II
III
IV
[A]
0,1
0,1
0,2
0,1
[B]
0,1
0,2
0,1
0,1
[C]
0,1
0,1
0,1
0,2
velocidade
2.10-3 mol/L.min
4.10-3 mol/L.min
8.10-3 mol/L.min
2.10-3 mol/L.min
Determine a expressão matemática da velocidade instantânea e a ordem de cada componente e a ordem global da reação.
13) Para aumentar a velocidade de produção da indústria, um químico sugeriu o aumento da concentração dos
reagentes, pois assim uma maior quantidade de produtos seria formada por unidade de tempo aumentando a
lucratividade da empresa. Calcule a variação da velocidade instantânea da síntese da amônia quando dobrarmos a
concentração de N2 e H2.
14) Considere dois gases X e Y em um recipiente fechado, à temperatura ambiente, reagindo de acordo com a
seguinte lei: V = k[X].[Y]2.
a) mantida constante a temperatura, como e de quanto variará a velocidade inicial da reação se o volume inicial for
reduzido à metade?
b) mantido constante o volume, qual será o efeito da diminuição de temperatura sobre a velocidade inicial da reação?
15) Os dados da tabela a seguir referem-se ao processo químico A + B + C X.
[A] M
0,5
0,5
0,5
1,0
1,0
I
II
III
IV
V
[B] M
0,5
1,0
1,0
0,5
1,0
[C] M
0,5
0,5
1,0
0,5
1,0
Veloc.(mol/L.s)
0,015
0,015
0,060
0,030
0,120
Com base na tabela, calcule o valor da constante de velocidade.
16) Dado o gráfico abaixo:
(Kcal)
132
109
52
-24
Responda:
a)
b)
c)
Indique o valor da energia de ativação com catalisador?
Indique o valor da energia de ativação sem catalisador?
Indique o valor da variação de entalpia sem catalisador?
17) Considere a reação elementar gasosa:
2X + R + 3T → produtos
Considerando que em uma experiência as concentrações são alteradas, calcule a nova velocidade, em função da
velocidade inicial, quando a concentração de X é dobrada e a de T é triplicada.
18) Uma reação química gasosa de 2L + 3R L2R3, que ocorre em três etapas, possui variação de entalpia negativa
(H < 0):
1a etapa: 2L + R L2R (lenta)
2a etapa: L2R + R L2R2 (rápida)
3a etapa: L2R2 + R L2R3 (rápida)
Escreva a expressão matemática que governa a velocidade instantânea para a reação 2L + 3R L2R3 e indique a ordem
global da reação.
19) Foram realizados quatro experimentos. Cada um deles consistiu na adição de solução aquosa de ácido sulfúrico
de concentração 1mol/L a certa massa de ferro. A 25°C e 1 atm, mediram-se os volumes de hidrogênio
desprendido em função do tempo. No final de cada experimento, sempre sobrou ferro que não reagiu. A tabela
mostra o tipo de ferro usado em cada experimento, a temperatura e o volume da solução de ácido sulfúrico
usado. O gráfico mostra os resultados.
Experimento
A
B
C
D
Material
Prego
Limalha
Limalha
Limalha
Temperatura
(oC)
20
60
20
60
Volume de H2SO4
(mL)
50
80
80
100
Escreva, em ordem crescente, os quatro experimentos em função da liberação de gás H2.
20) Observe alguns fenômenos descritos e indique os fatores que influenciam na sua velocidade
I - Queimadas alastrando-se rapidamente quando está ventando;
II - Conservação dos alimentos no refrigerador;
III - Efervescência da água oxigenada na higiene de ferimentos;
IV - Lascas de madeiras queimando mais rapidamente que uma tora de madeira.
GABARITO
1–D
2–B
3–D
4–C
5–A
6–C
7–D
8–E
9–B
10 – E
Questões discursivas
11 –
a) EA(com cat) = +399Kcal
b) EA(com cat) = +831Kcal
c) ΔH(direta)= -104Kcal
d) ΔH(inversa) = +104Kcal
12 - V = k [A]2.[B]
A ordem da reação em relação a A = 2 ordem
A ordem da reação em relação a B = 1 ordem
A ordem da reação em relação a C = ordem zero
A ordem global da reação = 3 ordem
13 - V = 16Vi
14 – a) aumenta 8(oito) vezes e b) diminui a velocidade da reação
15 - R: K = 0.12(mol/L)-2/s
16 - a) +57Kcal; b) +80Kcal e c) -76Kcal
17 - R:aumenta 108vezes
18 - R: V = K[L]2.[R] e 3ª ordem
Questões desafio
19 – A < C < B < D
20 –
I) Concentração do gás oxigênio
II) Temperatura
III) Catalisador
IV) Superfície de contato