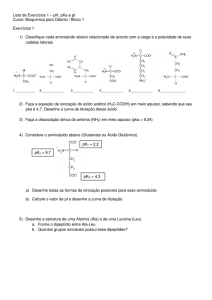
Ácidos e Bases, intermediários de
reações orgânicas
Parte I
Profa. Alceni Augusta Werle
Profa. Tania Marcia do Sacramento Melo
1- Introdução
• Revisão da teoria de ácidos de Arrhenius,
Brönsted-Lowry e de Lewis.
• Estes conceitos foram abordados em Química
Geral, iniciaremos com uma breve revisão.
• Você deve revisar os cálculos.
2
TEORIA DE ARRHENIUS (1887)
• Ácido – substância que libera íons H+ (prótons), quando
dissolvida em água.
• Base - substância que libera íons –OH (hidroxila), quando
dissolvida em água.
3
TEORIA DE ARRHENIUS (1887)
• Substâncias neutras dissolvidas em água formam espécies carregadas
“íons” .
• Dissociação Iônica ou Ionização em Solução
4
TEORIA DE BRONSTED-LOWRY (1923)
• ÁCIDO: doador de próton
• BASE: aceptor de próton
5
Aplicação da teoria de Brönsted-Lowry (BL)
O
NH3
base
+ H
ácido
H
+
NH4
+
Ácido
conjugado
- OH
Base
conjugada
Anfótero
Água como Bases de BL : H2O + HCl → H3O+ + ClÁgua como Ácido de BL :NH3 + H2O → NH4+ + HO6
• O ácido acético se dissocia em água ou em
amônia, porém a dissociação em amônia é
completa, em água é parcial. Por que ?
7
TEORIA ÁCIDO–BASE DE LEWIS(1923)
• Mais geral que a teoria de Brönsted;
• Substâncias Doadoras do par de elétrons são base de
Lewis e as aceptoras de par de elétrons são
consideradas como ácidos de Lewis.
Ácidos de Lewis :
Fe3+ BF3 AlCl3
Bases de Lewis :
NH3 H2O (CH3)2S
8
Doador de
elétrons
Aceptor de
elétrons
9
2- pKa’s e Força dos Ácidos
• pKa – aspectos físico-químicos das reações ácido-base.
• pKa - Maneira de expressar a força de um ácido.
Temos que saber
qual é o Ka?
Exemplo: Um ácido tem pKa de 5,2. Qual o % de
ionização em uma solução de pH=6?
Exercício: Calcular o pka do Ácido orgânico em uma
solução de pH=6 que tem um % i de 95.
10
3- ENERGIA LIVRE
• Maneira de expressar a força de um ácido.
ΔG = - RTln Ka
ΔG = - 2,3.RT.log Ka
– R=1,98 cal.mol-1.k-1
– T=298 k
– pKa = -log Ka
ΔG = - 1,36.pKa
KCN + CH3COOH
H2O
pKa =4,8
CH3COOK + HCN
pKa= 9,1
∆ pKa = - 4,3
∆G = - 5,85
11
4- Energia Livre de Gibbs e a posição do equilíbrio
• A constante de acidez em meio aquoso
• Em uma reação ácido base, a transferência de próton ocorre sempre do
ácido mais forte para o ácido mais fraco e a direção da transformação é
aquela que conduz a menor energia livre.
KCN + CH3COOH
H2O
pKa =4,8
CH3COOK + HCN
pKa= 9,1
∆ pKa = - 4,3
∆G = - 5,85
12
5- RELAÇÃO ENTRE pKa and Ka
Usamos pKa para expressar a força dos ácidos, que é um simples número
sem expoentes.
13
6- AVALIAÇÃO DA FORÇA DO ÁCIDO
(ESTABILIDADE DA BASE CONJUGADA)
14
7- SOLVATAÇÃO SEGUIDA DE IONIZAÇÃO
Observe que os íons tem maior energia que o ácido,
mas a Solvatação envolvida no processo diminui a
Energia do íon (ácido forte, processo exotérmico).
Observe que ∆G é exergônica ou endergônica.
Quando usamos ∆H indicamos exotérmica ou endotérmica .
15
8- FATORES QUE AUMENTAM A ACIDEZ
(ESTABILIZAÇÃO DA BASE CONJUGADA)
Fatores que
diminuem a
Energia
(estabilizam) a
base
conjugada.
16
RESSONÂNCIA: Mais estruturas de ressonância, ou maior
contribuição de ressonância,na base conjugada leva a
formação do Ácido mais forte.
17
E
Q
U
I
V
A
L
E
N
T
E
S
18
Mais estruturas, mas com menor
contribuição que o íon acetato
Estruturas Não-equivalente
Com carga no carbono e no oxigênio
19
ELETRONEGATIVIDADE
• Quando temos dois ácidos com elementos do mesmo período
devemos colocar a carga negativa no elemento mais
eletronegativo da base conjugada.
20
EFEITO DO TAMANHO DO ATOMO
• A correlação de tamanho é estabelecida entre o hidrogênio mais ácido e o
átomo a ele conectado.
• Colocar a carga negativa no maior átomo para identificar a base
conjugada.
• Fazer a distribuição eletrônica para identificar a relação de tamanho.
21
22
EFEITO DA HIBRIDIZAÇÃO
• Quanto maior o caráter “s” do orbital contendo a carga
negativa na base conjugada mais forte será a sua respectiva
forma ácida. Por que?
pKa
Efeito da hidridização
no ácido conjugado
23
EFEITO INDUTIVO: menor contribuição, porém é aditiva.
Tipos
Retirador de elétrons: Grupos que
diminuem a densidade eletrônica
Doador de elétrons: Grupos que
aumentam a densidade eletrônica
EFEITO SE PROPAGA ATRAVÉS DE LIGAÇÃO SIGMA E É AFETADO
PELA DISTÂNCIA
24
Efeito do número de átomos, da natureza do átomo e distância
Aditividade
pKa
Natureza
pKa
Eletronegatividade
Normalmente não atua
além de 3 ligações σ
pKa
25
SOLVATAÇÃO
• Solvatação é uma interação fraca.
• Quando um íon é solvatado libera Energia.
• A solvatação diminui a energia do íon.
26
Efeito da cadeia carbônica na solvatação
pKa
Pouca
interação
com a
água
Impedimento
estérico
27
ESPÉCIE CARREGADA versus ESPÉCIE NEUTRA
H3C OH
15,5
HO
H
H3C O H
O
HO
O
C
C
4,2
- 7,8
H
- 2,2
O ÁCIDO CONJUGADO É SEMPRE
MUITO MAIS FORTE DO QUE
O ÁCIDO DE ORIGEM
28
EFEITOS MULTIPLOS
Os efeitos podem estar presentes unitariamente ou em adição ou em subtração.
Exemplo:
29
RESUMO
• EFEITOS PRINCIPAIS
– Eletronegatividade
– Tamanho
– Hibridização
– Ressonância
– Átomos carregados -(+)-
Produzem grande alteração no pKa
• EFEITO MINORITÁRIO
– Efeito Indutivo
Produz pequena alteração a menos
que tenha efeito aditivo
30
Resumo dos diferentes efeitos sobre os valores de pKa
31
RESUMO
Os efeitos não estão listados em ordem de importância, pois não é possível
estabelecer uma ordem de grandeza
32
Acidez típica de alguns grupos funcionais
Atividade extra-classe: justifique os diferentes pka aplicando os fatores
anteriormente apresentados.
33
9- ESTRUTURA MOLECULAR E BASICIDADE
• Segundo a teoria BL, base é toda substância que tem
capacidade de receber um próton.
34
• pKb se correlaciona com pKa.
• Ácido fraco = base conjugada forte.
• Ácido forte = base conjugada fraca.
35
• Bases mais forte normalmente
são
espécies
carregadas
negativamente e bases fracas são
espécies neutras.
H 3C
OH
H 3C
O
Basicidade aumenta
O
O
• Quanto menor a estabilização da
carga negativa ou dispersão do
par de elétrons não ligantes,
maior será a força da base.
H3C
C
O
Basicidade aumenta
O
H3C
H3C
C
NH2
NH2
Basicidade aumenta
36
Por que o nitrogênio é mais básico do que os oxigênios?
37
Qual do dois oxigênios é mais básico?
O
H3C
C
OH
O
H3C
C
+ H3O
OH
O
H3C
C
OH
O
H3C
H
C
OH
+ H3O
O
H3C
C
O
H
H
38
Atividades extra-classe
1- Justifique os pKa das séries a seguir, baseando a discussão em
fatores estruturais:
39
40
2- Justifique as diferenças de basicidade das séries a seguir (os
pKa fornecidos referem-se aos respectivos ácidos
conjugados), baseando a discussão em fatores estruturais.
41
42