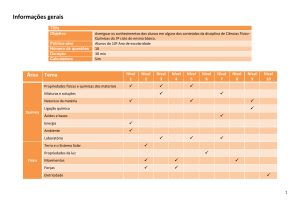
Programação da 2ª Etapa
1ª Série do Ensino Médio
Daniella e Jéssica
Química
“SE QUERES SEGUIR A DEUS, DEIXA-O IR ADIANTE. NÃO QUEIRAS QUE ELE TE SIGA.”
Sto. Agostinho
CONTEÚDOS:
Química I – Professora: Jéssica Silva
Processos de separação de misturas (Capítulo 2 - Livro Texto – Tito e Canto).
Teorias e modelos atômicos: experimentos e aplicações (Capítulo 4, 5, 6 - Livro Texto – Tito e
Canto).
1. Dalton, Thomson, Rutherford e Bohr.
2. Modelo atual.
Introdução à estrutura atômica da matéria (Capítulo 4, 5, 6 - Livro Texto – Tito e Canto).
1. Átomos, íons.
2. Prótons, nêutrons, elétrons, número de massa, massa atômica.
3. Níveis, subníveis, orbitais.
4. Isótopos e isoeletrônicos
5. Distribuição eletrônica.
Tabela Periódica: Classificações e estrutura (Capítulos 7 - Livro Texto – Tito e Canto).
1. Propriedades de metais, ametais, hidrogênio e gases nobres.
2. Colunas e períodos.
Propriedades periódicas dos elementos (Capítulos 7 - Livro Texto – Tito e Canto).
1. Conceito de propriedade periódica.
2. Raio atômico, energia de ionização, afinidade eletrônica e eletronegatividade.
Introdução a ligações químicas (Capítulo 8 - Livro Texto – Tito e Canto).
1. Gases nobres e a regra do octeto.
2. Ligações químicas interatômicas: covalente, iônica e metálica.
Ligação covalente (Capítulo 8 - Livro Texto – Tito e Canto).
1. Ligações interatômicas e suas propriedades: formação da ligação, características da
ligação.
2. Classificações: simples, dupla, tripla, polar e apolar, coordenada.
Substâncias covalentes e moleculares (Capítulo 8 - Livro Texto – Tito e Canto).
Química II - Professora: Daniella Olandim
Aspectos quantitativos das reações químicas (Livro Texto – Tito e Canto – Capítulo 15).
1. Relações estequiométricas fundamentais.
2. Reagente limitante e reagente em excesso.
3. Reagente que contém impurezas.
4. Reações que não apresentam rendimento total.
O comportamento físico dos gases (Livro Texto – Tito e Canto – Capítulo 14).
1. Transformações envolvendo gases.
2. Lei do Gás Ideal.
3. Volume molar dos gases.
4. Relações estequiométricas com volume de gás.
PROGRAMAÇÃO DA 2ª ETAPA – 1ª SÉRIE DO ENSINO MÉDIO - PE 087-2016
HABILIDADES:
Competência 1: Dominar a leitura, interpretação e a capacidade de produção de textos em
diferentes formas de linguagem e representações que envolvem conhecimento químico, incluindo
símbolos, códigos e nomenclatura científica, a fim de se comunicar adequadamente.
H1. Identificar uma substância, reagente ou produto, por algumas de suas propriedades
características: temperatura de fusão e de ebulição; densidade, solubilidade, condutividade
térmica e elétrica.
H3. Correlacionar propriedades físicas com o grau de pureza de uma substância, a fim
reconhecer ou caracterizar materiais em seus contextos de aplicação.
H4. Correlacionar propriedades físicas e químicas de uma substância com o seu
comportamento em reações químicas, reconhecendo ou caracterizando materiais em seus
contextos de aplicação.
H5. Representar informações experimentais referentes às propriedades das substâncias em
tabelas e gráficos.
H6. Elaborar procedimentos experimentais baseados nas propriedades dos materiais,
objetivando a separação de uma ou mais substâncias presentes em um sistema (filtração,
flotação, destilação, recristalização, sublimação).
H7. Representar as substâncias e as transformações químicas a partir dos códigos, símbolos
e expressões próprias da Química.
H8. Conhecer os modelos de núcleo, constituídos de nêutrons e prótons, identificando suas
principais forças de interação.
H9. Relacionar número de nêutrons e prótons com a massa isotópica e com sua eventual
instabilidade, assim como relacionar sua composição isotópica natural com a massa
usualmente atribuída ao elemento.
Competência 2: Apropriar-se de conhecimentos da Química para, em situações problemas,
interpretar, avaliar ou planejar intervenções científico-tecnológicas.
H1. Reconhecer as transformações químicas por meio de diferenças entre os seus estados
iniciais e finais, seja em situações do cotidiano, em processos naturais ou industriais.
H2. Descrever transformações químicas em diferentes linguagens e representações, ocorridas
e observadas no cotidiano, em processos naturais ou industriais.
H3. Reconhecer transformações químicas que ocorrem na natureza e em diferentes sistemas
produtivos e tecnológicos.
H5. Compreender a conservação de massa nas transformações químicas e aplicar a lei da
conservação de massa em cálculos estequiométricos.
H6. Interpretar informações sobre variáveis nas transformações químicas apresentadas em
tabelas ou gráficos.
H7. Interpretar uma representação de uma transformação química em termos das quantidades
de matéria envolvidas e traduzir, em termos de quantidade de matéria (mol), as relações
quantitativas de massa nas transformações químicas.
H8. Compreender as relações quantitativas de massa e de quantidade de matéria nas
transformações químicas.
H9. Estabelecer relação entre a estequiometria e o rendimento das reações químicas,
prevendo, em função dessa relação, quantidades envolvidas nas transformações que ocorrem
na natureza ou em sistemas produtivos.
Competência 3: Trabalhar com modelos explicativos para a representação de fenômenos ou
sistemas.
H1. Utilizar as ideias de Dalton para explicar as transformações químicas e suas relações de
massa.
H2. Reconhecer as limitações dos modelos de Dalton e de Thomson para compreender
fenômenos nucleares.
H3. Utilizar as ideias de Thomson e as de Rutherford para explicar a natureza elétrica da
matéria.
H6. Associar a luz emitida por gases de substâncias aquecidas (espectro descontínuo) com
2
PROGRAMAÇÃO DA 2ª ETAPA – 1ª SÉRIE DO ENSINO MÉDIO - PE 087-2016
transições entre seus níveis quânticos de energia.
H7. Compreender a maior estabilidade de certos elementos e a maior interatividade de outros,
em função da ocupação dos níveis eletrônicos na eletrosfera.
H9. Interpretar a periodicidade das propriedades químicas, em termos das sucessivas
ocupações de níveis quânticos em elementos de número atômico crescente.
H11. Compreender os estados de agregação que caracterizam sistemas sólidos, líquidos e
gasosos, em função das interações eletrostáticas entre átomos, moléculas ou íons.
Competência 5: Identificar informações ou variáveis relevantes em uma situação problema que
envolve diferentes dados de natureza química, e elaborar possíveis estratégias para equacioná-la
ou resolvê-la.
H2. Prever a absorção ou produção de energia sob a forma de calor, a partir de informações
pertinentes obtidas em tabelas, gráficos ou outras fontes.
Competência 6: Correlacionar conhecimentos sobre sistemas materiais, fenômenos, fatos e
concepções, identificando regularidades e diferenças, a fim de construir significados no contexto
da Química.
H1. Compreender processos de geração de energia térmica, elétrica ou mecânica envolvendo
a combustão de energéticos encontrados no solo ou subsolo – carvão, petróleo, gás natural.
Competência 7: Compreender a Química e as tecnologias associadas como conhecimento
científico socialmente construído e como parte integrante da cultura humana contemporânea,
percebendo seu papel nos processos produtivos e no desenvolvimento econômico da sociedade.
H1. Caracterizar o estado gasoso em termos do comportamento das partículas, a fim de se
discutir a pertinência e a abrangência dos modelos científicos aplicados a este contexto.
H2. Compreender os processos de separação dos componentes do ar para obtenção de
matéria-prima (oxigênio, nitrogênio e gases nobres).
H6. Compreender o processo de destilação fracionada do petróleo.
Competência 8: Construir uma visão sistematizada das diferentes linguagens e campos de
estudo da Química, estabelecendo conexões entre seus diferentes temas e conteúdos.
H3. Comparar as propriedades da água, enquanto substância pura, tais como capacidade de
dissolução, temperatura de solidificação e de ebulição, densidade e condutibilidade térmica e
elétrica, com as de águas naturais.
DISTRIBUIÇÃO DE PONTOS:
Valor total da segunda etapa: 30,0 pontos
Primeira prova aberta:............. 6,0 pontos
Segunda prova aberta: ............7,0 pontos
Prova fechada: ...................... 6,0 pontos
Simulado: ................................7,0 pontos
Laboratório: .............................4,0 pontos.
DICAS DE APROFUNDAMENTO:
Informe-se sobre a Química – textos complementares ao final de cada capítulo do livro didático
adotado.
http://dicasdequimica.vila.bol.com.br
http://educar.sc.usp.br
http://sbqensino.foco.fae.ufmg.br
www.estequiometricamente.blogspot.com.br
3