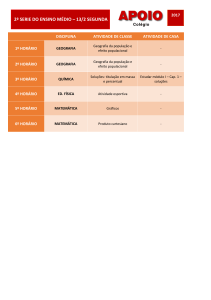
![Experimento10_Volumetria_Precipitacao[1]](//s1.studylibpt.com/store/data/000047832_1-f26a8ad8581583c3b8eb610f874a1ece-768x994.png)
UNIVERSIDADE FEDERAL DE SÃO CARLOS
DEPARTAMENTO DE QUÍMICA
QUIMICA ANALITICA EXPERIMENTAL
Experimento n° 10 – Volumetria de precipitação – Determinação de cloreto em
soro fisiológico
1. Introdução
Os métodos de precipitação são baseados em reações de formação de
compostos pouco solúveis. As reações de precipitação devem satisfazer as
condições gerais para que possam ser utilizadas como base do método volumétrico:
(1) A reação de precipitação deve processar-se praticamente de forma quantitativa
no ponto de equivalência, (2) completar-se em tempo relativamente curto e (3)
oferecer condições para uma conveniente sinalização do ponto final. Em relação ao
grau com que se completa, a reação pode ser estudada com base no produto de
solubilidade do composto formado. Na prática, tais condições limitam muito o
número de reações de precipitação utilizáveis. Muitas delas não podem servir em
virtude da carência de meios apropriados para a localização do ponto final.
Os métodos titulométricos de precipitação são numerosos e os métodos
argentimétricos são os mais comuns. Estes métodos utilizam soluções de nitrato de
prata para a determinação de haletos e outros ânions que formam sais de prata
pouco solúveis.
Na determinação do ponto final da titulação podem ser utilizados indicadores
relativamente específicos, isto é, apropriados para uma dada reação de precipitação.
Na análise titulométrica, em geral, a variação das concentrações dos íons reagentes
em torno do ponto de equivalência depende grandemente do grau em que se
completa a reação. Os fatores que determinam essa questão são o produto de
solubilidade do precipitado e as concentrações dos reagentes.
O ponto final nas titulações de precipitação pode ser determinado de duas
formas:
a) formação de um composto colorido (método de Mohr): esse método se aplica à
determinação de cloreto (ou brometo) utilizando cromato de potássio como
indicador. O cloreto é titulado com solução padrão de nitrato de prata. Um sal solúvel
de cromato é adicionado como indicador. No ponto final da titulação, os íons cromato
1
reagem com os íons prata para formar cromato de prata pouco solúvel, de cor
vermelha, de acordo com a reação:
2Ag+(aq) + CrO42-(aq) Ag2CrO4(s)
A concentração do indicador é importante e o Ag2CrO4 deve justamente
começar a precipitar no ponto de equivalência, quando se tem uma solução saturada
de AgCl. A titulação de Mohr deve ser efetuada em pH ao redor de 8,0. Se a solução
for muito ácida (pH < 6,0), parte do indicador estará presente como HCrO 4- e mais
Ag+ será necessário para formar o precipitado. Acima de pH 8,0 pode precipitar
hidróxido de prata (pH 10,0). O pH pode ser convenientemente mantido pela adição
de carbonato de cálcio sólido à solução. A titulação de Mohr é utilizada para
determinar cloreto em soluções neutras ou não tamponadas, como por exemplo, a
água potável.
b) utilização de indicadores de adsorção (Método de Fajans): a ação desses
indicadores se deve ao fato de, no ponto de equivalência, o indicador ser adsorvido
pelo precipitado, ocorrendo mudança de cor. As substâncias empregadas podem ser
corantes ácidos ou básicos como, por exemplo, a fluoresceína, a eosina e a
rodamina.
O objetivo deste experimento é determinar a concentração de cloreto de sódio
em uma amostra de soro fisiológico comercial utilizando o método de Mohr.
2. Parte Experimental
2.1- Materiais e reagentes
- Solução de nitrato de prata (AgNO3, P. M. = 169,87) 0,1000 mol/L (esta solução
estará
previamente
padronizada
e
os
alunos
DEVERÃO
ANOTAR
CONCENTRAÇÃO REAL);
- Solução do indicador de cromato de potássio (K2CrO4, P. M. = 194,2) 5% (m/v);
- Bureta de 25,00 ou 50,00 mL;
- Pipeta volumétrica de 25,00 mL;
- Balão volumétrico de 100,0 mL;
- Pipeta volumétrica de 10,00 mL;
- Erlenmeyer de 200 mL;
2
A
2.2- Procedimento
Pipetar 25,00 mL do soro fisiológico e transferir o volume para um balão
volumétrico de 100,0 mL. Completar o volume com água destilada, homogeneizar a
solução, pipetar 10,00 mL do soro diluído e transferir o volume para um erlenmeyer.
Adicionar 1,00 mL do indicador de cromato de potássio e titular com a solução de
nitrato de prata.
3. Resultados
Com base no volume gasto na titulação, calcule a porcentagem de cloreto no
soro fisiológico e compare o resultado obtido com aquele informado no rótulo do
produto.
4. Referências Bibliográficas
- Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M. J. K., Análise Química
Quantitativa, Rio de Janeiro: LTC – Livros Técnicos e Científicos Editora S.A., 2002.
- Skoog, D. A.; West, D. M.; Holler, F. J.; Crouch, S. R., Fundamentos de Química
Analítica, São Paulos: Thomson, 2004.
- Harris, C. D. Análise Química Quantitativa, LTC Editora, Rio de Janeiro, Tradução:
Bonapace, J. A. P. e Barcia, O. E. 2005.
3
![Experimento10_Volumetria_Precipitacao[1]](http://s1.studylibpt.com/store/data/000047832_1-f26a8ad8581583c3b8eb610f874a1ece-768x994.png)