Lista 6 - Calor Latente, Potência e Curva de Aquecimeto
1. Misturam-se 200 g de água a 20 °C com 800 g de gelo a 0 °C. Admitindo que as trocas de
calor apenas aconteçam entre o gelo e a água, determine qual será a temperatura final da mistura
e qual a massa final de líquido.
Resposta: 0°C e 250 g de líquido
2. Um bloco de gelo, de calor específico 0,5 cal/g°C, e de 3,0 kg de massa está a uma
temperatura de – 10 °C. É colocado em um calorímetro ideal que contém 5,0 kg de água a 40 °C.
Sabendo que o calor latente de fusão do gelo é 80 cal/g, determine a massa de gelo que não irá
derreter.
Resposta: 687,5 g
3. Um bloco de gelo de 200 g de massa recebe calor à razão constante de 50,0 cal/s (fluxo de
calor fornecido ao gelo). Estando o gelo inicialmente à temperatura de – 10 °C, determine quanto
tempo levará para o gelo se transformar em água a 40 °C.
Resposta: 8 minutos e 20 segundos
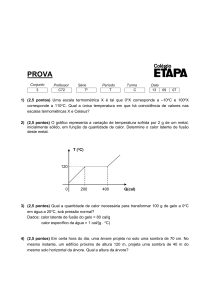
4. O aquecimento de uma amostra m de água da fase sólida a – 20 °C para a fase líquida a 20 °C
é demonstrado no gráfico abaixo.
T(°C)
20
500
4500
5500
Q(cal)
- 20
Considerando o calor latente de fusão do gelo igual a 80 cal/g, determine o valor de m, em
gramas.
Resposta: 50 g
5. O gráfico mostra a quantidade de calor , Q, absorvida por um corpo de 20,0 g de massa,
inicialmente no estado sólido, em função da temperatura T.
Q(cal)
500
400
200
0
20
40
T(°C)
Observando o gráfico, determine:
a) A capacidade térmica do corpo, no estado sólido.
b) O calor específico da substância que compõe o corpo, no estado líquido.
c)As temperaturas de fusão da substância que compõe o corpo.
Resposta: a) 10 cal/°C, b) 0,5 cal/g, c) 20 °C
6. Um recipiente de capacidade térmica 200 cal/°C, que tem volume de 1,0 litro, contém 500 g
de água a 0°C (d = 1,00g/cm3 e c = 1,00 cal/g°C). Introduzindo nesse recipiente um corpo
maciço de certo material (d = 3,00 g/cm3 e c = 0,20 cal/g°C) a 100 °C, ele fica completamente
cheio. Sendo o sistema termicamente isolado, deter mine a temperatura de equilíbrio térmico.
7. O gráfico representa a variação de temperatura de uma amostra de 20,0 g de um líquido, a
partir de 0 °C, em função do calor por ela absorvido. Determine a relação entre o calor especifico
cL do líquido e o seu calor específico cG na fase gasosa.
Resposta: cL = cG/2
T (°C)
120
80
0
1000
3000
4000 Q(cal)
8. O calor específico da água é 1,0 cal/g°C e o seu calor latente de vaporização é 540 cal/g. Sob
pressão normal, uma chama constante gasta 1 minuto para elevar a temperatura de certa massa
de água de 40 °C a 100 °C. Determine o tempo decorrido desde o início da vaporização até o seu
final.
Resposta: 9 minutos
9. Coloca-se m gramas de gelo em fusão num calorímetro de capacidade térmica 100 cal/°C, que
contém 400 g de água a 30 °C. Determine o valor de m, para que o equilíbrio térmico ocorra a
10 °C.
Resposta: 11,1 g
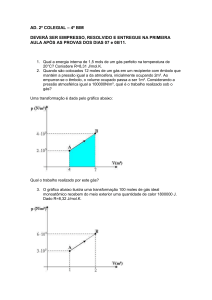
10.Um bloco de gelo de 200 g a 0 °C foi colocado num calorímetro ideal, que contém 400 g de
água líquida a 100 °C. O gráfico abaixo representa a temperatura T em função da variação da
quantidade de calor ∆Q sofrida pelo gelo e pela água.Nesse caso, determine os valores de X e Y.
Resposta: 24 kcal e 40 °C
T(°C)
Y
X
∆Q(kcal)