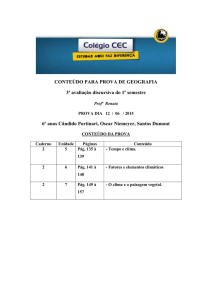
LISTA DE EXERCÍCIOS - AULA 05
Lei dos Gases Ideais
Número de Avogrado
𝑁𝐴 = 6,023 1023
Conceito de Mol
𝑚
Número de Mols de uma substância: 𝑛 = 𝑀
onde
n é o número de mols
m é a massa considerada da substância
M é o peso molecular, de acordo com os constituintes (átomos) desta substância
Equação de Clapeyron para os gases ideais
𝑝𝑉 = 𝑛𝑅𝑇
p
V
n
R
T
pressão do gás
volume ocupado pelo gás
número de mols
0,082 𝑎𝑡𝑚.𝑙
𝐽
constante dos gases ideais (𝑅 = 𝑚𝑜𝑙 𝐾 , ou 𝑅 = 8,31 𝑚𝑜𝑙 𝐾
Temperatura em Kelvin
Lei dos Gases Perfeitos
𝑃1 𝑉1
𝑃2 𝑉2
=
𝑇1
𝑇2
Condições Normais de Temperatura e Pressão (TPN)
Temperatura: 0°C = 273,15 K
Pressão: 1atm
1 - Ex. 43 pág 622 Tipler 5a ed Ex. 47 pág 596 Tipler 6a ed R - 1,79 mol
Um recipiente de 10 l contém gás à temperatura de 0°C e à pressão de 4 atm.
a. Quantos moles do gás estão no recipiente?
b. Quantas moléculas?
2 - Exemplo 17.6 pág 607 - Tipler 5a ed R- a) 295 K b) 0,688 atm
Uma amostra de 100g de CO2 ocupa o volume de 55 L a 1 atm de pressão .
a. Qual a temperatura da amostra?
b. Se o volume for aumentado para 80 L e a temperatura for mantida constante, qual
a nova pressão?
3 – Certa massa de gás ideal ocupa o volume de 49,2 l sob pressão de 3 atm e temperatura
0,082 𝑎𝑡𝑚.𝑙
de 27 °C. A constante universal dos gases ideais é 𝑅 = 𝑚𝑜𝑙 𝐾 . Determine:
a. o número n de mols do gás
b. a massa do gás, sendo a massa molar M = 28 g/mol
c. o volume de um mol (volume molar) desse gás nas condições de pressão e
temperaturas consideradas
3 - Ex. 46 pág 622 Tipler 5a ed Ex. 50 pág 596 Tipler 6a ed R- a) 360,7 K b)
385,9 K
Um motorista enche os pneus do carro a uma pressão monométrica de 180 kPa, em um dia
que a temperatura é de - 8,0°C. Quando chega ao seu destino, a pressão nos pneus
aumentou para 245 kPa. Qual a temperatura dos pneus, admitindo que:
a) os pneus não se expandem ;
b) que os pneus se expandem de 7%?
4 - O motor de combustão interna é uma máquina térmica que transforma a energia
proveniente de uma reação química em energia mecânica. O processo de conversão se dá
através de ciclos termodinâmicos que
envolvem expansão, compressão e mudança
de temperatura de gases. Em um motor de
automóvel, uma mistura de ar e gasolina é
comprimida no interior do cilindro antes da
ignição. Um motor típico possui uma razão
de compressão de 9 para 1; isso significa que
o gás no cilindro é comprimido até um
volume igual a 1/9 do seu volume original. A
pressão inicial é igual a 1,00 atm e a
temperatura inicial é igual a 27 °C. Se a
pressão depois da compressão for igual a
21,7 atm, calcule a temperatura do gás comprimido.
Primeira Lei da Termodinâmica
Chamamos de 1ª Lei da Termodinâmica, o princípio da conservação de energia aplicada à
termodinâmica, o que torna possível prever o comportamento de um sistema gasoso ao
sofrer uma transformação termodinâmica.
Analisando o princípio da conservação de energia ao contexto da termodinâmica:
Um sistema não pode criar ou consumir energia, mas apenas armazená-la ou transferi-la ao
meio onde se encontra, como trabalho, ou ambas as situações simultaneamente, então, ao
receber uma quantidade Q de calor, esta poderá realizar um trabalho e aumentar a
energia interna do sistema ΔU, ou seja, expressando matematicamente:
Q=
+ U
Sendo todas as unidades medidas em Joule (J).
1 - Cap. 18 Exemplo 18.5 pág 634 Tipler 5a R – 426 m
Você deixa cair um recipiente com água, termicamente isolado, de uma altura h do solo. Se
a colisão for perfeitamente inelástica e toda energia mecânica se transformar em energia
térmica da água, qual deve ser a altura h para a temperatura da água aumentar de 1 oC?
2 - Ex. 47 pág 660 Tipler 5a ed Ex. 48 pág 631 Tipler 6a ed
Uma bala de chumbo que se desloca a 200 m/s entra em repouso ao atingir um bloco de
madeira. Considerando que toda a variação de energia contribua para o aquecimento da
bala, estime a temperatura final da bala se sua temperatura inicial era de 20°C.
R – T = 449K
t =176 C
3 - Ex. 48 pág 660 Tipler 5a ed 18 Exemplo 18.5 pág 606 Tipler 6a ed
(a) Nas cataratas do Niágara a água cai de uma altura de 50 m. Calcule o aumento da
temperatura da água, se toda a variação da energia potencial contribuir para o aumento da
energia interna da água. (b) Faça o mesmo cálculo para as cataratas de Yosemite, onde a
queda é de 740 m.
R – a) t = 0,12k b) t = 1,7 k
4 - Ex. 45 pág 660 Tipler 5a ed Ex. 45 pág 631 Tipler 6a ed
Um gás diatômico realiza 300 J de trabalho e absorve 600 cal de calor. Qual a variação da
energia interna do gás?
R - U = 2.21 kJ
5 - Ex. 49 pág 660 Tipler 5a ed Ex. 47 pág 631 Tipler 6a ed
Quando 20 cal de calor são absorvidas por um gás, o sistema realiza 30 J de trabalho. Qual
a variação da energia interna do gás?
R - U = 53.7 J
Trabalho e Diagrama PV para um Gás
Nos Problemas 52 até 55 pág 660 Tipler 5a ed e nos problemas 50 e 53 pág 631
Tipler 6a ed
O estado inicial de 1 mol de um gás ideal é P1 = 3 atm, V1 = 1 L e U inicial = 456 J, e seu
estado final é P2 = 2 atm, V2 = 3 L e U final = 912 J.
Ex. 52 pág 660 Tipler 5a ed Ex. 50 pág 631 Tipler 6a ed
Um gás se expande a pressão constante até um volume de 3 L Depois, é resfriado a volume
constante até a pressão de 2 atm. Mostre esse processo em um diagrama PV e calcule o
trabalho realizado pelo gás. Calcule o calor absorvido durante esse pr cesso.
Ex. 53 pág 660 Tipler 5a ed Ex. 51 pág 631 Tipler 6a ed
Um gás é resfriado a volume constante até a sua pressão alcançar 2 atm. Depois expandese até o volume de 3 L . Mostre esse processo em um diagrama PV e calcule o trabalho
realizado pelo gás. Calcule o calor absorvido durante esse processo.
Ex. 54 pág 660 Tipler 5a ed Ex. 52 pág 631 Tipler 6a ed
Um gás se expande isotermicamente até seu volume atingir 3 L e sua pressão 1 atm. Ele é
então aquecido a volume constante até que sua pressão atinja 2 atm. Mostre esse processo
em um diagrama PV e calcule o trabalho realizado pelo gás. Calcule o calor adicionado
durante esse processo.
Ex. 55 pág 661 Tipler 5a ed Ex. 53 pág 631 Tipler 6a ed
Um gás é aquecido e ao mesmo tempo se expande, sendo representado por um segmento
de reta em um diagrama PV que vai de seu estado inicial até o seu estado final. Mostre esse
processo em um diagrama PV e calcule o trabalho realizado pelo gás. Calcule o calor
adicionado durante esse processo.
Ex. 56 pág 661 Tipler 5a ed Ex. 54 pág 631 Tipler 6a ed
Um mol de um gás ideal está inicialmente a P1 = 1 atm e V1 = 25 L e uma energia interna
de 456 J. Conforme o gás é levemente aquecido, a sua posição no diagrama PV se desloca
em uma linha reta até a condição de P2 = 3 atm e V2 = 75 L e uma energia interna de 912 J.
Calcule o trabalho realizado pelo gás e o calor absorvido .
Ex. 59 pág 661 Tipler 5a ed Ex. 57 pág 632 Tipler 6a ed
Um gás ideal inicialmente a 20°C e 200 k Pa tem 4 L de volume. Em uma expansão isotérmica
quase-estática sua pressão é reduzida a um valor de 100 k Pa. Calcule:
a) o trabalho feito pelo gás
b) o calor adicionado ao gás durante a expansão.